Молекулярный анализ опухоли что это
Таргетная терапия – одно из направлений медикаментозного лечения онкологических заболеваний в Юсуповской больнице, действующего непосредственно на клетки злокачественной опухоли. Молекулярная диагностика позволяет предсказать индивидуальную чувствительность опухоли к таргетным препаратам. Комплексное молекулярное генотипирование – это современные молекулярные исследования, позволяющие проверить все клинически значимые биомаркеры, поставить точный диагноз и подобрать эффективную терапию.
Молекулярное исследование опухоли показано для пациентов с колоректальным раком, раком легкого, меланомой, гастроинтестинальными стромальными опухолями, раком молочной железы, раком щитовидной железы. Наибольшую ценность оно представляет в тех случаях, когда терапия стандартными методами невозможна.
В клинике онкологии Юсуповской больницы также можно пройти генетические тесты на выявление носительства мутаций: генетический тест Риск, позволяющий выявить носительство мутаций в более чем 170 генах, связанных со всеми известными наследственными онкологическими заболеваниями, генетический тест ABC – секвенирование генов BRCA1/2, ATM и CHEK2, помогающий найти мутации в любом участке генов, повышающих вероятность заболеть раком молочной железы/яичников, предстательной железы и поджелудочной железы.
Наши специалисты


Цены на онкодиагностику с комплексным молекулярным генотипированием *
Персонализированная онкодиагностика в Юсуповской Больнице
Задача онкологов нашей клиники — таргетная терапия онкологических заболеваний и мониторинг состояния онкопациентов на основе комплекса данных о ткани или клетках опухоли. Для этого мы проводим комплексное исследование онкологических биомаркеров для подбора таргетного лечения.
Что такое персонализированная онкодиагностика в Юсуповской Больнице?
Наши тесты — это полный комплекс современных молекулярных исследований. Сочетание этих тестов позволяет проверить все клинически значимые биомаркеры, поставить точный диагноз и выбрать наиболее эффективное лечение после анализа более двух тысяч генов ДНК и РНК опухоли.
Зачем мне нужно делать комплексное молекулярное исследование?
Чтобы назначать эффективное лечение зачастую требуется не только знать точный диагноз, но и индивидуальные молекулярные особенности опухоли — такой подход лежит в основе персонализированной медицины. Молекулярное исследование опухоли помогает сделать выбор лекарств персональным и оценить эффективность более 50 препаратов еще до начала лечения. Это помогает выиграть время — ценнейший ресурс в борьбе против рака.

Кому мы рекомендуем пройти молекулярное исследование опухоли?
- стандарты лечения подразумевают исследование большого спектра мутаций для определения препарата выбора: НМРЛ, Колоректальный рак, меланома, гастроинтестинальные стромальные опухоли, рак молочной железы, рак щитовидной железы;
- клинические рекомендации недостаточно информативны для опухоли данного типа или клиническая картина заболевания не позволяет сделать уверенный выбор схемы лечения;
- редкие нозологии, для которых не определены рекомендации лечения или стандарты лечения не информативны для данной клинической картины;
- отсутствие или малое количество биологического материала не позволяют провести необходимые молекулярно-генетические исследования;
- метастатическое или агрессивное заболевание, не отвечающее на стандартные схемы лечения;
- исчерпаны возможности стандартной терапии;
- опухоли с неустановленным первичным очагом;
Как я могу пройти молекулярное исследование опухоли?
- Наш онколог перед тестом собирает всю важную клиническую информацию и получает образцы опухоли – это могут быть стандартные парафиновые блоки и гистологические стекла;
- Образцы опухоли исследуются в российских лабораториях, сертифицированных по международным стандартам (EMQN, NORDIQC и др.);
- Проводится анализ полного ДНК- и РНК-профиля опухоли;
- Моделируется воздействие на опухоль более 140 таргетных препаратов;
- Составляется персонализированный рейтинг эффективности препаратов;
- Результаты исследований обрабатываются с помощью уникальной базы данных биомаркеров. Прогноз потенциальной эффективности лекарств формируется на основе международных руководств и крупных клинических исследований;
- В результате вы получаете развернутый отчет о результатах исследований.
Также в клинике онкологии Юсуповской больницы вы можете пройти генетические тесты на выявление носительства мутаций.
- Генетический тест Риск - генетическое исследование, которое позволяет выявить носительство мутаций в более чем 170 генах, связанных со всеми известными на сегодняшний день наследственными онкологическими заболеваниями.Технология, лежащая в основе данного теста - секвенирование клинического экзома, что позволяет динамично увеличивать объем анализируемых генов при появлении новых данных о генах, ассоциированных с наследственными онкологическими синдромами.
Результатом такого исследования является комплекс рекомендаций по скринингу и изменению образа жизни в зависимости от выявленных мутаций и в соответствии с возрастом обследуемого.
Важно, что даже у пациента нет патогенных наследственных мутаций, в отчете все равно будут приведены рекомендации по скринингу, основанные на рекомендациях международных сообществ в соответствии с возрастом обследованного и той информацией, которую он указал в опроснике.
Кроме того, если все же будут выявлены патогенные мутации, в отчете также будет приведена оценка рисков для ближайших кровных родственников.
- Генетический тест ABC - это секвенирование генов BRCA1/2, ATM и CHEK2, которое позволяет найти мутации в любом участке гена. Наличие мутаций в данных генах у здоровых людей повышает вероятность в течение жизни заболеть раком молочной железы/яичников у женщин, предстательной железы у мужчин, а также поджелудочной железы у тех и других.
При проведении теста онкологическим больным по образцу опухоли оценивается потенциальная эффективность таргетных препаратов - PARP-ингибиторов (напр., олапариба) и препаратов платины.
Преимущества молекулярной диагностики для персонализированной терапии рака
Наши молекулярные тесты разработаны для помощи врачам-онкологам при выборе лекарственной терапии и используются при всех солидных опухолях. Эти исследования наиболее ценны, когда существует ряд альтернативных схем или, наоборот, когда стандартные варианты лечения отсутствуют (исчерпаны).
Наши тесты обладают рядом преиимуществ

Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Показания:
Генетические исследования в онкологии помогают решать важные задачи:
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Анализы для людей, у которых уже диагностирован рак
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Анализы для здоровых людей, направленные на оценку рисков
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Что показывает анализ?
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
Существуют ли противопоказания?
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Как происходит сдача анализа?
Насколько достоверны результаты?
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Что может повлиять на точность результата?
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.

Расшифровка анализа
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
Генетические исследования на рак в Европейской клинике
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь. Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.


Так, рак щитовидной железы может протекать 20-30 лет, в течение которых пациент может продолжать обычный образ жизни. В другом случае тот же рак может убить человека за полгода. Поэтому важным шагом в развитии онкологии было выделение групп заболеваний, отличающихся по агрессивности и чувствительности к терапии.
В настоящий момент "золотым стандартом" в онкологии является гистологическое исследование. Оно позволяет выделить отдельные формы, типы и подтипы опухолей, прогнозировать развитие каждой из них по отдельности, определить тип лечения. Однако с развитием методов диагностики появилась возможность более глубокого изучения опухоли и определения ее молекулярных характеристик, что позволило более четко стратифицировать типы онкологических заболеваний. Произошел сдвиг парадигмы от лечения типа онкологического заболевания к лечению конкретного пациента и конкретной опухоли. Принцип, учитывающий особенности каждого пациента, лежит в основе персонализированной медицины, которая находит свое дальнейшее развитие в т.н. прецизионной, то есть точной медицине (precision medicine). Ее отличие в том, что при выборе лечения используется информация о полном наборе молекулярных изменений в клетке.


Опухоли даже одного типа могут существенно различаться набором таких изменений. Поэтому картина даже хорошо изученного онкологического заболевания может принципиально отличаться от привычной. Оценка этой информации позволяет максимально точно подбирать лечение для каждого пациента, а также открывает возможность использования так называемой таргетной (target - цель) терапии у конкретного пациента. В результате такого подхода к лечению многие онкологические пациенты получили возможность не просто продлить свою жизнь, но и улучшить ее качество, а некоторые - шанс на полное исцеление.
Генетический портрет опухоли
Прежде онкологи имели лишь узкий набор биомаркеров с относительно доказанной эффективностью. С появлением и развитием молекулярно-генетических тестов онкодиагностика вышла на новый уровень. Сегодня есть арсенал методов, которые позволяют выявлять молекулярные нарушения на любом уровне функционирования опухолевой клетки, будь то изменение в структуре или последовательности ДНК, изменение в составе белков или в процессах метаболизма.
Наиболее широко применяемым методом является определение мутаций и перестроек в последовательности ДНК. Методы их определения непрерывно совершенствуются, в клиническую практику входят более чувствительные и высокопроизводительные, их высокая точность дает возможность определять даже редкие мутации и проводить анализы крови (жидкостная биопсия).
Еще 20 лет назад нам был доступен просмотр только одного гена за один тест, на это уходило около двух дней. Сейчас появилась возможность проводить полную оценку генетического портрета опухоли за 2-5 дней и накапливать эти данные для дальнейшего анализа. Технология секвенирования нового поколения (NGS) позволяет "прочитать" одновременно сразу несколько участков генома, что наряду с высокой чувствительностью является главным отличием от более ранних методов. Поэтому на сегодняшний день NGS является основным методом, применяемым в современных исследованиях и создании баз данных. Такие базы данных в дальнейшем используются для выявления новых клинически значимых мутаций, уточнения их роли в патогенезе опухоли и влиянии на ее характеристики.


При использовании молекулярных методов исследования можно обходиться минимальным количеством биологического материала, а большую его часть сохранить для более глубокого изучения в дальнейшем при появлении новых методов анализа. Основным средством для решения таких задач стал биобанкинг - сбор и накопление опухолевого материала, а также образцов крови с последующим хранением в условиях глубокой заморозки. Это позволяет создать библиотеку, которая становится незаменимым помощником при принятии сложных решений в диагностике. С развитием цифровых технологий появляется возможность переносить данные из ежедневной клинической практики в цифровое пространство и создавать базы данных, в которых можно оценивать как эффективность работы врачей, так и отвечать на новые научные запросы. Это выводит медицину на новый уровень, и, используя методы статистического анализа, позволяет понять, почему, например, мы получаем те или иные осложнения, или какая лечебная тактика лучше подходит определенной группе пациентов.
Решение для каждого
Использование новых методов диагностики и анализа данных позволяет четко выделять группы пациентов, у которых будет эффективна именно инновационная терапия. Комплексное геномное профилирование позволяет выявить потенциальные мишени для всех разрабатываемых в мире препаратов и, если возможности стандартных схем исчерпаны, выработать индивидуальную схему лечения. Применение метода с заранее известной эффективностью значительно снижает стоимость лечения онкологических пациентов в целом.
Несмотря на преимущества новых методов молекулярной диагностики, далеко не всегда они применяются в рутинной практике. Для их внедрения требуется множество сравнительных и подтверждающих исследований. Сегодня в большинстве национальных медицинских исследовательских центров России есть вся необходимая инфраструктура для их проведения. Появились и готовые решения как российских, так и зарубежных производителей для проведения комплексного геномного профилирования в различных областях медицины, в частности в онкологии. Следующим шагом является их апробация в клинической практике и внедрение в качестве медицинских услуг. Ключевой задачей на сегодня является валидация разработанных методов и сопоставление с существующими подходами.
Широкое внедрение методов молекулярной диагностики позволит существенно повысить эффективность терапии и качество жизни онкологических пациентов, а также сократить общие затраты на лечение.
Нельзя друг без друга
Развитие персонализированной медицины невозможно без взаимодействия между медицинскими центрами, лабораториями и фармкомпаниями. Эта тенденция наблюдается во всем мире. В частности, многие исследования по определению риска рецидива онкологических заболеваний и молекулярному профилированию проводятся именно в сервисных лабораториях. Такого рода партнерства позволяют медицинским учреждениям осуществлять высококачественную диагностику даже при отсутствии собственной инфраструктуры. Взаимодействие с фармкомпаниями обеспечивает наиболее быстрый доступ к современным препаратам (таргетная терапия, иммунотерапия). А также позволяет наиболее точно формировать цели для будущих исследований и поиска новых препаратов.
С развитием фармацевтики молекулярная диагностика становится все более и более важной сферой, которая определяет, какой препарат и почему будет показан пациенту и обеспечит эффективность его лечения. Но без диагностики препарат будет бесполезен. Разрабатывая и выпуская на рынок новейшие препараты таргетной и прецизионной медицины, производитель все больше будет зависеть от развития диагностики. И все чаще будет опираться на них при выпуске новых лекарств. В онкологии дальнейшее развитие, безусловно, будет идти именно в этом направлении. Соответственно, должны формироваться механизмы регистрации, оценки и применения подобных инновационных решений.
Виктория Морецкая, руководитель отдела молекулярно-генетической диагностики компании "Рош Москва":
- Рациональным диагностическим решением является комплексное геномное профилирование (КГП) опухоли с выявлением всех клинически значимых изменений. Оно предполагает выбор наиболее эффективной терапии, что, в свою очередь, может отсрочить прогрессирование заболевания. Активное внедрение КГП в рутинную онкологическую практику может оказать существенное влияние на снижение смертности от злокачественных новообразований, что поможет достичь целевых показателей эффективности онкологических служб субъектов Российской Федерации.
Дмитрий Власов, медицинский директор компании Bayer:


- Инновационные молекулы, доступные нашим пациентам уже сегодня, продлевают жизнь. Одним из примеров подобных "прорывов" является таргетная альфа-терапия, увеличивающая общую выживаемость мужчин, страдающих одним из самых распространенных видов злокачественных новообразований - раком предстательной железы. В ближайшей перспективе для пациентов в России станут доступны и препараты, предназначенные для терапии опухолей, развитие которых связано с изменениями отдельных генов. Данные препараты можно применять для лечения многих видов рака, вне зависимости от локализации, имеет значение только соответствующее генетическое изменение. Наш профессиональный и социальный долг - приложить все усилия, чтобы эти инновации как можно скорее были доступны для пациентов, чьи заболевания до сих пор были неизлечимы.
Для развития проектов в области персонализированной медицины в онкологии крайне важно развивать сотрудничество с научными центрами, в ходе которого идет разработка новых молекул и решений. Обладая серьезной экспертизой в области ядерной медицины, Bayer осуществляет поддержку таких проектов. Международное сотрудничество, участие в совместных научных и стартап-проектах в области исследований и разработок - один из важных путей развития направления, которое обеспечит большую доступность инновационных препаратов для россиян.
Алексей Шавензов, директор по взаимодействию с государственными органами власти компании "Джонсон&Джонсон":
- Сегодня инновационные технологии в здравоохранении развиваются настолько стремительно, что существующие регуляторные системы вскоре могут оказаться не готовы к их принятию. Терапевтическая медицина двигается по пути персонификации. Унифицированные регуляторные механизмы (например, проведение локальных клинических исследований на популяции или экспертиза качества препарата в лаборатории регуляторных органов) могут быть неприменимы для таких индивидуализированных решений, как генетически модифицированная аутологичная Т-клеточная иммунотерапия. Работа по созданию современного российского регуляторного пространства в отношении подобных инноваций должна проводиться заранее, в тесном сотрудничестве с профессиональным сообществом и с учетом уже накопленного международными регуляторными агентствами (такими, как FDA и EMA) опыта.
Сергей Андреев, директор по лабораторной диагностике "АстраЗенека", Россия и Евразия:


Основой современного подхода к лечению онкологических пациентов является применение "таргетных" препаратов. Более 70 процентов новых лекарственных препаратов для назначения требуют выявления молекул-мишеней, и лабораторная диагностика требует все более современных методов. Генетическими маркерами для назначения "таргетной" терапии являются наследственные или опухолевые (соматические) мутации. В силу требований к сертификации и регистрации тест-систем, клинические лаборатории проводят исследование стандартных мутаций методом полимеразной цепной реакции (ПЦР). Выявление расширенного спектра мутаций методом геномного профилирования (NGS) позволяет расширить количество пациентов с высокими шансами на излечение. Панели, объединяющие в себе десятки генов, связанных с заболеваниями, анализируют в крупных лабораториях, имеющих лицензию для научных исследований, однако в стандартной клинико-диагностической лаборатории такая услуга пока не доступна. Регистрация высокотехнологичного оборудования и панелей для анализа генов в Росздравнадзоре ведется, однако процедура новая, и требует принятия нестандартных решений, также как и внесение данной услуги в стандарты оказания медицинской помощи и в ОМС.
Молекулярные процессы в опухоли
Каждая здоровая клетка содержит молекулу ДНК, из которой она считывает информацию, какую форму и специальность получить, какие белки и ферменты производить, а главное, когда делиться и умирать. Подробнее о том, как это происходит почитайте в нашем первом материале .
Мутации в протоонкогенах и генах-супрессорах, отвечающие за деление и смерть клетки, приводят к тому, что клетка перестает следовать инструкции и синтезирует белки и ферменты неправильно. Молекулярные процессы выходят из-под контроля: клетка постоянно делится, отказывается умирать и копит генетические и эпигенетические мутации. Поэтому злокачественные новообразования часто называют болезнью генома.
Драйверные мутации создают различные популяции клеток, что обеспечивает разнообразие опухоли. Эти популяции или клоны по-разному реагируют на лечение: некоторые из них устойчивы и приводят к рецидиву. К тому же разная чувствительность клонов к терапии может привести к радикальному изменению молекулярного профиля в ходе лечения: даже незначительные в начале популяции клетки могут получить преимущество и стать доминирующими в конце лечения, что приведет к устойчивости и развитию опухоли.

Источник: Cell .
Иллюстрации: Майкл Ковальски .
Молекулярная диагностика
Драйверные мутации, изменения в количестве или структуре белков используют в качестве биомаркеров — мишеней, по которым подбирают лечение. Чем больше мишеней известно, тем более точным может быть выбор из потенциально эффективных схем лечения.
Отделить драйверные мутации от остальных и определить молекулярный профиль опухоли непросто. Для этого применяется технология секвенирования, флуоресцентной гибридизации in situ (FISH), микросателлитного анализа и иммуногистохимии.
Методы секвенирования нового поколения позволяют выявить драйверные мутации, включая те, что делают опухоль чувствительной к таргетной терапии.
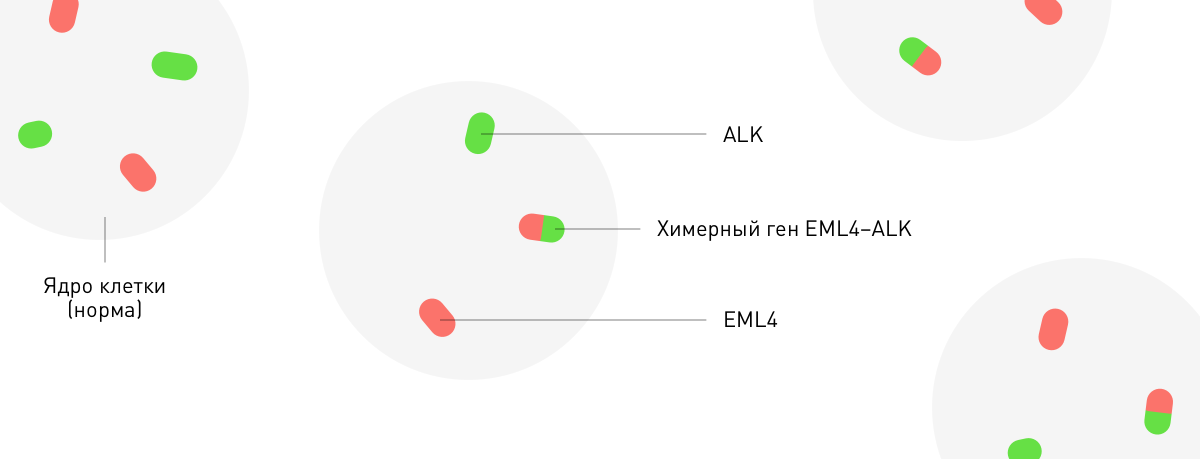
Флуоресцентная гибридизация in situ (FISH).
Микросателлитный анализ показывает степень нарушения системы репарации ДНК, а иммуногистохимия — белковые биомаркеры, расположенные на поверхности, в цитоплазме и ядрах опухолевых клеток.
Специалисты Solo исследуют до 450 генов и биомаркеров, чтобы оценить, как опухоль может ответить на применение более таргетных препаратов для лечения онкологических заболеваний. Для некоторых из них анализ биомаркера продиктован производителем. Для других используют данные клинических исследований и рекомендации международных сообществ онкологов.
Помимо выбора мишеней для таргетной терапии, молекулярное профилирование помогает обнаружить мутации, которые напротив, делают опухоль устойчивой к определенному лечению, или генетические особенности, которые связаны с повышенной токсичностью и требуют индивидуального подбора дозы лекарства.
Для исследований используется материал биопсии или парафинизированные блоки послеоперационного материала.
Молекулярное профилирование дает дополнительную информацию о заболевании, но она не всегда применима для выбора лечения. Например, в ситуациях, когда стандартная терапия обладает достаточной эффективностью или показано хирургическое лечение. Можно определить клинические ситуации когда такое исследование может быть наиболее полезно:
- Редкий вид опухоли;
- Опухоли с неустановленным первичным очагом (неизвестно, где изначально появилась опухоль, давшая метастазы);
- Тех случаев, когда требуется выбор из нескольких вариантов применения таргетной терапии;
- Исчерпаны возможности стандартной терапиии требуется экспериментальное лечение или включение пациента в клинические исследования.
Специалисты проекта Solo консультируют онкологов или пациентов и подсказывают, нужен ли тест в данном случае.
Результат диагностики также включает рекомендации по клиническим исследованиям с подходящим тестируемым препаратом. У пациента есть возможность принять в них участие.
Прецизионная медицина и клинические исследования
Обычно в медицинской практике применяют общие стратегии для лечения пациентов с определенным диагнозом. Для мелкоклеточного рака легкого используется одна стратегия, для немелкоклеточного — другая. Для онкологических заболеваний этот метод подходит не всегда. Из-за различий на молекулярном уровне даже при одном и том же типе опухоли пациенты могут получить неэффективное или лишнее лечение.
С увеличением исследований и изобретением таргетных препаратов, подход к лечению онкологических заболеваний начал меняться. Чтобы увеличить безрецидивный период и продолжительность жизни пациента, нужно учитывать молекулярный профиль опухоли, ответ организма на лекарственные препараты и химиотерапию (фармакогеномика), знать главные биомаркеры.
Прецизионная медицина позволяет существенно улучшить прогноз конкретного пациента, избежать серьезных побочных эффектов онкологических препаратов и значительно повысить качество жизни больного. Но и у этого метода существуют недостатки.
Таргетных препаратов становится все больше, и они имеют два основных ограничения: большинство молекулярно-направленных агентов обеспечивают лишь частичное подавление сигнальных путей и многие из них слишком токсичны для использования в комбинации.
Представьте, что вы архитектор Москвы. Перед вами стоит непростая задача — решить проблему с пробками в час пик, построив один мост. Молекулярные механизмы можно сравнить с движением машин, а мост — главный препарат, который должен решить основную проблему. Кажется, что несколько лекарств (серия мостов), направленные на главные молекулярные нарушения, могут решить эту проблему. Но токсичность препаратов при этом увеличивается и может быть непредсказуемой.
Мы стали лучше понимать молекулярные процессы злокачественных опухолей, но текущие методы внедрения точной онкологии в клиническую практику сильно отстают. Чтобы ускорить изучение таргетной терапии, ученые разработали два новых подхода — Basket и Umbrella.

Суть метода Basket в том, что для исследования выбирают пациентов с определенным биомаркером, независимо от расположения и названия опухоли. В мае 2017 года FDA одобрила такой метод лечения для биомаркера под названием высокая микросаттелитная нестабильность (MSI-H) или дефект восстановления несоответствия (dMMR).
Молекулярные нарушения отличаются не только у разных пациентов, но и в пределах одной опухоли. Гетерогенность — большая проблема в онкологии, для решения которой был разработан дизайн исследования Umbrella. Для метода Umbrella пациентов сначала отбирают по типу злокачественных новообразований, а потом учитывают генетические мутации.
Такие исследования помогают не только собрать информацию о действии таргетных препаратов — иногда это единственная возможность для пациентов, которые не отвечают на стандартное лечение зарегистрированными препаратами.
Клинический пример
Мы решили привести наглядный пример, как может выглядеть использование расширенного молекулярного профилирования.
Пациент с меланомой кожи и метастазами в печени обратился к онкологу. Врач и пациент приняли решение сделать молекулярное профилирование, чтобы получить более полную информацию о заболевании. Пациенту провели биопсию и отправили образцы ткани на исследование. В результате диагностики в опухоли обнаружили несколько важных генетических нарушений:

Ориентируясь на результаты клинических исследований и рекомендации можно прийти к следующим выводам:
- Потенциально эффективными могут быть препараты класса BRAF-ингибиторов (Вемурафениб), более того, наличие мутации NRAS может служить дополнительным основанием для назначения двойной блокады сигнального каскада — комбинацией с MEK-ингибиторами (Траметиниб).
- Несмотря на то что нет одобренной терапии, направленной непосредственно на онкоген NRAS, известно, что мутации в нем повышают вероятность успешного лечения при назначении иммунотерапии (Ипилимумаб и Пембролизумаб).
- Наследственный генетический вариант в гене TPMT указывает на повышенную индивидуальную токсичность Цисплатина, что требует коррекции дозы при назначении платиносодержащих режимов терапии.
Таким образом, врач получает возможность ориентироваться среди возможных вариантов лечения отталкиваясь не только от клинических параметров пациента, но и учитывая молекулярные особенности опухоли.
Молекулярная диагностика — это не панацея для всех онкологических заболеваний. Но это важный инструмент для онколога, который позволяет подойти к лечению злокачественных опухолей с новой стороны.
Спасибо, что читали и комментировали наши материалы об онкологии. Вот полный список статей:
Читайте также:

