Миелома метастазы в тазу
Метастазы в костях — явление вторичного ракового заболевания, при котором раковые клетки мигрируют в костные ткани и образуют злокачественные опухоли. Метастазирование происходит на поздних стадиях развития рака и сопровождается болью, повышением уровня кальция в плазме крови, нарушением кровотока и переломами.
- Причины
- Симптомы
- Гиперкальциемия
- Патологические переломы
- Спинномозговая компрессия
- Виды
- Остеобластический
- Остеолитический
- Диагностика
- Лечение
- Операция
- Химиотерапия
- Лечение бисфосфонатами
- Иммунотерапия
- Сколько живут с метастазами в костях
- Профилактика
- Видео: Метастазы в костях
- Анонимные отзывы
Причины
Появление mts (метастазов) в костях обусловлено распространением раковых клеток по кровеносным сосудам из первично пораженного органа в костные ткани, развиваясь в злокачественные опухоли. Чаще всего раковые клетки мигрируют из первично пораженных щитовидной, предстательной и молочной желез, легких, почек, а также при Саркомах, лимфомах и лимфоме Ходжкина. Реже встречаются метастазы из шейки матки, яичников, ЖКТ и мягких тканей и очень редко из других органов. Наиболее частую локализацию имеют метастазы в кости с обильным кровоснабжением: кости таза, рук, ног, грудной клетки, позвоночник, череп, костный мозг и в ребрах. Не редко метастазы обнаруживаются в тазобедренном суставе, плечевом и коленном суставах. При раке груди у женщин, при раке щитовидной железы, почек и легких метастазы могут пойти в мечевидный отросток, тело и рукоятку грудины, а также в подвздошную кость, ребра, тазовые, тазобедренные кости и кости плеча.
Опухоли нарушают работу остеобластов и остеокластов — больших многоядерных клеток, ответственных за регуляцию строения и разрушения костных тканей в процессе клеточного обновления.
Хирургическое вмешательство, патологические переломы и прочие осложнения метастазирования могут вызвать хилостаз (застой лимфы), что приводит к отекам. Метастазы в костях могут причинять сильные боли, например, при меланоме позвоночника или опухоли седалищной кости, которая может сдавливать нерв.
Ведущие клиники в Израиле



Симптомы
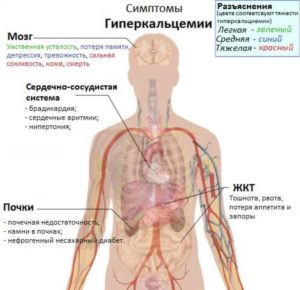
Основные симптомы вызывают гиперкальциемия, патологические переломы и спинномозговая компрессия. Также отмечается повышенная температура из-за активного метаболического процесса и ускоренного деления клеток.
У трети пациентов метастазы в костях вызывают гиперкальциемию. Кальций, входящий в состав костей, при эрозии кости высвобождается и попадает в кровь. Гиперкальциемия вызывает ряд симптомов:
Нервная система:
- Нестабильность психики;
- Заторможенность;
- Депрессия;
- Расстройство умственной деятельности.
Сердечно-сосудистая система:
- Понижение давления;
![]()
- Аритмия.
ЖКТ:
- Отсутствие аппетита;
- Тошнота;
- Рвота;
- Язвенные образования.
Мочевыделительная система:
- Увеличенное образование мочи;
- Почечная недостаточность;
- Интоксикация.
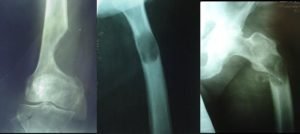
Пораженный метастазами участок кости становится хрупким из-за сбоя в работе остеобластов и остеокластов, что приводит к патологическим переломам. Патологические переломы появляются, если повреждено более половины внешнего костного слоя. Перелом может спровоцировать несильный удар или же очевидная причина может вовсе отсутствовать. От метастатических поражений чаще всего страдают бедренные кости, грудной и поясничный отдел позвоночника.
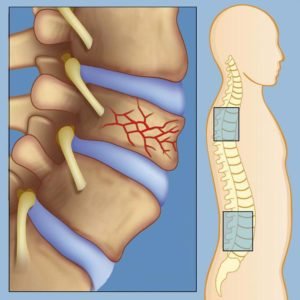
До 5% пациентов с mts в позвоночнике подвергаются развитию спинномозговой компрессии, из которых в более половины случаев метастазы обнаруживаются в грудном позвоночном отделе. Разрастающаяся опухоль или обломки кости от перелома могут сдавливать спинной мозг, что приводит к зачастую необратимому параличу, если вовремя не обнаружить нарушение. В случае уже развившегося паралича лишь одному из десяти пациентов удается восстановить двигательную функцию.
Если компрессии способствовало постепенное увеличение опухоли, то признаки сдавливания спинного мозга бывают долго не замечены, в отличие от случая, когда к компрессии приводит сдвинувшийся обломок позвонка.
Остеобласты и остеокласты — основные клетки, участвующие в нормальном обновлении костных тканей. При метастазах в костях нарушается аллостаз (способность организма реагировать на нетипичные изменения и осуществлять гомеостаз – саморегуляцию), из-за чего клетки начинают работать с патологическим уклоном, организм не справляется с регуляцией клеточных процессов и в костях возникает субтотальное поражение.
Остеобласты — это строительные клетки скелета, которые заполняют собой пустые участки, производят межклеточное вещество (матрикс) и превращаются в клетки костной ткани (остеоциты). Если из-за метастазов в костях происходит сбой работы остеобластов, то в костях образовываются остеосклеротические очаги (иначе склеротические, т. е. уплотнения) — такие нарушения называются остеобластическими или бластическими, а образование уплотнений остеобластическим процессом.
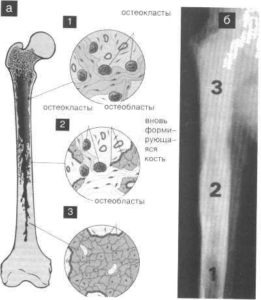
Остеолитическими называют нарушения в костях, при которых происходит деструкция костной ткани. Что это такое? Остеокласты разрушают костную ткань, чтобы дать возможность образоваться новым костным клеткам. Сбой в их работе приводит к неконтролируемому разрушительному процессу, при котором образуются отверстия в костях. Кости становятся хрупкими и ломкими, легко ломаются и трескаются.
Редко встречаются метастазы в костях, приведшие к одному единственному типу повреждения и проявление повреждений чаще всего смешанного типа, с признаками как уплотнения тканей на отдельных участках, так и разрушения.
Диагностика
Чтобы проверить наличие метастазов, существует ряд процедур для диагностики на разных стадиях развития заболевания:
- Сцинтиграфия — обследование путем ввода радиоактивных изотопов для получения двумерного изображения, где проявляются пораженные участки, которые выглядят как белые пятна. Помогает узнать о присутствии метастазов на раннем этапе их развития;
- Рентгенография — позволяет выявить характер поражения, заметный только на поздних стадиях;
- Компьютерная или магниторезонансная томография дают трехмерное изображение скелета;
- Биохимическое исследование крови для проверки уровня кальция в плазме крови и диагностики гиперкальциемии;
- Биопсия — позволяет точно определить злокачественность новообразований и поставить окончательный диагноз.
Лечение
Лечение назначается врачом-онкологом на основании данных анализа крови, локализации первичных и вторичных раковых образований, стадии разрушения и разновидности поражения костей (остеобластические и остеолитические лечатся по-разному). Основное направление лечения заключается в устранении тяжелых осложнений для улучшения качества жизни пациента. Если болят позвоночник и кости, то прибегают к обезболиванию. Как лечить метастазы онколог определяет после всех необходимых диагностических процедур.
Лечение заключается в применении медикаментозных средств, таких как гормональные препараты, бисфосфонаты, препараты для повышения иммунитета и процедуры местного воздействия: облучение и хирургические операции. Чтобы снять боли, назначают обезболивающие. К народным средствам относятся отвары трав, припарки, в том числе народные средства от боли, например, мазь из корня окопника, которой лечат, нанося на больное место.
Оперативное вмешательство производится в случае, если пошли тяжелые осложнения, такие как перелом, спинномозговая компрессия, потеря подвижности конечностей или паралич. Оперативным путем удаляются опухолевидные образования. Если необходимо восстановить структуру костей, устанавливаются поддерживающие штифты и пластины. Операцию показано делать при благоприятной картине заболевания и хорошем общем состоянии пациента. В иной ситуации рекомендуется для поддержки костей использовать приспособления для фиксации.
Для проведения операции остеосинтеза (сращения костей посредством сплавов металла) рекомендуется использовать титан, чтобы избежать металлоза – окисления металла и проникновения его частиц в мышечную ткань. При сильной деформации кости после удаления опухоли в некоторых клиниках пластический хирург проводит пластическую операцию на кость или эндопротезирование суставов.
Химиотерапия и лучевая терапия назначаются для уничтожения раковых клеток, предупреждения дальнейшего развития метастазов. Курс химии и облучения подготавливает пациента к операции и поддерживает после нее. Лучевой терапией называется просвечивание ионизирующим излучением, которое разрушает раковые клетки, либо введение препаратов стронций-89 или самарий-153. Постлучевые осложнения требуют реабилитации по окончанию курса.
Бисфосфонатные препараты оказывают значительную помощь в замедлении секундарных изменений (вторичных раковых образований) в целом и разрушения костей в частности, подавляя неконтролируемую работу остеобластов и обеспечивая баланс между разрушительным и восстановительным процессом.
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную смету на лечение.
Миелома позвоночника – это не совсем верный термин. Есть такое заболевание, которое называется миеломная болезнь. Она развивается в результате злокачественного перерождения предшественников лимфоцитов. В результате образуется клон злокачественных клеток, который постепенно распространяется по всему организму, поражая костный мозг и внутренние органы.
- Причины заболевания
- Механизм прогрессирования заболевания
- Ранние признаки миеломы позвоночника
- Диагностика
- Лечение
- Дает ли миелома позвоночника метастазы?
- Прогноз выживаемости
- Осложнения
- Ремиссия
Поражение позвоночника при миеломе может быть представлено двумя вариантами:
- Единичный очаг остеодеструкции. В этом случае речь идет о солитарной плазмоцитоме.
- Множественные очаги остеодеструкции. Картина соответствует множественной миеломе.
Ряд авторов считает солитарную плазмоцитому ранней стадией развития множественной миеломы, поскольку у большинства больных она со временем диссеминирует по всему организму даже на фоне, казалось бы, радикального излечения.
Поражение костей при миеломе – это неизбежный процесс, который на поздних стадиях заболевания сопровождает каждого больного. При этом отмечаются следующие признаки:
- Остеолизис — расплавление костной ткани.
- Остеопороз — снижение плотности костной ткани.
- На фоне остеолизиса и остеопороза неизбежно возникают патологические переломы — нарушение целостности кости без воздействия выраженного травмирующего фактора.
- Гиперкальциемия — увеличение содержания ионов кальция в крови за счет его выхода из костной ткани.
Причины заболевания
Миелома развивается из-за злокачественного перерождения В-лимфоцитов, точнее их предшественников. Что вызывает эти мутации, не ясно, но есть некоторые закономерности, на фоне которых вероятность развития заболевания увеличивается по сравнению с общей популяцией людей. Эти закономерности называют факторами риска. Для миеломы это:
- Возраст старше 40 лет.
- Мужской пол.
- Негроидная раса.
- Наличие иммунодефицитных состояний, причем как врожденных, так и приобретенных: ВИЧ, лечение цитостатиками, необходимость приема иммуносупрессивной терапии при трансплантации органов и др.
- Наличие миеломы у близких родственников.
- Воздействие радиации, в том числе и лучевая терапия при лечении онкологии.
- Моноклональная гаммапатия.
Механизм прогрессирования заболевания
Механизмы прогрессирования солитарной плазмоцитомы во множественную миелому до конца не изучены ввиду редкости данной патологии. Тем не менее, есть основания полагать что трансформацию вызывает нестабильность генома, когда случайные генетические поломки приводят к тому, что нарушается процесс дифференцировки плазматических клеток, блокируется механизм апоптоза и они начинают бесконтрольно делится и размножаться.

Ранние признаки миеломы позвоночника
На ранних этапах поражения позвоночника симптомы могут отсутствовать, и заболевание обнаруживается случайно, при обследовании по другому поводу. Первым признаком являются боли. Сначала они не интенсивны и не постоянны. Чаще всего, локализуются в области поясницы и грудного отдела. Симптоматика имеет неспецифический характер, поэтому больным часто выставляют неверный диагноз, типа остеохондроза, радикулитов или невралгии.
По мере прогрессирования заболевания, усиливается разрушение костной ткани, что приводит к нарастанию симптоматики. Боли в позвоночнике становятся постоянными, усиливаются от малейшего движения. В некоторых случаях миелома манифестирует с внезапной острой боли, которая возникает из-за патологических переломов. В ряде случаев последние осложняются компрессионным сдавлением спинного мозга и его корешков.
В целом интенсивность болей находится в прямой зависимости от опухолевой массы. Чем больше злокачественных клеток, тем сильнее деструкция костной ткани, соответственно более ярче выражены симптомы.
При очаговой миеломе неврологическая симптоматика в основном развивается на фоне сдавления опухолевой массой нервных корешков и спинного мозга. При этом будут наблюдаться парезы и параличи, в зависимости от уровня поражения. Второй причиной развития неврологических симптомов являются патологические переломы позвонков.
При трансформации во множественную миелому, неврологические осложнения обнаруживаются у 10-40% больных. Они связаны как с неопластическим действием опухоли на нервные ткани, так и с побочным влиянием химиотерапии, применяющейся для специфического лечения. При этом может поражаться как центральная, так и периферическая нервная система:
- Вегетативная дисфункция — головокружение, быстрая утомляемость, тошнота, тахикардия, нарушения сна и др.
- Пирамидальная недостаточность — нарушается деятельность мышц, снижается их двигательная активность и тонус, постепенно это приводит к атрофическим изменениям. Могут быть клонические судороги.
- Мозжечковая недостаточность — нарушение координации движения, выраженное в виде непроизвольных мышечных сокращений (хорея, миоклонии), нарушение мимики, речи и интеллекта, тремор головы и конечностей.
Под действием опухолевых клеток, в ткани кости возникают очаги деструкции. Во-первых, это связано с непосредственным замещением костной ткани опухолью. Во-вторых, злокачественные клетки выделяют вещества, которые подавляют деятельность остеобластов (клеток, отвечающих за репарацию костного вещества) и активируют действия остеокластов, которые наоборот, приводят к разрушению кости за счет растворения ее минеральной составляющей.
Диагностика
Для постановки диагноза необходимо проведение комплексного обследования, включающего ряд инструментальных исследований.
Анализ крови и мочи
В общем анализе крови часто обнаруживается нормохромная, реже – макроцитарная анемия. Характерным признаком является увеличение СОЭ, у некоторых пациентов оно может превышать 100 мм/час. При обширном поражении костного мозга выявляется нейтропения и тромбоцитопения.
В общем анализе мочи обнаруживается нарастающая протеинурия, которая связана с прогрессированием нефропатии. При специальных исследованиях обнаруживается специфический белок — М-белок, М-градиент, белок Бенс-Джонса.
В миелограмме (изучение образца костного мозга под микроскопом) обнаруживается увеличение содержания плазматических клеток. Диагноз миелома выставляется, если количество плазмоцитов превышает 10%.
Лечение
Большинство больных с миеломой позвоночника проходят лечение с помощью лучевой терапии в суммарной дозе 40 Гр, поскольку миеломные клетки очень чувствительны к ионизирующему излучению. При размере опухоли более 5 см, дозу могут увеличить до 50Гр. Поле облучения должно включать минимум по одному непораженному позвонку сверху и снизу от места локализации опухоли. Признаками эффективности лечения является склероз и реминерализация очага поражения.
При лечении множественной миеломы с поражением позвоночника, облучение применяется в рамках паллиативной терапии для облегчения болевого синдрома и замедления остеолизиса.
Хирургическое лечение показано пациентам с функциональной нестабильностью позвоночника и при наличии неврологической симптоматики. В ряде случаев, при наличии показаний, пациенту предлагают провести операцию превентивно, не дожидаясь патологических переломов. В рамках лечения применяются различные виды вертебропластики.
Применение химиотерапии для пациентов с солитарной плазмоцитомой остается спорным моментом. А вот для пациентов с множественной миеломой с поражением позвоночника, это ключевой метод лечения. Большие успехи были достигнуты при включении в протоколы талидомида, леналидомида и бортезомиба:
- Бортезомиб — ингибитор протеасом – ферментов, которые играют важную роль в поддержании гомеостаза клетки, ее росте и размножении. Подавление действия протеасом блокирует селективный протеолиз, что влияет на многие внутриклеточные процессы, в том числе на передачу сигналов. Все вместе это приводит к гибели клетки. Помимо этого, экспериментально было подтверждено, что бортезомиб усиливает активность остеобластов и подавляет функции остеокластов у больных с миеломой.
- Талидомид — препарат, оказывающий иммуномодулирующее, антиангиогенное и цитотоксическое действие. Предпосылкой к применению данного препарата послужили данные о том, что у больных с миеломой в костном мозге обнаруживается усиление ангиогенеза, что способствует пролиферации и рассеиванию злокачественных клеток. При дальнейших испытаниях было выявлено, что помимо антиангиогенного действия, препарат вызывает клеточный апоптоз. В настоящее время талидомид применяется у больных, лечение которым еще не назначалось, при рецидивах после предыдущих курсов химиотерапии, а также у больных, резистентных к другим видами препаратов. Может применяться как в качестве монотерапии, так и в схемах полихимиотерапии.
- Леналидомид. С точки зрения структуры, аналогичен талидомиду, но оказывает более выраженное биологическое действие. Наибольшую эффективность показал при терапии гемопоэтических опухолей, особенно при наличии мутаций 5 хромосомы.
Пациенты с костными миеломами, в том числе с миеломой позвоночника являются сложной категорией больных, сложно поддающихся терапии. Поэтому им по возможности назначаются 4-5 компонентные схемы химиотерапии, например, VDCR или VD-PACE, которые имеют в своем составе бортезомиб.
Дает ли миелома позвоночника метастазы?
К сожалению, все имеющиеся на сегодняшний день методы терапии солитарной плазмоцитомы не гарантируют полного излечения. Могут развиваться рецидивы, которые локализуются как вне пределов первичной опухоли, так и на месте бывшего очага. Реже поражаются регионарные лимфатические узлы.
Также очаговая миелома (плазмоцитома) может трансформироваться в миеломную болезнь. У половины больных, трансформация обнаруживается в течении 5 лет после лечения плазмоцитомы, и у 72% – в течение 10 лет. Среднее время до прогрессирования составляет 2 года, но могут быть существенные различия. Ключевым моментом является возраст больного – чем он старше, тем выше риск трансформации.
Прогноз выживаемости
При хороших результатах лечения первичной опухоли и отсутствии трансформации в множественную миелому, прогнозы относительно неплохие. Общая пятилетняя выживаемость таких больных составляет 74%, 10-летняя 34-54%. Главным фактором, влияющим на выживаемость, является возраст больного. Для пациентов младше 60 лет, прогноз более благоприятный.
Осложнения
Основными осложнениями миеломы позвоночника являются компрессионные переломы со сдавлением спинного мозга и спинномозговых корешков. При этом развиваются выраженные боли, парезы и параличи. Для устранения таких осложнений применяются реконструктивные хирургические вмешательства.
Ремиссия
О достижении ремиссии свидетельствует склероз и реминерализация опухолевого очага. Все пациенты, прошедшие лечение по поводу очаговой плазмоцитомы, должны находиться под пожизненным медицинским наблюдением, поскольку всегда сохраняется вероятность прогрессирования заболевания во множественную миелому.
Множественная миелома является одной из неоплазм В-клеток. Ее клетки постоянно продуцируют Ig, и при делении клона В-лимфоцитов образуют большое количество незрелых плазматических клеток. Эти клетки инфильтрируют костный мозг и иногда обнаруживаются в крови. Малигниза-ция может происходить на ранних этапах дифференцировки В-клеток, однако клональная экспансия осуществляется на уровне плазматических клеток. Поэтому клетки множественной миеломы продуцируют большие количества моноклонального Ig.
Молекула иммуноглобулина состоит из двух легких (22 кДа) и двух тяжелых (55-70 кДа) полипептидных цепей. Цепи соединяются между собой ковалентными (дисульфидными) и нековалентными связями. Строение тяжелой цепи варьирует, и известно пять самостоятельных ее типов: γ, α, μ, δ, и ε. Эти пять типов соответствуют пяти классам иммуноглобулинов, IgG, IgA, IgM, IgD и IgE.
Более того, всего существует 10 различных типов тяжелой цепи, четыре γ, две а, две u и только по одной δ и ε. Из всех у-иммуноглобулинов, IgG3 обладает повышенной способностью к полимеризации. Полимеризу-ются также молекулы IgA и IgM. Однако существуют только два типа легкой цепи — каппа (κ) и лямбда (λ). Иммуноглобулины IgG, IgD и IgE присутствуют в плазме крови в виде мономерных молекул с молекулярной массой 160-200 кДа.
Молекула IgM представляет собой макроглобулин (молекулярная масса 900 кДа), который синтезируется в виде пентамера, имеющего структуру IgG. Иммуноглобулин IgA продуцируется плазматическими клетками кишок и дыхательных путей. Поэтому он присутствует в секретах, например в слюне, слезах, а также в слизистой бронхов и кишечника и в крови. Этот иммуноглобулин играет важную роль в защите организма от инфекций.
Обычно различные иммуноглобулины синтезируются в клетке в ответ на разные антигенные стимулы. Каждая молекула иммуноглобулина узнает только соответствующий ей антиген, и часть молекулы, которая ответственна за это узнавание, называется идиотипической детерминантой. В миеломе иммуноглобулин продуцируется клоном трансформированных плазматических клеток и относится к одному определенному типу (т. е. к одному идиотипу). Это белок миеломы или М-белок, или парапротеин. Его не следует путать с IgM. Легкая цепь всегда представлена только двумя типами — к или X.
Когда легкие цепи выходят в кровь, они проходят через гло-мерулярную мембрану и попадают в мочу. Они обладают характерной способностью образовывать хлопьевидный осадок (белок Бенс-Джонса) при нагревании мочи до 50-60°, а при дальнейшем повышении температуры до значений близких к температуре кипения осадок растворяется.
В 40-50% случаев миеломы наблюдается экскреция свободных легких цепей, и в настоящее время это обнаруживается методом иммуноэлектрофореза мочи.
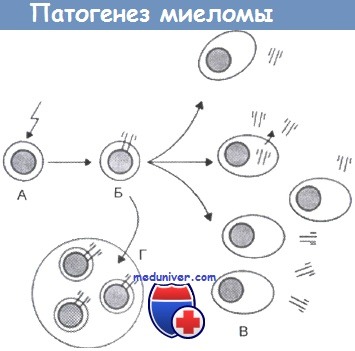
Патогенез миеломы:
(А) трансформация В-клетки;
(Б) клональная экспансия трансформированных В-клеток;
(В) пролиферация плазматических клеток, приводящая к поражению костей и к синтезу парапротеина;
(Г) подавление функции нормальных В-клеток, приводящее к гипогаммаглобулинемии.
Основные классы иммуноглобулинов обладают различными физическими свойствами. Это имеет большое клиническое значение, поскольку многие стороны заболевания связаны или с самими молекулами Ig, или с их физическими характеристиками. Например, IgM характеризуется высокой молекулярной массой, и синдром гипервязкости является довольно распространенным (см. ниже). Молекулы IgA полимеризуются в плазме, в результате чего увеличивается вязкость крови. Белок легких цепей может откладываться в почечных канальцах, что приводит к нарушениям функции почек.
Полимеры легких цепей являются одним из компонентов амилоида, который также способствует нарушениям почечной функции. Заболеваемость различными типами миеломы примерно соответствуют концентрации нормальных сывороточных Ig и отражает количество плазматических клеток, характерное для каждой группы больных. Наиболее распространенной является IgG-миелома. Второе место занимает IgA-миелома. Клетки настоящей миеломы редко продуцируют иммуноглобулин М, и обычно это связано с макроглобулинемией Вальденстрема или с неходжкинскими лимфомами. IgD-миелома крайне редка, еще реже встречается IgE-миелома. Для того чтобы обнаружить дискретную полосу парапротеина, необходимо, чтобы у больного насчитывалось более 5х10 9 плазматических клеток.
Оценить массу опухоли у больных с миеломой можно, используя формулу, учитывающую такие показатели, как уровень гемоглобина, кальция и мочевины в крови, наличие множественных поражений костей, а также концентрацию парапротеина. Больные с опухолью большой массы (более 0,5 х 10 12 клеток) характеризуются худшим прогнозом, и их лекарственное лечение не всегда оказывается эффективным. В таблице выше представлены некоторые важные прогностические показатели.

В одной из наиболее успешных попыток оценить прогноз заболевания использовалась формула, в которую подставлялись значения содержания сывороточного b2-макроглобулина (s-b2m) и исходного уровня гемоглобина (Hb). Чем выше была полученная величина, тем хуже оказывался прогноз.
Характерной особенностью заболевания является подавление синтеза нормального иммуноглобулина. Каким образом, в результате этого вместо доброкачественных вариантов моноклональной гаммапатии развивается миелома, остается загадкой. Подавление синтеза затрагивает все классы иммуноглобулинов, и сильно способствует росту восприимчивости организма к бактериальным инфекциям.

Согласно современной точке зрения, между МГНЗ и миеломой существует целый спектр патологий, имеющих как относительно доброкачественную, так и несомненно злокачественную природу. МГНЗ разделяет с миеломой некоторые общие свойства: усиленный синтез Ig, и в некоторых случаях наличие в моче белков Бенс-Джонса. Однако при этой патологии инфильтрация костного мозга плазматическими клетками происходит в более слабой степени ( 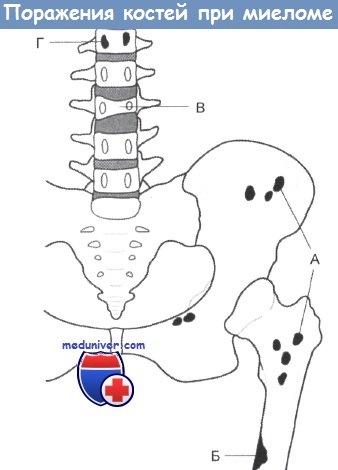
А Типичные повреждения, имеющие характер множественных округлых полупрозрачных пятен без признаков склероза
Б Некоторые повреждения могут достигать значительных размеров и часто вызывают ломкость длинных костей
В Нередко наблюдается остеопороз и разрушение позвонков
Г Исчезновение ножки дуги позвонка - признак инфильтрации, который при осмотре нередко пропускают
Однако уверенная гистологическая диагностика возможна, только если степень инфильтрации составляет не менее 20% от всех ядерных элементов костного мозга. Впрочем, можно поставить диагноз и при меньшей степени инфильтрации.
Обычно поражения костей носят литический характер, что приводит к частым патологическим переломам. Механизм разрушения кости не вполне ясен, однако известны факторы активирующие остеокласты, которые продуцируются клетками миеломы или зрелыми В-клетками. Поражаются все кости скелета, и наиболее часто позвонки, ребра, кости таза и черепа, а также длинные трубчатые кости.
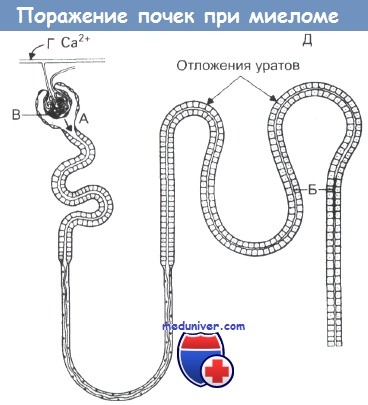
Поражение почек происходит различными путями. Во-первых, легкие цепи захватываются дистальными клетками почечных канальцев, где обычно происходит их деградация. Большие количества белка повреждают канальцы, и крупные фрагменты легкой цепи и альбумин заполняют канальцы, приводя к закупорке. Тем самым увеличивается нагрузка на оставшиеся нефроны. Из-за образования белковых агрегатов в клетках почечных канальцев происходит нарушение процессов реабсобции, сопровождающееся потерей аминокислот, глюкозы, ионов калия и фосфата (приобретенный синдром Фанкони).
Во-вторых, у 10% больных в гломерулярных кровеносных сосудах откладывается амилоид. Особенно это характерно для случаев, когда продуцируются только одни легкие цепи. При миеломе этот белок частично состоит из полимеризованных фрагментов легких цепей. Наиболее часто амилоид образует λ-легкая цепь. К числу других патологий, приводящих к нарушению функции почек, относятся периодическая гипер-кальциемия и обезвоживание, гиперкальциурия и нефрокаль-циноз, отложение уратов и утечка жидкости через почечные канальцы.
- Вернуться в оглавление раздела "Онкология"
Читайте также: