Мезоректумэктомия при раке прямой кишки
Принцип низкой передней резекции прямой кишки (НПР, тотальной мезоректумэктомии) - анатомическая резекция прямой кишки с сохранением интактной мезоректум, выполненная по онкологическим принципам.
Пороговый уровень местных рецидивов 
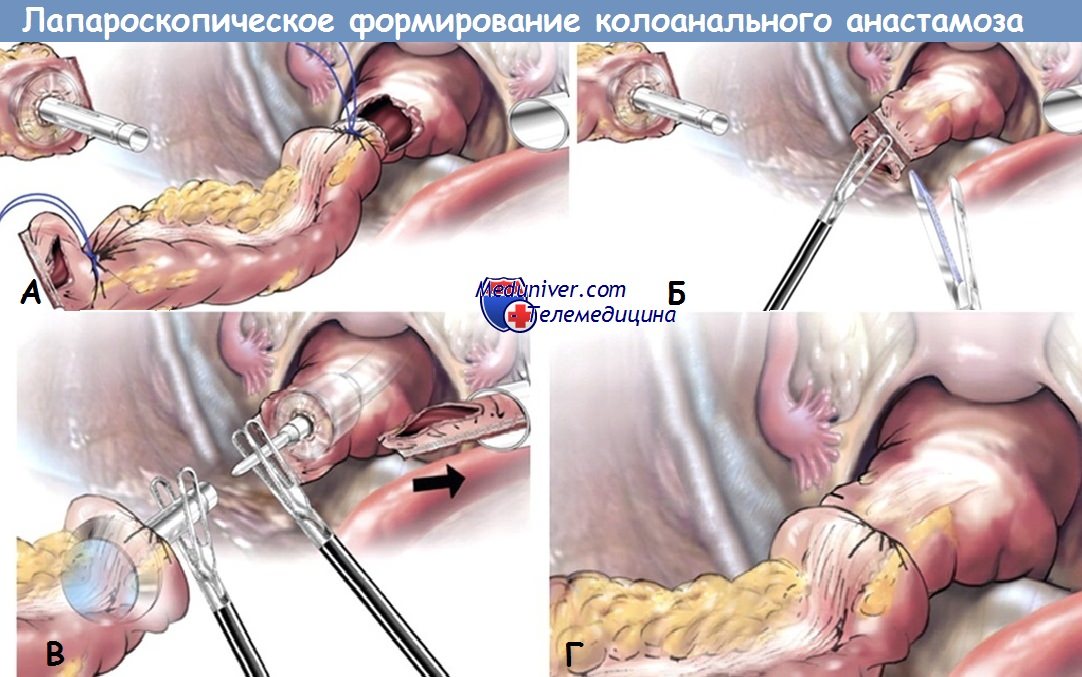
Низкая передняя резекция прямой кишки:
А - резекция прямой кишки,
Б - колоанальный анастамоз,
В - J-резервуар толстой кишки с анальным анастамозом после тотальной мезоректумэктомии,
Г - колоанальный анастамоз с тотальной мезоректумэктомией,
д) Этапы операции низкой передней резекции прямой кишки (НПР):
1. Положение пациента: модифицированное положение для промежностного камнесечения.
2. Лапаротомия:
а. Нижне-срединная: разрез до пупка считается адекватным, если желудок и селезеночный изгиб достижимы, в противном случае разрез продолжается выше пупка.
б. Альтернативный доступ: поперечный надлобковый разрез (с пересечением прямых мышц), по Пфанненштилю (поперечное рассечение кожи и апоневроза с разведением прямых мышц живота).
3. Ревизия брюшной полости: местная резектабельность, вторичные патологические изменения (печень/желчный пузырь, толстая кишка, женские половые органы, тонкая кишка), другие изменения.
4. Установка абдоминального ранорасширителя (например, ретрактора Bookwalter). Введенная под нерассеченную переднюю брюшную стенку большая пеленка оттесняет петли тонкой кишки из операционной раны, предоставляя свободный доступ в полость таза.
5. Ретроградная диссекция от сигмовидной кишки в направлении селезеночного изгиба вдоль белой линии Тольдта. Вход в забрюшинное пространство, выполненное рыхлой соединительной тканью. Тупое отделение брыжейки сигмовидной кишки от забрюшинных тканей, идентификация левого мочеточника. Разрез брюшины продолжается на таз.
6. Если необходимо: полная мобилизация селезеночного изгиба путем ретракции дистальной части поперечно-ободочной кишки и проксимальной части нисходящей кишки с поэтапной перевязкой связок. Необходимо избегать повреждения селезенки.
7. Рассечение брюшины справа от корня сигмовидной кишки с продолжением разреза на тазовую брюшину после адекватной мобилизации.
8. Вход в аваскулярное пространство позади верхней прямокишечной артерии, но кпереди от гипогастрального нервного сплетения; продолжение диссекции в аваскулярном слое вдоль фасции Вальдеера.
9. Пересечение сосудистой ножки (НБА или верхнепрямокишечная артерия) между зажимами с перевязкой или прошиванием. Перед пересечением необходимо убедиться в удаленности мочеточника.
10. Поэтапное пересечение брыжейки сигмовидной кишки до проксимальной границы резекции.
11. Продолжение диссекции в полости таза под контролем зрения с сохранением нервных сплетений, тупое выделение недопустимо (риск повреждения пресакральных вен!).
12. Острое выделение по передней и боковым полуокружностям до тазового дна, идентификация семенных пузырьков (мужчины), осторожная диссекция от ректовагинальной перегородки (женщины). При опухолях передней локализации - диссекция с включением в препарат фасции Денонвилье, при опухолях задней локализации - диссекция непосредственно позади фасции с сохранением вегетативных нервов.
13. А) Двойной степлерный шов: пересечение прямой кишки у тазового дна, т.е. примерно на 2-3 см проксимальнее зубчатой линии с помощью поперечного линейного или линейно-режущего степлера.
Б) Ручной шов: переход к промежностному доступу, установка анорасширителя Lone Star, разрез слизистой у зубчатой лини и мукозэктомия в направлении пуборектальной мышцы, у верхнего края которой происходит соединение с пресакральным пространством. Альтернатива: интерсфинктерная резекция -разрез на уровне зубчатой линии, вход в межсфинктерное пространство и продолжение диссекции в проксимальном направлении до соединения с абдоминальной бригадой.
14. Удаление препарата и макроскопическое исследование, гистологическое исследование замороженных срезов дистальной границы резекции.
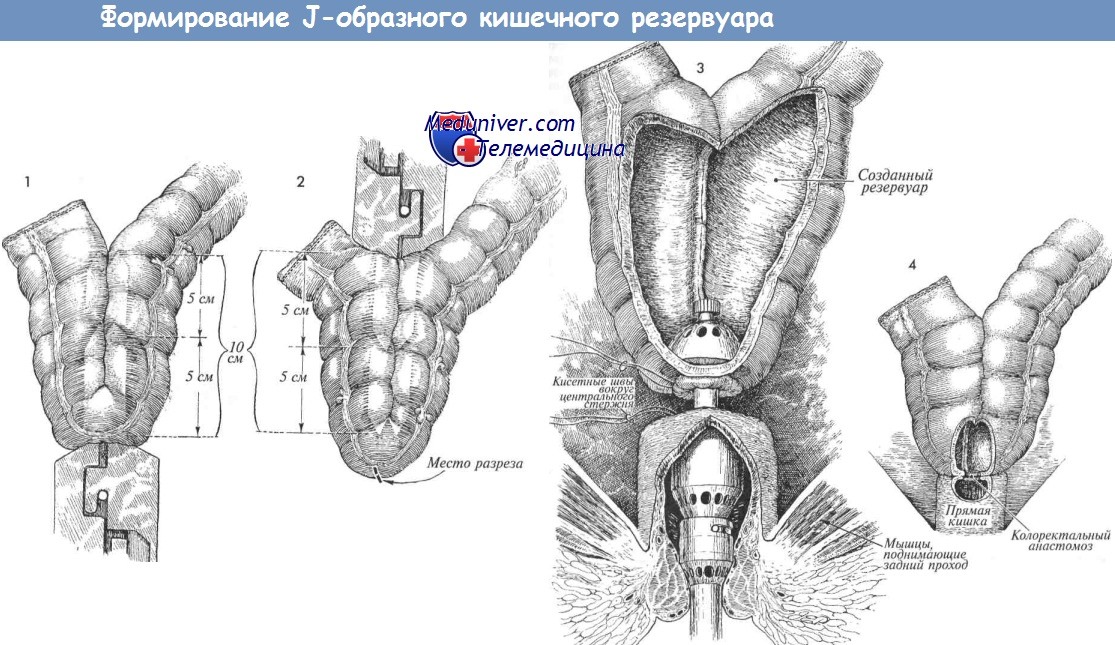
15. Толстокишечный резервуар: может рассматриваться как вариант во всех случаях ТМЭ, но абсолютно показан в тех случаях, когда диаметр проксимального отдела кишки не позволяет ввести головку 33-мм циркулярного степлера:
а. Толстокишечный J-резервуар: складывание кишки вдвое, апикальная энтеротомия, формирование резервуара длиной 5-6 см путем прошивания 75-мм линейно-режущим степлером. Свободный конец J-резервуара подшивается несколькими отдельными швами к приводящему колену резервуара.
б. Поперечный колопластический резервуар: продольный разрез стенки кишки длиной 4 см проксимальнее дистальной линии резекции на 3-4 см. Поперечное ушивание двухрядным швом.
16. А) Степлерный анастомоз: наложение кисетного шва на дистальный конец толстой кишки (прямой анастомоз, поперечный колопластический резервуар) или на энтертомное отверстие на верхушке J-резервуара; завязывание на введенной в просвет головке циркулярного степлера максимально возможного размера. Введение степлера в прямую кишку с формированием анастомоза без натяжения. Проверка целостности колец и пальцевое исследование анастомоза.
Б) Ручной анастомоз (накладывается со стороны промежности): зажимом, введенным в анус, захватывается конец кишки или верхушка J-резервуара и осторожно низводится в анальный канал, где подшивается шестью фиксирующими серозно-мышечными швами, отдельными швами восстанавливается слизистая. Удаление ретрактора.
17. Дренирование пресакрального пространства в зависимости от предпочтений хирурга. Необходимость в назогастральном зонде (НГЗ) отсутствует.
18. При двухэтапном лечении: формирование петлевой илеостомы. Иссечение кожи в виде диска в месте, выбранном и маркированном до операции. Рассечение подкожно-жировой клетчатки, апоневроза, разведение мышц и формирование отверстия под стому. Оборачивание петли тонкой кишки (дистальное колено маркируется) Seprafilm и выведение ее на переднюю брюшную стенку.
19. Ушивание лапаротомной раны.
20. Формирование петлевой илеостомы с хоботком длиной 3 см. Калоприемник.
е) Анатомические структуры, подверженные риску повреждения: левый мочеточник, яичковые/яичниковые сосуды, гипогастральные нервы, фасции, пресакральное венозное сплетение, влагалище.
з) Осложнения низкой передней резекции прямой кишки (НПР):
• Кровотечение (связанное с хирургическим вмешательством): пресакральные вены, неадекватное лигирование сосудистых пучков, разрывы селезенки, яичковые/яичниковые сосуды.
• Несостоятельность анастомоза (5-15%): технические ошибки, натяжение, неадекватное кровоснабжение, плохое состояние тканей после химиолучевой терапии.
• Повреждение мочеточника (0,1-0,2%).
- Вернуться в оглавление раздела "Хирургия"
+7 925 191 56 65
| Радиотерапия и радиохирургия |
| Химиотерапия |
| Рак матки |
| Дифференцирование рака матки |
| Факторы риска развития рака матки |
| Диагностика рака матки |
| Признаки рака тела матки |
| Метастазирование рака эндометрия |
| Лечение рака матки |
| Показания к лимфаденэктомии при раке матки |
| Экстирпация матки с лимфаденэктомией |
| Методика проф.Пучкова К.В. - лечение рака матки |
| Рак шейки матки |
| Скрининг на рак шейки матки |
| Стадии рака шейки матки |
| Факторы риска развития рака шейки матки |
| Симптомы рака шейки матки |
| Диагностика рака шейки матки |
| Лечение рака шейки матки |
| Рак яичника |
| Лапароскопия при раке яичника |
| Преимущества лапароскопического доступа |
| Пангистерэктомия - операция при раке яичника |
| Метод лечения рака яичника - проф.Пучков К.В. |
| Лечение рака яичников 3-4 стадии |
| Рак почки |
| Классификация рака почки |
| Факторы развития рака почки |
| Симптомы рака почки |
| Диагностика рака почки |
| Лечение рака почки |
| Лапароскопическая резекция почки |
| Органосохраняющая операция при раке почки |
| Опухоль надпочечника |
| Андостерома |
| Синдром Конна - гиперальдостеронизм |
| Гипертензионный синдром |
| Феохромацитома |
| Лапароскопия в лечении опухоли надпочечника |
| Органосохраняющая адреналэктомия |
| Синдром Иценко-Кушинга |
| Опухоль селезенки |
| Симптомы опухоли селезенки |
| Диагностика опухоли селезенки |
| Лечение опухоли селезенки |
| Спленэктомия лапароскопическая |
| Опухоли и полипы толстой кишки |
| Капсульная эндоскопия |
| Рак прямой кишки |
| Признаки рака прямой кишки |
| Стадии рака прямой кишки |
| Диагностика рака прямой кишки |
| Лечение рака прямой кишки |
| Лучевая терапия рака прямой кишки |
| Химиотерапия при раке прямой кишки |
| Пучков К.В.- метод лечения рака прямой кишки |
| Тотальная мезоректумэктомия |
| Лечение рака толстой кишки |
| Химиотерапия при раке толстой кишки |
| Внимание к родинкам |
| Меланома кожи |
| Базалиома кожи |
Операции на толстой кишке относятся к сложным и продолжительным вмешательствам. Верхняя прямокишечная артерия является непосредственным продолжением нижней брыжеечной артерии, направляется в ретроректальное пространство полости малого таза, разветвляясь позади прямой кишки и в ее стенках. Артерия кровоснабжает верхние отделы прямой кишки, ее ветви анастомозируют между собой и с ветвями средней и нижней прямокишечной (геморроидальной) артерии.
Средние прямокишечные артерии с обеих сторон с одноименными венами подходят к боковым стенкам прямой кишки в толще боковых связок прямой кишки. Они чаще отходят от подчревной артерии, реже – от внутренней срамной артерии. Нижняя прямокишечная артерия отходит от внутренней срамной артерии в канале Олкокка, прободает медиальную стенку этого канала, вместе с сопровождающей веной и нервом образуя нижний нейро-васкулярный тяж. Как правило, артерия делится на несколько ветвей, которые кровоснабжают внутреннюю запирательную и большую ягодичную мышцы, а также мышцу, поднимающую задний проход и анальный сфинктер.
Венозная кровь от прямой кишки до участка над аноректальной линией оттекает в систему воротной вены, а дистальнее этого участка – в систему нижней полой вены. В прямой кишке различают три основных венозных сплетения: верхнее, средне и нижнее. Венозный путь, по данным многих авторов, является основным в диссеминации раковых клеток. Поэтому рекомендуется начинать операцию с лигирования основного венозного, а не артериального ствола. С этой точки зрения весьма важным является рассмотрение различных вариантов архитектоники вен.
Основные венозные стволы толстой кишки весьма изменчивы в своем строении. Наиболее отличающиеся друг от друга формы могут иметь или сетевидное строение, или характеризоваться разобщенным ходом вен. Лимфатическая система толстой кишки включает в себя лимфоорганные лимфатические сети и выносящие лимфатические сосуды.
Экстрамуральные лимфатические сосуды подразделяются на три группы. Первая (верхняя) группа представлена лимфатическими узлами, расположенными у бифуркации верхней прямокишечной артерии (восходящий путь лимфооттока). Боковые лимфатические сосуды отводят лимфу от среднеампулярного отдела прямой кишки (латеральный путь лимфооттока). Расположенные на уровне крестцового мыса лимфатические сосуды и узлы являются своеобразным коллектором, куда устремляется лимфа из зоны средней прямокишечной и боковых крестцовых артерий и др. По третьей (нижней) группе лимфатических сосудов осуществляется лимфоотток от нижнеампулярного отдела прямой кишки и анального канала в паховые узлы (нисходящий путь лимфооттока). Кроме того, существующее множество анастомозов между лимфатическими сосудами прямой кишки способствует ретроградному оттоку лимфы.
Вегетативная нервная система прямой кишки представлена симпатической и парасимпатической нервными системами. Симпатические нервные волокна начинаются от центральных корешков 11 и 12 грудных и 1-3 поясничных сегментов спинного мозга. При выходе из спинного мозга они образуют поясничные внутренностные нервы, которые, соединяясь над аортой, формируют верхнее гипогастральное сплетение. Следуя вдоль верхней прямокишечной артерии в малый таз, верхнее гипогастральное сплетение делится на 2 части, которые, достигая тазового сплетения на латеральной стенке таза, формируют нижнее гипогастральное сплетение.
Парасимпатическая иннервация прямой кишки осуществляется ветвями блуждающего нерва, а также нервными волокнами, начинающимися из вентральных корешков 2, 3 и 4 крестцовых сегментов. Они входят в полость таза через крестцовые отверстия кзади от париетальной фасции и направляются вниз и латерально к тазовому сплетению. Таким образом, тазовое сплетение представляет собой переплетение симпатических и парасимпатических нервных волокон. Понятие тазового сплетения тесно связано с понятием боковой связки прямой кишки с проходящими в ней средними прямокишечными артериями.
В последнее время рядом японских исследователей показано, что боковая связка прямой кишки представляет собой не что иное, как тазовое нервное сплетение с проходящей в ней средней прямокишечной артерией. Радикальность оперативного вмешательства при раке нижнеампулярного отдела прямой кишки требует неизбежного пересечения указанных нервных структур.
Следует отметить, что гипогастральное нервное сплетение редко бывает представлено только одним тяжем, поэтому одностороннее его пересечение редко сопровождается тазовыми расстройствами. Иногда радикальность вмешательства требует двустороннего пересечения симпатических и парасимпатических волокон, которое почти сопровождается урогенитальными расстройствами (нарушение мочеиспускания, аменоррея у женщин и отсутствие эякуляции у мужчин). С целью предупреждения возникновения урогенитальных нарушений при проведении лимфодиссекции была предложена так называемая нервосохраняющая техника (nerve-sparing technique - NST).
ФАСЦИИ ТАЗА Висцеральная фасция (собственная фасция) таза, окружает прямую кишку со всех сторон, переходя внизу в париетальную фасцию таза, представляя собой заполненный жировой тканью рукав, что, с одной стороны, обеспечивает прямой кишке необходимую подвижность, а с другой – выполняет роль фиксирующего аппарата. Было отмечено, что с передней стороны собственная фасция плотно сращена с брюшинно-промежностным апоневрозом (фасция Денонвилье). Было показано, что этот футляр отграничивает сосудистую и отчасти лимфатическую системы прямой кишки от париетальных сосудов таза, вследствие чего раковая опухоль сравнительно редко распространяется за пределы собственной фасции прямой кишки. Данные анатомические исследования были положены в основу хирургической техники лечения рака прямой кишки под названием тотальная мезоректумэктомия.
ЛАПАРОСКОПИЧЕСКАЯ ТЕХНИКА ТОТАЛЬНОЙ МОЗОРЕКТУМЭКТОМИИ В ЛЕЧЕНИИ РАКА ПРЯМОЙ КИШКИ Пациент укладывается на спину с приподнятыми и разведенными ногами в положении Тренделенбурга. Хирург располагается справа от больного, ассистент с видеокамерой - со стороны головы пациента, а другой ассистент - слева от больного. Монитор устанавливают возле левой ноги пациента.
Для выполнения лапароскопической резекции прямой кишки обычно используется 4-5 троакаров: в параумбиликальной области, в правой подвздошной области, в левой подвздошной и левой мезогастральной области.
Хирургическая техника ТМЭ
Основные этапы удаления прямой кишки с применением техники ТМЭ:
1. высокая перевязка нижнебрыжеечных сосудов;
2. отсепаровка нижнебрыжеечных сосудов от преаортального верхнего гипогастрального сплетения;
4. острое выделение (с помощью ультразвуковых ножниц или энергетической платформы Force Triad) боковых поверхностей мезоректум;
5. острое выделение (с помощью ультразвуковых ножниц или энергетической платформы Force Triad) вентральной поверхности прямой кишки путем рассечения переходной складки брюшины с последующей отсепаровкой от семенных пузырьков или влагалища;
6. выделение прямой кишки с мезоректумом во всех плоскостях под визуальным контролем целостности мезоректальной фасции и сохранности нижних гипогастральных (правого и левого) и сакральных (справа и слева) нервов, формирующих в совокупности тазовое сплетение;
7. если операция заканчивается формированием анастомоза, то в дистальном отделе прямой кишки, состоящем исключительно из слизистого, подслизистого и мышечного слоев, наложение специального зажима (изоляция новообразования) с обязательным промыванием дистального отдела прямой кишки 0,02% раствором хлоргексидина;
8. наложение линейного степлера ENDO-GIA-60 дистальнее пережатого участка кишки с пересечением прямой кишки между ними;
9. в левой подвздошной области (в области троакара) послойно рассекается брюшная стенка, в рану выводится петля приводящей кишки в зоне проксимального края резекции и выделяется необходимый для наложения анастомоза участок кишки. В этом месте кишка пересекается между двумя зажимами, удаляется резецированный препарат в пластиковом контейнере. На проксимальный конец кишки накладывается кисетный шов, который затягивается после введения в просвет кишки головки циркулярного степлера, далее кишка погружается в брюшную полость и брюшная стенка ушивается;
10. после обработки культи прямой кишки раствором антисептика, трансанально вводится базовая часть циркулярного степлера, острой частью перфорируется культя в средней части шва, наложенного аппаратом ENDO-GIA-60. Затем головка аппарата вставляется в базовую часть, выполняется прошивание и извлечение аппарата.
11. по показаниям формирование превентивной илео- или трансверзостомы;
12. если пациенту выполняется брюшно-промежностная экстирпация прямой кишки, то промежностный этап выполняется второй хирургической бригадой. Границы резекции при ТМЭ и экстирпации прямой кишки схематически представлены на рисунке. Если имеется местно распространенная опухоль или относительно небольшая карцинома, прорастающая висцеральную фасцию, то мобилизацию следует проводить за пределами париетальной фасции.
Спорным остается вопрос о целесообразности латеральной лимфодиссекции при среднеампулярном раке. Однако анализ тех же авторов частоты латерального поражения лимфоузлов, в зависимости от локализации дистального уровня опухоли, во многом проясняет ситуацию.
Oбъемы резекции и лимфодиссекции при лапароскопических вмешательствах не уступают традиционным лапаротомным. Количество удаленных лимфоузлов при выполнении лимфодиссекции составило в среднем 22 (14-31) - против 8(4-20) у пациентов, которым лимфаденэктомия не проводилась.
Записаться на консультацию в Швейцарскую клинику можно:
- по телефону: +7 (925) 191-56-65
- заполнить:ЗАПРОС В КЛИНИКУ
- по электронной почте: surgery@rusmedserv.com
- адрес клиники: г. Москва, ул. Николоямская, д.7/8
(495) 506-61-01 - информация о швейцарской клинике в Москве
Сидоров Д.В., Франк Г.А., Майновская О.А., Ложкин М.В., Гришин Н.А., Петров Л.О., Троицкий А.А.
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва, Россия
В работе приведен собственный, первый в России опыт применения водоструйного диссектора ERBEJET2 ® в ходе выполнения оперативных вмешательств по поводу рака прямой кишки.
Методика водоструйной диссекции на этапе мобилизации препарата применена нами у 5 больных раком прямой кишки. Средний возраст больных составил 58,3±14,2 лет (47-78). В исследованной группе было 2 мужчин и 3 женщины. У всех больных оперативные вмешательства выполняли по поводу аденогенного рака прямой кишки, морфологически верифицированного на предоперационном этапе. Удаленные препараты исследованы морфологически. Для оценки качества хирургического лечения были использованы критерии, разработанные в исследованиях Ph. Quirke. При микроскопическом исследовании циркулярного края резекции, помимо определения хирургического клиренса, оценивали выраженность и глубину повреждения ткани мезоректума. Для сравнения были выбраны две контрольные группы по 5 больных, у которых мобилизацию прямой кишки производили с применением монополярного коагулятора и гармонического скальпеля. Исследованные группы были сопоставимы по гендерному составу, возрасту, локализации и распространенности опухоли. Все оперативные вмешательства выполняла одна бригада хирургов.
Средняя продолжительность операции составила 143±39,1 мин. (от 105 до 190). Объем кровопотери оценен как минимальный во всех 5 наблюдениях. Интраоперационных осложнений не зафиксировано. Течение послеоперационного периода гладкое у всех больных. Дизурические нарушения отсутствовали. Средняя продолжительность послеоперационного пребывания пациентов в стационаре – 9 дней (7-11).
При морфологическом исследовании качество мезоректумэктомии было оценено как хорошее (Grade 3) у всех 5 пациентов. Среднее количество исследованных лимфоузлов составило 24,2±6,4. Метастатическое поражение лимфатических узлов мезоректальной клетчатки выявлено у трех больных. В двух контрольных группах качество мезоректумэктомии также было оценено как хорошее (Grade 3) у всех 10 пациентов. В группе больных, у которых мобилизацию прямой кишки выполняли с применением водоструйной диссекции, повреждения тканей (фасции и клетчатки) практически не отмечалось. Наибольшее повреждение ткани (в виде термического воздействия, вплоть до очагов коагуляционного некроза) по латеральному краю резекции отмечали при использовании монополярного коагулятора. Глубина термического повреждения ткани по латеральному краю в этой группе составила от 1,7 до 3,0 мм. Латеральное повреждение тканей при мобилизации прямой кишки при помощи гармонического скальпеля было менее выражено, чем при использовании монополярного коагулятора. Ткани удаленного препарата практически не имели признаков термического воздействия, и изменения проявлялись преимущественно в деформации тканевых структур. Максимальная глубина повреждения ткани по латеральному краю резекции в данной группе составляла от 1,0 до 1,5 мм.
Водоструйные диссекторы могут занять свое место в списке оборудования, используемого при выполнении оперативных вмешательств по поводу рака прямой кишки и внести свой вклад в улучшение онкологических и функциональных результатов хирургического лечения данной группы больных.
Ключевые слова: рак прямой кишки, тотальная мезоректумэктомия, водоструйная диссекция.
Методика ТМЭ подразумевает мобилизацию прямой кишки острым путем под контролем зрения в пределах мезоректальной фасции, с сохранением элементов вегетативной нервной системы таза. Для выполнения такой мобилизации хирурги во всем мире традиционно используют ножницы, коагулятор, в последние годы – гармонический скальпель.
Несмотря на публикации, посвященные возможностям применения водоструйной диссекции на этапе ТМЭ при выполнении внутрибрюшных резекций по поводу РПК [9, 22], данная методика к настоящему моменту не получила широкого распространения в онкопроктологии. Так, в доступной отечественной литературе упоминания об использовании водоструйного диссектора в хирургии РПК отсутствуют, а общее число таких публикаций в зарубежной печати не превышает десятка.
В работе мы приводим собственный, первый в России опыт применения водоструйного диссектора ERBEJET2 ® в ходе выполнения оперативных вмешательств по поводу РПК.
Материалы и методы
Методика водоструйной диссекции на этапе мобилизации препарата применена нами у 5 больных РПК. Средний возраст больных составил 58,3±14,2 лет (47-78). В исследованной группе было 2 мужчин и 3 женщины. У всех больных оперативные вмешательства выполняли по поводу аденогенного РПК, морфологически верифицированного на предоперационном этапе. Объем предоперационного обследования, помимо клинических и лабораторных методов, включал УЗИ (в т.ч. – трансректальное и трансвагинальное) и МРТ органов малого таза. Опухоли локализовались в среднеампулярном (у 3 пациентов) и нижнеампулярном (2 больных) отделах прямой кишки. Расстояние от нижнего полюса опухоли до края ануса варьировало от 4 до 9 см. Латеральное распространение опухоли по результатам предоперационного обследования расценено как Т2 (инвазия мышечной оболочки стенки кишки без выхода в мезоректальную клетчатку) у трех больных, T3 (выход опухоли за пределы стенки кишки) – у двух пациентов. Данных за поражение лимфатических узлов мезоректальной клетчатки и других регионарных зон не было получено ни у одного пациента. Противопоказаниями к проведению предоперационной химиолучевой терапии у больных с опухолевой инвазией мезоректальной клетчатки в одном наблюдении были эпизоды активных кровотечений из опухоли, во втором – наличие синхронных билобарных метастатических очагов в печени.
Удаленные препараты подвергали морфологическому исследованию. Макроскопическое исследование препарата включало оценку сохранности собственной фасции прямой кишки, степени выраженности клетчатки по передней, задней и боковым поверхностям кишки. Для оценки качества хирургического лечения были использованы критерии, разработанные в исследованиях Ph. Quirke [17]. Кроме этого, при микроскопическом исследовании циркулярного края резекции, помимо определения хирургического клиренса, оценивали выраженность и глубину повреждения ткани мезоректума. Для сравнения были выбраны две контрольные группы по 5 больных, у которых мобилизацию прямой кишки производили с применением монополярного коагулятора и гармонического скальпеля. Исследованные группы были сопоставимы по гендерному составу, возрасту, локализации и распространенности опухоли. Предоперационную лучевую терапию не проводили ни одному из 15 пациентов. Все оперативные вмешательства выполняла одна бригада хирургов.
Всем больным выполнены нервосберегающие низкие передние резекции прямой кишки с парааортальной лимфаденэктомией. Одной пациентке дополнительно произведена билатеральная обтураторная лимфаденэктомия. Средняя продолжительность операции составила 143±39,1 мин. (от 105 до 190). Объем кровопотери оценен как минимальный у всех 5 больных. Интраоперационных осложнений не зафиксировано. Течение послеоперационного периода гладкое у всех больных. Дизурических нарушений не было. Самостоятельное мочеиспускание восстановилось на 1-е сутки (после удаления мочевого катетера) у всех 5 пациентов. Средняя продолжительность послеоперационного пребывания пациентов в стационаре – 9 дней (7-11).
При морфологическом исследовании качество мезоректумэктомии было оценено как хорошее (Grade 3) у всех 5 пациентов. Инвазия опухоли в мезоректальную клетчатку рТ3 выявлена у трех больных; опухоль в пределах стенки кишки рT2 – у двух пациентов (у одного больного имела место некоторая недооценка распространенности опухоли по данным предоперационного обследования). Статус CRM расценен как негативный в 4 наблюдениях. В одном случае выявлен опухолевый депозит в мезоректальной клетчатке на расстоянии менее 1 мм от циркулярного края резекции (CRM+). Среднее количество исследованных лимфатических узлов составило 24,2±6,4. Метастатическое поражение лимфатических узлов мезоректальной клетчатки выявлено у трех больных.
В двух контрольных группах качество мезоректумэктомии также было оценено как хорошее (Grade3) у всех 10 пациентов. У двух зафиксирован положительный статус циркулярного края резекции (опухолевый депозит и метастатический лимфатический узел на расстоянии менее 1 мм от CRM).
При исследовании глубины повреждения тканей по латеральному краю удаленного препарата получены следующие данные.
В группе больных, у которых мобилизацию прямой кишки выполняли с применением водоструйной диссекции, повреждения тканей (фасции и клетчатки) практически не отмечалось (рис. 1, 2).

Рис. 1. Макропрепарат. На поверхности мезоректума (вид сзади) при его мобилизации с использованием водоструйного диссектора определяется небольшое разволокнение собственной фасции кишки без ее повреждения.

Рис. 2. Микропрепарат. Мобилизация прямой кишки с использованием водоструйного диссектора. Небольшое разволокнение собственной фасции (окрашена черной краской) без ее деформации (синяя стрелка) и полное сохранение субфасциальных структур – нервных стволов (красные стрелки). Окраска гематоксилином и эозином. Увеличение ×100.
Наибольшее повреждение ткани (в виде термического воздействия, вплоть до очагов коагуляционного некроза) по латеральному краю резекции отмечали при использовании монополярного коагулятора. Причем в большей степени деформации подвергались мезоректальная фасция, элементы боковых связок и резецированные экстрафасциальные структуры (сосуды и нервы). Глубина термического повреждения ткани по латеральному краю в группе больных, оперированных с применением монополярного коагулятора, составила от 1,7 до 3,0 мм (рис. 3, 4).

Рис. 3. Макропрепарат. Поверхность мезоректума (вид сзади) при его мобилизации с использованием монополярного коагулятора: определяются крупные участки термовоздействия (стрелки).

Рис. 4. Микропрепарат. Мобилизация прямой кишки с использованием монополярного коагулятора: широкая зона термического воздействия по латеральному краю резекции (окрашен черной краской) с выраженной деформацией фасции и экстрафасциальных структур – нервных стволов (стрелки). Окраска гематоксилином и эозином. Увеличение ×50.
Латеральное повреждение тканей при мобилизации прямой кишки при помощи гармонического скальпеля менее выражено, чем при использовании монополярного коагулятора. Ткани удаленного препарата практически не имели признаков термического воздействия, и изменения проявлялись преимущественно в деформации тканевых структур. Максимальная глубина повреждения ткани по латеральному краю резекции в данной группе составляла от 1,0 мм до 1,5 мм (рис. 5, 6).

Рис. 5. Макропрепарат. Поверхность мезоректума (вид сзади) при его мобилизации с использованием гармонического скальпеля. Определяются небольшие участки воздействия на уровне боковых связок кишки (стрелка).

Рис. 6. Микропрепарат. Мобилизация прямой кишки с использованием гармонического скальпеля. Умеренно выраженная деформация по латеральному краю резекции (окрашен черной краской) с разволокнением собственной фасции (синяя стрелка) и значительной деформацией экстрафасциальных структур – нервных стволов (красная стрелка). Окраска гематоксилином и эозином. Увеличение ×100.
Принцип водоструйной диссекции долгое время применяли в областях, далеких от медицины (в стекольной промышленности, для обработки металлических изделий и т.п.). Первые упоминания о возможности клинического применения тонкой струи воды под высоким давлением для резекции паренхиматозных органов относятся к началу 90-х годов прошлого века [2]. Несмотря на тот факт, что данная методика является относительно новой, она уже нашла достаточно широкое применение в различных областях хирургии. Основной областью применения водоструйных диссекторов в настоящий момент следует признать хирургическую гепатологию [18, 19, 23]. При этом в мировой литературе имеются многочисленные публикации о применении данной методики в хирургии печени, почек, предстательной железы и в нейрохирургии [3, 22]. В качестве основных преимуществ метода упоминается деликатность разделения тканей, сохранение целостности сосудистых и других трубчатых структур, минимальная травматизация окружающих тканей, отсутствие термического повреждения [18, 23].
Как показали результаты нашего исследования, глубина латерального повреждения тканей при использовании водоструйного диссектора минимальна, что связано с техническими особенностями метода – диссекция тонкой струей воды комнатной температуры. Аналогичный показатель в группе больных, оперированных с применением монополярного коагулятора и гармонического скальпеля, достигает 1,5 мм и 3,0 мм соответственно. Это обусловливает возможность повреждения элементов вегетативной нервной системы таза даже при точном соблюдении плоскости мобилизации препарата. Такое повреждение, в свою очередь, может существенно ухудшить функциональные результаты операций по поводу РПК за счет денервации соответствующих тазовых структур (мочевого пузыря, предстательной железы, шейки матки и влагалища).
Водоструйные диссекторы, с нашей точки зрения, могут занять свое место в длинном списке оборудования, используемого при выполнении оперативных вмешательств по поводу РПК, внести свой вклад в улучшение онкологических и функциональных результатов хирургического лечения данной группы больных.
- Федоров В.Д., Воробьев Г.И., Ривкин В.Л. Клиническая оперативная колопроктология. М., 1994.
- Baer HU, Stain SC, Guastella T et al. Hepatic resection using a water jet dissector. HPB Surg 1993; 6: 189-196.
- Basting RF, Corvin S, Antwerpen C et al. Use of water jet resection in renal surgery: early clinical experiences. Eur Urol 2000; 38: 104-107.
- Celentano V, Fabbrocile G, Luglio G et al. Prospective study of sexual dysfunction in men with rectal cancer: feasibility and results of nerve sparing surgery. Int J Colorectal Dis 2010; 25(12): 1441-1445. Epub 2010 Jun 26.
- Clausen N, Wolloscheck T, Konerding MA. How to optimize autonomic nerve preservation in total mesorectal excision: clinical topography and morphology of pelvic nerves and fasciae. World J Surg 2008; 32(8): 1768-1775.
- Fisher B, Wolmark N, Rockette H et al. Postoperative adjuvant chemotherapy or radiation therapy for rectal cancer: results from NSABP protocol R-01. J Nat Cancer Inst 1988; 80(1): 21-29.
- Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986; 1(8496): 1479-1482.
- Ko R, Tan AH, Chew BH et al. Comparison of the thermal and histopathological effects of bipolar and monopolar electrosurgical resection of the prostate in a canine model. BJU Int 2010; 105(9): 1314-1317.
- Kockerling F. Rekrumkarzinom: Schneiden mit dem Wasser-strahl. Neue technische variante der totalen mesorektalen exzision. Chirurgische Allemeine 2000;3:128-9.
- Krivokapic Z, Barisic G, Markovic V et al. First thousand rectal cancer cases--local recurrence and survival. Acta Chir Yugosl 2004; 51(2): 133-137.
- Kyo K, Sameshima S, Takahashi M et al. Impact of autonomic nerve preservation and lateral node dissection on male urogenital function after total mesorectal excision for lower rectal cancer. World J Surg 2006; 30(6): 1014-1019.
- Mahteme H, Påhlman L. Good colorectal cancer surgery. Tech Coloproctol 2005; 9(1): 1-7.
- Maurer CA. Urinary and sexual function after total mesorectal excision. Recent Results Cancer Res 2005; 165: 196-204.
- Moriya Y. Function preservation in rectal cancer surgery. Int J Clin Oncol. 2006; 11(5): 339-343.
- Moszkowicz D, Alsaid B, Bessede T et al. Where does pelvic nerve injury occur during rectal surgery for cancer? Colorectal Dis 2011; 13(12): 1326-1334.
- Påhlman L, Glimelius B. Local recurrences after surgical treatment for rectal carcinoma. Acta Chir Scand 1984; 150(4): 331-335.
- Quirke P., Dixon MF. The prediction of local recurrence in rectal adenocarcinoma by histopathological examination. Int J Colorect Dis 1988; 3: 127-131.
- Rau HG, Schardey HM, Buttler E et al. A comparison of different techniques for liver resection: blunt dissection, ultrasonic aspirator and jet-cutter. Hepatogastroenterology 1998; 45: 2333-2338.
- Rau HG, Wichmann MW, Schinkel S et al. Surgical techniques in hepatic resections: Ultrasound Aspirator versus Jet-Cutter. A prospective randomized trial. Zentralbl Chir 2001; 126: 586-590.
- Sartori CA, Sartori A, Vigna S et al. Urinary and sexual disorders after laparoscopic TME for rectal cancer in males. J Gastrointest Surg 2011; 15(4): 637-643. Epub 2011 Feb 17.
- Szynglarewicz B, Zietek M, Forgacz J et al. Urinary complications in rectal cancer patients are related to the dissection tool. Hepatogastroenterology 2011; 59(115-116).
- Total mesorectal excision with the Water-Jet. F. Kockerling, ed. Hanover; Science Med Dr. Sperber, 2002.
- Vollmer CM, Dixon E, Sahajpal A et al. Water-jet dissection for parenchymal division during hepatectomy. HPB (Oxford) 2006; 8(5): 377-385.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Читайте также:

