Меланома у детей клинические рекомендации
Уже давно известно, что раковые опухоли встречаются и у детей. Одной из особенно опасных опухолей человека является меланома. Может ли она развиваться у ребенка? Что способствует возникновению злокачественного новообразования? Как распознать патологию и какие способы лечения меланомы применяются у детей? Отвечаем на все важные вопросы и рассказываем о профилактике.
Часто ли у детей бывает меланома?

К счастью, эта болезнь достаточно редко встречается в детском возрасте. Само заболевание представляет собой злокачественную опухоль нейроэктодермального происхождения. Меланома развивается из меланоцитов. Это клетки, которые продуцируют пигмент – меланин.
По данным разных авторов, меланома встречается в 2,5% случаев от всех объемных новообразований у детей. Это всего 0,3% от всех опухолей кожи и слизистых оболочек в детском возрасте. В среднем ежегодно заболевает один ребенок на 1 000 000 детского населения. Тревожно, но в последние годы количество случаев меланомы у детей растет.

В США ежегодно регистрируются случаи детской меланомы: на 99 взрослых с данным диагнозом приходится примерно 1 ребенок.
Самая высокая заболеваемость зарегистрирована в Австралии (4 ребенка на миллион).
В России наиболее подвержены заболеванию дети, проживающие в Северо-Кавказском федеральном округе.
Меланома бывает только на коже?
Чаще всего опухоль бывает на коже. Но встречаются и такие случаи, когда опухолевый процесс развивается на слизистых оболочках, в пищеварительной системе и других внутренних органах, а также в сосудистой оболочке глаз (увеальная меланома). И заметить их сложнее.
Среди всех больных увеальной меланомой доля детей составляет чуть больше 1%. Чаще такая опухоль встречается у подростков. Благодаря гистологическим особенностям увеальной меланомы в детском и подростковом возрасте отмечается лучший прогноз для жизни и здоровья в сравнении со взрослыми пациентами.
По каким симптомам можно заподозрить меланому кожи у ребенка?
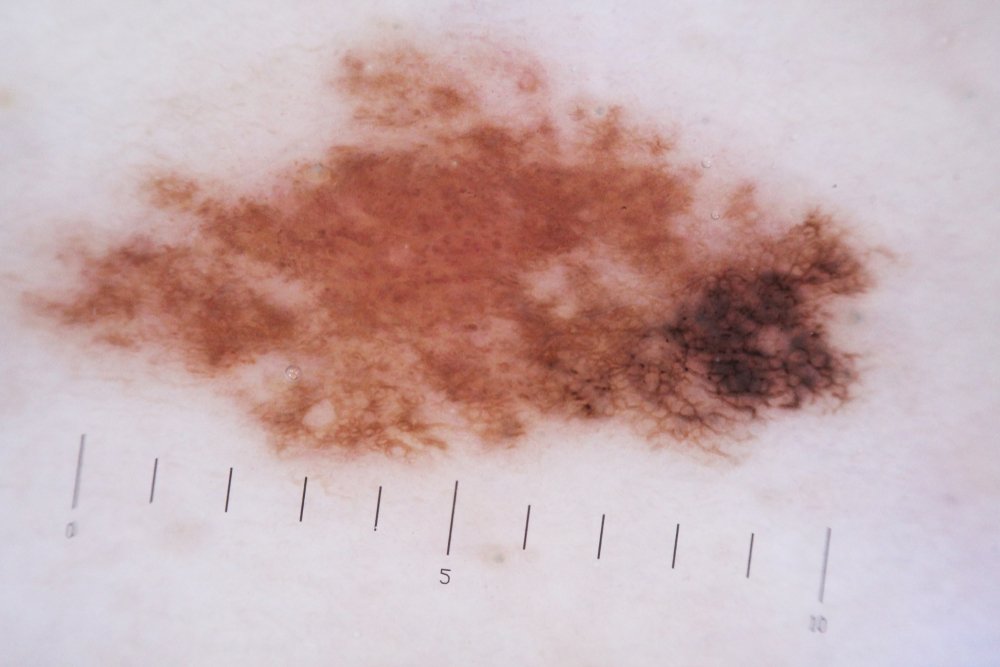
- Родинка поменяла форму, выросла в размере (более чем у 60% пациентов), изменился ее цвет (примерно у 40% заболевших).
- Появилась болезненность родинки.
- Родинка имеет вид ранки, которая никак не заживает, кровоточит.
- Есть зуд образования.
- Образование блестит или покрыто корочкой.
Меланома может развиваться и под ногтем. Она выглядит, как темное пятнышко, появление которого не связано с травмой.
Как подразделяется меланома у детей и подростков?
В зависимости от возраста возникновения опухоли меланома в детском возрасте подразделяется на три категории:
- врожденная – процесс развился внутриутробно;
- инфантильная – опухоль образовалась в промежутке от рождения до 1 года;
- меланома детей – развитие опухоли произошло в возрасте старше 12 месяцев.
Меланома может локализоваться на разных частях тела. У малышей до 4-х лет чаще поражаются голова и шея. У подростков процесс начинается преимущественно на туловище или на конечностях.
Перечислим основные факторы риска развития меланомы в детском возрасте.
- Чаще заболевают дети со светлой кожей и волосами, с голубыми глазами, с розовыми веснушками.
- В группе риска те дети, которые много времени проводят раздетыми под прямыми лучами палящего солнца, а также те, кто имеют в анамнезе солнечные ожоги (пусть и очень давно).
Меланомы у маленьких детей обычно (но не всегда) развиваются из врожденных пигментных невусов. Они не связаны с негативным влиянием солнечных лучей на кожу и могут возникать у детей с любым цветом кожи.
Наличие любого невуса требует регулярного осмотра у врача!
- Развитию меланомы может способствовать посещение солярия, что особенно актуально для подростков.
- В возникновении болезни играет роль семейный анамнез: выше риск меланомы в тех семьях, в которых уже были случаи злокачественного опухолевого заболевания кожи. Такая меланома называется семейной или генетически-ассоциированной.
- Выше риск развития меланомы кожи у детей, имеющих множественные невусы (более 50). Чаще болеют мальчики. Причем у мальчиков чаще меланома бывает на руках, а у девочек на ногах.
- В группу риска входят больные пигментной ксеродермой.
Пигментная ксеродерма является редким наследственным заболеванием кожи, которое проявляется прогрессирующей повышенной чувствительностью кожи к ультрафиолетовому облучению и относится к предраковым состояниям кожи.
Пигментной ксеродермой страдала главная героиня фильма, которая была вынуждена прятаться от солнышка всю свою недолгую жизнь.
От чего зависит выбор методики лечения?
Оставьте свой email, чтобы всегда получать важную информацию и сервисы для сохранения вашего здоровья
Выбор методики лечения в первую очередь зависит от стадии процесса. Также играет роль расположение опухоли, возраст пациента, наличие сопутствующих болезней.
В целом, патология у детей лечится гораздо более успешно, чем у взрослых. Выживаемость больных на ранних стадиях составляет примерно 80%. При выявлении заболевания на 4 стадии прогноз неблагоприятный, дети погибают в течение 2-х лет после постановки диагноза.
- При первой стадии обычно успешно используется оперативное лечение, которое предполагает иссечение опухоли, а также часть здоровых тканей (по краям).
- При второй стадии помимо операции (более обширной, чем при первой стадии), как правило, требуется биопсия регионарных лимфатических узлов. Кстати, у детей лимфоузлы при меланоме поражаются чаще, чем у взрослых.

Чтобы распознать меланому на ранних стадиях, необходимо очень внимательно осматривать кожу ребенка, особенно в том случае, если он входит в группу риска. Все необычные образования или изменения родинок необходимо показывать врачу педиатру, а также дерматологу.
При необходимости юный пациент будет направлен к онкологу, который возьмет необходимые анализы, проведет гистологическое исследование образования.
- Третья стадия характеризуется повреждением опухолью лимфатических узлов, а четвертая – развитием отдаленных метастазов в других органах. При данных стадиях требуется оперативное лечение, а также лучевая терапия и химиотерапия.
При развитии подкожных метастазов врачи иногда используют методику криодеструкции образовавшихся очагов. В стадии изучения находится методика иммунотерапии у детей.
Как защитить ребенка от меланомы кожи?
Существуют ли профилактические мероприятия, которые могут предотвратить развитие меланомы? Да, к ним относятся следующие мероприятия.
3 ЗЕТ – Детская онкология, Ультразвуковая диагностика…
1) Какие морфологические изменения характерны для I уровня меланомы кожи по Кларку?
– все опухолевые клетки находятся в эпидермисе, до базальной мембраны
2) Что представляет собой беспигментная меланома?
– пятно или узел телесного или розового цвета
3) Что такое дерматоскопия?
– это неинвазивный метод диагностики кожной патологии при помощи простой лупы (или дерматоскопа)
4) К какому уровню убедительности рекомендаций относится проведение дерматоскопии?
– D
5) Что представляет собой десмопластическая меланома?
– очень редкая форма меланомы с преобладанием стромы, напоминающая непигментированный шрам или рубец
6) Сколько фототипов кожи выделяют по Фитцпатрику?
– шесть типов
7) Какие морфологические изменения характерны для V уровня меланомы кожи по Кларку?
– опухоль прорастает в жировую клетчатку
8) Что представляет собой поверхностно распространяющаяся меланома кожи?
– пятно, характеризующееся неинвазивным горизонтальным ростом в пределах эпидермиса, которое со временем переходит в стадию вертикального роста и начинает метастазировать
9) Какая форма меланомы кожи развивается внутриутробно?
– врожденная
10) Что представляет собой лентиго-меланома?
– ассиметричное пятно большого диаметра, которое развивается на фоне лентиго и часто располагается на открытых участках кожи (лице, шее, тыльных поверхностях конечностей)
11) Когда возникает инфантильная меланома?
– с момента рождения до однолетнего возраста
12) Что представляет собой акрально-лентигозная меланома кожи?
– ассиметричное пятно большого диаметра, которое развивается на фоне лентиго и располагается на коже кистей, стоп, в области околоногтевых валиков
13) Что представляет собой узловая меланома кожи?
– темную бляшку или узел, часто покрытый коркой и легко кровоточащий, характеризующийся вертикальным ростом в толщу кожи с момента формирования, что приводит к быстрой генерализации опухолевого процесса
14) Какие морфологические изменения характерны для IV уровня меланомы кожи по Кларку?
– опухолевые клетки обнаруживаются в сетчатом слое дермы
15) От чего зависит деление опухоли на стадии по Бреслоу?
– от толщины опухоли (глубины инвазии)
16) Какой фототип кожи по Фитцпатрику всегда быстро загорает, никогда не обгорает и загар держится долго?
– средиземноморский
17) Какое исследование используется для диагностики метастатического поражения лимфатических узлов?
– радиоизотопное исследование с цитратом галлия
18) Какое исследование используется для диагностики метастатического поражения костной системы?
– радиоизотопное исследование с технецием
19) Назовите внекожные формы меланомы?
– меланома мозговых оболочек
– увеальная меланома
20) Назовите основные факторы риска для развития меланомы кожи
– семейный анамнез меланомы
– избыточное воздействие ультрафиолетового излучения
– наличие невуса
21) При каких фототипах кожи по Фитцпатрику наблюдается наибольшее количество пигментных невусов на коже?
– I
– II
22) Назовите морфологические характеристики малигнизации невуса
– рост меланоцитов с проникновением в эпидермис
– лимфоцитарная инфильтрация окружности пигментного очага
23) К чему может привести избыточная инсоляция?
– к развитию специфической иммуносупрессии
– повреждению кератиноцитов
– повреждению меланоцитов
24) Назовите физические факторы риска развития меланомы кожи?
– хроническая травматизация кожи
– ионизирующая радиация
– ультрафиолетовое излучение солнца
25) От каких факторов зависит прогноз при заболевании меланомой кожи?
– от характера поражения лимфатических узлов
– от толщины инвазии
26) Какие органы чаще поражаются метастазами меланомы кожи?
– легкие
– кости
– головной мозг
– печень
27) Какие формы меланомы кожи выделяют по степени распространенности?
– местнораспространенную форму
– диссеминированную форму
– локальную форму
28) Где, помимо кожи, также может образовываться меланома?
– в сетчатке глаза
– в желудочно-кишечном тракте
– в надпочечниках
29) Какие типы меланомы кожи выделяют по клеточному составу?
– мелкоклеточную
– смешанную
– веретеноклеточную
– эпителиоидную
30) Что относится к ранним клиническим симптомам меланомы кожи?
– кровоточивость
– изъязвление поверхности опухоли
– покалывание, жжение, возвышение над поверхностью кожи
– появление венчика воспаления вокруг опухоли
31) Какие органы чаще всего поражаются при врожденной меланоме?
– кожа
– печень
32) Что относится к поздним клиническим симптомам меланомы кожи?
– выраженные симптомы интоксикации
– увеличение регионарных лимфатических узлов
– появление сателлитов
33) Назовите основные морфологические типы меланомы кожи, которые выделяют на основе клинико-морфологической классификации?
– узловая меланома
– меланома типа злокачественного лентиго
– акрально–лентигинозная меланома
– поверхностно распространяющаяся меланома
34) В какой стране зарегистрирована самая высокая заболеваемость меланомой кожи у детей?
– в Австралии
35) Через какое время обычно метастазирует меланома кожи?
– в течение первого года
36) Какой фототип кожи по Фитцпатрику всегда обгорает?
– кельтский
37) Какой фототип кожи по Фитцпатрику никогда не обгорает?
– азиатский
38) Каким становится цвет невуса при его озлокачествлении?
– черным
39) К какому уровню убедительности рекомендаций относится проведение МРТ органов брюшной полости и головного мозга с в/в контрастированием?
– D
40) Какое исследование рекомендуется провести пациенту с меланомой кожи и жалобами на судороги, потери сознания, нарастающие по характеру головные боли?
– цитологическое исследование ликвора
Заболеваемость
Средний показатель заболеваемости меланомой кожи варьирует от 3-5 случаев на 100 тыс. чел. в год в странах Средиземноморья до 12-20 случаев на 100 тыс. чел. в год в странах Северной Европы и продолжает расти. Показатель смертности составляет 2-3 случая на 100 тыс. чел. в год с небольшими изменениями в зависимости от географического положения, и остается относительно стабильным в последнее десятилетие. Однако, показатель смертности у мужчин, в отличие от женщин, увеличился в течение последних 25 лет. Возросшая экспозиция к ультрафиолетовому излучению генетически предрасположенной популяции, по меньшей мере, отчасти обусловливает постоянный рост заболеваемости на протяжении последних десятилетий.
Диагноз
Подозрительные образования характеризуются асимметричностью, нечеткостью границ, неоднородным цветом, а также изменением цвета, уровня и размеров в течение последних месяцев («правило ABCD”). В настоящее время многие первичные новообразования имеют диаметр менее 5 мм [B]. Демография, проведенная опытным врачом, повышает диагностическую достоверность [B].
Диагноз должен быть поставлен после выполнения полной эксцизионной биопсии опухолевого образования с отступом от края опухоли с последующим морфологическим исследованием материала в специализированном онкологическом учреждении.
Гистологическое заключение должно соответствовать классификации AJCC (Американский объединенный онкологический комитет) и включать в себя максимальную толщину опухоли в миллиметрах (по Below), уровень инвазии (по Clark I-V), наличие изъязвления, наличие и выраженность признаков регрессии, и расстояние до краев резекции. Однако в определенный момент оценка уровня инвазии по Clark была опущена и заменена определением скорости митозов в первичной опухоли.
Стадирование
Необходимы общий осмотр пациента и особое внимание к подозрительным пигментированным образованиям на коже, сателлитным образованиям, транзиторным метастазам, метастазам в регионарные лимфоузлы и системным метастазам [V,D].
При меланоме с низким риском рецидива (толщина
Лечение локальных стадий
Необходимо широкое иссечение первичной опухоли в пределах здоровых тканей с краями резекции от границы опухоли [II, B]:
- 0,5 см для меланомы in situ;
- 1,0 см при толщине опухоли по Breslow 1–2 мм;
- 2,0 см при толщине опухоли 2 мм. Модифицированные варианты резекции возможны для сохранения функций при меланоме кожи пальцев или кожи ушной раковины.
Не рекомендуется рутинное выполнение избирательной лимфаденэктомии или проведение лучевой терапии на регионарные лимфатические узлы [II, B].
В настоящее время не существует стандартной адъювантной терапии для пациентов с высоким риском рецидива заболевания после удаления первичной опухоли (стадия IIB/C) или радикального удаления регионарных лимфоузлов (стадия III).
В ряде проспективных рандомизированных исследований изучалось лечение низкими, средними и высокими дозами интерферона (ИФН-.). Проведение данной терапии после резекции первичной опухоли улучшило показатели безрецидивной выживаемости (RFS), однако не повлияло существенно на общую выживаемость (OS).
Первым исследованием, в котором отмечалось улучшение общей выживаемости, было исследование ECOG 1684: в него было включено 287 пациентов, 1-я группа пациентов получала терапию высокими дозами ИФН-альфа, 2-я группа была оставлена под наблюдением. Из-за тяжелых побочных эффектов лечение у 25% пациентов было отменено. 5-летняя безрецидивная выживаемость составила 37% против 26%, общая выживаемость была 46% против 37%. Результаты этого протокола привели к регистрации FDA данного режима терапии в качестве адъювантного лечения. Мета-анализ исследований тяжелой высокодозной терапии интерфероном не выявил статистически значимого влияния на показатель общей выживаемости. Тогда было сделано предположение, что лечение ИФН наиболее эффективно при длительной терапии.
Предположение о целесообразности пролонгированного назначения ИНФ в высоких дозах послужило предпосылкой для проведения Европейской организацией по исследованию и лечению рака (EORTC) крупного проспективного рандомизированного исследования для изучения эффективности пегилированного интерферона-альфа2b (ПЭГ-ИФН-альфа-2b) в адъювантном режиме у пациентов с III стадией меланомы. Всего 1256 больных только III стадией меланомы после удаления первичного образования были рандомизированы в лечебную группу или группу наблюдения. Рандомизация была стратифицирована в соответствии с микроскопическим (N1) и макроскопическим (N2) поражением лимфатических узлов, количеством вовлеченных узлов, наличием изъязвления и толщиной опухоли. Безрецидивная выживаемость (первичная конечная точка), выживаемость без отдаленных метастазов и общая выживаемость были проанализированы у всех, включенных в исследование пациентов, принявших хотя бы одну дозу препарата.
Это исследование показало, что пролонгированная адъювантная терапия ИФН-альфа улучшает безрецидивную выживаемость и выживаемость без отдаленных метастазов в подгруппе пациентов с небольшой массой опухоли.
Таким образом, в данной популяции пациентов пегилированный интерферон может быть рекомендован к использованию, если пациент хорошо переносит его применение [C].
Адъювантную терапию пациентов с резекцией пораженных макроскопических узлов предпочтительно проводить в рамках рандомизированных клинических исследований в специализированных центрах. И, тем не менее, данный диагноз является утвержденным показанием к применению высоких доз ИФН-альфа-2b.
Адъювантная химиотерапия или гормонотерапия не улучшают результаты лечения.
Адъювантная иммунотерапия другими цитокинами с включением интерлейкина- 2, вакцинотерапия и иммунохимиотерапия являются экспериментальными лечебными подходами [III], которые не рекомендуется использовать вне клинических исследований.
Возможность проведения лучевой терапии должна быть рассмотрена в случае неадекватной резекции краев опухоли при невозможности выполнения повторной резекции у больных меланомой типа злокачественного лентиго или при неадекватной резекции (R1) метастазов меланомы [B].
Лечение локорегионарных стадий
В случае изолированного поражения регионарных лимфоузлов всем пациентам должна выполняться радикальная лимфодиссекция. Удаление только пораженного лимфоузла является недостаточным объемом операции [II–III,C].
При наличии транзиторных метастазов или неоперабельных первичных опухолей конечностей может быть применена изолированная регионарная перфузионная терапия с включением мелфалана и фактора некроза опухоли (TNF) [II–III,C]. Данная терапия требует расширенного хирургического вмешательства и должна быть использована в отдельных лечебных учреждениях, имеющих опыт проведения подобного лечения. Лучевая терапия может использоваться в качестве альтернативы, хотя не существует четких данных о ее положительном влиянии на результаты лечения [V,D].
Лечение диссеминированных стадий (стадия IV; классификация AJCC 2002 г.)
Преимущественно лечение должно проводится в рамках клинических исследований. Однако не все пациенты c отдаленными метастазами меланомы могут в них участвовать. В этих случаях в качестве паллиативной терапии распространенного процесса с метастазами в нескольких различных анатомических областях для начала можно использовать хорошо переносимые цитостатики, такие как дакарбазин (DTIC), таксаны, фотемустин и др., а также цитокины (интерферон, интерлейкин-2) или их комбинации. Не cуществует стандартной терапии. Однако в таких ситуациях дакарбазин рассматривается как препарат выбора. При агрессивном метастатическом процессе многокомпонентная полихимиотерапия [C], включающая паклитаксел и карбоплатин или цисплатин, виндезин и дакарбазин дают частичный ответ и стабилизацию процесса у большого числа пациентов.
Рандомизированных клинических исследований интерлейкина-2 в монотерапии нет.
Некоторые центры до сих пор используют его в качестве первой линии терапии при небольшой массе опухолей. Рандомизированных исследований не выявили улучшения выживаемости при интенсивной терапии ИЛ-2. За последние десятилетия несколько клинических исследований II фазы показали возможность блокады CTLA4, а также ее применение в комбинации с вакцинами или химиотерапией. Лечение с использованием CTLA4 блокады способствовало увеличению выживаемости больных меланомой с метастатическим поражением до двух лет и больше. Однако эти перспективные результаты должны быть подтверждены рандомизированными клиническими исследованиями III фазы (таблица №2).
Хирургическое удаление висцеральных метастазов может быть проведено в отдельных случаях у больных с хорошим соматическим статусом и изолированным опухолевым поражением.
Возможности паллиативной лучевой терапии рассматриваются при наличии симптомов поражения головного мозга или локализованного поражения костей.
Наблюдение за больными с локальными и локорегионарными стадиями
Пациенты и члены их семей (особенно маленькие дети) должны быть предупреждены о необходимости регулярного осмотра кожи и лимфоузлов, а также о необходимости избегать появление солнечных ожогов или продолжительного воздействия искусственного UV-излучения без защитных средств. Пациенты должны быть предупреждены о повышенном риске развития заболевания у членов их семей [B].
Повторное заболевание развивается у 8% пациентов в течение 2-х лет после выявления первичной меланомы. Пациенты с меланомой кожи имеют повышенный риск развития других опухолей кожи. У пациентов со злокачественным лентиго вероятность развития других опухолей кожи в течение 5 лет достигает 35%.
Больные меланомой после первичного лечения активно мониторируются с целью более раннего выявления рецидива или повторной опухоли.
В настоящее время нет единого мнения в отношении необходимой частоты наблюдения за больными и рекомендуемого объема обследования. Не существует достаточных оснований для рекомендации регулярного проведения анализов крови, радиографического обследования с включением УЗИ, КТ и ПЭТ исследования вне протоколов по изучению адъювантной терапии и наблюдения за больными.
Больные с наследственным или спорадическим синдромом диспластического невуса имеют высокий риск и должны наблюдаться в течение жизни.
Рекомендации по наблюдению за пациентами строятся в зависимости от риска рецидива заболевания.
Клинический осмотр рекомендуется проводить каждые 3 месяца в течение первых 3 лет и далее каждые 6-12 месяцев. Поскольку пациенты с первичной опухолью методов исследования или специфических анализов крови при наблюдении за больными.
Показатель заболеваемости варьирует от 3-5 случаев на 100 тыс. населения в год в странах Средиземноморья до 12-25 случаев на 100 тыс. населения в год в Северной Европе и продолжает возрастать. Рост заболеваемости за последние десятилетия по крайней мере частично связан с увеличением дозы ультрафиолетового (УФ) излучения, получаемой генетически предрасположенным населением. Соотношение смертность/заболеваемость существенно различается между странами Западной и Восточной Европы, что предполагает необходимость усовершенствования профилактики, особенно в странах Восточной Европы. Главным этиологическим фактором меланомы является УФ‑излучение. Доказано, что предотвращение избыточного его воздействия, в том числе использование солнцезащитного крема, снижает частоту возникновения меланомы кожи.
Подозрительные образования характеризуются асимметричностью, нечеткостью границ, неоднородным цветом, а также изменением цвета, уровня и размеров в течение последних месяцев (правило ABCD). В настоящее время многие первичные новообразования имеют диаметр менее 5 мм. Концепция ≪гадкого утенка≫, согласно которой все невусы на теле определенного человека похожи друг на друга, в то время как меланома не соответствует этому шаблону, повышает шансы на раннюю диагностику.
Дерматоскопия, проведенная опытным врачом, повышает диагностическую достоверность. Диагноз должен основываться на результатах полной эксцизионной биопсии опухолевого образования с отступом от края опухоли с последующим морфологическим исследованием материала в специализированном учреждении.
Гистологическое заключение должно соответствовать классификации Американского объединенного онкологического комитета (AJCC)
и включать в себя следующую информацию: – максимальная толщина опухоли в мм (по Breslow);
– скорость митозов, если толщина опухоли менее 1 мм;
– наличие и выраженность признаков регрессии;
– расстояние до краев резекции.
Кроме того, необходимо указывать локализацию, в том числе внекожную (слизистая оболочка и конъюнктива), степень воздействия солнечных
лучей и тип меланомы (поверхностная меланома, злокачественное лентиго, акральная лентигинозная меланома, узловая меланома). В редких случаях меланома может возникать из дермальных меланоцитов (злокачественный синий невус).
В случае поверхностной и узловатой меланом чаще наблюдаются BRAF- и NRAS-мутации, а при акральной лентигинозной меланоме и меланоме
слизистых оболочек генитальной области чаще встречаются с-Kit-мутации.
Тест на генетическую мутацию является обязательным у пациентов на поздних стадиях (III или IV) и настоятельно рекомендуется при высоком
риске при резектабельных IIC, IIIB-IIIC стадиях. Если опухоль дикого типа BRAF, можно рассмотреть проведение теста на мутации в NRAS и c-Kit.
Не рекомендуется проведение теста у пациентов с первичной опухолью без метастазов.
Рекомендовано широкое иссечение первичной опухоли в пределах здоровых тканей с краями резекции от границы опухоли:
• 0,5 см для меланомы in situ;
• 1 см для опухоли толщиной 2 мм.
Модифицированные варианты резекции для сохранения функции при акральной меланоме и локализации меланомы на лице следует проводить с использованием микрографической техники.
Не рекомендовано рутинное выполнение избирательной лимфоаденэктомии или проведение лучевой терапии регионарных лимфатических узлов.
Биопсия ≪сторожевого≫ лимфатического узла необходима для точного стадирования при меланоме толщиной >1 мм. Биопсия также проводится, если опухоль >0,75 мм и имеются дополнительные факторы риска, такие как изъязвление и высокая скорость митозов (pT1b). При поражении ≪сторожевого≫ лимфатического узла возможно проведение полной лимфоаденэктомии регионарных лимфоузлов, данная процедура должна проводиться только в специализированных учреждениях, и нет достоверных данных, что она улучшает общую выживаемость.

Адъювантная химиотерапия интерлейкином‑, вакцинация опухоли, иммунохимиотерапия, применение ингибиторов BRAF являются экспериментальными методами терапии и должны применяться исключительно в рамках контролируемых клинических испытаний.
Возможность проведения лучевой терапии следует рассматривать в случае неадекватной резекции краев опухоли по типу злокачественного лентиго, неадекватной резекции (R1) метастазов меланомы, резекции объемных образовани.
В случае изолированного поражения регионарных лимфатических узлов проводится радикальная лимфодиссекция, удаления только лишь пораженного лимфатического узла недостаточно.
Перед переходом к более агрессивной тактике хирургического лечения необходимо определить стадию опухолевого процесса, визуализировать опухоль (КТ, МРТ) и исключить отдаленные метастазы. Если опухоль неоперабельна, следует рассмотреть другие методы терапии, такие как электрохимиотерапия или виротерапия (Talimogene laherparepvec, T-Vec), но проводить их предпочтительно в рамках клинических исследований.
Хирургическое удаление или стереотаксическая лучевая терапия рекомендуются в случае одиночного метастаза в паренхиматозных органах, а также в центральной нервной системе. При наличии транзитных метастазов или неоперабельных первичных опухолей конечностей может быть проведена изолированная регионарная перфузия конечности с помощью мелфалана и/или фактора некроза опухоли, данную терапию следует проводить исключительно в специализированных учреждениях, так как она требует расширенного хирургического вмешательства. Может также использоваться лучевая терапия, электрохимиотерапия и внутриочаговая терапия с репликацией T-VE.
Новые стратегии терапии с применением иммунотерапии препаратами, воздействующими на ингибиторы активации Т-лимфоцитов, продемонстрировали высокую эффективность. Блокаторы рецепторов CTLA‑4, такие как ипилимумаб, ингибиторы PD‑1, такие как ниволумаб и пембролизумаб, а также селективные ингибиторы BRAF, такие как вемурафениб, энкорафениб и дабрафениб (отдельно или в сочетании с ингибиторами MAPK/ERK киназы – МЕК, к примеру, биниметинибом, кобиметинибом и траметинибом), обладают впечатляющей противоопухолевой активностью. Таким образом, основными в системной терапии меланомы являются иммунотерапия и ингибиторы киназ.
Химиотерапия рекомендована в качестве терапии 2-й линии или бриджинг-терапии.
Опухолевые ткани, преимущественно метастатические, должны быть обследованы на наличие мутации BRAF V600. Если такой мутации не выявлено, то рекомендуется обследовать ткани на наличие мутаций
NRAS, с-Kit, GNA11 или GNAQ, что способствует применению специфической таргетной терапии или помогает направить пациента на соответствующие клинические исследования. Есть ранние данные II фазы клинических испытаний о том, что у пациентов с метастатической меланомой с мутацией NRAS терапия ингибиторами MEK может иметь успех. Дополнительный анализ экспрессии PD-L1 поможет выявить пациентов, для которых анти-PD‑1 терапия будет наиболее эффективной.
Рекомендации относительно терапии 1-й линии находятся в стадии обсуждения.
В то же время оптимальным подходом к терапии 1-й линии является применение анти-PD‑1 антител и, в случае мутации BRAF, комбинации BRAF-и МЕК-ингибиторов. Комбинация BRAF- и МЕК-ингибиторов показывает высокую частоту объективного ответа (70%), быструю индукцию ответа, связанную с контролем симптомов, и выживаемость без прогрессирования около 12 мес. Анти-PD‑1 антитела и в меньшей степени ипилимумаб показывают продолжительный ответ, но частота ответа у них ниже.
Ранее ипилимумаб считался стандартом лечения у пациентов с диким типом BRAF на основе показателя 1-, 2- и 3-летней выживаемости более 10%.
По результатам рандомизированных исследований по сравнению эффективности анти-PD‑1 антител и ипилимумаба, анти-PD‑1 антитела предпочтительнее в 1-й линии терапии пациентов с диким типом BRAF.Анти-PD‑1 антитела продемонстрировали свою эффективность и у пациентов с другими мутациями BRAF.Также применение анти-PD‑1 антител рекомендовано в качестве терапии 2-й линии при неэффективности ипилимумаба.
В двойном слепом рандомизированном клиническом исследовании по сравнению анти-PD‑1 терапии ниволумабом и эталонной химиотерапии дакарбазином (DTIC) у пациентов с диким типом BRAF 1-летняя выживаемость в группе пациентов, получавших ниволумаб, была выше и составила 72,9%, тогда как в группе, получающей DTIC, этот показатель равнялся 42,1%. Ниволумаб и пембролизумаб имеют хороший профиль безопасности.
Оба препарата сравнивались со стандартными химиопрепаратами 2-й линии и показали более высокую эффективность, обеспечивая более продолжительную выживаемость без прогрессирования.
По результатам рандомизированных исследований, пембролизумаб (10 мг/кг каждые 2-3 нед) в сравнении с ипилимумабом показал лучшие результаты. Так, 6-месячная выживаемость без прогрессирования была 47 против 26,5% у ипилимумаба, 12-месячная выживаемость – 70%, а ответ на терапию составил 33% для пембролизумаба, тогда как эти показатели при приеме ипилимумаба были соответственно 58 и 11,9%.
У пациентов с симптомными объемными метастазами, происходящими из меланомы с мутацией BRAF V600, допустимой в терапии 1-й и 2-й линии, является комбинация BRAF- и MЕК-ингибиторов. Данная комбинация дает высокие шансы на быстрый ответ и улучшение качества жизни. В то же время нет убедительных данных, на основании которых можно принять решение о последовательности назначения комбинации BRAF- и МЕК-ингибиторов пациентам с метастатической меланомой с мутацией BRAF V600. Все больше данных свидетельствуют о том, что ингибирование BRAF эффективно даже после иммунотерапии. Ингибиторы BRAF показали свою эффективность у пациентов, у которых отмечалось прогрессирование заболевания в ответ на терапию ингибиторами киназ.
Ингибиторы киназ и ипилимумаб и/или антиPD‑1 антитела безопасны даже для пациентов с симптомными метастазами в головном мозге и показали высокую эффективность.
С учетом постоянного совершенствования методов терапии и разработки новых экспериментальных вариантов лечения пациентов с поздними стадиями метастатической меланомы, в том числе комбинированной терапии с анти-CTLA‑4 и анти-PD‑1 антителами, пациентов рекомендуется направлять в передовые специализированные учреждения, которые участвуют в масштабных программах клинических испытаний.
Если нет возможности участвовать в клинических исследованиях или современные препараты недоступны, больному могут быть назначены цитотоксические препараты, такие как DTIC, темозоломид, таксаны, фотемустин, производные платины, цитокины (интерферон, интерлейкин‑2) и их комбинации. DTIC до сих пор считается референтным препаратом в этой ситуации. Полихимиотерапия паклитакселом и карбоплатином или цисплатином, виндезином и DTIC в случае агрессивного метастатического процесса может обеспечить в основном недолгосрочный частичный ответ и стабилизацию заболевания у значительного количества пациентов. Несмотря на более высокую частоту ответа, полихимиотерапия не улучшает показатели выживаемости по сравнению с монохимиотерапией. В некоторых случаях пациентам с хорошим функциональным статусом и изолированными проявлениями опухолевого процесса может быть показано хирургическое иссечение висцеральных метастазов.
Целью операции является R0 резекция. Следует рассматривать возможность проведения паллиативной лучевой терапии, особенно в случае симптомных метастазов в головном мозге или локализованных и болезненных костных метастазов. При метастазировании в головной мозг стереотаксическое облучение предпочтительнее облучения всего головного мозга. Стереотаксическое облучение является оптимальным в случае прогрессирующего метастатического поражения головного мозга, если системная терапия позволяет добиться частичного контроля над заболеванием.
Биомаркеры мутаций таких генов, как NRAS, с-Kit, BRAF, уже сегодня являются незаменимыми в эффективном ведении пациентов с меланомой на поздних стадиях. Изучение дополнительных мутаций и определение общей их частоты может выявить дополнительные прогностические маркеры в ближайшем будущем. На основании последних данных по изучению эффективности анти-PD‑1 антител у пациентов с PDL‑1-позитивной меланомой, этот показатель, определяемый при помощи иммуногистохимии и отражающий наличие Т-клеток в микроокружении опухоли, вскоре может стать релевантным маркером. Предполагается, что алгоритмы терапии меланомы на поздних стадиях могут развиваться в парадигме доказательной медицины в рамках таргетной и иммунотерапии.
Пациентов с меланомой следует предупредить о необходимости избегать солнечных ожогов и продолжительного воздействия естественного или искусственного УФ-излучения на незащищенную кожу. Также им следует самостоятельно регулярно осматривать кожу и периферические лимфатические узлы. Пациенты должны быть предупреждены о повышенном риске развития меланомы у членов их семей.
После проведенного лечения пациенты находятся под контролем с целью более раннего выявления рецидива или иных опухолей кожи. Повторно меланома развивается у 8% пациентов в течение 2 лет после выявления первичной опухоли. Пациенты с меланомой имеют повышенный риск развития других опухолей кожи. У пациентов со злокачественным лентиго с вероятностью 35% в течение 5 лет развиваются и другие новообразования кожи. В настоящее время нет общего мнения относительно частоты наблюдения и рекомендуемого объема обследований. Так, по одним из рекомендаций, первые три года следует проходить обследование каждые 3 мес, а в дальнейшем каждые 6-12 мес. Интервалы между посещениями могут быть адаптированы в соответствии с индивидуальными рисками и потребностями пациента.
У пациентов с толщиной меланомы 2 мм.
• Биопсия сторожевого лимфоузла проводится при меланоме толщиной >1 мм и/или при наличии изъязвления. Проведение данной процедуры должно обсуждаться с пациентом с pT1b и опухолью толщиной >0,75 мм.
• У пациентов с проведенной резекцией меланом III стадии следует рассмотреть применение адъювантной терапии интерфероном.
На стадии IIIB и выше настоятельно рекомендуется участие в клинических испытаниях.
• Хирургическое удаление или стереотаксическое облучение локорегионарного рецидива или одиночного отдаленного метастаза следует рассматривать как терапевтический вариант, способствующий долгосрочному контролю заболевания.
У пациентов с метастатической меланомой необходимо определить наличие мутации BRAF V600 в тканях метастаза (предпочтительно) или первичной опухоли.
• анти-PD‑1 антитела и анти-CTLA‑4 антитела – для всех пациентов;
• комбинация BRAF- и МЕК-ингибиторов у пациентов с мутацией BRAF.
Если участие в клинических исследованиях невозможно или современные препараты недоступны, то показано умеренное применение цитотоксических препаратов, таких как дакарбазин или темозоломид.
• Пациентов с меланомой следует предупредить о необходимости избегать солнечных ожогов и продолжительного воздействия естественного или искусственного УФ-излучения на незащищенную кожу. Также им следует самостоятельно регулярно осматривать кожу и периферические лимфатические узлы.
• В настоящее время нет общего мнения относительно частоты наблюдения и рекомендуемого объема обследований.
Статья печатается в сокращении.
Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis,
treatment and follow-up, R. Dummer, A. Hauschild, N. Lindenblatt,
G. Pentheroudakis & U. Keilholz, on behalf of the ESMO Guidelines
Читайте также:

