Медиастинальные лимфоузлы при раке легких
Метастазирование рака легкого в медиастинальные лимфатические узлы представляет собой обычное явление, наблюдаемое, по данным А. М. Липковича (цит. по И. Л.Тагеру), в 47,5%, а по данным Я. Г. Диллона, — в 96% случаев. Значительно более редкое (всего 7%) метастазирование легочного рака в лимфатические узлы средостения отмечают Я- О. Крижевский и А. В. Вальтер.
Роббинс (Robbins), изучая метастазирование легочного рака у 103 оперированных больных, установил, что метастазы развиваются в 15,1% случаев в паратрахеальных, в 8,7% — в бифуркационных и в 16,5% случаев — в околососудистых лимфатических узлах.
На основании приведенных литературных данных с учетом широкого распространения легочного рака можно было бы предположить, что медиастинальная форма рака легкого встречается очень часто. Однако повседневный опыт этого не показывает. Даже в Институте рентгенологии и радиологии, где концентрируются больные, страдающие различными видами опухолевых процессов, в том числе и больные легочным раком, В. М. Бенцианова смогла собрать в течение примерно 6 лет лишь 31 наблюдение, относящееся к медиастинальной форме рака легкого.
Эта форма заболевания составляет 1,6% всех опухолей и кист средостения. Эта цифра в действительности должна быть несколько больше, так как ряд иностранных авторов относил медиастинальную форму рака легкого к общей группе метастатических опухолей средостения.
Мы располагаем наблюдениями над 9 больными с наличием медиастинальной формы легочного рака.
Литературные данные (И. В. Давыдовский, Я. Г. Диллон, М. П. Кончаловский) свидетельствуют о том, что мужчины заболевают бронхогенным раком легких в 6 раз чаще женщин. Рак легкого и его медиастинальная форма встречаются преимущественно в возрасте 40—60 лет.
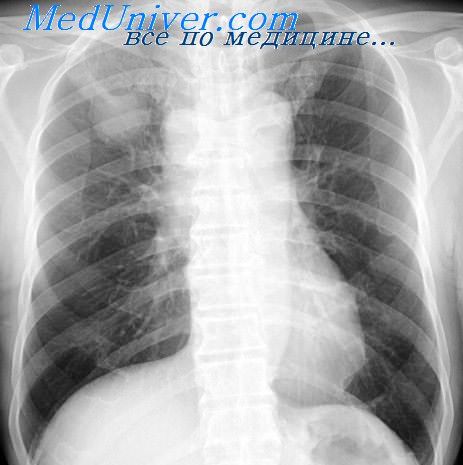
Клиника рассматриваемого заболевания обусловлена главным образом более или менее выраженной компрессией органов средостения. Именно это обстоятельство послужило поводом для выделения М. П. Кончаловским медиастинальной формы легочного рака. Однако клиника медиастинального рака — это прежде всего клиника легочного рака, на которую уже наслаиваются признаки сдавления тех или иных органов средостения. Поэтому было бы неправильным с нашей точки зрения искусственно сводить начало клинического проявления и дальнейшее развитие медиастинальной формы рака легкого только к компрессионному синдрому, как это делает, например, В. М. Бенцианова. Об этом свидетельствует тот факт, что у некоторых больных явления компрессионного синдрома отсутствуют, несмотря на большую величину пораженных лимфатических узлов средостения.
Таким образом, у этих больных не может идти речь о внезапности возникновения компрессионного синдрома. Правда, признаки сдавления органов средостения присоединяются к перечисленным общим симптомам в течение довольно короткого периода (до 1—1,5 месяцев от начала заболевания), и в дальнейшем эта компрессия быстро прогрессирует. Последнее обстоятельство имеет более важное значение в диагностике, чем признак внезапности. Только у 2 больных мы могли на фоне полного благополучия отметить внезапное появление охриплости голоса—симптома поражения возвратного нерва.

-
6 минут на чтение
Своеобразной реакцией на различные происходящие внутри организма патологические процессы является увеличение лимфоузлов.
- Что такое
- Причины
- Симптомы
- Диагностика
- Лечение
- Возможные осложнения
- Прогноз
- Профилактика
Лимфаденопатия средостения легких связана в большей степени с органами дыхания. Определить причину увеличенных узлов можно лишь пройдя полное обследование в медицинском учреждении.
Что такое
Медиастинальная лимфаденопатия средостения – это состояние, характеризующееся патологическим увеличением, изменением функций и структуры лимфоузлов. Это не самостоятельная болезнь, а симптом какого-то заболевания, чаще всего органов дыхания.
Медиастинальные лифоузлы принимают лимфу от лёгких и расположены они в клеточном пространстве средостения. Это редко одиночные структуры, больше групповые. Существуют передние, задние и трахеальные группы лимфатических узлов.
Лимфоузлы, входящие в средостение:
- трахеобронхиальные;
- паратрахеальные;
- бифуркационные;
- претрахеальные;
- преаортокаротидные;
- превенозные;
- околопищеводные.

- Дыхательная система
![]()
Наталья Геннадьевна Буцык- 27 мая 2019 г.
О заболеваниях в лёгких также свидетельствует увеличение внутрилёгочных, надключичных и корневых лимфоузлов. Все они принимают лимфу от различных отделов лёгких и вместе с медиастинальными входят в лимфатическую систему этого органа дыхания.
Лимфатические узлы являются важным компонентом иммунной системы. В них отфильтровывается лимфа, и задерживаются погибшие клетки, токсины, частички пыли, МБТ. Содержащиеся в жидкости вирусы, бактерии, опухолевые клетки атакуются в лимфоузлах. Здесь происходит процесс очищения лимфы. Жидкость от лёгких через лимфатические узлы поступает в венозное русло.
Если в лёгких или бронхах возникает воспалительный и опухолевый процесс, то это сказывается на состоянии лимфоузлов, находящихся в средостении. Лимфаденопатия средостения и корней легких – это реакция белых клеток на внедрение в организм патологического агента. Лимфоузлы вначале воспаляются, а затем увеличиваются.
Спровоцировать лимфаденопатию могут инфекционные, онкологические, системные заболевания. Если в лимфоузлах воспалительный процесс переходит в нагноение, то у больного диагностируют лимфаденит.
Причины
Основные причины, вызывающие изменения размеров лимфоузлов средостения;
- реакция на попадание бактерий или вирусов;
- опухолевый процесс.
Лимфаденопатия опухолевой природы:
- вследствие первичного процесса, который поражает лимфатический аппарат;
- в результате метастатического поражения узлов из-за рака лёгких, молочных желез и др. органов.
Увеличение лимфоузлов неопухолевой природы:
- инфекция;
- аутоиммунный процесс;
- длительный приём лекарственных препаратов.

- Дыхательная система
![]()
Наталья Геннадьевна Буцык- 27 мая 2019 г.
Если лимфоузлы средостения увеличены, то это повод для диагностического онкопоиска. Лимфаденопатия средостения проявляется при различных патологиях. Они могут быть вызваны злокачественными новообразованиями, а также инфекциями.
Заболевания, вследствие которых возникает внутригрудная лимфоденопатия:
- лимфома;
- лимфолейкоз;
- метастазирующая карцинома;
- туберкулёз;
- рак лёгких, гортани, щитовидной железы и др.;
- туберкулёз;
- пневмония;
- мононуклеоз;
- ВИЧ;
- саркоидоз.
Лимфома включает широкую группу онкозаболеваний. На начальной стадии болезнь может ничем себя не проявлять. У человека отмечается лишь слабость, головная боль, периодическое повышение температуры до 37-38 градусов.
Диагноз устанавливается с помощью анализа крови на онкомаркеры и биопсии. Когда злокачественная опухоль распространяется по организму, наступает метастатическое поражение.
Рак лёгких появляется, когда злокачественные новообразования развиваются в лёгких и бронхах. Болезнь развивается на протяжении многих лет. Лечение онкологического процесса предусматривает хирургическое удаление лёгкого, если поражаются регионарные лимфоузлы, то убирают и их. Проявляется болезнь кашлем, кровохарканьем, болью в области грудной клетки, резкой потерей веса.
- Дыхательная система
![]()
Наталья Геннадьевна Буцык- 28 февраля 2019 г.
При туберкулёзе отмечается не только увеличение узлов, но и кашель, субфебрильная температура. Для заболевания характерна положительная реакция на туберкулиновые пробы. Болезнь вызывается микробактериями, такими как палочка Коха и другими. Передаётся заболевание при тесном контакте с зараженным человеком, при кашле, разговоре, чихании. Для лечения применяется 4-5 компонентная противотуберкулёзная химиотерапия.
Чаще всего лимфоузлы увеличиваются вследствие пневмонии. Это самое распространённое простудное заболевание, которое поражает взрослых и детей. Даже после проведения лечения гиперплазия сохраняется на протяжении 2-х месяцев. Отличительной чертой является небольшое увеличение узлов, причём их структура и функции не меняются.
Мононуклеоз – это вирусное заболевание. Возбудитель – вирус Эпштейна-Барра. Заболеть можно при контакте с больным человеком. У человека увеличиваются узлы не только средостения, но и других групп. У больного поражается ротоглотка.
Признаки мононуклеоза: покраснение горла, увеличение миндалин, субфебрильная температура, насморк, боль при глотании. Диагноз устанавливается исходя из общей клинической картины, а также с помощью анализов крови. Для лечения заболевания назначают антибиотики, проводят симптоматическую терапию.
Саркоидоз – это болезнь, которая чаще всего встречается у шахтёров, работников химических производств, ювелирных мастерских, аграриев, а также курильщиков. У людей, работающих в неблагоприятных условиях, поражаются лёгкие и лимфоузлы средостения. Это заболевание характеризуется образованием эпителиоидных гранулём. Такие новообразования доброкачественные.
Гранулёмы растут и сливаются в большие очаги. Эти скопления нарушают функции лёгкого. У человека появляется кашель, одышка, температура тела повышается. Диагностируется болезнь с помощью анализа крови, рентгенографии, КТ, МРТ, биопсии.
Лечение проводится на протяжении 6-8 месяцев. Больному назначают стероидные, противовоспалительные препараты, иммунодепрессанты.
- Дыхательная система
![]()
Наталья Геннадьевна Буцык- 19 февраля 2019 г.
Существуют медикаменты, при длительном применении которых возникают иммунные реакции, которые проявляются увеличением медиастинальных узлов.
Лекарства, которые могут привести к лимфаденопатии: антибиотики (пенициллины, сульфаниламиды, цефалоспорины), антигипертензивные средства (Каптоприл), противосудорожные (Карбамазепин), антиметаболиты (Аллопуринол). После отмены медикамента увеличение узлов исчезает спустя некоторое время.
Лимфоденопатия – это веский повод обратиться к врачу. Заболевание может диагностировать терапевт, гематолог, онколог, пульмонолог, инфекционист. Чем раньше будет выявлена болезнь и назначено лечение, тем больше у больного шансов на полное выздоровление.
Симптомы
Очень часто увеличение узлов в области средостения не вызывает никаких болезненных симптомов у пациентов. Такое происходит на начальных стадиях практически любого заболевания.
Независимо от причин, лимфаденопатия имеет ряд общих проявлений для всех болезней. Выраженность признаков зависит от размеров узлов и их местонахождения.
- ощущение тяжести в области грудной клетки;
- боль;
- дискомфорт;
- трудности с прохождением пищи по пищеводу;
- одышка;
- отёчность лица, шеи, плеч;
- кашель;
- увеличение печени, селезёнки;
- повышение температуры;
- слабость;
- головная боль;
- потеря веса;
- повышенная потливость и др.

- Дыхательная система
![]()
Наталья Геннадьевна Буцык- 19 февраля 2019 г.
Симптоматика дополняется теми признаками, которые характерны для заболеваний, вызвавших лимфаденопатию.
Причинами различных болезней могут быть инфекции, гормональные сбои, слабая иммунная система. Спровоцировать заболевания могут нервные расстройства, вредные привычки или неблагоприятная экологическая обстановка.
Диагностика
Лимфаденопатия – это не первопричина болезни. Для того чтобы узнать, причиной какого заболевания является увеличение узлов, необходимо пройти обследование. Это означает, то нужно обратиться за помощью к врачу и посетить медицинское учреждение.
- сбор анамнеза;
- общий анализ крови;
- анализ крови на ВИЧ, гепатит, сифилис;
- ПЦР на возбудитель инфекции;
- ИФА на антитела к туберкулёзу;
- рентгенография (в 2-х проекциях);
- фибробронхоскопия;
- УЗИ;
- КТ (с болюсным усилением);
- биопсия.
Чаще всего наличие увеличенных узлов выявляется во время рентгенографии грудной клетки при проведении профилактического осмотра. Обычно люди даже не подозревают о наличии в своём организме серьёзной патологии. При ярко выраженных симптомах диагностика проводится, когда больной обращается за помощью к врачу.
Лечение
Лечение заболевания проводится на основании результатов обследования. В зависимости от диагноза врач назначает больным курс медикаментозной терапии.
Если у больного подтвердилось наличие злокачественной опухоли, то ему назначают хирургическую операцию, лучевую и химиотерапию, а также приём гормональных медикаментов.
Неонкологические болезни лечатся при помощи антибиотиков (пенициллины, макролиды), жаропонижающих препаратов (Парацетамол, Ибупрофен), антивирусных средств, отхаркивающих медикаментов, лекарств, снимающих болезненные симптомы (Но-шпа, Анальгин) и других медицинских препаратов.
Подобрать лекарства в зависимости от заболевания может только лечащий врач. Самостоятельно принимать медикаменты и заниматься самолечением нельзя.
Возможные осложнения
Если вовремя не обратиться к врачу и не пройти курс лечения, болезнь, вызвавшая увеличение лимфоузлов, может из острой формы перейти в хроническую, вылечить которую бывает намного труднее. Запущенные заболевания приводят к всевозможным осложнениям.
Игнорирование пневмонии может привести к плевриту, абсцессу и гангрене лёгкого. Осложнения туберкулёза – пневмоторакс, кровохаркание, лёгочное кровотечение.
При прогрессировании рака лёгких может возникнуть закупорка дыхательных путей, плевральный выпот, лёгочное кровотечение, раковый лимфангит, метастазирование в другие органы, смерть.
Прогноз
В зависимости от вида и стадии заболевания прогноз бывает благоприятным или неблагоприятным. Многое зависит от грамотного и своевременного лечения болезни.
При срочной антибиотикотерапии выздоровление после пневмонии наступает спустя 2-4 недели, это заболевание полностью излечимо. Лечение туберкулёза занимает 6-10 месяцев, по окончании курса больной может жить обычной жизнью.
После хирургического вмешательства при раке лёгких начальной стадии 5-летняя выживаемость составляет почти 70%. В запущенных фазах онкологического процесса прогноз 5-летней выживаемости составляет 20%.
Если злокачественное новообразование не лечить, то смертность в первые 2 года составит 90%.
Профилактика
Основными профилактическими мерами являются здоровый образ жизни, питание, богатое полезными витаминами и элементами, а также регулярное полное обследование у врача минимум раз в год. Чем раньше будет обнаружена патология, тем благоприятнее прогноз.
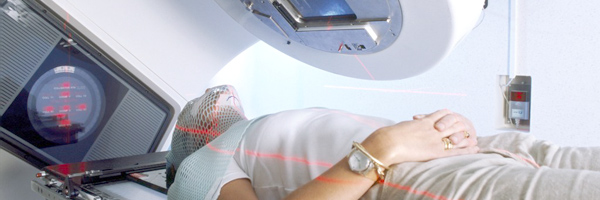
Лечение рака легкого зависит от ряда факторов, среди которых тип опухоли, общее состояние пациента и стадия заболевания. Немелкоклеточный рак легкого (НМРЛ) III стадии включает гетерогенную группу опухолей, разнящихся степенью и локализацией заболевания. Многие аспекты лечения НМРЛ III стадии довольно противоречивы, тем не менее, общие тенденции отражены как в международных рекомендациях Американского общества радиационной онкологии (ASTRO) [1,2], Американского общества клинической онкологии ASCO [3], NCCN [4], так и в российских рекомендациях 2016 года [5].
Для НМРЛ III стадии характерно распространение опухоли во внелегочные структуры (Т3 или Т4) и/или поражение медиастинальных лимфоузлов (N2 или N3), но без признаков отдаленных метастазов (М0). Согласно изданию AJCC TNM 8-го пересмотра, к опухолям III стадии также относятся поражения размером более 5 см с вовлечением внутригрудного, внутрилегочного или перибронхиального лимфатического узла (T3N1), а также опухоли размером более 7 см (Т4), независимо от вовлечения лимфатических узлов (таблица 1).
Таблица 1. Стадирование рака легкого
в соответствии с классификацией TNM 8-го пересмотра.
Важным этапом стадирования заболевания является оценка вовлечения в патологический процесс лимфатических узлов средостения. Отсутствие опухолевого поражения медиастинальных лимфоузлов считается одним из самых важных факторов, определяющих показания и возможность хирургического вмешательства.
О возможном поражении опухолевым процессом медиастинальных лимфатических узлов может свидетельствовать их увеличение на компьютерной томографии (КТ) или метаболическая активность по данным позитронно-эмиссионной томографии (ПЭТ) с радиоактивной глюкозой [6].
Если в ходе обследования подтверждено отсутствие вовлечения медиастинальных узлов, целесообразно проведение хирургического удаления опухоли с последующей оценкой состояния лимфоузлов средостения, как и при стадии I и II НМРЛ.
При выявленном вовлечении медиастинальных лимфатических узлов в опухолевый процесс пациентам показана химиолучевая терапия, при этом может быть предложена как двух-, так и трехмодальная терапия.
Инвазивное медиастинальное стадирование целесообразно проводить всем пациентам с центральным расположением опухоли, пациентам с потенциально резектабельными Т2, Т3 и Т4 опухолями, а также пациентам с увеличением грудных лимфоузлов по данным КТ и/или клиническом вовлечении N1 по данным ПЭТ, в том числе в случаях, когда область средостения остается без видимых патологических изменений по данным и КТ, и ПЭТ [7,8]. Кроме того, наряду с медиастиноскопией все чаще используются тонкоигольная транспищеводная, транстрахеальная и трансбронхиальная аспирация EUS-FNA и пункционная биопсия EBUS-TBNA под контролем внутриполостного ультразвукового исследования [9].
При высоком риске метастазов в оккультных лимфатических узлах необходимо проводить предоперационную оценку состояния медиастинальных лимфоузлов. Целесообразность подобной тактики подтверждают данные исследования, в котором у 6,5% пациентов с первичными поражениями Т1 было выявлено оккультное поражение N2 несмотря на отрицательные результаты КТ и ПЭТ средостения [7].
Следует отметить, что роль предоперационной оценки вовлеченности медиастинальных лимфатических узлов у пациентов с периферическим первичным поражением T1a и отсутствием данных за вовлечение N1 или N2-3 лимфоузлов по данным КТ и ПЭТ остается противоречивой. Некоторые специалисты полагают, что в таких случаях целесообразна первичная резекция опухоли без предоперационного патологического исследования лимфатических узлов. Этот подход основан на относительно низкой частоте вовлечения медиастинальных лимфатических узлов [10,11].
Согласно 8-й редакции системы TNM, опухоль T3N1 представляет собой образование более 5 см с поражением N1 и соответствует стадии IIIA. Первоначальная терапия в случае подтверждения отсутствия поражения медиастинальных лимфоузлов инвазивными методами включает хирургическую резекцию (если это технически возможно) с последующей адъювантной химиотерапией для пациентов после полной резекции образования. Если R0 резекция невозможна, наряду с химиотерапией показана лучевая терапия.
Исключением являются пациенты с опухолью верхней борозды (опухолью Панкоста). В подобных случаях показана химиолучевая терапия, после которой целесообразно хирургическое лечение [4].
Адъювантная химиотерапия основана на назначении цисплатин-содержащих схем. Ее применение улучшает безрецидивную (39% против 34%) и общую пятилетнюю выживаемость (45% против 40%) в сравнении с наблюдением [5]. Данные мета-анализа LACE, проанализировавшего результаты пяти рандомизированных исследований с участием 4584 пациентов [12], показали, что использование цисплатин-содержащих режимов после радикальной операции заболевания pT1-3N1-2M0 сопряжено с увеличением 5-летней выживаемости на 5,4%.
Адъювантная химиотерапия назначается сразу после восстановления пациента от хирургического вмешательства (но не позже 8 недель) и включает 3-4 цикла лечения. При этом могут использоваться любые платиносодержащие комбинации с включением препаратов 3 поколения или этопозида. Наиболее изученными считаются комбинации винорельбина и цисплатина, гемцитабина и цисплатина, паклитаксела и карбоплатина [5].
Опухоли Т4 классифицируются как стадия IIIB. Даже при совершенствовании хирургических методов терапии операбельные T4N0-1 поражения нетипичны, и в большинстве случаев пациентам показана химиолучевая терапия, так же как и для пациентов с вовлечением средостения. Тем не менее, для определенных категорий больных оперативное вмешательство показано. Так, при вовлечении карины возможна пневмонэктомия с ее резекцией. По данным исследований, 5-летняя выживаемость в подобных случаях составляет 51% при N0 и 32% при N1 [13]. Следует отметить, что возможности резекции опухолей Т4 открываются в крупных центрах, имеющих большой опыт подобных оперативных вмешательств.
У некоторых пациентов может быть целесообразно назначение неоадъювантной химиотерапии. Химиотерапия также показана как самостоятельный метод лечения при противопоказаниях к хирургическому и/или лучевому лечению, а также при прогрессировании опухолевого процесса после радикальной терапии. В таких случаях большое значение при выборе варианта лечения приобретают гистологический тип опухоли и ее молекулярно-генетические характеристики. У пациентов с наличием мутаций в гене EGFR препаратами первой линии являются ИТК EGFR (гефитиниб, эрлотиниб, афатиниб), а при транслокации ALK показан кризотиниб [5]. При отсутствии драйвер-мутаций назначаются двухкомпонентные химиотерапевтические режимы на основе производных платины. У пациентов с неплоскоклеточным раком в удовлетворительном состоянии наряду с химиотерапией может применяться бевацизумаб [5].
Оптимальный объем химиотерапии в составе химиолучевой терапии составляет введение паклитаксела и цисплатина/карбоплатина еженедельно. При противопоказаниях к паклитакселу в качестве альтернативы может выступать этопозид. Кроме того, наряду с лучевой терапией возможно применение химиотерапии по стандартной схеме: паклитаксел + карбоплатин 1 раз в 3 недели, пеметрексед + цисплатин 1 раз в 3 недели [5].
Оптимальная терапия НМРЛ при вовлечении лимфоузлов средостения четко не определена. На выбор лечения влияет ряд факторов, среди которых размер первичной опухоли и степень поражения лимфоузлов, возможность (или невозможность) полной хирургической резекции, общее состояние и предпочтения пациента.
Если пациент является кандидатом на хирургическое лечение и при этом доказано вовлечение в опухолевый процесс лимфоузлов средостения, ограничение терапии только резекцией сопряжено с высоким риском рецидивов (как местных, так и отдаленных), поэтому подход к лечению должен иметь многокомпонентный характер.
В большинстве случаев при поражении N2 показана химиолучевая терапия с использованием химиотерапии на основе препаратов платины и полнодозной лучевой терапии.
Оптимального режима химиотерапии, который можно было бы назвать терапией выбора, как такового не существует. Некоторые режимы химиотерапии ассоциируются с повышенной токсичностью, особенно при включении в комбинацию гемцитабина [14]. Чаще всего применяются два режима: комбинация цисплатина и этопозида или карбоплатина с паклитакселом еженедельно на фоне лучевой терапии. Одновременная химиолучевая терапия дает лучшие результаты по сравнению с последовательной, однако она более токсична [5].
Эффективность комбинации цисплатина и этопозида в комбинации с лучевой терапией у пациентов с НМРЛ с подтвержденной IIIB стадией была изучена в многоцентровом исследовании II фазы [15]. Согласно результатам исследования, 3- и 5-летняя выживаемость на фоне химиолучевой терапии составила 17% и 15% соответственно.
При еженедельном введении паклитаксела и карбоплатина в комбинации с лучевой терапией пациентам со стадией IIIB медиана выживаемости, по результатам рандомизированного исследования III фазы, составила 16,3 месяца [16].
В некоторых случаях целесообразно хирургическое лечение, однако среди специалистов до сих пор нет единого мнения, какие же именно критерии являются достаточным показанием для резекции. Рандомизированных данных, на которые можно было бы опираться при подборе кандидатов на хирургическое лечение, не существует. Противопоказаниями к хирургической резекции могут быть тяжелое состояние пациента, низкие дыхательные резервы, сердечно-сосудистые заболевания в стадии обострения, прогрессия заболевания после начальной терапии, Т4, множественные поражения N2, экстракапсулярное увеличение лимфоузлов.
В работе Albain K. с соавт. [17] было показано, что оперативное лечение не улучшает результатов химиолучевой терапии у больных с IIIA стадией с поражением медиастинальных лимфоузлов, причем наиболее низкие результаты терапии были получены в группе пациентов после пневмонэктомии (высокая послеоперационная смертность). На основании этих данных можно сделать вывод, что после химиолучевой терапии может быть целесообразна только лобэктомия.
Стандартный режим фракционирования химиолучевой терапии при НМРЛ III стадии составляет 60 Гр/30 суточные фракции. При невозможности назначения химиотерапии может быть целесообразно увеличение дозы лучевой терапии.
Пациентам с поражением N3 в большинстве случаев показана химиолучевая терапия без хирургического лечения. Нецелесообразность оперативного вмешательства при N3 была продемонстрирована в исследовании SWOG, результаты которого показали, что 3-летняя выживаемость пациентов после проведения индукционной химиолучевой терапии и последующей резекции опухоли составила 0% [15].
Доказана более высокая эффективность конкурентной химиолучевой терапии по сравнению с химиотерапией уже после лучевой терапии (последовательной) 20. Так, в исследовании RTOG с участием 610 пациентов с неоперабельным НМРЛ III стадии [22] было показано, что при назначении химиолучевой терапии медиана выживаемость составляла 17 месяцев, в то время как при назначении цисплатина и винбластина уже после лучевой терапии выживаемость не превысила 14,6 месяца.
Эндоскопическая картина метастазов рака легкого в медиастинальных лимфатических узлах определяется степенью их поражения (инвазии). По этому признаку мы сочли целесообразным выделить 3 степени метастатического поражения лимфатических узлов. Такое подразделение может быть полезно при оценке резектабельности, в частности для решения вопроса о возможности радикального удаления лимфатических узлов и клетчатки средостения (медиастинальная лимфодиссекция).
При / степени инвазии мы видим картину внутриузловых метастазов, в зарубежной литературе обозначаемую как "minimal N2 disease". Лимфатический узел выглядит как нормальный либо опухолевая ткань просматривается, но капсула узла сохранена. Клетчатка средостения рыхлая, лимфатические узлы легко выделяются. Медиастинальная плевра мягкая, податливая, при парастернальной медиастиноскопии легко захватывается кусачками и перфорируется. При // степени инвазии лимфатические узлы, как правило, увеличены и частично или полностью замещены опухолевой тканью, местами прорастающей капсулу узла и окружающую клетчатку, но препаровка лимфатических узлов при этом возможна.
При парастернальной медиастиноскопии медиастинальная плевра выглядит обычной, иногда отмечается незначительное расширение сосудов (см. рис. 3.18). Опухолевой инвазии соседних анатомических образований не определяется. При /// степени инвазии выраженная опухолевая инфильтрация медиастинальной клетчатки затрудняет манипуляции и продвижение медиастиноскопа. Может наблюдаться поражение трахеи и главного бронха (рис. 3.22). При высокодифференцированных карциномах, особенно при плоскоклеточном раке, пораженные лимфатические узлы плотные, несмещаемые (см. рис. 3.22), при мелкоклеточном раке — рыхлые, легко распадающиеся (см. рис. 3.14). Со стороны плевральной полости медиастинальная плевра выглядит утолщенной и ригидной. В ряде случаев мы видим рост опухолевой ткани по медиастинальной плевре (см. рис. 3.21).

Ярко выражены расширение сосудов медиастинальной плевры и переполнение их кровью. Следует подчеркнуть, что последний симптом, где бы он ни наблюдался (перикард, медиастинальная плевра, грудная стенка), означает далеко зашедшую степень опухолевой инфильтрации (рис. 3.23). В ряде случаев можно видеть переход опухолевой ткани с лимфатического узла на непарную и верхнюю полую вены. На основании эндоскопической картины можно сделать вывод, что при I степени инвазии медиастинальная лимфодиссекция показана и выполнима. При II степени инвазии эта операция технически выполнима, однако ее радикальность сомнительна, а прогноз скорее всего неблагоприятный. При III степени инвазии медиастинальная лимфодиссекция невозможна, процесс расценивается как нерезектабельный.

Медиастиноскопия во всех ее вариантах предназначена выявлять метастазы в лимфатических узлах средостения. Однако парастернальная медиастиноскопия дает возможность диагностировать прорастание первичной опухоли из легкого в различные анатомические структуры: перикард (см. рис. 3.23), гепарную и верхнюю полую вены (рис. 3.24), грудную стенку рис. 3.25).


Биопсию лимфатических узлов при раке легкого выполняот следующим образом. Лимфатический узел должен быть в lempe поля зрения. Необходимо четко видеть прилегающие к узлу анатомические образования, особенно сосуды. Диссектоом производят препаровку лимфатического узла из клетчатси, стараясь выделить его со всех сторон. При выполнении тарастернальной медиастиноскопии перед препаровкой лимфатического узла следует перфорировать медиастинальную плевру. Это легко сделать, захватив плевру кусачками.
После этого лимфатический узел захватывают биопсийными кусачсами и удаляют (см. рис. 3.19). Если лимфатический узел упютнен или окружен склерозированной клетчаткой, препаровса его затруднена. Не следует ее форсировать, а биопсию процесса произвести из более доступной части узла (см. рис. 3.22). Гомемостаз места биопсии осуществляют с помощью диатермосоагуляции.
Иногда фрагмент стенки крупной вены (чаще всего непарной вены) по цвету и размеру может выглядеть как лимфатический узел. В таких случаях следует предварительно пунктировать место предполагаемой биопсии тонкой иглой; Этот прием позволяет избежать травмы стенки сосуда кусачками. Видеосопровождение дает возможность более четко представлять структуру лимфатического узла и окружающих его тканей, что способствует адекватной и безопасной биопсии.
Медиастинальная форма рака легкого характеризуется массивным поражением медиастинальных лимфатических узлов четко определяемой первичной опухоли в легком и представляет собой несмещаемый конгломерат метастатических узлов с обширным прорастанием перикарда и медиальных сегментов легкого (рис. 3.26).

При раке легкого медиастиноскопию применяют для уточнения стадии опухолевого процесса и решения вопроса о возможности выполнения радикального оперативного вмешательства. Следует подчеркнуть, что практически все работы, опубликованные в последние годы, посвящены медиастиноскопии с видеосопровождением. Общепризнано, что определение состояния медиастинальных лимфатических узлов (символ N) является важнейшим моментом в определении стадии рака легкого.
Современные неинвазивные методы диагностики (компьютерная и ядерно-магнитная томография) не обеспечивают достаточного уровня диагностики поражения средостения. Так, чувствительность, специфичность и диагностическая точность компьютерной томографии в уточнении стадии N составляют соответственно 63, 57 и 59 %, а медиастиноскопии — 89, 100 и 97 % [Gdeedo A. et al., 1997]. Это объясняется известным фактом, что увеличение размеров лимфатического узла может быть вызвано его гиперплазией в ответ на параканкрозные воспалительные явления в легком. Позитронэмиссионная томография дает возможность отличать нормальную ткань лимфатического узла от опухолевой.
Авторы, оценивающие эффективность позитрон-эмиссионной томографии по сравнению с медиастиноскопией при диагностике метастазов в средостении, считают, что она в определенных случаях позволяет отказаться от медиастиноскопии, но полностью заменить ее не может и что для решения этого вопроса необходимы дальнейшие проспективные исследования [Vansteenkiste J. F. et al., 1998; Hammoud Z. T. et al., 1999; Reid R. Т., Rudd R., 2001; Kernstine K. H. et al., 2002]. Таким образом, медиастиноскопия остается наиболее достоверным методом исследования средостения при раке легкого [Mentzer S. J. et al., 1997; Hammoud Z. T. et al., 1999; Krasna M. J. et al., 2000; Hurtgen M. et al., 2002; Rami-Porta R., Mateu-Navarro M., 2002].
Расширенная медиастиноскопия имеет сегодня мало сторонников [Lopez L. et al., 1994]. Нельзя не согласиться с авторами, считающими этот вариант медиастиноскопии слишком сложным технически [Mentzer S. J. et al., 1997; Hammoud Z. T. et al., 1999]. Значительно чаще для осмотра этой анатомической области применяют парастернальную медиастиноскопию [Jolly Р. С. et al., 1973; Page A. et al., 1985; Lacquet L., Schreinemakers J. H. J., 1990; Mentzer S. J. et al., 1997], парастернальную медиастинотомию по Мак-Нейлу—Чемберлену [Reid R. Т., Rudd R., 2001] либо торакоскопию [Rendina E. A. et al., 1994; Mentzer S. J. et al., 1997; Mouroux J. et al., 2001]. При необходимости прибегают к сочетанию медиастиноскопии по Карленсу с тем или иным из упомянутых методов [Rendina Е. A. et al., 1994; Nakanishi R. et al., 1994; Carbognani P. et al., 1996; Mouroux J. et al., 2001].
При медиастиноскопии определяют количество пораженных групп лимфатических узлов, оценивают степень их поражения, выявляют I степень инвазии (minimal N2 disease), при которой возможна и целесообразна радикальная медиастинальная лимфодиссекция [Asamura H. et al., 1999; Hurtgen M. et al., 2002]. Таким образом, соблюдаются принятые в настоящее время жесткие требования определения стадии рака легкого, планирования протокольных исследований по неоадъювантной полихимиотерапии, решения вопроса о радикальной операции [Carbognani P. et al., 1996; Asamura H. et al., 1999; Krasna M. J. et al., 2000; Reid R. Т., Rudd R., 2001; Hurtgen M. et al., 2002].
Для оценки эффективности неоадъювантной полихимиотерапии ряд авторов [Pauwels M. et al., 1998; Mateu-Navarro M. et al., 2000; Maas К. W., Schramel F. M., 2003] считают необходимым прибегать к повторной медиастиноскопии. При этом отмечено, что у 50 % обследованных не было найдено метастазов в тех группах лимфатических узлов, где они обнаруживались прежде [Mateu-Navarro M. et al., 2000]. Описана методика медиастинальной лимфодиссекции при медиастиноскопии [Hurtgen M. et al., 2002].
Касаясь нашего собственного материала, мы сочли целесообразным представить результаты применения медиастиноскопии при раке легкого с 1993 г. по август 2003 г. по следующим соображениям. С 1993 г. появилась возможность обследовать больных с применением компьютерной томографии.
К этому времени были сформулированы и оставались неизменными показания к медиастиноскопии и в практику была внедрена медиастиноскопия с видеосопровождением. У 426 больных выполнена 451 медиастиноскопия: медиастиноскопия по Карленсу — у 95, парастернальная медиастиноскопия —у 356 (у 25 больных было выполнено по 2 варианта медиастиноскопии). При рентгенологическом исследовании (включая компьютерную томографию) у 259 больных определялся синдром увеличения медиастинальных лимфатических узлов, у 105 —синдром инвазии опухолью экстрапульмональных анатомических структур и у 62 — оба указанных синдрома.
Из числа больных, у которых при рентгенологическом исследовании было выявлено увеличение медиастинальных лимфатических узлов (у 321), у 212 (66,0 %) при медиастиноско-пии обнаружены метастазы. При этом I степень инвазии отмечена у 95 (29,6 %) обследованных. По данным Z. Т. Натmoud и соавт. (1999), метастазы в средостении в аналогичной группе больных выявлены у 24,1 % больных, но только у 6,6 % опухолевое поражение было расценено как резектабельное.
Визуально при парастернальной медиастиноскопии инвазия была сочтена ограниченной и опухоль расценена как резектабельная у 61 (62,2 %) больного. Из них лишь у 5 (8,2 %) радикальная операция оказалась невозможной и, следовательно, степень инвазии при парастернальной медиастиноскопии была недооценена. В 9 случаях при парастернальной медиастиноскопии была найдена опухолевая диссеминация по париетальной плевре.
Таким образом, на основании оценки при медиастиноскопии по Карленсу и парастернальной медиастиноскопии степени регионарного метастазирования, а также степени инвазии первичной опухоли мы сочли возможным сформулировать критерии, согласно которым опухолевое поражение должно быть расценено как нерезектабельное:
• массивное экстракапсулярное поражение метастазами лимфатических узлов средостения;
• билатеральное метастатическое поражение лимфатических узлов средостения;
• прорастание опухоли в перикард на значительном протяжении;
• прорастание в крупные сосуды (верхняя полая вена, аорта);
• обширное (более трех ребер) поражение грудной стенки;
• опухолевая диссеминация по париетальной плевре;
• сочетание прорастания опухоли в соседние анатомические структуры с метастатическим поражением медиастинальных лимфатических узлов.
Разумеется, перечисленные критерии не являются абсолютными. Окончательное решение о радикальной операции следует принимать каждый раз индивидуально, с учетом гистологического варианта опухоли, возраста и общего состояния больного. В тех случаях, когда медиастиноскопическая картина по каким-то причинам (сращения, повышенная кровоточивость и пр.) представляется сомнительной, следует прибегнуть к торакотомии, чтобы устранить сомнения и не лишить больного шанса на радикальную операцию.
А.М. Шулутко, А.А.Овчинников, О.О.Ясногородский, И.Я.Могус
Читайте также:


