Медиана выживаемости при раке легкого

Прогноз выживаемости при раке
Важен и такой показатель, как относительная выживаемость. При его подсчёте учитывают количество лиц, страдающих раком определённой локализации, которые умерли от сопутствующей патологии. Выживаемость при раке зависит от стадии заболеваемости, пола, возраста и, чувствительности к проводимому лечению и наличия фоновых заболеваний.
Согласно данным ВОЗ (Всемирной организации здравоохранения) смертность от онкологической патологии увеличилась за последнее время на 11%. Рост заболеваемости раком отмечают у детей и лиц среднего возраста. Так, в 2011 году распространённость злокачественными новообразованиями составила 15000 на 100000 жителей страны, в Украине – 1520, а в Беларуси – 1514.
Структура онкологических заболеваний выглядит таким образом:
рак лёгкого, бронхов и трахеи, - 13,8%;.
новообразования кожи - 11,0%, меланома - 12,4%;
опухоли желудка составили - 10,4%;
рак молочной железы установлен в 10,0%;
неопроцесс ободочной кишки - 5,9%, прямой кишки, прямокишечно-сигмовидного соединения и анальной области - 4,8%;
онкопатология лимфатической и кроветворной системы - 4,4%;
шейки матки - 2,7% ,рак тела матки - 3,4%, а яичников - 2,6 %,
опухоли почек - 3,1%;
злокачественные новообразования поджелудочной железы - 2,9 %;
рак мочевого пузыря - 2,6 %.
Выживаемость после лечения рака предполагает подсчёт количества пациентов, которые выжили в течение определённого периода после проведенного радикального или паллиативного лечения. Учитывается двухлетняя, пятилетняя, семилетняя и десятилетняя выживаемость.
Процент выживаемости при раке различной локализации
Рассмотрим показатели выживаемости при различной локализации злокачественных новообразований в зависимости от стадии заболевания. Для этого, прежде всего, определимся со стадиями рака. Наиболее приемлемой для определения прогноза выживаемости является классификация TNM, в которой T – размер опухоли, N – поражение лимфатических узлов, а M – наличие метастазов в отдалённых органах.
Прогноз выживаемости при раке кожи определяется, прежде всего, стадией заболевания. Он зависит и от гистологической структуры опухоли, а также степени дифференцировки раковых клеток.
Рак 1 степени. Прогноз таков: излечение наступает у 100% пациентов.
Рак 2 степени. Прогноз для выздоровления удовлетворительный у 86% пациентов.
Рак 3 степени. Прогноз выздоровления – 62%.
Рак 4 стадии. Прогноз пятилетней выживаемости 12%.
Меланома является чрезвычайно агрессивной опухолью, которая происходит из пигментных клеток. Прогноз выживаемости зависит от стадии болезни, локализации опухоли и степени дифференциации атипичных клеток.
При I стадии меланомы до пяти лет живут около 97% пациентов.
При II стадии пятилетняя выживаемость составляет 65%.
При III стадии рака процент выживаемости –37%.
При IV стадии заболевания до одного года доживает всего 15%пациентов.
Прогноз выживаемости при раке нижней губы находится в прямой зависимости от стадии заболевания, возраста пациента, степени дифференцировки опухоли и её чувствительности к лучевой терапии:
A. При I стадии до пяти лет живут 70% пациентов.
B. При II стадии пятилетняя выживаемость 59% .
C. Когда в III стадии определяют рак, процент выживаемости всего 35%.
D. При IV стадии рак губы до одного года доживает 21% болеющих людей.
Многим пациентам ставят диагноз рак ротовой полости. Процент выживаемости у них зависит не только от стадии заболевания, но и от формы роста опухоли, степени дифференцировки раковых клеток и возраста пациента. Прогноз выживаемости показан на таблице №1.
Таблица №1.Прогноз выживаемости при раке слизистой оболочке ротовой полости
Процент пятилетней выживаемости
Опухоль ротовой полости – это достаточно агрессивный рак. Процент выживаемости до одного года – всего лишь 16.
Динамику пятилетней выживаемости при раке щитовидной железы в зависимости от стадии заболевания можно увидеть на графике №1.
График №1. Динамика пятилетней выживаемости при разных стадиях рака щитовидной железы.

Трагическая судьба пациентов при выявлении неоперабельного рака лёгких: 90% из них погибает в течение первых двух лет после установления диагноза. При одном выполненном хирургическом вмешательстве в течение пяти лет выживает 30% пациентов, у которых в лёгких диагностирован рак. Процент выживаемости при радикальном комплексном лечении рака лёгких можно увидеть на таблице№2.
Таблица №2. Пятилетняя выживаемость пациентов, страдающих раком лёгких, в случае полноценного радикального лечения
Процент пятилетней выживаемости
Выживаемость после радикального оперативного лечения рака пищевода является чрезвычайно информативным показателем. Она представлена на таблице №3.
Таблица №3. Пятилетняя выживаемость после оперативных вмешательств по поводу рак пищевода
Конечно же, на показатель выживаемости пациентов, страдающих раком пищевода, влияет и стадия заболевания. При первой стадии онкологического процесса процент пятилетней выживаемости наиболее высокий: он составляет 57%. В течение пяти лет выживает 43% людей, у которых выявлен рак пищевода второй стадии. При третьей стадии заболевания в течение пяти лет живут 25% больных людей. К сожалению, только пациентов, у которых рак пищевода диагностирован на четвёртой стадии, выживают один год.


03 марта 2016, 14:23
Рак грудины – злокачественное новообразование, развивающееся в результате мутации костных клеток. В большинстве случаев он.

03 марта 2016, 14:17
Рак желудка до сих пор является одним из наиболее распространённых злокачественных новообразований органов пищеварения. В.

03 марта 2016, 14:09
Рак молочной железы относится к визуальным формам рака. Это значит, что опухоль на ранней стадии.

Все пациенты по-разному реагируют на диагноз онкологического заболевания. Многие предпочитают избегать информации, которая может быть неприятной, в то время как другие ищут максимально точные ответы. Никто не может сказать, какая из этих стратегий является более правильной. Тем не менее, одним из частых вопросов онкологических пациентов является вопрос к врачу о предполагаемой продолжительности жизни. В онкологии для предполагаемой оценки продолжительности жизни пациентов используются различные статистические термины, многие из которых непонятны для пациента. В данном материале описаны основные термины, которые используют врачи для определения прогноза при онкологических заболеваниях.
Важно понимать, что ни один врач не может точно ответить пациенту на вопрос о его продолжительности жизни. Срок жизни любого человека зависит от многих факторов, не все из которых связаны с болезнью. Предполагаемая продолжительности жизни онкологического пациента зависит от:
- Вида злокачественной опухоли и её расположения в организме (локализации);
- Стадии заболевания, включая размеры и распространенность опухоли;
- Биологических особенностей опухоли. её агрессивности и скорости роста, а также некоторых генетических особенностей раковых клеток;
- Чувствительности опухоли к проводимому лечению;
- Возраста и общего состояния здоровья пациента.
Для оценки эффективности различных методов лечения применяются статистические методы, которые позволяет оценить выживаемость групп пациентов. Наиболее часто оцениваются следующие показатели выживаемости:
Разновидностью общей выживаемости является относительная выживаемость пациентов, которая является наиболее удобным показателем для оценки выживаемости пациентов пожилого возраста. При оценке этого показателя оценивается соответствие выживаемости пациентов определенного возраста со злокачественным новообразованием с выживаемостью людей схожего возраста, но без наличия онкологического заболевания.
Пример 1: 5-летняя выживаемость пациентов с диагнозом рака шейки матки составляет 68%. Это означает, что 68 пациенток из 100 переживает 5 лет с момента постановки диагноза.
Пример 2: медиана выживаемости пациенток с диагнозом определенной злокачественной опухоли составляет 60 месяцев. Это означает, что 50% пациенток с данным заболеванием переживают 5-летний срок с момента постановки диагноза.
Именно указанные выше показатели используются в клинических исследованиях (подробнее про клинические исследования – здесь) для того, чтобы оценить эффективность различных методов лечения и сделать вывод о целесообразности их применения.
Для графического отображения показателей выживаемости используются специальные графики, на которых изображаются так называемые "Кривые Каплана-Майера" (Рисунок 1).
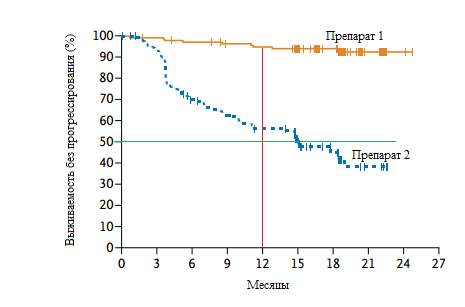
Рисунок 1. Пример кривых Каплана-Мейера по выживаемости без прогрессирования пациентов в одном из исследований. Красной линией обозначена 1-летняя выживаемость без прогрессирования, зеленой - медиана выживаемости без прогрессирования. Из графика видно, что препарат 1 демонстрирует значительные преимущества перед препаратом 2.
Таким образом, предсказать точную продолжительность жизни для отдельного пациента является крайне трудной задачей. Для предположительной оценки выживаемости врачи используют статистические данные, полученные в ходе проведения клинических исследований, в которых участвовало большое количество пациентов с определенными видами и стадиями опухолей. Такие оценки позволяют оценить среднюю выживаемость в больших группах пациентов, однако эту статистику бывает трудно перенести на отдельного пациента. Кроме того, методы лечения злокачественных опухолей постоянно совершенствуются, по этой причине данные такой статистики могут не учитывать все многообразие доступных методов лечения.
К примеру, Ваш врач может сообщить, что он оценивает прогноз течения заболевания как благоприятный. Это означает, что имеющиеся данные указывают на чувствительность опухоли к терапии и высокую вероятность хорошего контроля болезни в течение длительного времени, достижения длительной ремиссии – или даже излечения.
Подводя итоги, следует еще раз подчеркнуть следующие основные моменты:
- Статистика позволяет оценить выживаемость больших групп пациентов, но не позволяет предсказать прогноз течения заболевания и точную продолжительность жизни отдельного пациента;
- Статистика выживаемости может значительно отличаться при различных типах и стадиях опухолевого процесса, возраста пациента и проводимого лечения;
- Показатели общей выживаемости и выживаемости без прогрессирования широко применяются в клинических исследованиях для того, чтобы оценить эффективность изучаемого метода лечения;
- Статистические данные дают врачам полезную информацию для выбора наиболее подходящего метода лечения, но являются лишь одним из факторов, которые необходимо учитывать при выработке плана лечения.
Заболеваемость и смертность от мелкоклеточного рака легких во всем мире делают эту болезнь заметной проблемой для здравоохранения. Диагноз основывается на результатах гистологии, для подтверждения проводят иммуногистохимические исследования в сложных случаях. Типичными пациентами являются мужчины старше 70 лет, которые были раньше или являются сейчас заядлыми курильщиками и которые имеют сопутствующие заболевания дыхательной и сердечно-сосудистой систем. Симптомы могут начать быстро проявляться из-за локального внутригрудного роста опухоли, внелегочного отдаленного распространения, паранеопластических синдромов или комбинации этих особенностей [2]. Термин МРЛ впервые введен в 1926 году, когда было признано его эпителиальное происхождение [2].
Эпидемиология
Рак легких является причиной 12 % всех выявленных случаев рака во всем мире и основной причиной смерти от рака в США [4]. МРЛ представляет 13 % всех вновь диагностированных случаев рака легких во всем мире, или более 180 000 случаев в год. В развитых странах распространенность МРЛ снизилась за последние 30 лет, вероятно, из-за антитабачной политики. Ожидается увеличение заболеваемости в странах, где распространенность курения остается высокой [2].
Гистология
Хотя в 95% случаях мелкоклеточный рак развивается в легких, он также может возникать во внелегочных участках, включая носоглотку, желудочно-кишечный тракт и мочеполовой тракт. 11-13 Мелкоклеточный рак, как легочный, так и внелегочный, имеющие сходное клиническое и биологические течение, склонны к быстрому метастазированию [3].
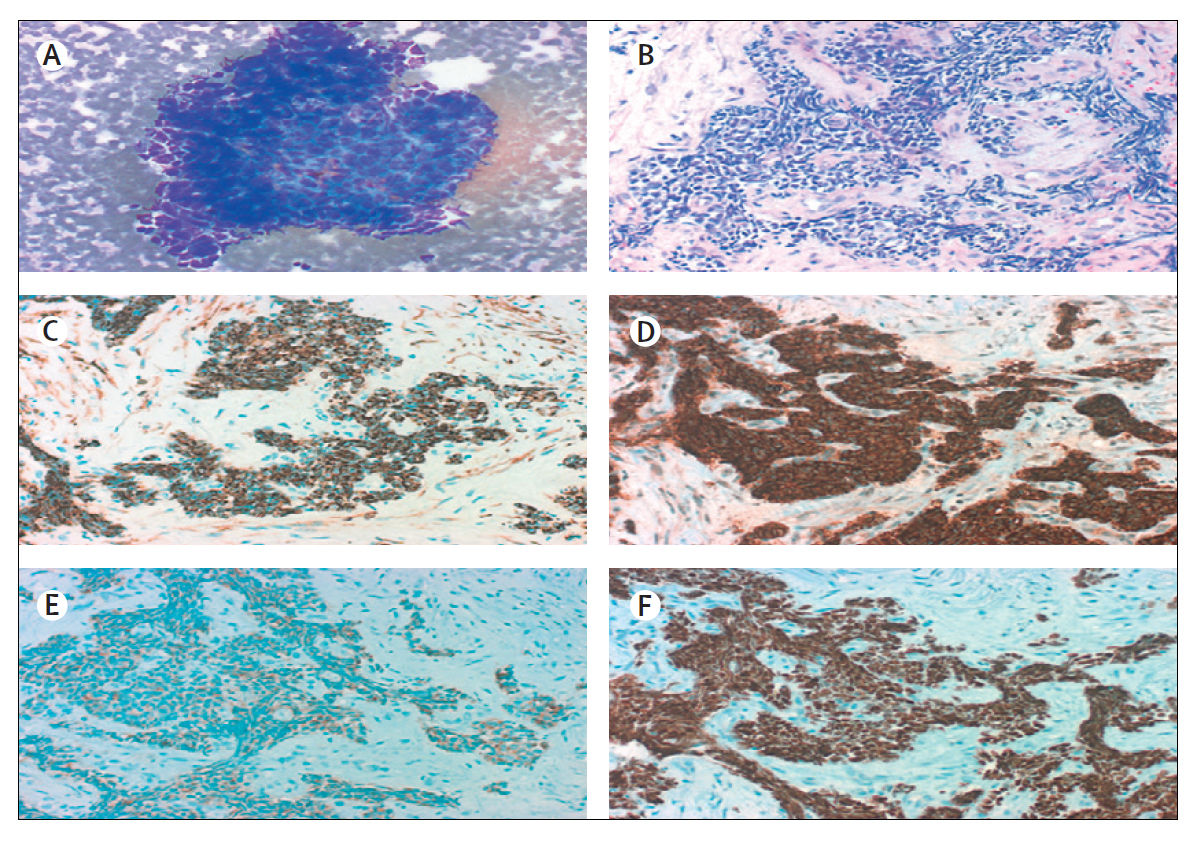
(A) При типичном МРЛ клетки маленькие (обычно меньше, чем размер трех маленьких лимфоцитов) с небольшим количеством цитоплазмы, ядра мелкозернистые, ядрышки отсутствуют (окраска Дифф - Квик, увеличение ×200).
(B) Клетки могут быть круглыми, овальными или веретенообразными, и клеточная стенка видна редко. Группы клеток могут формировать розетки. В опухоли часто определяются некрозы (окраска гематоксилином и эозином, увеличение × 200).
При иммуногистохимии результаты для (C) CK-7, нейроэндокринных маркеров (D) CD56 и (E) синаптофизина; и (F) TTF-1 положительны.
Все фотографии предоставлены с разрешения М. Праета и Л. Фердинанде, Гентский университет, Бельгия.
МРЛ можно заподозрить при наличии определенных симптомов и признаков. Для подтверждения диагноза требуются гистологические и цитопатологические исследования. Образцы из первичной опухоли, лимфатических узлов или других метастатических участков получают с помощью бронхоскопии или тонкоигольной аспирационной пункционной биопсии (ТАПБ). Опухоль растет под слизистой бронхов, и, следовательно, бронхоскопия или исследование мокроты могут не дать результатов. Иммуногистохимические исследования проводятся для подтверждения диагноза в сложных случаях. Тест на нейроэндокринные маркеры, такие как хромогранин, синаптофизин и CD56, также может быть полезным — менее 10 % опухолей МРЛ являются отрицательными для всех нейроэндокринных маркеров. Почти все МРЛ являются иммунореактивными в отношении кератина, антигена эпителиальной мембраны и фактора транскрипции щитовидной железы-1 (TTF-1) [3]. Реакция МРЛ на TTF-1 положительна в 90% случаев. Эпителиальные маркеры, такие как цитокератины, обнаруживаются во многих опухолях МРЛ и помогают отличить их от лимфом и других маленьких круглых опухолей. Но отличить мелкоклеточный от немелкоклеточного с помощью маркеров трудно [2].
Первыми описали отчетливые клинические особенности МРЛ Watson и Berg: центральное расположение на рентгенографии грудной клетки, тенденцию к раннему распространению, высокую чувствительность к химиотерапии и высокую частоту метастазов при вскрытии. Симптомы начинают проявляться, как правило, в течение 8–12 недель. Наиболее частыми симптомами являются кашель, хрипы, одышка, кровохарканье, вызванное локальным внутрипульмональным ростом опухоли; симптомы, обусловленные внутригрудным распространением на стенку грудной клетки, верхней полой веной или пищеводом, боль, усталость, анорексия и неврологические жалобы, вызванные отдаленное распространение и паранеопластические синдромы [2].
Предпочтительными участками для метастазирования являются мозг, печень, надпочечники, кости и костный мозг. МРЛ является наиболее частой причиной паранеопластических синдромов. Эти синдромы следует активно исключать всякий раз, когда у пациента проявляются какие-либо из их признаков. Наиболее частыми проявлениями синдромов со стороны эндокринной системы являются синдром неадекватного антидиуреза и синдром Кушинга. Известно о субклинических проявлениях обоих. Дерматологические аномалии, специфически связанные с МРЛ, включают приобретенный тилоз, трипальные пальмы и эритему. Редкими проявлениями являются дерматомиозит, гипергликемия, гипогликемия, гиперкальциемия и гинекомастия [2,4].
Классификация
Мелкоклеточный рак легкого входит в группу эпителиальных бронхопульмональных нейроэндокринных (НЭ) опухолей. Все НЭ опухоли легкого являются злокачественными новообразованиями и представлены четырьмя основными подтипами [1]:
1) типичный карциноид (ТК);
2) атипичный карциноид (АК);
3) крупноклеточный НЭ рак (КНЭР);
4) мелкоклеточный рак (МРЛ).
При этом ТК и АК являются высокодифференцированными нейроэндокринными опухолями с низкой степенью злокачественности (G1 и G2), а КНЭР и МРЛ — это низкодифференцированные нейроэндокринные опухоли с высокой степенью злокачественности (G3) [1,4].
Оценка распространенности опухолевого процесса влияет на решение о назначении терапии. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей [1,4].
Классификация, по которой выделяют пациентов с локализованным и распространенным мелкоклеточным раком легкого актуальна [1].
Локализованная стадия — опухоль занимает одну половину грудной клетки с регионарными метастазами в лимфоузлы корней легких с обеих сторон, с метастазами в надключичные узлы и лимфоузлы средостения, а также с выпотом в плевральной полости с этой же стороны.
Распространенная стадия — процесс, выходящий за пределы локализованного. Наличие М1 — это всегда распространенная стадия.
Лечение МРЛ
Распространенная стадия
Первая линия химиотерапии. В течение последних десяти лет комбинации ЕР или ЕС (этопозид + цисплатин / карбоплатин) является стандартом для лечения пациентов с МРЛ. Доказано, что противоопухолевая активность данного лечения при распространенном МРЛ составляет 60–78 % (полный эффект — у 10–20 % больных). Медиана выживаемости — 7,3–11,1 мес. Большинство новых режимов современной химиотерапии основыввется на комбинации ЕР (или ЕС) или путем замены этопозида на другое средство [1].
Вторая линия химиотерапии. Несмотря на высокую чувствительность МРЛ к химио- и лучевой терапии, в большинстве случаев приходится сталкиваться с рецидивом заболевания. В такой ситуации выбор дальнейшей лечебной тактики (химиотерапия второй линии) зависит от ответа пациентов на первую линию лечения, интервала времени, прошедшего после ее окончания, и от расположения метастазов [1,4].
У пациентов с рецидивом МРЛ прогноз сомнительный, в особенности при рефрактерном рецидиве. Медиана выживаемости после обнаружения рецидива не превышает 4 месяца. В настоящее время схема CAV стала второй линией лечения МРЛ. Больным с резистентной формой МРЛ назначают химиотерапию второй линии. При этом эффективность отмечается у небольшого процента больных, но применение химиотерапии может стабилизировать болезни и/или замедлить прогрессирование [1].
Третья линия химиотерапии. Эффективность третьей линии химиотерапии распространенного МРЛ остается неизвестной. Больные в третьей линии могут получать таксол, гемцитабин, ифосфамид как в монотерапии, так и в комбинации с цисплатином или карбоплатином. Выживаемость больных с распространенным МРЛ следующая: 1 год после постановки диагноза живут 44 % больных, 1,5 года — 24 %, 2 года — 12 %, 3 года — 6 %, от 3,5 до 5 лет — 4 % больных [1].
Локализованная стадия МРЛ
Лучевая терапия МРЛ
Применяется у пациентов с локализованной и распространенной стадиями болезни. В результате отмечается регрессия опухоли в 60–80 % случаях, но отдельно от химиотерапии не увеличивает продолжительность жизни из-за появления отдаленных метастазов. Без облучения локальное прогрессирование болезни встречается у 80 % больных с локализованным МРЛ, получавших только химиотерапию. Лучевая терапия также проводится у больных с распространенной стадией (при метастазах в кости, в мягкие ткани, мозг). При появлении метастазов в мозге ЛТ является основным методом лечения. Химиолучевая терапия улучшает результаты лечения и увеличивает продолжительность жизни [1,4].
Профилактическое облучение мозга
Метастазы в головной мозг появляются у 20–30 % пациентов к моменту установления диагноза МРЛ и часто протекают бессимптомно. Иногда появление метастазов в головном мозге является первым симптомом МРЛ. Профилактическое облучение (ПОМ) показано больным с невыявленными метастазами в мозге, т. к. шансы на появление их в ближайшие 1,5–2 года достигают 70 % [1].
Таргетная терапия МРЛ
Молекулярно-генетические механизмы МРЛ разнообразны и пока недостаточно изучены. Для МРЛ характерны делеция хромосомы 3р, мутации гена р53, экспрессия Bcl-2, активация теломеразы и немутантного c-kit у 75–90 % пациентов. При МРЛ наблюдаются и другие молекулярные нарушения: экспрессия VEGF, потеря гетерозиготности хромосом 9р и 10q у большинства пациентов. Аномалии KRAS и р16 при МРЛ относительно редки. Многие таргетные препараты были изучены при МРЛ, но это не изменило клинические подходы и возможности терапии этого заболевания [1,2].
Хирургическое лечение МРЛ
Хирургическое лечение является доказанным методом выбора только у пациентов с I стадией болезни. Операция возможна у больных МРЛ и со II стадией, но клинических исследований недостаточно. При I стадии МРЛ 5-летняя выживаемость после операции — 48–50 %, а при II стадии — 32–39 %. Хирургическое лечение МРЛ также возможно у пациентов с неуточненным морфологичеким диагнозом и при наличии смешанных форм (с мелкоклеточным и немелкоклеточным компонентами). Во всех случаях через 2–3 нед. после оперативного вмешательства необходимо проведение адъювантной ХТ (4 курса с интервалами 3–4 нед.). Схемы адъювантной ХТ: этопозид + карбоплатин или этопозид + цисплатин [1].
Источники:
1. Бычков М.Б., Горбунова В.А. Клинические рекомендации по диагностике и лечению больных раком легкого // М.: Общероссийский союз общественных объединений ассоциация онкологов России. – 2014.
2. Fennell D. A. et al. Small-cell lung cancer //Lancet (London, England). – 2011. – Т. 378. – №. 9804. – С. 1741-1755.
3. Kalemkerian G. P. et al. Small cell lung cancer //Journal of the National Comprehensive Cancer Network. – 2013. – Т. 11. – №. 1. – С. 78-98.
4. Kalemkerian G. P. et al. NCCN guidelines insights: Small cell lung cancer, Version 2.2018 //Journal of the National Comprehensive Cancer Network. – 2018. – Т. 16. – №. 10. – С. 1171-1182.
Лекарственное лечение. НМРЛ
Профессор М.Б. Бычков
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Рак легкого является ведущей причиной смертности в большинстве развитых стран мира как у мужчин так и женщин при всех злокачественных опухолях и занимает 9 место среди общих причин смертности в США. Смертность от рака легкого в США выше чем от рака молочной железы, толстой кишки и предстательной железы вместе взятых. По данным American Cancer Society (2000), если соотношение смертность/заболеваемость для рака предстательной железы, молочной железы и толстой кишки составляют 17,6%, 22,5% и 43,2% соответственно, то при раке легкого эта цифра равна 95,6%. Общая 5–летняя выживаемость для всех больных с установленным диагнозом рака легкого составляет около 13–15%. Основной причиной смерти является распространение болезни. К моменту установления диагноза более 75% всех больных имеют неоперабельный местнораспространенный или метастатический процесс. Эти больные с III B и IV стадией болезни подлежат лекарственному лечению. Целью такого лечения является продление жизни больных, снятие различных симптомов, сопровождающих болезнь и, таким образом – улучшение качества жизни.
В прошлом отдаленные результаты лечения больных с распространенным немелкоклеточным раком легких (НМРЛ) были плохими, медиана выживаемости 4–5 месяцев, а 1–летняя выживаемость не превышала 10%. В то время часто обсуждался вопрос: нужна ли вообще химиотерапия больным с НМРЛ, учитывая ее малую эффективность и значительную токсичность.
В последние годы достигнут определенный прогресс в лекарственном лечении НМРЛ. Данные различных рандомизированных исследований по сравнению активности таких препаратов, как паклитаксел, доцетаксел, Навельбин, гемцитабин и др. с наилучшей симптоматической терапией (ВSC), показали, что использование цитостатиков, несмотря на наличие побочных эффектов, приводило к объективному эффекту, улучшению качества жизни и значительному увеличению медианы выживаемости и 1–летней выживаемости по сравнению с BSC.
Появление платиновых производных в 80–х годах несколько улучшило отдаленные результаты, медиана выживаемости выросла до 6,5 мес., а 1–летняя выживаемость до 25%.
В последние десятилетие появились новые препараты таксаны, гемцитабин, Навельбин, иринотекан, топотекан, которые вновь улучшили отдаленные результаты лечения НМРЛ: медиана выживаемости увеличилась до 6–9 месяцев, а 1–летняя выживаемость превысила 25% для монотерапии этими препаратами. При использовании комбинированной химиотерапии с цисплатином эти новые дублеты увеличили 1–летнюю выживаемость до 40–50% у больных с распространенным НМРЛ [1].
Raftopoulos H. и соавт. провели всесторонний анализ больших рандомизированных клинических испытаний за 10 лет, с 1991 по 2001 г., с целью определения роли химиотерапии при распространенном НМРЛ [2]. Исследовались результаты лечения 8468 больных. Медиана выживаемости была наименьшей в группе 783 больных, получавших лечение одним цисплатином – 7,2 мес., в группе 509 пациентов, лечившихся по схеме цисплатин + этопозид, она равнялась 7,8 мес., а наибольшей медиана выживаемости была в группе больных, получавших цисплатин с новыми цитостатиками – 9,2 мес.
Baggstrom M.Q. с соавт. (США) провели мета–анализ опубликованной литературы о влиянии различных режимов химиотерапии в качестве 1 линии лечения на выживаемость больных III–IV ст. НМРЛ [3]. Авторы отметили, что III поколение современной химиотерапии – комбинация платиновых препаратов с таксанами, гемцитабином, Навельбином – увеличивает число объективных эффектов на 13% (р=0,001) и медиану выживаемости на 4% (р=0,001) по сравнению со II поколением комбинированной химиотерапии (комбинация платиновых препаратов с другими цитостатиками). Для проведения этого мета–анализа авторы использовали 8 больших клинических испытаний, в которые было включено 3296 пациентов с НМРЛ.
Schiller J.H. (США) представил анализ ECOG испытаний с 1980 по 2000 г. по сравнению отдаленных результатов и характеристике больных с распространенным НМРЛ, получавших различные схемы химиотерапии [4]. В анализ автор включил 3398 больных, разделенных на 2 группы: в 1–й – лечившиеся до 1990 г. (1574 человека), а во 2–й – после 1990 г. (т.е. получавших новые цитостатики – таксаны, гемцитабин, Навельбин и др.) – 1824 человека. Медиана выживаемости в 1 гр. была 5,9 мес., а во 2 гр. – 8,1 мес., т.е. увеличилась в 1.4 раза. Время до прогрессирования в 1 гр. было 2,7 мес., а во 2 гр. 3,5, т.е. также увеличилось в 1,3 раза. Интервал времени от начала прогрессирования до смерти в 1 гр. был 2,7 мес., а во 2 гр. – 4,1 мес. также увеличился в 1,6 раза. Автор приводит и некоторые другие характеристики, которые претерпели изменения за эти годы. Так до 1990 г. потеря веса у больных больше 10 кг была у 15,4% больных, а после 1990 г. лишь у 11,9%. Число больных с более чем 1 метастазом во 2 гр. уменьшилось в 2 раза (45,3 и 22,8% соответственно), а интервалы от момента установления диагноза до начала лечения уменьшились с 1,4 мес. до 1 мес..
Основные эффективные дублеты для лечения распространенного НМРЛ
Авторы сделали заключение, что между тремя схемами комбинированной химиотерапии не было отмечено статистически достоверной разницы как по числу объективных эффектов, медиане выживаемости, так и по 1–летней выживаемости, но с тенденцией к меньшей эффективности в группе паклитаксел + гемцитабин.
При анализе этих данных авторы отметили, что О.Э. был сходный в каждой руке, но был большим в группах цисплатин + паклитаксел и цисплатин + гемцитабин (не отмечено статистической достоверности). Медиана выживаемости и 1–летняя выживаемость также были одинаковы. В то же время 2–х летняя выживаемость была больше в группе цисплатин + гемцитабин (13%) по сравнению с контрольной группой (10%).
Токсичность III–IV ст. была наибольшей в группе цисплатин + паклитаксел. Авторы сделали также вывод, что все 4 схемы являются переносимыми и могут быть альтернативами при выборе схем лечения при НМРЛ. Выбор той или иной схемы зависит от предпочтений врач – больной. Схема гемцитабин + цисплатин является эффективным режимом при лечении НМРЛ, но врачи обратили внимание на сложности, связанные с введением цисплатина, и обусловленные им побочные явления. Поэтому в настоящее время проводятся клинические испытания, в которых цисплатин в этой комбинации заменяется карбоплатином. Карбоплатин является хорошей альтернативой цисплатину и не дает многих побочных явлений, связанных с цисплатином. Возможно, что результаты текущих исследований позволят рекомендовать схему гемцитабин + карбоплатин, как схему I линии лечения НМРЛ.
Massarelli E. с соавт. [8] провели ретроспективный анализ отдаленных результатов лечения в различных клиниках США и Великобритании больных, которые получали ранее 2 режима химиотерапии, включающие в себя платиновые производные и доцетаксел при рецидивирующем НМРЛ. Объективный эффект отмечался у 21% пациентов после 1 линии лечения, 16,3% после 2 линии, а после 3 и 4 линий лечения, когда применялся гемцитабин и комбинации с другими препаратами, объективное улучшение было отмечено лишь у 2,3% до 0%. Контроль болезни (ОЭ + стаб.) после 1 линии достигался у 62,8% больных, а после 3 и 4 линии – лишь у 21,4%. Общая однолетняя выживаемость при всех линиях химиотерапии была 81,2%, а 2–летняя – 18,7%. Авторы делают вывод о низкой эффективности 2 линии лечения НМРЛ и о минимальной эффективности 3 и 4 линий лечения, что требует дальнейшей разработки новых схем химиотерапии для 2 и других линий лечения НМРЛ.
Rudd R.M. с соавт. [9] в Великобритании провели III фазу клинических испытаний по сравнению схемы GC (гемцитабин + карбоплатин) со схемой MIP (митомицин + ифосфамид + цисплатин). В исследование было включено 422 больных с распространенным НМРЛ. В 1 гр. гемцитабин вводили в дозе 1200 мг/м2 1 и 8 дни, а карбоплатин AUC–5 в 1 день 1 раз в 3 недели (212 чел.). Во 2 гр. (210 чел.) митомицин вводили в дозе 6 мг/м2, ифосфамид 3,0 г/м2, цисплатин 50 мг/м2 в 1 день 1 раз в 3 недели. Число курсов лечения в обеих группах было по 4. Авторы не отметили разницы в группах по числу эффектов (37% в 1 гр. и 40% во 2 гр.), однако медиана выживаемости была статистически достоверно выше в 1 гр. – 10 мес. по сравнению со 2 гр. – 6,5 мес. Кроме того, в 1 гр. только в 14% курсов требовалась госпитализация, а во 2 гр. – у 89% курсов. Тошнота, рвота и алопеция также статистически меньше были в 1 гр. (табл. 7).
Результаты II фазы клинических испытаний SWOG по лечению больных III ст. с НМРЛ с плохим прогнозом представили Davis A.M. с соавт. (США) [10]. Они проводили одновременную химиотерапию карбоплатином и этопозидом и лучевую терапию с последующей терапией паклитакселом с целью консолидации. Карбоплатин вводили по 200 мг/м2 1, 3, 29, 31 дни, этопозид 50 мг/м2 с 1 по 4 дни и с 29 по 32 дни. Лучевая терапия проводилась с 1 дня лечения разовой дозой 1,8–2 Гр, суммарно 61 Гр. Паклитаксел вводили в дозе 175 мг/м2 1 раз в 3 недели, начиная с 11 дня 3 цикла химиотерапии. Всего лечили 56 больных. Объективный эффект после химиолучевой терапии был достигнут у 49%, а после лечения паклитакселом он увеличился до 58%. Медиана выживаемости составила 10,3 мес., а 2–летняя выживаемость была 27%. Нейтропения и тромбоцитопения III–IV ст. были соответственно у 45% и 23% пациентов. Авторы сравнили результаты этого исследования с данными своего другого исследования, в котором не вводили паклитаксел для консолидации, и отметили, что хотя данная схема лечения приводит к увеличению объективного эффект в 2 раза (58% и 29%), но медиана выживаемости и 2–летняя выживаемость не увеличились, что, возможно, связано с высокой цифрой лекарственной смертности (9,2%) в группе получавших паклитаксел во время консолидирующей терапии.
Gandara D.R. с соавт. представили материалы консорциума по изучению рака в Калифорнии, в которых исследовалось влияние уровня гена р53 на результаты лечения больных НМРЛ. 33 больных получали химиотерапию по схеме: гемцитабин 1000 мг/м2 1 и 8 дни в качестве 2 линии лечения. Медиана выживаемости без прогрессирования и общая медиана выживаемости у больных с гиперэкспрессией р53 была почти в 2 раза меньше, чем у пациентов без гиперэкспрессии [11].
Современные схемы комбинированной химиотерапии распространенного НМРЛ:
Дублеты:
1. Этопозид + Цисплатин
2. Гемцитабин + Цисплатин
3. Паклитаксел + Цисплатин
4. Доцетаксел + Цисплатин
5. Навельбин + Цисплатин
6. Паклитаксел + Карбоплатин
Триплеты:
1. Паклитаксел + Карбоплатин + Гемцитабин
2. Паклитаксел + Цисплатин + Навельбин
3. Доцетаксел + Цисплатин + Гемцитабин
Выбор той или иной равноэффективной схемы зависит от предпочтения врач – больной, профиля токсичности, а также от стоимости лечения.
Литература:
1. Bunn P/A/, Kelly K. New chemotherapeutic agents prolonging survival and improve guality of life in NSCLC: a rewiew of the literature and future directions. Clin. Cancer Res., 1998,4/
2. Raftopoulas H., Gralla R.J., Bria E. et al. Assessing the role of chemotherapy in advanced NSCLC: a comrehensive review of large, randomized trial 1991–2001. Proc. ASCO, 21, 322a, abs. 1284.
3. Baggstrom M.Q., Sosinski M.A., Hensing T.A. Third generation chemotherapy regimens improve survival over second generation regimens in stage III B – IV NSCLC: aa metaanalys of the published literature. Proc. ASCO, 2002, 21, 306a, abs.1222.
4. Schiller J.H., Bernardo P., Harrington D. et al. Comparison of out come aud patients characteristics in advanced NSCLC: analys of ECOG 1980–2000. Proc. ASCO, 2002,21,304f,abs.12-15.
5. Scagliotti G., De Marinis F., Rinaldi M. et al. Phase III Randomised trial comparing three platinum – based doublets in NSCLC. Proc. ASCO, 2001, 20,308a,abs.12-27.
6. Van Meerbeeck J, Smit F, Lianes D et al. A EORTC randomized phase III trial of three chemotherapy regimens in advanced NSCLC. Proc. ASCO,2001,20,308,abs.12-28.
7. Schiller J, Harrington D, Belani C et al. Comparison of four chemotherapy regiments for advanced NSCLC. New Engl.J.Med.2002,10,92–98.
8. Massarelli E, Andre F, Liu D.D. et al. A retrospective analysis of the outcome who received two prior chemotherapy regimens including a platin and docetaxel for recurrent NSCLC. Proc. ASCO,2002,331a,abs.13-23.
9. Rudd R.M., Gover N.H., James L.E et al. Phase III randomized comparison of gemcitabine and carboplatin with mitomycin, ifosfamide and cisplatin (MIP) in advanced NSCLC. Proc, ASCO,2002,21,292a,abs.11-64.
10. Davis A.M., Lau D.H., Growley J et al. Concurent carboplatin/etoposide and radiation followed by paclitaxel for poor risk stage III NSCLC: a Soutwest oncology Group phase II trial. Proc. ASCO,2002,298a,abs.1191.
11. Gandara D.R., lara P.N., Edelman M.J. p53 status in platinum–refractory NSCLC receiving gemcitabine: a California Cancer Consortium trial. Proc. ASCO,2002,21,312a,abs.12-47.
12. Thompson D., Hainthworth J, Burris H. et al. Prospective randomized study of four third generation chemotherapy regimens in patients with advanced NSCLC. Proc. ASCO,2001,20,314a,abs.12-53.
Читайте также:

