Маркер опухоли мягких тканей
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Саркомы – это группа различных по клиническим и морфологическим признакам злокачественных новообразований, которые происходят из любых неэпителиальных тканей. В этом заключено основное отличие саркомы от рака, ростком которого являются эпителиальные клетки.
Риск возникновения данного заболевания повышается при некоторых генетических патологиях:
- синдром базальноклеточных невусов;
- синдром Вернера;
- синдром Гарднера;
- туберозный склероз;
- кишечный полипоз т.д.
А болезнь Реклингхаузена, или нейрофиброматоз 1 типа, является наиболее распространенным наследственным заболеванием, которое осложняется опухолевыми процессами. При этой патологии нейрофибросаркомы возникают примерно в 15% случаев. Описаны также случаи возникновения саркомы в зоне воздействия ионизированного излучения, как патологического, так и с лечебными целями.
Гистоморфологическая классификация сарком
Зачастую точно определить, из какой именно ткани возникла конкретная опухоль, довольно сложно. Кроме того, выделяется большая группа опухолей, которые имеют неясный гистогенез.
Наиболее часто диагностируются фибросаркомы, липосаркомы и рабдомиосаркомы. Вторыми по частоте встречаемости следует злокачественная гистиоцитарная саркома мягких тканей и саркомы неясного генеза. Ангиосаркомы, синовиальные саркомы, злокачественные шванномы, лейомиосаркомы и прочие типы наблюдаются редко.
Опухоли жировых тканей
Промежуточные (местно-агрессивные) формы:
- атипичный липоматоз;
- высокодифференцированные липосаркомы.
Злокачественные формы:
- недифференцированные липосаркомы;
- миксоидные липосаркомы;
- круглоклеточные липосаркомы;
- полиморфная липосаркома;
- липосаркомы смешанного типа;
- липосаркомы без признаков дифференцировки.
Миофибропластические и фибробластические опухоли
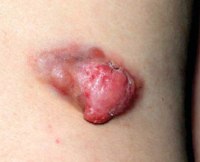
Промежуточные, или местно-агрессивные, формы:
- поверхностные подошвенные или ладонные фиброматозы;
- фиброматозы десмоидного типа;
- липофиброматозы.
Редко метастазирующие формы:
- солитарные фиброзные опухоли;
- гемангиоперицитомы, включая липоматозные гемангиоперицитомы;
- воспалительные миофибропластические опухоли;
- миофибропластические саркомы низкой степени дифференцировки;
- миксоидные фибропластические саркомы;
- инфантильные фибросаркомы.
Злокачественные формы:
- зрелые фибросаркомы;
- миксофибросаркомы;
- медленнорастущие фибромиксоидные саркомы;
- гиалинизирующие веретеноклеточные саркомы;
- склерозирующие эпителиоидные фибросаркомы.
Фиброгистиоцитарные опухоли
Промежуточные, или местно-агрессивные формы:
- плеоморфные фиброгистиоцитарные опухоли;
- гигантоклеточные саркомы мягких тканей.
Злокачественные формы:
- недифференцированные плеоморфные саркомы;
- недифференцированные плеоморфные саркомы с гигантскими клетками;
- недифференцированные плеоморфные саркомы с преобладанием воспаления.
Саркома мышечной ткани
Опухоли скелетных мышц:
- эмбриональные веретеноклеточные и анапластические рабдомиосаркомы;
- альвеолярные солидные и анапластические рабдомиосаркомы;
- плеоморфные рабдомиосаркомы.
Саркома гладких мышц: лейомиосаркома, включая и кожные формы.
Периваскулярные опухоли
- Злокачественные гломусные опухоли;
- миоперицитомы.
Сосудистые опухоли
Промежуточные, или местно-агрессивные формы: гемангиоэндотелиомы типа Капоши.
Редко метастазирующие формы:
- ретиформные гемангиоэндотелиомы;
- папиллярные внутрилимфатические ангиоэндотелиомы;
- смешанные гемангиоэндотелиомы;
- саркомы Капоши.
Злокачественные формы:
- эпителиоидные гемангиоэндотелиомы;
- гемангиосаркома мягких тканей.
Костно-хрящевые опухоли
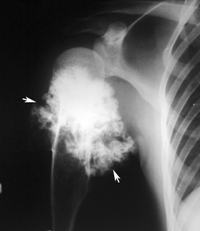
Опухоль костной ткани, или остеогенная саркома:
- обыкновенные: хондробластические, фибробластические, остеобластические;
- телеангиоэктатические;
- мелкоклеточные;
- центральные, имеющие низкую злокачественность;
- вторичные;
- параоссальные;
- периоссальные;
- поверхностные, имеющие высокую злокачественность.
Опухоли хрящевой ткани (хондросаркомы):
- центральные, первичные и вторичные;
- периферические;
- дедифференцированные;
- мезенхимальные;
- светлоклеточные.
Опухоли неясного происхождения
Редко метастазирующие формы:
- ангиоматоидные фиброзные гистиоцитомы;
- оссифицирующие фибромиксоидные опухоли;
- миоэпителиомы;
- парахондромы.
Злокачественные формы:
- синовиальная саркома;
- эпителиоидные саркомы;
- альвеолярная мягкотканная саркома;
- светлоклеточная саркома мягких тканей;
- внескелетные миксоидные хондросаркомы хордоидного типа;
- примитивные нейроэктодермальные опухоли (PNET);
- внескелетные саркомы Юинга;
- десмопластические мелко- и круглоклеточные опухоли;
- внепочечные рабдоидные опухоли;
- злокачественные мезенхимомы;
- миелоидная саркома;
- новообразования, имеющие периваскулярную эпителиоидно-клеточную дифференцировку (PEComa);
- светлоклеточные миомеланоцитарные опухоли;
- интимальные саркомы.
Каждый из названных гистологических типов отличается не только своими морфологическими признаками и гистогенезом, но также имеет определенное клиническое течение. Конечно, подобное многообразие морфологических форм сарком вызывает значительную трудность в их диагностике.
Еще больше гистологическое типирование сарком осложняется в детском возрасте. Обусловлено это тем, что у детей большая часть опухолей происходит из примитивных эмбриональных клеток (эмбриональная саркома) или клеток, которые еще не завершили свое гистогенетическое становление. Такие опухоли, имея большое разнообразие морфологических форм, зачастую не имеют четких признаков гистотиповой дифференцировки, характеризуются резкой анаплазией и вариабельностью клеточного состава. Вместе с тем часто наблюдается и обратная картина: новообразования различного происхождения часто имеют сходные признаки строения. Все это делает типирование опухолей значимой проблемой.
Распределение основных типов сарком по преобладанию в их составе
клеток определенной формы
Рутинная оценка сарком начинается с оценки общего строения опухоли, которая базируется, прежде всего, на ее "узнаваемости" при микроскопии. Описывается общая картина преобладания клеток определенной формы.
Опухоли, состоящие из округлых клеток:
- нейробластома;
- саркома Юинга/PNET;
- мезенхимальная хондросаркома;
- эмбриональная и альвеолярная рабдомиосаркома;
- десмопластичная круглоклеточная саркома;
- круглоклеточная липосаркома;
- малигнизированная рабдоидная опухоль.
Опухоли, состоящие из веретенообразных клеток:
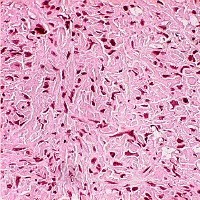
- фибросаркома;
- веретеноклеточная рабдомиосаркома;
- лейомиосаркома;
- злокачественные опухоли периферических нервных стволов;
- веретеноклеточная ангиосаркома;
- монофазная веретеноклеточная синовиальная саркома.
Опухоли, состоящие из эпителиоидных клеток:
- эпителиоидноклеточная синовиальная саркома;
- эпителиоидноклеточная ангиосаркома;
- эпителиоидноклеточные злокачественные опухоли нервного ствола;
- склерозирующая эпителиоидноклеточная фибросаркома;
- злокачественная фиброзная гистиоцитома;
- эпителиоидноклеточная лейомиосаркома.
Остальные гистоморфологические типы сарком, входящие в классификацию, имеют преимущественно смешанную форму клеток. Кроме того, иногда форма злокачественно перерожденных клеток не поддается описанию и определению. В таких случаях опухоль классифицируется как плеоморфная саркома.
Типирование сарком по степени дифференцировки клеток
После определения гистологического типа саркомы оценивается степень ее дифференцировки (G). При этом учитываются такие критерии, как клеточный полиморфизм, митотическая активность и др.
Степени дифференцировки сарком:
- GX – степень дифференцировки клеток определить невозможно;
- G1 – саркома высокодифференцирована;
- G2 – саркома дифференцирована умеренно;
- G3 – саркома низкодифференцирована;
- G4 – недифференцированая саркома.
Дифференциация клеток определяется возможностью установить, к какому именно виду ткани относится конкретная клетка. Чем ниже степень дифференциации клеток, составляющих опухоль, тем более выраженную злокачественность имеет данная саркома. Это напрямую связано с шансами раннего метастазирования в другие органы и ткани. Кроме этого, чем выше злокачественность саркомы, тем быстрее она увеличивается в размерах, тем большую инфильтративность имеет ее рост и тем стремительнее прогрессирует заболевание.
Иммуногистохимическое (ИГХ) типирование сарком
Иммуногистохимическое исследование позволяет:
- провести гистогенетическое типирование опухоли и определить нозологический вариант новообразования;
- определить органопринадлежность первичной опухоли при метастазах неизвестного происхождения;
- определить степень злокачественной трансформации клеток опухоли;
- прогнозировать течение опухолевого заболевания;
- прогнозировать чувствительность и резистентность опухолевых клеток к химиотерапевтическим препаратам и лучевой терапии;
- определить возможность проведения узконаправленной терапии.
Сегодня при верификации сарком используется несколько десятков основных ИГХ-маркеров. Поскольку практически нет ИГХ-маркеров, которые были бы специфичными только для какого-то конкретного типа опухоли, для типирования новообразования должен использоваться набор из нескольких антител.
1. В группу опухолей, состоящих из мелких округлых клеток, относятся новообразования, наиболее часто встречающихся в детском возрасте. Они обычно имеют низкую дифференцировку и высокую степень злокачественности.
- Бластная нейрогенная саркома. Все ее разновидности экспрессируют нейрональные маркеры, такие как нейронспецифическая энолаза (NSE), синаптофизин, хромогранины (CgA), СD56, СD57.
- Рабдомиосаркома. Все ее виды экспрессируют виментин, десмин и мышечный специфический актин (MA), а также СD99. Основными же ее специфическими маркерами является миогенные ядерные регуляторные протеины – миогенин и МуоD1.
- Основными диагностическими маркерами для саркомы Юинга и примитивной нейроэктодермальной опухоли являются СD99 (продукт гена MIC2) и Fli-1. Также клетки этих опухолей экспрессируют виментин, сравнительно часто - синаптофизин, в редких случаях - цитокератины (CK), CD57.
- Клетки мезенхимальной хондросаркомы экспрессируют виментин, S-100 протеин и, реже, СD57.
- Мелкоклеточная остеосаркома характеризуется экспрессией виментина, остеокальцина, может наблюдаться экспрессия СD57 и СD99.
- Мелкоклеточная низкодиференцированная синовиальная саркома мягких тканей, как и другие типы синовиальных сарком (монофазная веретеноклеточная синовиальная саркома, эпителиоидная синовиальная саркома, дедиференцированная полиморфноклеточная саркома), экспрессируют CK, эпителиальный мембранный антиген (EMA), виментин, коллаген IV типа.
- Десмопластическая мелкокруглоклеточная опухоль - очень редкий вид чрезвычайно агрессивного новообразования. Обычно клетки этой опухоли экспрессируют эпителиальные (СК и ЕМА), мезенхимальные (виментин), миогенные (десмин) и нейральные (СD56, NSE) маркеры.
2. К опухолям, состоящим из веретенообразных клеток, прежде всего относятся новообразования, развивающиеся из производных мезенхимы.
- Фибросаркома и инфантильная фибросаркома не имеют специфического иммунопрофиля, но всегда положительны к виментину, а иногда – и к SMA.
- Клетки лейомиосаркомы, как правило, экспрессируют виментин, десмин, МА, SMA, кальдесмон.
- Злокачественная опухоль оболочки периферического нервного ствола экспрессирует виментин, коллаген IV типа и СD57.
- Сосудистая эпителиоидно- и веретеноклеточная саркома, а также саркома Капоши экспрессируют Fli-1, CD31, CD34 и фактор фон Виллебранта (фактор VIII связывающий протеин).
- Гемангиоперицитома и солитарная фиброзная мягкотканая саркома относятся к новообразованиям, пограничным по своему потенциалу злокачественности. Их клетки обычно экспрессируют CD34, CD99, а также bcl-2.
3. Опухоли, состоящие из эпителиоидных клеток, характеризуются признаками, присущими специализированным клеточным элементам соединительной ткани (миофибробластам, эпителиоидным клеткам сосудов, миоэпителиальным клеткам).
- Злокачественная воспалительная миофибробластическая опухоль (воспалительная фибросаркома) демонстрирует иммунореактивность с кальпонином, SMA и десмином.
- Злокачественная фиброзная гистиоцитарная саркома характеризуется коэкспрессией виментина, EMA и CD68, в некоторых случаях наблюдается экспрессия MA, однако не экспрессируются миогенин и МиоD1.
- Периваскулярные эпителиоидноклеточные опухоли (PEC-омы) – это группа опухолей, к которым относятся: ангиомиолипома почек (и других локализаций), светлоклеточная саркома легких ("сахарная" опухоль), лимфангиолейомиоматоз и др. Клетки этих опухолей демонстрируют меланоцитарный иммунофенотип (положительны к: Мелан-А, НМВ45, тирозиназе) с коэкспрессией SMA.
- Эпителиоидная саркома коэкспрессирует виментин и СК.
Помимо гистогенетического типирования опухолей, принципиально важной задачей ИГХ является определение степени злокачественности опухоли и выявление прогностических маркеров. Это позволяет намного более обоснованно и достоверно прогнозировать течение болезни, а также чувствительность опухоли к лечебным средствам.
Злокачественные опухоли продуцируют особые белки, которые могут быть обнаружены в кровяном русле и могут служить своеобразными маркерами как самого факта наличия опухоли, так и в некоторых случаях ее размеров. Специфические опухолевые маркеры, как правило, являются химерными белковыми продуктами, связанными со злокачественным преобразованием, при котором онкоген обычно транслоцируется и сливается с активным промотором отдельного гена.
Определение опухолевых маркеров играет заметную роль в диагностике таких заболеваний, как рак семенников и гермогенный рак яичников, хориокарцинома и гепатома. В идеале опухолевый маркер должен обладать следующими свойствами:
1. Опухоль определенного типа должна всегда продуцировать конкретный маркер. К сожалению, большинство маркеров не обладает этим свойством. При тератобластомах а-фетопротеин (АФП) и хорионический человеческий гонадотропин (ХГЧ) присутствуют в сыворотке 75% больных, а ХЧГ обнаруживается почти при всех хориокарциномах. Кроме карциноэмбрионального антигена (КЭА) и кислой фосфатазы, почти все другие маркеры не могут служить для точного определения стадии развития заболевания.
2. Маркер должен позволять точно определять массу опухоли. Это свойство характерно для b-субъединицы ХГЧ и АФП при гермогенных опухолях и в меньшей степени для простато-специфичного антигена (ПСА) при раке простаты. Степени развития колоректального рака, продуцирующего КЭА, и рака яичников, продуцирующего СА-125, также могут определяться по уровню содержания в плазме крови соответствующих маркеров. Множество других видов рака продуцируют свои специфические маркеры либо в крайне малых количествах, либо слишком интенсивно, чтобы их концентрацию можно было привязать к стадии развития заболевания.
3. Маркер должен продуцироваться при рецидивах заболевания или при метастатическом росте. Одна из основных областей использования маркеров в диагностике — ранее обнаружение рецидивов заболевания. Так, при тератомах возникновение рецидивов всегда сопровождается ростом содержания в плазме либо ХЧГ, либо АФП, даже если первичная опухоль продуцирует оба этих маркера. Маркер-негативные рецидивы (при первично-позитивной опухоли) встречаются крайне редко. Аналогично, повышение уровня КЭА, ПСА или СА-125 является клиническим доказательством наличия рецидивов рака кишечника, простаты или яичников соответственно.

4. Опухоль должна поддаваться терапевтическому воздействию. Если опухоль не поддается лечению, в раннем обнаружении рецидивов мало смысла. Например, рецидивы рака поджелудочной железы практически неизлечимы и их ранняя диагностика просто ставит пациента перед фактом. В противоположность этому, повышение уровня АФП или ХЧГ при тератомах является четким сигналом к проведению полного исследования для назначения соответствующего последующего лечения, которое во многих случаях может оказаться успешным.
5. Маркер должен легко детектироваться и быть специфичным к данному заболеванию. Некоторые маркеры, такие как АФП и ХЧГ (а-субъединица), практически не обнаруживаются в организме, если в нем не присутствует опухоль. В то же время следует отметить, что уровень АФП может возрастать в период беременности и при некоторых заболеваниях печени. Уровень КЭА может возрастать как при колоректальном раке и раке поджелудочной железы, так и при воспалительных заболеваниях кишечника. Повышение уровня КЭА было также зарегистрировано у курящих людей.
Введение в клиническую практику чувствительных методов радиоиммунологического анализа сделало определение уровней АФП и ХЧГ стандартной процедурой при диагностике гермогенных раков и гепатом. И наоборот, содержание некоторых пептидных гормонов (например, антидиуретического гормона (АДГ)) чрезвычайно трудно оценить количественно.
6. В идеале методика определения маркера должна быть достаточно чувствительна, а анализы должны быть относительно дешевыми, чтобы их можно было использовать в мониторинге больших групп населения. Рак яичника, как правило, обнаруживается уже на запущенных неоперабельных стадиях, и смертность от него выше совокупной смертности от раков матки и шейки матки. В этих условиях использование маркера СА-125 может стать обещающим подходом для всеобщей диспансеризация населения.
Примеры опухолевых маркеров представлены в таблице. Некоторые из них уже нашли свое применение в клинической практике и потому требуют более подробного рассмотрения.
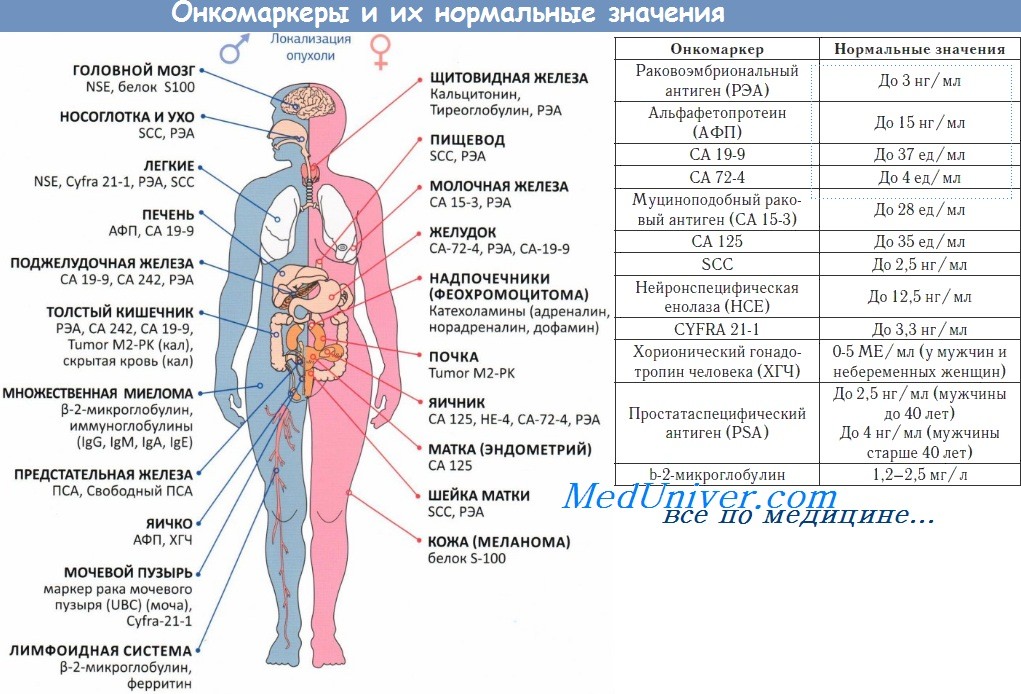
Видео онкомаркеры в норме и при раке
- Вернуться в оглавление раздела "Онкология"
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Хусейнов З.Х., Зикиряходжаев Д.З., Вишневская Я.В.
Исследование и анализ прогностических маркёров в зависимости от степени злокачественности проведено 62 больным с местнораспространёнными саркомами мягких тканей. Выбору правильной постановки диагноза, лечения и прогнозирования течения местнораспространённых сарком мягких тканей способствует определение молекулярно-биологических маркёров опухолей. На основании экспрессии онкомаркёров выявлена степень злокачественности, неоангеогенез и специфичность саркоматозной ткани.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Хусейнов З.Х., Зикиряходжаев Д.З., Вишневская Я.В.
Molecular Biological Markers as Factors of Prognosis of Local Sarcomas of Soft Tissues
Investigation and analysis of prognostical markers in dependence from degree of malignancy in 62 patients with local sarcomas of soft tissues are made. Determination of molecular biological markers of sarcomas promotes to a choice of right diagnosis, treatment and prognosis of local sarcomas of soft tissues . On the base of expression of oncomarkers the degree of malignancy, neoangiogenesis and specifity of sarcoma tissue.
DINAMICS OF MORPHOFUNCTIONAL ALTERATIONS OF BONE TISSUE DURING HEMATOGENIC OSTEOMYELITIS IN CHILDREN
On a base of complex investigation of hematogenic osteomyelitis in children at different stages of disease morphofunctional alterations of bone tissue are shown. General moments of inflammatory process and principles of pathogenetically based methods of correction of these alterations in a dinamics of complex treatment that allowed to improve results of the treatment.
Key words: hematogenic osteomyelitis, children, morphofunctional alterations, bone tissue
Адрес для корреспонденции: Султонов Ш.Р. - ассистент кафедры детской хирургии ТГМУ; Таджикистан, Душанбе, пр. И. Сомони, 59а. E-mail:sherali2004@mail.ru
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ МАРКЁРЫ КАК ФАКТОРЫ ПРОГНОЗА МЕСТНОРАСПРОСТРАНЁННЫХ
САРКОМ МЯГКИХ ТКАНЕЙ З.Х. Хусейнов, Д.З. Зикиряходжаев, Я.В. Вишневская Государственное учреждение "Онкологический научный центр" МЗ РТ; Российский онкологический научный центр им. Н.Н. Блохина
Исследование и анализ прогностических маркёров в зависимости от степени злокачественности проведено 62 больным с местнораспространёнными саркомами мягких тканей.
Выбору правильной постановки диагноза, лечения и прогнозирования течения местнорасп-ространённых сарком мягких тканей способствует определение молекулярно-биологических маркёров опухолей. На основании экспрессии онкомаркёров выявлена степень злокачественности, неоангеогенез и специфичность саркоматозной ткани.
Ключевые слова: местнораспространённые саркомы, онкомаркёры, саркома мягких тканей
Введение. К прогностическим факторам относятся факторы, ответственные за опухолевую дифференцировку (р53, EGFR), показатель пролиферативной активности (Ю-67), апоп-тоза ^^2) и ангиогенеза (стимуляторы ангиогенеза, в том числе, VEGF). Белок р53 получил образное название "стража генома". Этот белок является ключевым компонентом внутриклеточной защитной системы, предотвращающей накопление аномальных клеток в организме. При различных стрессорных и аномальных процессах в клетке происходит активация р53, что приводит к остановке клеточного цикла в сверочных точках и репарации ДНК или апопто-зу. При активации р53 может выступать как транскриптационный фактор, регулирующий экспрессию таких генов, как р21/WAF, 1Г^1Г|2, GADD45, Bax, циклин G, которые опосредуют основные механизмы действия р53. Мутации р53 могут быть ассоциированы с агрессивным течением заболевания и устойчивостью клеток к химио- и лучевой терапии.
Bcl-2 является ведущим геном, определяющим механизм клеточной смерти, подавляя апоп-тоз [3]. Белки семейства Bcl-2 кодируют образование протеина, накапливающегося в митохондриях, и регулируют проницаемость митохондриальной мембраны для этого белка.
Bcl-2 выявляется иммунногистохимическим исследованием, экспрессия Bcl-2 связана с факторами, указывающими на благоприятный прогноз. Высокая экспрессия этого онкогена может являться независимым показателем общей и безрецидивной выживаемости при саркомах мягких тканей.
VEGF является наиболее эффективным прямым ангиогенным фактором из всех известных. Одна из особенностей VEGF - усиление проницаемости сосудов, что является одним из дополнительных механизмов неоангиогенеза и может приводить к накоплению фибрина плазмы крови в тканях. Использование его in vivo в различных исследованиях позволяло добиться резко выраженной стимуляции образования сосудов.
Исследования показали, что VEGF не только активно участвует в неоангиогенезе, но и является фактором выживаемости для вновь образованных капилляров в опухоли. Benjamin et al. показали, что при искусственном снижении уровня VEGF происходит регрессия недавно образованных капилляров, но не капилляров нормальной ткани [4]. Инициирование или усиление экспрессии белков и связанные с ними механизмы, защищающие злокачественную клетку от гибели, осуществляются белком-рецептором к эпидермальному фактору роста (Epidermal Growth Factor Receptor, EGFR). Описаны четыре трансмембранных EGFR, похожих между собой по структуре и функции, и образующих семейство c-erbB. В некоторых работах есть информация о наличии экспрессии EGFR в мезенхимальных опухолях, экспрес-сирующих эпителиальные маркеры. Активация тирозинкиназных рецепторов инициирует стимуляцию внутриклеточных сигнальных путей и, соответственно, пролиферативную активность опухоли. Уровень экспрессии EGFR коррелирует с неблагоприятным прогнозом заболевания [2]. Тирозинкиназа рецептора С-kit (KIT, CD117) является мишенью для таргетного химиопре-парата - Гливек. Мутации С-kit приводят к лиганд-независимому аутофосфорилированию рецептора и опухолевой прогрессии [1]. Роль увеличения тирозинкиназной активности С-kit показана при некоторых видах сарком мягких тканей.
Целью исследования является изучение прогностических факторов молекулярно биологических маркёров при местнораспространённых саркомах мягких тканей.
Материалы и методы. Исследование проведено в лаборатории патоморфологии опухолей человека Онколгического научного центра им. H.H. Блохина, г. Москвы. Определение прогностических молекулярно-биологических маркёров р53, Ki-67, Bcl-2, VEGF, EGFR и С-kit проводилось в 62 случаях сарком мягких тканей. Исследование прогностических маркёров р53, Ki-67, Bcl-2, VEGF, EGFR проводилось в первичной опухоли и в одном из рецидивов. Экспрессии прогностических маркёров определялись по окраске следующими символами, которые означают "-" слабую экспрессию маркёров, "+/-" слабо положительную, "+" положительную, "++" умеренно положительную и "+++" резко положительную экспрессию).
Результаты и их обсуждение. Проведённое исследование отражено в таблицах 1-3.
Экспрессия Ki67 и р53 в первичных местнораспространённых саркомах мягких тканей (n-62)
Маркёры Гистологический " вариант „„^ Ki 6 7 р53
Фибросаркома 2 - - - 2 -
Синовиальная саркома 10 8 4 12 8 2
Рабдомиосаркома - 2 - 2 - -
Ангиосаркома 2 - - 2 - -
Липосаркома 8 2 2 4 6 2
ЗФГ 1 13 - 5 2 7
Эпителиоидная саркома - 2 - - 2 -
Мезенхимома 2 - - 2 - -
Итого 29 27 6 31 20 11
Из таблицы видно, что уровень Ю67 в подавляющем большинстве (56 опухолей) случаев соответствует низкой или умеренной пролиферативной активности. Экспрессия фактора апоп-тоза р53, соответствует низкой ( 25%) у 31 больного и умеренной (26-50%) в 20 случаях, что говорит о прогностической значимости фактора апоптоза.
Экспрессия Бс12 и 0-кК в первичных местнораспространённых саркомах мягких тканей (п-62)
Маркёры Гистологический вариант " -— Вс 1-2 С-кИ
Фибросаркома 2 - - - - 2 - -
Синовиальная саркома 6 4 6 4 2 22 - -
Рабдомиосаркома - 2 - - - 2 - -
Ангиосаркома - - - - 2 2 - -
Липосаркома 2 4 6 - - 4 4 4
ЗФГ 8 4 - 2 - 2 12 -
Эпителиоидная саркома 2 - - - - 2 - -
Мезенхимома - - - 2 - 2 - -
Итого 20 16 14 8 4 42 16 4
Низкий уровень экспрессии Вс1-2 ("-","+/-", "+"), связанный с неблагоприятным прогнозом, наблюдается в подавляющем (80,6%) большинстве опухолей у 56 больных (см. табл. 2). Экспрессия С-М, преимущественно фокальная, наблюдалась лишь в липосаркоме (8 больных) и злокачественной фиброзной гистиоцитоме (ЗФГ-12 больных), в остальных гистологических вариантах сарком мягких тканей экспрессии С-М не выявлено.
Далее нами приведено заключение иммуногистохимического исследования экспрессии VEGF и EGFR (табл. 3).
Экспрессия VEGF и EGFR в первичных местнораспространённых саркомах мягких тканей (п-62)
Маркёры Гистологическии""^^ вариант V EG F EGFR
Фибросаркома - - 2 - - 2 - - - -
Синовиальная саркома - 2 12 8 - 22 - - - -
Рабдомиосаркома - - 2 - - 2 - - - -
Ангиосаркома - - 2 - - 2 - - - -
Липосаркома 2 4 6 - 12 - - - -
ЗФГ - - 2 4 8 10 2 2 - -
Эпителиоидная - 2 - - - 2 - - - -
Мезенхимома - - 2 - - 2 - - - -
Итого - 8 28 18 8 58 2 2 - -
Рис.1. Ядерная экспрессия №67 в синовиальной саркоме, х10 (п-22) (б-ная Н., 27 лет)
Рис.3. Мембранно-цитоплазматическая экспрессия Бс1-2 в ЗФГ, х40 (п-6) (б-ной Дж., 38 лет)
Рис.2. Ядерная экспрессия р53 в липосаркоме, х20 (п-12) (б-ная В., 71 год)
Рис.4. Фокальная мембранно-цитоплазматическая экспрессия С-КК в липосаркоме, х20 (п-8) (б-ная В., 71 год)
Рис.5. Мембранно-цитоплазматическая экспрессия VEGF в синовиальной саркоме, х20 (п-20) (б-ная Н., 27 лет)
По результатам, приведённым в таблице 3, видно, что в большинстве (54-87,0%) случаев наблюдается умеренная или выраженная экспрессия VEGF. Экспрессия EGFR отмечена лишь в 2 (4,6%) случаях первичной плеоморфной злокачественной фиброзной гистиоцитомы (ЗФГ), в остальных случаях экспрессии EGFR не выявлено. Учитывая слабую фокальную экспрессию EGFR в единичных случаях исследованных местно-распространённых сарком мягких тканей, она не может служить прогностическим маркёром.
Ниже мы приводим фотографии иммуногистохимических исследований экспрессии прогностических маркёров у больных с различными морфологическими формами МСМТ (рис.1-5).
Вывод. Анализ прогностических маркёров в зависимости от степени злокачественности 62 исследованных больных с местнораспространёнными саркомами мягких тканей (первичных опухолевых узлов) убедительно показал, что:
- отмечается увеличение пролиферативной активности Ki 67 с увеличением степени злокачественности (в опухолях с 1 степенью злокачественности отмечалась слабая и умеренная пролиферативная активность, со 2 степенью - умеренная и высокая, при 3 степени - только высокая пролиферативная активность);
- выраженность экспрессии маркёра апоптоза р53 наблюдалась относительно равномерно и не коррелировала со степенью злокачественности саркомы;
- более выраженная экспрессия Bcl-2 наблюдалась в более дифференцированных саркомах и была фокальной или отсутствовала в менее дифференцированных опухолях;
- экспрессия VEGF наблюдалась во всех исследованных случаях, но выраженность экспрессии усиливалась в более злокачественных новообразованиях;
- слабая фокальная экспрессия EGFR выявлена лишь в единичных случаях исследованных сарком мягких тканей и не может служить прогностическим маркером;
- фокальная экспрессия C-Kit выявлена в большинстве случаев ЗФГ и липосарком мягких тканей, независимо от степени злокачественности. В саркомах мягких тканей другого гистогенеза в нашем исследовании экспрессии C-Kit выявлено не было.
Таким образом, молекулярно-биологические маркёры местнораспространённых сарком мягких тканей способствуют правильной постановке диагноза, выбору терапии и прогнозированию течения самой болезни.
1. Мещеряков А.А. Гливек-патогенетическая терапия злокачественных новообразований //Современная онкология. Том 9. №2. 2007
2. Носов Д.А. Механизмы регуляции внутриклеточной передачи сигнала и апоптоза: успехи и неудачи целенаправленной терапии // Матер. VIII Российского онкологического конгресса. М. 2004. РОНЦ
3. Пожарисский К.М., Леенман Е.Е. Значение иммунногистохимических методик для определения характера лечения и прогноза опухолевых заболеваний // Арх. Пат. М., 2000. №. 5. С. 3
4. Benjamin R.S., Rouesse J., Bourgeois H., van Hoesel QGCM. Should patients with advanced sarcomas be treated with chemotherapy? // Europ. Cancer. 1998. Vol. 34. Р. 958-965
Маркёрхои молекулавию биологи хамчун омилхои пешбинии саркомаи чузъй пахншудаи бофтахои нарм З.Х.Хусейнов, Д. З. Зикриёхочаев, Я. В. Вишневская
Тахди; ва тах,лили нишонх,ои (маркёрх,ои) пешгуи дар вобастаги аз дарачаи бадзоти дар 62 нафар бемори саркомаи чузъи пах,ншудаи бофтах,ои нарм гузаронида шуд.
Барои интихоби дурусти ташхис, табобат ва пешгуии чараёни ин бемори муайян намудани нишонхои молекулави-биологии омосхо мусоидат мекунад. Дар асоси фишурда баровардани онкомаркёрхо дарачаи бадзоти, неоангеогенез ва махсусияти бофтаи саркоматози ошкор карда шудааст.
MOLECULAR BIOLOGICAL MARKERS AS FACTORS OF PROGNOSIS OF LOCAL SARCOMAS OF SOFT TISSUES Z.H. Huseinov, D.Z. Zikiryahojaev, Ya.V. Vishnevskaya
Investigation and analysis of prognostical markers in dependence from degree of malignancy in 62 patients with local sarcomas of soft tissues are made. Determination of molecular biological markers of sarcomas promotes to a choice of right diagnosis, treatment and prognosis of local sarcomas of soft tissues. On the base of expression of oncomarkers the degree of malignancy, neoangiogenesis and specifity of sarcoma tissue.
Key words: local sarcoma, oncomarkers, soft tissues
Адрес для корреспонденции: З.Х.Хусейнов - замдиректора ГУ "Онкологический научный центр" МЗ РТ; Таджикистан, Душанбе, пр. И. Сомони, 59а, тел.: 907-71-05-35, 235-19-12
НЕКОТОРЫЕ АСПЕКТЫ КОСТНОЙ АУТОТРАНСПЛАНТАЦИИ ПРИ КОСТНЫХ НОВООБРАЗОВАНИЯХ И ОПУХОЛЕПОДОБНЫХ
Н.И. Базаров, В.А. Нарзулоев, Х.С. Усмонов, Д.М. Курбанов Кафедры онкологии; оперативной хирургии и топографической анатомии ТГМУ им. Абуали ибни Сино
Аутотрансплантация кости, безусловно, остаётся достаточно надёжным и весьма распространённым методом операционного вмешательства в случае замещения послеоперационного дефекта даже при онкологическом поражении костной ткани. Но имеется и некоторые недостатки аутотрансплантации, что побуждает в поиску новых альтернативных подходов, ускоряющих костно-хирургическую реабилитацию сложного контингента больных с костными новообразованиями.
Ключевые слова: новообразования костей, костная аутотрансплантация
Введение. Вопросы пластического замещения костных дефектов, образовавшихся в результате оперативных вмешательств по поводу опухолевых заболеваний, по-прежнему весьма актуальна, особенно по поводу опухолей челюстно-лицевой области и шеи, которые занимают по частоте одно из первых мест среди других новообразований человеческого тела, так как эта локализация составляет 23-25% [1-8,10,12]. Практическое значение применения замещения костных дефектов возросло в последние десятилетия, что обусловлено увеличением числа запущенных распространённых опухолей костей и суставов, а также расширением диапазона хирургической активности на фоне снижения чувствительности микрофлоры к антибиотикам, что приводит к резкому увеличению числа гнойных послеоперационных осложнений [1,3,5,13].
Читайте также:

