Локальная свч гипертермия при раке прямой кишки

Что такое гипертермия?
Гипертермия (повышенная температура) – это вспомогательный метод, применяемый при лечении больных с онкологическими и неонкологическими заболеваниями.
В онкологической практике гипертермию проводят при температурах 41-45 °С с целью улучшения результатов лучевой-, химио- и/или гормонотерапии. Механизм её действия заключается в торможении восстановления клеток опухоли от повреждений, полученных после лучевой и лекарственной терапии.
Нагревание осуществляется с помощью специальных аппаратов, генерирующих электромагнитные (ЭМ) излучения различных диапазонов волн.
Когда применяется гипертермия?
В онкологии гипертермия применяется в тех случаях, когда необходимо усилить действие лучевой, химио- и гормонотерапии, особенно если известно, что опухоль является устойчивой к таким видам лечения. Наиболее широко используется при лечении рецидивных опухолей или метастазов, которые, как правило, являются устойчивыми к любым видам противоопухолевой терапии.
В некоторых случаях, при противопоказаниях к лучевой или химиотерапии, гипертермия проводится в самостоятельном виде для повышения качества жизни больных: снятия болевых симптомов и улучшения общего самочувствия.
В неонкологической практике гипертермия применяется при лечении хронических неспецифических воспалительных заболевании (бронхит, пародонтит, простатит и др.), поздних лучевых фиброзов.
Методы гипертермии
Существуют следующие способы гипертермии:
- Наружная локальная гипертермия – нагревание только опухоли.
- Наружная регионарная гипертермия – нагревание органа с опухолью и регионарными лимфоузлами.
- Внутриполостная гипертермия – нагревание опухолей полых органов (прямая кишка, пищевод) с помощью специальных внутриполостных аппликаторов (излучателей).
- Общая гипертермия – нагревание всего тела человека, используется при обширных метастатических процессах.
Оборудование, используемое для гипертермии
Основными установками, которые используются в настоящее время для проведения лечебного нагрева, являются аппараты, генерирующие ЭМ-поле в СВЧ-, УВЧ- или ВЧ-диапазоне. Выбор методики и аппарата зависит от глубины залегания опухоли, её конфигурации и размера. В зависимости от этих параметров подбирается установка с определенной частотой излучения и длиной волны.
Противопоказания к проведению лучевой терапии
- острые соматические (заболевания внутренних органов) и инфекционные заболевания;
- соматические заболевания в стадии декомпенсации;
- тяжелые заболевания центральной нервной системы и психические расстройства (эпилепсия, шизофрения и т.п.);
- прорастание опухолью крупных сосудов или её распад, угроза кровотечения из облучаемой области;
- анемия, лейкопения, тромбоцитопения;
- раковая кахексия (истощение организма);
- выраженный синдром опухолевой интоксикации.
Как проводится лечение в онкологии?
Перед лечением выполняются необходимые исследования (рентгенография, УЗИ, компьютерная томография, магнитно-резонансная томография и др.), с помощью которых определяется точное месторасположение новообразования. На основании имеющихся данных принимается решение о способе лечения больного: выбор аппарата и аппликатора. Врач обязательно рассказывает пациенту о планируемом лечении, риске возникновения побочных эффектов и мерах по их профилактике. Врач выбирает план лечения пациента: методику гипертермии, количество сеансов и сочетание с другими методами лечения (по согласованию с другими специалистами). Процедура гипертермии проводится в течение 60-150 мин и завершается непосредственно перед лучевой терапией В случае комбинации её с химиотерапией нагрев осуществляется во время или сразу после завершения введения химиопрепаратов.
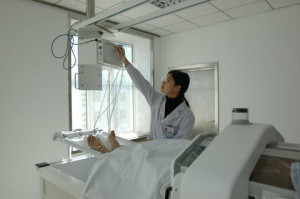
Наружная (локо-регионарная) гипертермия проводится на кушетке в удобном для больного положении. В случае лечения рака прямой кишки внутриполостной аппликатор вводится в просвет опухоли. Температура в опухоли контролируется введенными в нее 1-2 термодатчиками, или она вычисляется расчетным методом по специальной программе. Во время нагревания кожа или слизистая оболочка охлаждается водой (10-30 °С), циркулирующей в аппликаторе. Поэтому больной во время сеанса гипертермии чувствует только тепло разной степени выраженности и может даже читать или слушать музыку.
Общая гипертермия проводится на гипертермической установке "Яхта-5" под общим наркозом. Контроль температуры осуществляется в прямой кишке, при необходимости в пищеводе. Голова больного во время процедуры охлаждается с помощью холодного воздуха от специального аппарата. Курс лечения состоит из 2-4 процедур, проводимых 1 раз в 3-6 недель в комбинации с химиотерапией. Технически общая гипертермия осуществляется одинаково при всех локализациях опухолей, различие заключается в интенсивности и продолжительности нагревания, а также в количестве процедур и интервалов времени между сеансами, которое зависит от общего состояния пациента.
Как проводится лечение неонкологических больных?
При лечении неонкологических больных, по сравнению с онкологическими, применяется более низкий температурный режим (39-40 °С) и более короткое воздействие (15-40 мин). С другой стороны, это лечение схоже с физиотерапией, где также используется ЭМ-излучение. Отличие состоит в том, что при физиотерапии уровень нагрева в воспалительном участке весьма слабый, не превышает 37,5-38 °С (в основном греется кожа). Поэтому лечебный эффект при физиотерапии связан со специфическим воздействием ЭМ-поля и меньше всего – тепловым эффектом. При гипертермии лечебный эффект в основном связан с воздействием тепла.
Побочные эффекты гипертермии
Побочные эффекты наблюдаются при лечении только онкологических больных из-за необходимости поддержания высокой температуры в опухоли (41-45 °С) и продолжительностью воздействия.
Тел. Колл-центра +7 495 – 150 – 11 - 22
Позвоните нам сегодня, чтобы мы смогли Вам помочь!
Рак прямой кишки в общей структуре злокачественных новообразований занимает 5—7-е место, составляя 7—10% от раков всех локализаций и 2/3 всех злокачественных новообразований желудочно-кишечного тракта. Наряду с этим отмечается неуклонный рост заболеваемости, которая за последние 2.0 лет возросла в нашей стране в 4 раза, достигнув в РСФСР уровня в 10,1 на 100 000 населения (Милитарев Ю.М. с соавт., 1987).
Несмотря на постоянное совершествование диагностики, расширение сети диспансерного учета и профилактических осмотров, по-прежнему остро стоит проблема поздней обращаемости: у 50— 80% больных уже при первичном осмотре диагностируются III— IV стадии заболевания, причем лишь у 52% пациентов опухоли оказываются первично резектабельными (Catterall, 1982). К тому же среди больных, подлежащих хирургическому лечению, приблизительно 40% составляют лица преклонного возраста, либо лица, страдающие тяжелыми сопутствующими заболеваниями, что ставит риск радикального вмешательства на грань совместимого с жизнью (Саркисян Ю.X. с соавт., 1986). Наконец, нередко приходится сталкиваться с категорическим отказом от операции, связанной с наложением противоестественного ануса.
Все вышеизложенное свидетельствует об актуальности проблемы консервативной терапии неоперабельных больных раком прямой кишки. В то же время возможности традиционных методов лечения—лучевой и химиотерапии — на сегодняшний день ограничиваются результатами, которые вряд ли могут удовлетворить клиницистов. Так, по среднестатистическим данным дистанционная гамма-терапия вызывает частичную регрессию аденокарциномы прямой кишки у 40—50% больных (Бердов Б. А. с соавт., 1986), а химиотерапия обеспечивает достижение клинической ремиссии лишь в 20—25% случаев (Качалов В.К., 1986).
В связи с этим возникает необходимость поисков новых путей решения данной проблемы. В последние годы все больший интерес вызывает применение радиомодуляторов, радиомодификаторов и адъювантов, среди которых одним из наиболее эффективных является гипертермия, позволяющая посредством многокомпонентного механизма воздействия на опухоль (изменение условий ее кровоснабжения, в первую очередь на микроциркуляторном уровне, усиление повреждения опухолевых клеток, снижение их репаративных возможностей, механическое и биохимическое повреждение клеточного гомеостаза, радиосенсибилизирующий эффект и т.д.) улучшить результаты лучевой терапии (Ярмоненко С.П. с соавт., 1986). Известен также и потенцирующий эффект гипертермии при ее сочетании с системной химиотерапией (Gilliett Е.L., 1984).

Целесообразность сочетания облучения с гипертермией при проведении предоперационной терапии рака прямой кишки была отмечена в работах Б.А. Бердова (Бердов Б.А. с соавт., 1986, Berdow В.A. et al., 1986 и You Qingshan et al., 1987). Имеется сообщение и о применении этого метода в качестве самостоятельного пособия при консервативной терапии данного контингента больных (Мардынский Ю.С. с соавт., 1988). Однако предлагаемая авторами методика связана с подведением к очагу дозы облучения, далеко превышающей толерантность здоровых тканей и чреватой развитием ближайших и отдаленных лучевых реакций. Данных относительно применения термохимиотерапии в консервативном лечении рака прямой кишки в доступной нам литературе мы не встретили.
Целью настоящего исследования являлось изучение возмоности повышения эффективности консервативной терапии неоперабельных больных раком прямой кишки путем комплексного воздействия на опухоль эндолимфатической химиотерапии, вызывающей по данным Г. К. Максимова (1985) более чем в 50% случаев регрессию первичной опухоли, с последующей дистанционной гамма-терапией в дозах, не превышающих порога толерантности здоровых тканей, на фоне внутриполостной локальной СВЧ-гипертермии, проводимой в режиме, исключающем риск развития терморезистентности опухолевых тканей.
Настоящая работа представляет собой анализ результатов лечения 70 больных раком прямой кишки в стадиях Т1—4NXMO, не подлежащих радикальной операции в силу местной распространенности процесса, наличия тяжелой сопутствующей патологии, преклонного возраста, либо в силу категорического отказа от операции. 30 из них составили контрольную группу.
Клиническая характеристика больных представлена в табл. 1. Гистологически у 67 больных выявлена аденокарцинома. У одного больного в основной и у 2 больных в контрольной группе был обнаружен плоскоклеточный рак.
Методика заключалась в следующем:
1. На первом этапе осуществлялось введение 5-фторурацила в дозе 30 мг на кг массы тела больного в лимфатические сосуды тыла стопы дважды с 7-дневным интервалом между введениями (общая доза химиопрепарата в среднем составила 4,0 г);
2. Дистанционная гамма-терапия проводилась расщепленным курсом до СОД 60 Гр при 2—3 недельном перерыве в лечении на СОД 28—32 Гр с режимом облучения 3 раза в неделю в разовой очаговой дозе, равной 4 Гр. При этом использовали ротационное облучение со стороны крестца с углом качания источника излучения, равном 240°, размерами осевого поля по ширине 6— 10 см, по длине—12—18. см и при расстоянии источник—опухоль 75 см. Глубину оси качания рассчитывали индивидуально на основании топометрических данных. В зону облучения стремились включать помимо опухоли параректальную клетчатку, клетчатку малого таза и регионарные лимфатические узлы. К облучению приступали спустя 7 дней от последнего эндолимфатического введения 5-фторурацила;

3. Внутриполостную локальную СВЧ-гипертермию осуществляли начиная с первой фракции облучения, сочетая ее с нечетными сеансами лучевой терапии (интервал между сеансами СВЧ-гипертермии составлял 4—5 сут). Перегревание проводили за 30— 60 мин до сеанса облучения при температуре 44—46°С в течение 60—90 мин в зависимости от переносимости процедуры больным, стремясь к максимально быстрому (не более 5 мин) выходу на уровень температурного плато. В случае наличия болевого синдрома сеанс СВЧ-гипертермии предваряли внутримышечным введением ненаркотических анальгетиков. Общее количество сеансов СВЧ-гипертермии на весь курс лечения составило в среднем 5—6.
В контрольной группе больные получали эндолимфатическую химиотерапию и дистанционную гамматерапию по описанной выше методике без внутриполостной локальной СВЧ-гипертермии.
Результаты оценивали спустя 6 мес,после окончания полного курса лечения на основании данных физикального обследования, ректоро-, мано- и колоноскопии, ирригографии и гистологического исследования.
Полученные данные представлены в табл. 2. Согласно данным табл. 2 применение внутриполостной локальной СВЧ-гипертермии в комплексе консервативных лечебных мероприятий позволило более чем в 5 раз повысить частоту полной регрессии опухолей прямой кишки по сравнению с контролем (17,5% против 3,3% соответственно), улучшить показатели частичной регрессии и стабилизации (57,7% против 33,3%, из которых регрессия более чем на 50% была достигнута в 27,5% случаев против 13,3% при сравнении основной группы с контрольной, а регрессия менее чем на 50% и стабилизация, сопровождавшаяся клинической ремиссией— в 30% случаев против 20% соответственно), а также в 2,5 раза сократить число неудач (25% против 63,4% в контроле).
Успех лечения как в основной, так и в контрольной группах не зависел от пола больного. Относительно возрастной зависимости следует отметить, что если в контрольной группе результаты заметно ухудшались в более старших возрастных группах (частота регрессий у больных до 60 лет составила 50% по сравнению с 33,3% у больных до 70 лет и отсутствием регрессий в возрасте старше 70 лет), то среди больных, получавших химиотерморадиотерапию, такой закономерности не обнаружено, результаты оставались относительно стабильными во всех возрастных контингентах (так, показатель частоты частичных регрессий и стабилизаций колебался от 52,6 до 66,7%).
В основной группе удалось добиться заметного улучшения результатов лечения местно-распространенных процессов по сравнению с контролем (общее число регрессий при T3NXMO — 85,4% по сравнению с 41,2% в контроле при T4NXMO).
В обеих группах более благополучные результаты получены при более дистальной локализации опухолевого процесса. Однако показатель общего числа регрессий после химиотерморадиотерапии рака средне- и верхнеампулярного отделов прямой кишки оказался значительно выше, чем в контроле (80% против 35,7% и 58,3% против 20% соответственно).
Существенных различий в течении общей и местной реакций на лучевое воздействие в группах мы не нашли. Нам ни разу не пришлось прерывать лечения из-за резкого ухудшения общего состояния, либо утяжеления сопутствующих заболеваний. Несколько чаще, чем в контроле, после химиотерморадиотерапии наблюдались эпителииты (16,7% против 27,5% соответственно). Частота и степень выраженности различных лучевых реакций в обеих группах представлены в табл. 3.

Таким образом, сравнительный анализ ближайших результатов химиотерморадиотерапии и химиолучевой терапии свидетельствует о существенном преимуществе первой из методик, выражающемся в увеличении частоты полной регрессии опухоли в 5 раз, улучшении показателей частичной регрессии и стабилизации.
Применение химиотерморадиотерапии позволяет значительно улучшить результаты консервативной терапии рака прямой кишки у больных преклонного возраста, при местно распространенных процессах, а также при опухолях, локализующихся в средней и верхней третях ампулы.
Предшествующая терморадиотерапия, эндолимфатическая химиотерапия позволяют добиться улучшения результатов лечения при проведении облучения в суммарной очаговой дозе, не превышающей порога толерантности здоровых тканей.
Химиотерморадиотерапия хорошо переносится больными. Включение в комплекс лечебных мероприятий внутриполостной локальной СВЧ-гипертермии не связано с увеличением, либо утяжелением общих и местных лучевых реакций.
Кроме общей гипертермии в лечении онкологических заболеваний применяются методы локальной и внутритканевой гипертермии.
Локальная гипертермия в онкологии
Ей обычно подвергаются поверхностно расположенные опухоли (опухоли кожи, нижней губы, молочной железы, нижнеампулярного отдела прямой кишки, простаты). Глубина оптимального разогрева обычно составляет 4–5 см. Для проведения локальной гипертермии наиболее часто применяются СВЧ-установки с рабочей частотой 915 мГц. Основным достоинством электромагнитного нагрева является способность электромагнитных волн проникать вглубь биологических тканей. При этом энергия поглощается непосредственно тканями, поток тепла возникает в каждой точке облучаемого объема.
Наиболее важный момент — максимально быстрое прохождение в ходе сеанса температурной зоны 38–39 °C, провоцирующей опухолевый рост, и выхода на рабочий режим гипертермии 43–44 °C.
Термометрия при локальной гипертермии проводится инвазивным методом с помощью игольчатых термодатчиков, а также методом бесконтактной радиотермометрии (медицинский радиотермометр РТ-17). Большое значение для получения радиосенсибилизирующего эффекта локальной гипертермии имеет определение температурно-экспозиционных режимов, последовательности применения этих двух факторов. Пороговой дозой, при которой инактивирующий эффект излучения начинает превалировать над таковым в гипертермии, является 12 Гр. На практике это означает, что в схеме терморадиотерапии гипертермию следует подключать к лечению на момент подведения суммарно-очаговой дозы 12 Гр. Оптимальным экспозиционным режимом является нагрев опухоли до 43 °С в течение 1 ч.
Благодаря своим модифицирующим свойствам локальная гипертермия позволяет получить лечебный эффект с одновременным снижением суммарной очаговой дозы ионизирующего излучения на 30 %, что особенно важно при лечении рецидивов опухолей, ранее уже подвергавшихся лучевой терапии.
Результаты применения локальной гипертермии свидетельствуют, что она способна вызывать значительные повреждения опухоли, как правило в центре узлов, где формируется очаг некротических изменений. Так, при раке молочной железы Т3–Т4 ст. среднее значение площади некротического фокуса составило 6,0 ± 1,1 см 2 . Лечение позволило снизить индекс митотической активности до 5,5 ‰, тогда как при лучевой терапии без гипертермии он составляет 9 ‰.
Наряду с очевидными преимуществами лечения злокачественных опухолей, которые дает локальная СВЧ-гипертермия, у нее имеется и ряд недостатков, существенно ограничивающих использование данного метода. К ним относятся невозможность добиться равномерного нагрева опухолей более 5 см в диаметре, недостаточная глубина нагрева, отражение электромагнитной энергии от поверхности раздела сред (кистозные полости), ожоги кожи.
Только 50 % раковых опухолей молочной железы удается прогреть до температуры 42 °С. При этом до половины массы опухоли остается недостаточно нагретой, что снижает эффективность проводимой терморадиотерапии рака. Зоны недогрева, как правило, расположены на периферии опухолевых узлов, где и сохраняются опухолевые комплексы, обладающие митотической активностью. Это обусловливает скрытое отдаленное метастазирование, появление рецидивов в послеоперационном рубце. При местно-распространенных опухолях ввиду указанных недостатков этот метод оказался неприменим, в том числе и при производстве паллиативных операций.
Локальная гипертермия повысила эффективность лечения злокачественных опухолей, но исчерпала свои потенциальные возможности; она имеет некоторые недостатки, связанные с неравномерностью нагрева опухолей.
Внутритканевая гипертермия в онкологии
С целью преодоления недостатков локальной гипертермии предложено вводить вглубь опухоли микроферромагнитные иглы, ферромагнитные боросодержащие препараты, магнитные имплантаты (так называемые видеоуправляемые противоопухолевые средства). Большинство этих исследований находится еще на ранней стадии, что не позволяет оценить клинический эффект.
Была изучена возможность:
- введения ферромагнитных жидкостей (карбонильное железо и магнетит — FeOFe2О3) с размером частиц от 0,7 до 20 мкм в кровеносное русло и концентрации в опухоли;
- удержания частиц железа в опухоли и метастатических узлах с помощью постоянных и переменных магнитов;
использования частиц железа для транспорта противоопухолевых препаратов; - введения ферромагнитных жидкостей в опухоль и перитуморально;
- использования для нагрева высокочастотного тока (13,56 мГц).
В результате проведенных исследований на животных с экспериментальными опухолями 20 ґ было показано, что при введении суспензии железа в кровеносную систему частицы железа захватываются опухолевыми клетками и могут проникать в ядра этих клеток. Однако еще более активно частицы железа захватываются гепатоцитами, задерживаются в канальцевой системе почек, вызывая расстройства их деятельности с выраженной картиной почечно-печеночной недостаточности.
Изучение возможности удержания частиц железа в опухоли с помощью магнитов после введения железа в кровеносное русло показало, что расположение постоянных и переменных магнитов не принесло ожидаемого эффекта. Введение суспензий карбонильного железа в опухоль и вокруг нее при раке молочной железы и саркомах мягких тканей с последующим нагревом ВЧ-током до 44 °С и выше оказалось высокоэффективным средством борьбы с первичной опухолью.
Результаты применения ферромагнитных суспензий показали их отрицательные свойства. К ним относится прежде всего развивающийся асептический некроз опухоли, сопровождающийся появлением уже в первые сутки клинической картины абсцесса или флегмоны соответствующей области тела и тяжелой интоксикации, которые не позволяют провести предоперационную лучевую терапию в нужном объеме. В этих условиях внутритканевая гипертермия с использованием частиц железа утрачивает свое назначение в качестве адъюванта лучевой терапии и может быть использована только после или вместо предоперационной лучевой терапии. Причем оперативное лечение должно проводиться не более чем через 1–2 дня после гипертермии вследствие прогрессирующей интоксикации.
Менее значительными, но также неблагоприятными последствиями применения ферромагнитных суспензий являются редко развивающиеся ожоги кожи и косметические дефекты в послеоперационном рубце.
Результаты морфологических исследований (на примере рака молочной железы) свидетельствуют, что применение термомодификаторов вызывает выраженные структурные изменения злокачественных опухолей: снижается плотность жизнеспособной паренхимы, уменьшается индекс митотической активности и число нормальных митозов.
При дистанционной СВЧ-гипертермии наиболее выраженное повреждение отмечено в центральной зоне опухоли. При внутритканевой гипертермии повреждение опухоли происходит равномерно во всех зонах. Причем если при использовании частиц железа фокусы некроза развивались поблизости от них, то при применении токопроводящих растворов некрозы распределялись равномерно по всей опухолевой массе.
Варианты внутритканевой гипертермии являются надежным методом девитализации опухолей, позволяющим выполнять органосохраняющие операции при раке молочной железы и саркомах мягких тканей.
Как вариант, этот вид локальной гипертермии может использоваться для лечения диссеминированного рака органов брюшной полости: карциноматозе брюшины, когда эти органы нагреваются в токопроводящем растворе, инстиллированном в брюшную полость. Однако клинические результаты этой методики требуют дальнейшей оценки.
Кроме вышеперечисленных вариантов локальной гипертермии задача равномерного нагрева опухоли может быть решена в рамках новых технологий электромагнитной гипертермии, сущность которой заключается в использовании веществ, испытывающих фазовый переход при температуре 43–45 °С, например сплав железа с никелем, двуокись ванадия. Все эти технологии, основанные на различных типах фазовых переходов (диэлектрик — проводник, проводник — диэлектрик, ферромагнетики и сегнетоэлектрики с температурой Кюри (43–45 °С), позволяют решить задачу автоматического поддержания заданной температуры и свободны от недостатков ферромагнитной гипертермии.
Таким образом, вышеизложенные результаты применения различных способов локальной гипертермии убедительно свидетельствуют об имеющейся возможности эффективного противоопухолевого воздействия путем локального разогрева злокачественных опухолей до высоких температур (46 °С).
Здравствуйте.У мамы опухоль в подключичной области (состояние после мастектомии в 2008 г, после которой еще была и химия и облучение в 201, 2013, 2016г).Сейчас нам отказано и в операции, и химию не очень советуют. Скажите, можно ли проконсультироваться заочно, чтоб не тащить зря человека так далеко (мы из Горловки, ДНР).? Заключения, последние КТ, все что нужно вышлю! Спасибо
Добрый день! Консультация возможна по телефону, позвоните нам по телефону 8 (831) 439-15-14 с 11-00 до 14-00 по МСК в рабочие дни.
Здравствуйте, весной сделали операцию по удалению части челюсти как рецедив амелобластомы, гистология показала хондросаркому. Сделали лучевую терапию, пока признаков опухоли нет, но сидеть ждать рецедив не имею желания, характер опухли очень агрессивен. За месяц достиг размеров 5на 7см. Боюсь повторения. Возможна ли гипертермия как предупреждающая терапия?
Добрый день! При таком диагнозе общая гипертермия с химиотерапией показана как основной метод лечения и как противорецидивная терапия. Для решения вопроса о проведении гипертермии именно в Вашем случае необходимо выполнить Иммуногистохимическое (ИГХ) исследование удаленной опухоли и пройти осмотр анестезиологом нашей клиники на предмет возможности дать наркоз.
Здравствуйте! Рак матки размером 13-13-11см с прорастанием в мочевой пузырь, ставят 3 стадию.Подскажите пожалуйста есть ли смысл делать гипертермию?
Добрый день! При таком диагнозе общая гипертермия с химиотерапией показана. Мы рекомендуем сделать 1-2 курса гипертермии до операции, затем провести операцию и продолжить лечение гипертермией с химиотерапией. Реализация этого плана позволит уменьшить опухоль, произвести радикальную операцию и снизить вероятность метастазирования в дальнейшем.
Здравствуйте, у моего мужа – рак поджелудочной железы.Сейчас выполняем уточняющие исследования. На следующей неделе будут готовы результаты биопсии. Показана ли гипертермия при таком диагнозе? И можно ли попасть к вам на лечение (мы из Ярославля)?
Добрый день, Марина! Гипертермия применяется при лечении рака поджелудочной железы, но чтобы понять возможно ли ее назначение в вашем случае нужно иметь полную картину диагноза. Заключения КТ, результаты биопсии и иммуногистохимического исследования, а также последние анализы вы можете отправить по электронной почте [email protected] . Тогда наши специалисты смогут уже детально сказать возможно\невозможно и предложить план лечения.
Здравствуйте. У мамы карциноматоз брюшины, МТС в надключичной и подключичной областях, образование на культе матки, асцит, жидкость в плевральной области. Низкодиференциируемый аденокарцинома, рак яичников. На химиотерапию ответа нет. Есть ли у нас показания к проведению гипертермии?
Терапевтическая гипертермия является типом лечения, при котором живые ткани подвергаются воздействию повышенной температуры. И это оказывает губительный эффект на раковые клетки, вызывающий их уничтожение, или снижает устойчивость этих клеток к воздействию радиоактивного лечения или препаратов химиотерапии. Стоит отметить, что температурное воздействие на атипичные ткани не относится к группе радиочастотной абляции, это совершенно иная методика. В сочетании с лучевой терапией метод теплового воздействия носит называние терморадиотерапия.
- Что такое гипертермия
- Локальная, регионарная и общая гипертермия
- Для каких видов рака применяется
- Абляция опухолей
- Осложнения и побочные эффекты
Гипертермия в онкологии: что это такое?
Международная онкология не выработала до сих пор общего мнения относительно того, какие показатели температуры являются самыми безопасными и одновременно самыми эффективными. Во время лечения температура тела, как правило, достигает уровня между 39,5 и 40,5 ° C. Тем не менее, другие исследователи определяют границы гипертермии между 41.8-42 ° C, что присуще для стран Европы и США. Япония и Россия принимают самые высокие показатели — 43-44 ° С.
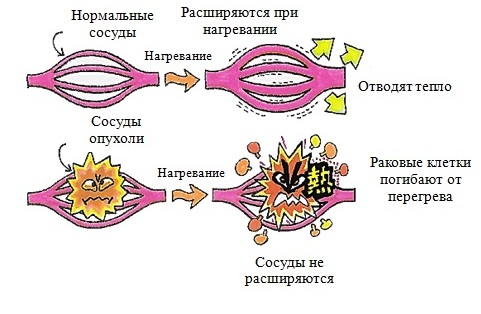
Температура и время воздействия взаимосвязаны. Более длительная продолжительность и высокие температуры очень эффективны для уничтожения раковых клеток, но они также достаточно серьезно повышают риск токсичности. Опухолевые клетки с дезорганизованной и компактной сосудистой структурой очень тяжело отводят тепло, что способствует стимуляции апоптоза (вид физиологически запрограммированной гибели клеток) в их отношении или обычной гибели. Тогда как здоровые ткани обладают лучшей теплопроводностью, в связи с чем лучше противостоят высоким температурам.
Даже если раковые клетки не гибнут сразу, они могут стать более восприимчивы к ионизирующему излучению в противораковой терапии или химиотерапии. Тепло при локальной гипертермии расширяет кровеносные сосуды опухоли, способствуя повышению оксигенации (насыщению кислородом) новообразования, тем самым делая лучевую противораковую терапию более эффективной. Кислород является мощным радиосенсибилизатором, что значительно повышает эффективность заданной дозы излучения путем формирования ДНК-повреждений. Опухолевые клетки при недостатке кислорода могут быть в 2-3 раза более устойчивы к радиационному повреждению, чем в нормальной кислородной среде.
Гипертермия, как было доказано, весьма эффективна в сочетании с химиотерапией. Опубликованные исследования показали улучшение 10-летней выживаемости без рецидивов и метастазов у пациентов, страдавших раком мочевого пузыря, которые получали комбинированное лечение гипертермией и химиотерапией. 53 % пациентов прожили 10 последующих лет, в то время как химиотерапия в единственном варианте обеспечила выживаемость только у 15 % заболевших.
Интенсивный нагрев вызывает денатурацию и коагуляцию клеточных белков, что быстро уничтожает клетки опухоли. Более длительный умеренный нагрев до температуры всего в несколько градусов выше нормы может вызвать более тонкие структурные изменения в клетках. Мягкая термообработка в сочетании с другими способами может привести к гибели клеток по причине стимуляции биологического разрушения.
Из минусов специалисты отмечают многие биохимические последствия теплового шока в нормальных клетках, в том числе замедление роста и повышенной чувствительности к последующей ионизирующей радиоактивной терапии.
Гипертермия увеличивает приток крови к нагретой области, что может провоцировать удвоение кровотока в опухолях. Такой феномен повышает положительное воздействие химиотерапевтических средств в патологических областях.
Мягкая гипертермия, которая обеспечивает температуру, равную естественно высокой при многих инфекционных заболеваниях, может стимулировать естественные иммунологические атаки на опухоли. Однако это также индуцирует естественный физиологический ответ под названием термотолерантность, который имеет тенденцию защищать атипичные клетки.
Очень высокие температуры, выше 50 ° C, используются для абляции — прямого уничтожения некоторых опухолей. Методика использует вставки в виде металлической трубки непосредственно в опухоль, наконечник которой нагревается, это и вызывает гибель клеток по его периметру.
Стоит подчеркнуть, что методика гипертермической абляции в России пока что в стадии изучения, и в практической медицине применяется редко. Однако эффективность испытаний прогнозирует весьма неплохие перспективы этого метода, в том числе и в нашей стране.
Отличия и особенности методов локальной, регионарной и общей гипертермии
Методы терапевтической гипертермии применяются, как правило, в трех вариантах, в зависимости от показаний и лечебных возможностей.
- Локальная гипертермия
Нагревается очень маленькая площадь, как правило, в рамках самой опухоли. В некоторых случаях цель метода заключается в гибели атипичных клеток путем нагревания, не повреждая окружающие ткани. Тепло может быть стимулировано с помощью:
- ультракоротких волн;
- высоких радиочастот;
- ультразвуковой энергии;
- с использованием магнитной гипертермии.
В зависимости от локализации опухоли, тепло может быть применено к поверхности тела, внутри тканей или глубжележащих областей за счет использования игл или зондов. Одним из относительно распространенных типов является радиочастотная абляция небольших опухолей. Терапевтической цели легче всего достичь, когда опухоль находится на поверхности тела (поверхностная гипертермия), или если существует возможность ввода игл или зондов непосредственно в опухоль (интерстициальная гипертермия).
- Регионарная гипертермия
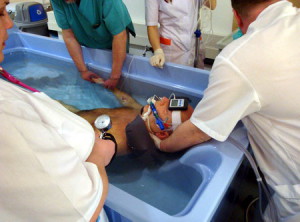
Нагревается большая площадь тела, например, целый орган или конечность. Как правило, цель метода состоит в ослаблении раковых клеток таким образом, чтобы достичь их гибели последующим радиоактивным излучением или действием химиотерапевтических препаратов. Как и в предыдущем методе, регионарная гипертермия может использовать те же поверхностные или интерстициальные методы или опираться на перфузию крови. Во время процесса перфузии кровь пациента удаляется из организма, нагревается и возвращается в кровеносные сосуды, которые ведут непосредственно в нужную часть тела. Как правило, химиотерапевтические препараты применяются одновременно.
Одним из специализированных типов такого подхода является непрерывная перитонеальная перфузия, которая используется для лечения сложных новообразований внутри брюшной полости, в том числе первичной мезотелиомы брюшной полости и рака желудка. Горячие химиотерапевтические препараты закачивают непосредственно в брюшную полость, чтобы убить раковые клетки.
- Общая гипертермия
Нагревается весь организм до температуры от 39 до 43 °С и выше. Метод, как правило, используется для лечения метастатического рака. Включает в себя использование инфракрасных гипертермических куполов, под которые помещается все тело пациента, за исключением головы. К другим способам можно отнести помещение пациента в очень горячую камеру или укутывание в нагретые влажные одеяла. Из редких методов используют специальные гидрокостюмы с постоянным подогревом или погружение в горячий воск.
Для каких видов рака может применяться гипертермия?
В одиночку гипертермия продемонстрировала уникальную способность терапии злокачественных новообразований. Также известно, что методика значительно увеличивает эффективность других методов лечения.
В сочетании с радиоактивным излучением гипертермия особенно эффективна в присутствии большого количества кислорода при условии одновременного воздействия не менее, чем в течение часа.
В последние десять лет гипертермия в сочетании с облучением была использована с лечебной целью у больных со следующими диагнозами:
- ранняя стадия рака молочной железы;
- при локализации рака на голове и шее;
- рак простаты.
Известные научные издания свидетельствуют об улучшении у 38 % пациентов при раке мочевого пузыря в сочетании с химиотерапией, по сравнению с применением только химиотерапии. У больных раком молочной железы результат показал улучшенную реакцию у 18 % пациентов.
Какие существуют еще типы рака, которые показывают значительное улучшение при лечении гипертермией?
- Меланома и рак кожи.
- Саркома мягких тканей.
- Рак мочевого пузыря.
- Рак шейки матки.
- Рак прямой кишки.
- Злокачественные опухоли подмышечной области и грудной стенки.
- Метастазы в лимфоузлах.
Исследования в России показали интересные результаты с высокой гипертермией в 43,5-44°C, когда метод применяли в отношении:
- рака пищевода;
- рака гортани;
- рака печени;
- при ВИЧ-инфекции и расстройствах иммунной системы.
Абляция опухолей — одна из разновидностей гипертермии
Радиочастотная абляция (РЧА), вероятно, наиболее часто используемая разновидность локальной гипертермии. Для повышения температуры применяются радиоволны высокой частоты.

- Тонкий игольчатый зонд вводится в опухоль на короткое время, как правило, от 10 до 30 минут.
- Размещение зонда регулируется с помощью ультразвука, МРТ или КТ.
- Наконечник зонда выдает высокочастотный ток, который способен создать тепло между 40 и 60°С, что вызывает гибель клеток в пределах определенной области.
- Мертвые клетки не удаляются, становятся рубцовой тканью и рассасываются с течением времени.
РЧА наиболее часто используется для лечения опухолей, которые не могут быть удалены хирургическим способом, или у пациентов, которые по разным причинам не операбельны. Процедура может быть выполнена амбулаторно. Повторения абляции возможно для опухолей, способных к рецидивам. Также РЧА может быть добавлена к другим лечебным мероприятиям, в том числе оперативному удалению новообразования, лучевой терапии, химиотерапии, инфузионной терапии, алкогольной абляции или химиоэмболизации.
РЧА может быть использована для лечения опухолей, достигших в диаметре вплоть до 5 см. Методика наиболее эффективна для лечения образований в печени, почках и легких. В настоящее время изучается ее применение в других областях тела. Долгосрочная эффективность после лечения гипертермической абляцией пока не известна, но первые результаты обнадеживают.
Возможные осложнения и побочные эффекты гипертермии
Применение высоких температур может привести к ожогам тканей, повреждению органа-мишени, особенно в случаях регионарного лечения. Степень поражений будет варьироваться в зависимости от времени воздействия, температуры и вида тканей. Самыми чувствительными к этому методу являются ткани головного мозга и легких.
- Отек.
- Образование тромбов.
- Внутренние кровотечения.
- Сердечно-сосудистые нарушения.
Сочетаемость с радиоактивным облучением или химиотерапией обладает достаточно сильной токсичностью, что выражается, как правило, через несколько часов после процедуры и может вызывать порой довольно тяжелые расстройства.
Читайте также:

