Локализация первых гематогенных метастазов при саркоме языка
Метастазирование рака легкого по кровеносным сосудам характеризует важную биологическую особенность его злокачественного роста. Сложные процессы, происходящие в наружной клеточной мембране клеток и межклеточных контактах первичной опухоли, характеризуются утратой ими способности к адгезии. Тогда отделившиеся от опухоли клетки поступают в кровеносное русло.
Перенос отдельных раковых клеток или их комплексов по кровеносным сосудам приводит к формированию новых очагов опухолевого роста за пределами легкого и грудной полости.
К настоящему времени накоплено и обобщено большое число наблюдений, позволяющих представить в общих чертах сложные взаимоотношения, возникающие при гематогенном метастазировании между организмом больного и различными проявлениями растущей злокачественной опухоли в легком.
Формированию и развитию гематогенных метастазов сопутствуют многочисленные изменения в организме больного раком легкого. Некоторые из них хорошо изучены и проясняют особенности патогенеза гематогенного метастазирования.
Достоверно установлена повышенная наклонность к свертыванию крови и тромбообразованию при снижении антитромбогенной активности стенки кровеносных сосудов. При этом циркулирующие в сосудистом русле опухолевые клетки адгезируют на своей поверхности тромбоциты, покрываются фибрином и формируют онкогеннотромбогенный эмбол. Снижение антитромбогенных свойств сосудистой стенки способствует задержке эмбола в сосудах, чаще всего — в зоне микроциркуляторного русла. В последующем, по мере роста метастаза, происходит деструкция сосудистой стенки и выход опухоли в окружающие ткани с их прогрессирующим поражением.
Известно, что метастазы особенно интенсивно развиваются при закономерно отмечаемых у больных раком легкого угнетении Т-системы иммунитета и снижении андрогенных гормонов, повышении уровня кортизола, нарушении соотношения между отдельными фракциями стероидов.
Тканевая гипоксия, наблюдаемая у онкологических больных, также снижает противоопухолевую резистентность их организма. Гипоксия ткани является одним из ведущих факторов, способствующих приживлению и развитию метастазирующих раковых клеток. Вероятно, она в различной степени реализуется в разных органах и анатомических структурах организма при раке легкого и этим определяется известная "тропность", избирательность его гематогенного метастазирования. Известно, что в первую очередь метастазами рака легкого поражаются органы, в нормальных условиях имеющие богатое кровоснабжение, с хорошо развитым микроциркуляторным руслом: печень, почки, надпочечники, головной мозг, кости и сами легкие. Эти структуры становятся своеобразными "биологическими ловушками" для метастазов ввиду особенностей строения и функционирования в кровеносной системе, подобно лимфатическим узлам в лимфатическом русле.
Таким образом, распространение раковых клеток в сосудистой системе происходит лимфогенным и гематогенным путем. Для рака легкого более характерен и реализуется раньше лимфогенный или смешанный — лимфогематогенный путь метастазирования. Своеобразие взаимоотношений лимфатической и кровеносной систем в самом легком и за его пределами определяет периодичность в течении заболевания. Обычно гематогенной диссеменации рака легкого предшествует поражение регионарных лимфатических коллекторов. Тем не менее, часто можно наблюдать обширное лимфогенное метастазирование рака легкого при отсутствии гематогенных метастазов или только локальное, одиночное поражение ими одного из органов.
Многообразие причино-следственных связей, особенности биологии раковой опухоли, различия ее клеточного строения и жизнедеятельности организма больного человека определяют широкий диапазон пределов гематогенного метастазирования рака легкого. Часто он весьма индивидуален: от обширного поражения до ограниченного, локального развития гематогенного метастаза, единственного очага опухоли за пределами легкого.
Морфологические изменения, наблюдаемые в метастазе, развивающемся в пораженном органе, своеобразны и могут несколько отличаться от первичной опухоли в легком. Гистологическое строение метастаза чаще всего повторяет структуру новообразования, вызвавшего его появление, но может и отличаться от него, особенно если речь идет о полиморфном раке, метастазировавшем одним из клеточных компонентов его составляющим. Тогда удается наблюдать снижение или повышение дифференцировки опухоли в ее метастазе, а развитие его по своим характеристикам будет больше соответствовать составляющей его клеточной структуре.
Высокодифференцировнные раки легкого реже метастазируют не только лимфогенным, но и гематогенным путем. В этих случаях поражение внутренних органов, если оно произошло, как правило, представлено одиночным, солитарным метастазом.
Недифференцированные формы рака легкого, напротив, метастазируют чаще и обширнее, а их распространение по кровеносным сосудам характеризуется множественностью своих проявлений. Нередко отмечается интенсивное, приближающееся по размерам к первичной опухоли в легком, увеличение в объеме гематогенных метастазов недифференцированного рака. При мелкоклеточных раках легкого такое развитие метастазов иногда даже опережает рост первичной опухоли.
Морфологические особенности строения и структуры солитарных гематогенных метастазов рака легкого наиболее детально исследованы при их развитии в головном мозге. Некоторые общие морфологические особенности их роста довольно сходно проявляют себя и при поражении других органов.
Метастатический очаг развития опухоли проявляет себя в виде прогрессирующего местного роста со смещением, разрушением и замещением ткани пораженного органа. Иногда предполагаемое при этом формирование вокруг метастаза в пораженной зоне его роста "капсулы"чаще всего не обнаруживается. Опухоль в виде коротких выростов, языков и пластов злокачественной ткани распространяется по перивазальным и межтканевым щелям.
Разрушение кровеносных сосудов нередко приводит к трофическим нарушениям и некрозу, расплавлению центральной части наиболее крупных солитарных метастазов.
При развитии гематогенного метастаза в органе, имеющем хорошо развитую лимфатическую систему — часто в противоположном легком, — возможно распространение опухолевых клеток из метастаза по лимфатическим коллекторам. Такие лимфогенные метастазы, возникающие из солитарного гематогенного метастаза в одном из органов, встречаются не очень часто. А.И.Савицкий образно назвал их "внучатными метастазами"в отношении к первичной опухоли в легком.
Целенаправленное патологоанатомическое исследование и клинические наблюдения убеждают, что к моменту распознавания рака легкого гематогенные метастазы могут быть установлены у 6—% больных. Наиболее высоких значений этот показатель достигает при раке легкого с метастазами в регионарные лимфатические коллекторы. Среди больных раком легкого, перенесших радикальные оперативные вмешательства и погибших в последующие годы от гематогенных метастазов, в 30—% наблюдений причиной смерти стало прогрессирующее развитие одиночного метастаза, чаще всего вполне доступного в более раннем периоде хирургическому удалению. Поэтому для части больных раком легкого подобное решение вопросов лечебной тактики представляется достаточно обоснованным.
В целом солитарные метастазы рака легкого по морфологическому строению, особенностям своего роста и развития больше приближаются к самостоятельной злокачественной опухоли. Это следует учитывать, планируя и выполняя их хирургическое удаление в онкологически обоснованных пределах.
Бисенков Л.Н., Гришаков С.В., Шалаев С.А.
Рак языка – онкологическое заболевание в полости рта, образующиеся из клеток плоского эпителия. От всех онкологических заболеваний рак языка составляет 2%, но, не смотря на это агрессивное течение болезни в силу анатомического расположения и строения поражаемого органа. Блеют данным видом заболевания в большей мере мужчины зрелого возраста (50-55 лет), у женщин болезнь диагностируется в 5-7 раз реже.
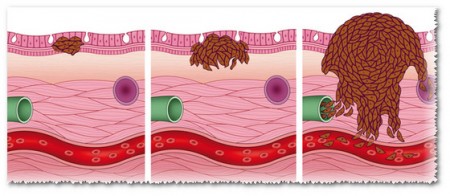
Распространение метастаз по лимфе и кровеносным сосудам
Метастазы, их распространение по человеческому организму
Разрастаясь, раковые клетки могут отрываться от первичной опухоли, проникать в лимфатические и кровеносные сосуды, циркулировать в крови и метастазировать в нормальных тканях в других частях тела. Ранее считалось, что к метастазированию способны только клетки злокачественной опухоли. Однако новые исследования показывают, что перемещаться могут и другие клетки.
Каждый день в человеческом организме появляется белее 30 тыс. аномальных клеток, которые в принципе могут стать раковыми. Иммунная система организма находит эти аномальные клетки и уничтожает их. Если же по какой-то причине иммунитет пропустил раковую клетку, начинается беспрерывное деление ее, в результате чего образовывается раковая опухоль.
Клетки по лимфе проникают во все органы человеческого организма, образовывая при этом метастазы. Таким образом, метастазами называют вторичные очаги новообразования.
Рак языка, метастазы характерны для III – IV стадии развития. Появляться метастазы начинают на первых стадиях развития болезни, спустя 3-4 месяца от начала образования опухоли. Они не проявляются клинически и их невозможно диагностировать. Распространение метастазов в 99% происходит через лимфу, гематогенный путь, метастазирование во внутренние органы и кости.
Многих интересует вопрос, как и куда метастазирует рак языка и каковы последствия заболевания? Метастазы распространяются с помощью лимфатического оттока, центром которого считаются узлы в области шеи (зона сонной артерии). Происходит значительное увеличение количества лимфососудов, в зоне основания языка, именно этот вид опухоли дает агрессивный рост метастазов.
Экзофитная форма рака языка дает метастазы реже и позднее, нежели эндофитные образования при которых происходит поражение регионарных лимфатических узлов в 70% случаев. Кроме того известно, что низкая гистологическая дифференциация опухоли характеризуется ранним и очень обширным развитием метастазов.
Частота поражение регионарных лимфатических узлов составляет:
- боковая часть языка – 43,5%;
- дно полости и корень языка – 44,5%;
- кончик языка – 15-20%.
Имеются подтверждения клиницистами, что около половины пациентов могут не иметь метастазов. Выявление поражений лимфоузлов является довольно сложным и обусловленное анатомической спецификой и поздними сроками диагностики рака языка.
Как выявить метастазы при раке языка?
Диагностика выглядит таким образом:
- пальпация шеи и подчелюстной зоны с двух сторон, при которой ощущаются сильные боли при раке языка;
- визуальный осмотр полости рта;
- пальцевое исследование полости рта, включая дно, язык и миндалины;
- УЗИ шейно-плечевого пояса;
- рентгенография органов грудной клетки и нижней челюсти;
- ортопантомография;
- КТ и МРТ.
- непрямая лимфосцинтиграфия;
- биопсия новообразования;
- мазок из зева для цитологии;
- анализы крови, мочи, слюны.
Основными и, пожалуй, самыми точными методами выявления метастазов на всех стадиях развития болезни является УЗИ и непрямая лимфосцинтиграфия. Если же опухоль диагностирована и возможно ее удаление хирургическим путем во время процедуры применяется регионарная лимфодиссекция шеи, которая позволяет определить наличие или отсутствие метастазирования в интактных лимфатических зонах.
Рак языка: рецидив болезни
Что такое рецидив? Возвращение болезни после периода ремиссии. На данный момент, точные причины повторения опухоли не известны. Вероятно, причиной является слабый иммунитет, а также раковые клетки, которые остались в организме после проведения лечения. Раковые клетки имеют возможность долгое время себя не проявлять, но, как только человек ослаб, и иммунная система дала сбой, они активно начинают размножаться. Таится, в организме человека они могут от нескольких недель до нескольких лет.
Возобновления опухоли делится на три категории:
- местные рецидивы ‒ повторение болезни в тех же тканях или в близи расположенных органов. При этом новообразование не распространилось на лимфоузлы или другие части тела;
- региональные рецидивы ‒ происходят в лимфатических узлах и тканях, расположенных в непосредственной близости от оригинального рака;
- отдаленные рецидивы ‒ относятся к раку, который распространился в отдаленные от первичного заболевания районы.
Симптомы рецидива рака языка
- боль в области полости рта и регионарных лимфоузлов, которая не проходит длительный период времени;
- необычные кровотечения или выделения из вновь образовавшихся язв, ран;
- утолщения или уплотнения в любых частях тела;
- расстройство желудка, затрудненное глотания;
- изменения в функционировании кишечника или мочевого пузыря;
- заметные изменения родинок, родимых пятен;
- довольно часто наблюдаются изменение цвета кожи и возникновение пятен на теле;
- головные боли, усталость, боли в костях;
- возможно появление кашля и охриплость голоса.
Важно! Рецидивы рака случаются без особенных признаков. Людям, у которых был рак полости рта необходимо регулярно проводить медицинские осмотры и периодически сдавать анализы на раковые клетки. Диагностика включает в себя анализ крови, рентгеновские лучи, КТ и ПЭТ.
Лечение рецидива рака
Лечение опухоли возникшей из рецидива включает в себя:
- хирургическое лечение (операция) – проводится в тех случаях, если опухоль не распространилась за пределы органа;
- химиотерапия при раке — возможность уничтожения раковых клеток или остановку механизмов их роста и деления, что позволяет достигнуть мутированные ткани, где бы они не находились. Если же рецидив произошел в течении 2 лет применение химиотерапии не возможно;
- лучевая терапия – дополнительный вид лечения к основному, когда опухоль не может быть устранена хирургическим путем и характеризируется метастазами. Проводится для улучшения жизни больного;
- целевое лечение и иммунотерапия;
- народная медицина.
Как предотвратить рецидив рака языка?
Условия, способствующие предотвращению рецидива рака языка:

Здоровый образ жизни — залог здоровья
- соблюдение правил полезного питания и диет, ведение здорового образа жизни, что подразумевает отказ от алкоголя, употребление большого количества свежих фруктов и овощей и как можно меньше насыщенных жиров;
- употребление большого количества витаминов и пищевых добавок склонно предотвратить рак и его повторение;
- физическая активность повышает жизненный тонус человека.
В любом случае нужно понимать, что не существует определенного лекарства от рецидива рака, однако стоит пробовать разные способы уберечь себя.
а) Определение:
• Распространение злокачественной опухоли в легкие гематогенным путем
• Чаще всего метастазы локализуются в легких: 50% случаев по данным патологоанатомических исследований
б) Лучевые признаки:
1. Основные особенности гематогенных метастазов в легких:
• Оптимальный диагностический ориентир:
о Множественные узелки с четким контуром в легких
• Локализация:
о Чаще всего располагаются в базальных и периферических отделах легких
о Разветвляющиеся участки уплотнения и перибронховаскулярные узелки с неровным контуром свидетельствуют в пользу наличия опухолевых эмболов
2. Рентгенография гематогенных метастазов в легких:
• Множественные узелки и объемные образования в легких, участки консолидации легочной ткани:
о В редких случаях наблюдается изолированный характер распределения очагов, либо выявляются лишь единичные патологические образования
• Вариабельный размер; четкие или нечеткие контуры
• Преимущественная локализация в базальных отделах легких
• В структуре образований могут выявляться полости
• Метастазы эндобронхиальной локализации могут приводить к развитию постобструктивных ателектаза или консолидации легочной ткани
• Лимфаденопатия корней легких или средостения, плевральный выпот
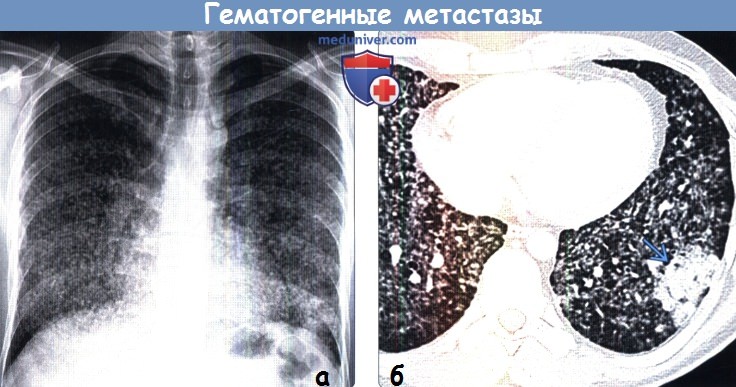
(а) Пациент с метастазами аденокарциномы легкого. При рентгенографии органов грудной клетки в ПП проекции в легких определяются множественные микроузелки, соответствующие милиарным метастазам.
(б) У этого же пациента при КТ с контрастным усилением в легких визуализируются множественные микроузелки, соответствующие гематогенному распространению аденокарциномы. Также выявляется первичная аденокарцинома. К наиболее частым первичным злокачественным опухолям внегрудной локализации, дающим милиарные метастазы, относят медуллярный рак щитовидной железы, почечноклеточный рак и меланому.
4. Методы медицинской радиологии. ПЭТ/КТ:
о Высокая чувствительность обнаружения узелков (>90%) идругих признаков метастатического поражения
5. Рекомендации к проведению лучевых исследований:
• Оптимальный метод лучевой диагностики:
о Наиболее чувствительным методом диагностики является ПЭТ/КТ; позволяет определить тип метастазов и протяженность поражения
в) Дифференциальная диагностика гематогенных метастазов в легких:
1. Множественные легочные узелки:
• Гранулемы:
о Часто выявляется доброкачественный характер кальцификации
о Сочетаются с кальцификатами в печени и селезенке
о Метастазы костеобразующих первичных опухолей могут имитировать гранулемы
• Инфекция:
о Милиарный туберкулез, вирусная пневмония
о Септические эмболы часто содержат полости
• Артериовенозные мальформации (АВМ):
о Питающие артерии и дренирующие вены
• Гранулематоз с полиангиитом:
о Обычно выявляются полости
о Может сочетаться с подскладковым стенозом и легочным кровотечением
2. Эндобронхиальное объемное образование:
• Рак легких:
о Сочетается с регионарной лимфаденопатией
о Встречается чаще, чем эндобронхиальный метастаз
о Сведения о курении в анамнезе
• Бронхолит:
о Кальцифицированный узелок эндобронхиальной локализации
• Инородное тело:
о Наиболее частое эндобронхиальное образование у детей
3. Интерстициальные заболевания легких:
• Саркоидоз:
о Перилимфатические микроузелки
о Часто наблюдается лимфаденопатия
о Описаны милиарные узелки
• Силикоз:
о Могут выявляться множественные узелки в легких
• Склеродермия и другие заболевания соединительной ткани:
о Равномерные перегородки без утолщений в виде бус
о Сопутствующие изменения костной ткани (ревматоидный артрит) или расширение пищевода (склеродермия)
5. Первичные злокачественные опухоли:
• Рак легких:
о Крупное единичное объемное образование, которое может приводить к обструкции дыхательных путей или сосудов
• Лимфома:
о Множественные узелки в легких + лимфаденопатия
о Часто встречается у ВИЧ-инфицированных пациентов
6. Эмболия легочной артерии:
• Преходящая острая симптоматика
• Отсутствует утолщение сосудов в виде бус
7. Саркома легочной артерии:
• Часто локализуется в легочном стволе
• Единичный очаг
г) Патоморфология гематогенных метастазов в легкие:
2. Стадирование,определение степени дифференцировки и классификация опухолей:
• В большинстве случаев наличие гематогенных метастазов соответствует стадии IV опухоли
3. Макроскопические патоморфологические и хирургические особенности:
• Стелющийся характер роста:
о Диссеминация в дистальных артериолах, рост в интерстиции и альвеолах
о Сохранена архитектоника
о Легочная ткань выступает в роли каркаса для роста опухоли
о Типичен для аденокарциномы
• Рост в корне легкого:
о Типичнее для гематогенных метастазов
4. Микроскопические особенности:
• Вследствие инвазии легочных вен опухолевые клетки попадают в венозный круг кровообращения
• Типичные особенности роста первичной опухоли
д) Клинические аспекты:
1. Проявления:
• Наиболее частые признаки:
о Вариабельны, зависят от характера распространения
о Симптомы могут отсутствовать
2. Демографические данные:
• Возраст:
о Встречаются у пациентов любого возраста, но чаще у взрослых
• Эпидемиология:
о Метастазы представляют собой наиболее частые новообразования в легких
о Плевральный тип метастазов характерен для аденокарцином, особенно для аденокарцином легких и молочных желез
о Метастазы в виде участков консолидации легочной ткани характерны для аденокарцином органов желудочно-кишечного тракта и лимфом
о Опухолевые эмболы характерны для гепатоцеллюлярной карциномы, рака молочных желез, почечноклеточного рака, хориокарциномы и ангиосаркомы
о Метастазы эндобронхиальной локализации характерны для аденокарциномы (консолидация легочной ткани), базальноклеточного рака области головы и шеи
3. Естественное течение заболевания и прогноз:
• В основном прогноз неблагоприятный, однако он зависит от того, какие методы доступны для терапии конкретного типа первичной опухоли
4. Лечение:
• Зависит от гистологического типа первичного новообразования: в большинстве случаев паллиативная лучевая терапия или химиотерапия
• При наличии метастазов лишь в легком возможна их резекция, особенно если интервал между временем удаления первичной опухоли и появлением метастазов составляет > одного месяца
о Резекция метастазов остеосаркомы, единичных и медленно растущих метастазов
• Многообещающим выглядит применение в качестве паллиативного лечения чрескожной абляции
е) Диагностические пункты. Следует учитывать:
• При наличии у пациентов со злокачественной опухолью множественных узелков, объемных образований в легких и участков консолидации легочной ткани в дифференциальный ряд следует включить метастатическое поражение
ж) Список литературы:
1. Aquino SL: Imaging of metastatic disease to the thorax. Radiol Clin North Am. 43(3):481-95, vii, 2005
2. Seo JB et al: Atypical pulmonary metastases: spectrum of radiologic findings. Radiographics. 21 (2):403—17, 2001
- Вернуться в оглавление раздела "Лучевая медицина"
Редактор: Искандер Милевски. Дата публикации: 18.2.2019
ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ • Т.6, № 4 - 2005
САРКОМА ЮИНГА И ПЕРИФЕРИЧЕСКИЕ ПРИМИТИВНЫЕ НЕЙРОЭКТОДЕРМАЛЬНЫЕ ОПУХОЛИ
(клиника, диагностика, лечение)
А.И. Семенова
ГУН НИИ онкологии
им. проф. Н.Н. Петрова,
Санкт-Петербург
I. Эпидемиология
Впервые в самостоятельную нозологическую форму данная опухоль была выделена в 1921 г. J. Ewing.
Помимо общепринятого названия саркомы Юинга, в литературе еще недавно можно было встретить такие обозначения заболевания, как эндотелиальная миелома, диффузная эндотелиома, лимфангиоэндотелиома, круглоклеточная саркома диафиза костей.
За последние 5-10 лет удалось достичь существенно большего понимания морфологии и молекулярнобиологических особенностей данной опухоли. Полученные результаты позволяют рассматривать саркому Юинга в качестве одного из представителей большой группы близкородственных злокачественных новообразований, характеризующихся высокоагрессивным течением и одинаковой способностью поражать как кости, так и мягкие ткани. Помимо саркомы Юинга, к данному семейству относятся так называемые периферические примитивные нейроэктодермальные опухоли (PNET), отличительной чертой которых является наличие ряда тканеспецифических маркеров.
До недавнего времени в зарубежной литературе для обозначения этих опухолей использовались такие названия, как периферическая нейроэпителиома, опухоль Аскина, нейробластомавзрослых, периферическая нейробластома.
По обобщенным данным, пик заболеваемости саркомой Юинга приходится на популяцию, возраст которой составляет от 10 до 25 лет. Около 90% больных PNET находятся во второй и третьей декадах жизни. В то же время, злокачественные новообразования этой группы могут встречаться практически в любом возрасте. Так, в литературе описаны клинические наблюдения развития саркомы Юинга у младенцев и лиц старческого возраста (75-90 лет).
В структуре общей онкологической заболеваемости на долю саркомы Юинга приходится около 10 - 15% всех первичных опухолей костей. В педиатрической практике опухоль Юинга занимает второе место среди наиболее часто регистрируемых злокачественных новообразований костной системы.
Заболеваемость PNET и саркомой Юинга имеет отчетливые географические и этнические особенности, подтвержденные результатами нескольких эпидемиологических исследований. Значительно чаще опухоли этой группы регистрируются у белых детей и подростков по сравнению с жителями или выходцами из стран Африки и Азии. Так, в европейских странах и США частота их встречаемости составляет 3,4 на 1 миллион белых детей в возрасте младше 15 лет в год. Аналогичный показатель у афроамериканского населения США не превышает 0,6 случаев в год.
Различия в заболеваемости PNET и саркомой Юинга прослеживаются и по половому признаку. Мальчики болеют практически в 2 раза чаще, чем девочки, соотношение составляет приблизительно 1,5 - 2,0:1. Ни в одном из проведенных к настоящему времени исследований не удалось выявить потенциальные этиологические факторы, влияющие на возникновение саркомы Юинга и PNET. В то же время, существует ряд научных данных, свидетельствующих о роли наследственного компонента в патогенезе этих заболеваний. В частности, многими исследователями описано одновременное развитие PNET у сиблингов, что позволяет судить о значении генетических дефектов в этиологии опухолевого процесса.
Высокоагрессивный характер саркомы Юинга и PNET обусловливает крайне неблагоприятный прогноз. До внедрения в клиническую практику современных цитостатиков 5 - ти летняя выживаемость больных не превышала 10%. Практически половина пациентов умирали в течение 12 мес. с момента установления диагноза. Следует отметить,что выживаемость больных зависит от локализации первичной опухоли. Так, при поражении длинных трубчатых костей 5 - ти летний рубеж переживают 22% больных, в то время, как развитие опухолевого процесса в костях черепа сопровождается гибелью практически всех пациентов в течение 1,5-2 лет.
2. Патоморфология, патогенез
Патоморфологические особенности саркомы Юинга и PNET, выявляемые при гистологическом исследовании, являются недостаточными для установления окончательного диагноза. Наибольшие сложности возникают при проведении дифференциального диагноза с другими мелкоклеточными злокачественными опухолями детей (нейробластомой, рабдомиосаркомой, неходжкинской лимфомой и др.). У подростков и взрослых сходная патоморфологическая картина характерна для некоторых мягкотканных сарком, таких как рабдомиосаркома, синовиальная саркома, лейомиосаркома.
Поскольку эти опухоли, несмотря на различный гистогенез, лишены специфических морфологических признаков, позволяющих установить точный диагноз, то для дифференциальной диагностики необходимо проведение ряда дополнительных исследований, к которым относятся световая (электронная) микроскопия, иммуногистохимический и цитогенетический анализ (FISH и PCR). Ранее предпринимались попытки использования гистохимических методов исследования (реакции на липиды, коллаген, гликоген и др.). Так, гликоген может быть определен практически в 90% случаев саркомы Юинга путем использования Шиффреакции. К сожалению, специфичность этих методик оказалась недостаточной.
Как уже упоминалось выше, все PNET, в отличие от саркомы Юинга, характеризуются наличием отчетливой нейроэктодермальной дифференцировки. Иммуногистохимическое (с помощью моно и поликлональных антител) исследование опухолевой ткани позволяет в этомслучае выявить экспрессию синаптофизина и нейрон специфической энолазы. В педиатрической практике весьма важным является проведение дифференциального диагноза PNET и нейробластомы. В обоих случаях определяется положительная реакция на нейронспецифическую энолазу, однако для нейробластомы характерноповышение уровня катехоламинов.
При световой микроскопии примитивные нейроэктодермальные опухоли демонстрируют формирование псевдорозеток HomerWright, что также отличает их от саркомы Юинга.
Несмотря на различия в нейроэктодермальной дифференцировке, клетки саркомы Юинга и PNET одинаково часто экспрессируют на своих мембранах продукт онкогена MIC2, известный, как гликопротеин р30/32 или СD 99. Выявление его экспрессии иммуногистохимическим методом служит убедительным подтверждением клинико - рентгенологического диагноза саркомы Юинга.
Проводимое в последние годы активное и целенаправленное изучение саркомы Юинга и PNET позволиловыявить множество опухолеспецифических генетических повреждений, являющихся промоторами неконтролируемой клональной пролиферации. Разнообразные
дефекты генома обусловливают клиническую гетерогенность злокачественных новообразований изучаемой группы и являются значимыми прогностическими факторами. Быстрая идентификация этих нарушений осуществляется с помощью флуоресцентной in situ гибридизации (FISH), одного из новейших методов молекулярногенетического анализа, позволяющего выявлять амплификацию генов.
Практически 95% клеток саркомы Юинга и PNET имеют характерные изменения хромосом в виде транслокаций [t (11; 22) (q24;q12)] между EWSгеном на хромосоме 22 и FLI1геном на хромосоме 11. Хромосомные транслокации активируют транскрипцию, приводящую к синтезу химерной РНК и нарушению регулирования роста и дифференцировки клеток. Менее часто регистрируемыми цитогенетическими аномалиями у больных саркомой Юинга и PNET являются трисомия хромосом 8 и 12, транслокация между хромосомами 1 и 16, а также делеция короткого плеча хромосомы 1. Частота и клиническая значимость этих повреждений генетического аппарата требует дальнейшего углубленного изучения. Результаты ряда молекулярногенетических исследований позволяют предположить, что одним из ключевых моментов туморогенеза является повреждение гена, кодирующего синтез рецептора трансформирующего фактора ростаβ II типа (TGFβ), который относится к белкам - супрессорам. Помимо FISH, для идентификации генетических дефектов успешно применяется методика полимеразной цепной реакции (PCR), характеризующаяся уникально высокой чувствительностью, в том числе при необходимости исследования минимальных объемов опухолевой ткани (например, образца крови или костного мозга).
3. Клиническая картина
Местом возникновения саркомы Юинга и PNET может являться практически любая кость, а также мягкие ткани конечностей, головы и туловища. Напомним, что мягкие ткани включают подкожную жировую клетчатку, фасции, сухожильные растяжения, рыхлую жировую межмышечную клетчатку, внутримышечные и периневральные соединительнотканные прослойки, синовиальную ткань, сосуды, а также поперечнополосатые мышцы и оболочки периферических нервов. Более характерным для PNET является ретроперитонеальная или интраабдоминальная локализация (20-24% наблюдений), реже - поражение висцеральных органов (в 18-20% случаев).
При развитии первичной саркомы Юинга в костной ткани вначале происходит замещение ею интрамедуллярного пространства, затем опухоль разрушает кортикальный слой и формирует мягкотканный компонент.
В возрасте до 20 лет саркомой Юинга чаще поражаются длинные (бедренная, мало и большеберцовые, плечевая) кости, в более старшем возрасте - плоские кости таза и черепа, ребра, лопатки, позвонки.
Не менее 70% всех сарком Юинга локализуются на нижних конечностях (45-50%) и в области тазового пояса (18-20%). Наиболее частой, составляющей от 20 до 27% всех наблюдений, первичной локализацией опухоли является бедренная кость, несколько реже (15-17%) - берцовые кости. Поражение костей таза с одинаковой частотой может затрагивать подвздошную, лонную или седалищную кости, а также крестец. Первичное вовлечение в опухолевый процесс костей верхних конечностей, в первую очередь плечевой кости, составляет от 12 до 16%. Более редкими, не превышающими по частоте 10-13%, локализациями саркомы Юинга являются позвонки, ребра, ключицы, лопатки, кости черепа, мелкие кости кисти и стопы.
В длинных трубчатых костях, как правило, наблюдается первичное поражение метафиза с дальнейшим распространением на диафиз. Локализация саркомы Юинга в эпифизах длинных костей конечностей крайне редка. У 5-10% больных, обычно при метафизарной локализации, заболевание осложняется развитием патологических переломов.
Симптоматика саркомы Юинга и PNET значительно варьирует в зависимости от локализации первичной опухоли. Так, поражение костей нижних конечностей приводит
к развитию хромоты. Вовлечение в опухолевый процесс позвонков может манифестироваться радикулопатией, компрессионноишемической миелопатией с явлениями
параплегии, нарушением функции тазовых органов. Поражение костей и мягких тканей грудной стенки составляет около 6,5% от всех первичных опухолей семейства PNET. Как правило, оно имеет вид крупных опухолевых образований, которые распространяются в грудную полость и вовлекают в патологический процесс легкие, плевру и органы средостения. Характерно наличие плеврального выпота, симптомов дыхательной недостаточности, кровохарканья. Приблизительно 25% больных при первичном обращении имеют общие симптомы интоксикации в виде субфебрильной и фебрильной лихорадки, слабости, потери массы тела вплоть до кахексии.
Изменения в клиникобиохимических показателях неспецифичны. Как правило, у больных саркомой Юинга определяются лейкоцитоз, анемия, увеличение СОЭ, повышение уровня лактатдегидрогеназы (ЛДГ). Наличие симптомов интоксикации в сочетании с отклонениями лабораторных показателей относится к неблагоприятным прогностическим факторам, поскольку косвенно свидетельствует о большом объеме опухолевых масс в организме.
Характерной особенностью патогенеза сарком Юинга и всех опухолей семейства PNET является ранняя непосредственная инвазия в окружающие мягкие ткани.
Поэтому даже локализованная форма этих злокачественных новообразований подразумевает наличие мягкотканного компонента, т. е. IIB или III стадию заболевания. Регионарные лимфатические узлы поражаются в 5-15% случаев, как правило, при непосредственном подрастании к ним первичной опухоли.
Высокоагрессивный характер саркомы Юинга обусловливает наличие отдаленных метастазов у 25-28% больных во время установления первичного диагноза. Весьма часто пациенты впервые обращаются за медицинской помощью с жалобами, вызванными метастатическим поражением тех или иных органов.
Все опухоли семейства PNET обладают выраженной способностью к образованию гематогенных метастазов с преимущественной локализацией в легких. Несколько
реже определяются метастазы в костном мозге и других костях, как правило, литического характера. Кроме этого, отдаленные метастазы могут обнаруживаться в лимфатических узлах средостения и забрюшинного пространства, в центральной нервной системе в виде поражения менингеальных оболочек, головного испинного мозга.
4. Обследование больных саркомой Юинга и PNET
Обследование больного с верифицированной саркомой Юинга или PNET включает исследование области первичной опухоли, исключение или подтверждение наличия отдаленных метастазов, а также ряд лабораторных анализов.
К обязательным диагностическим процедурам относятся:
1. Рентгенография пораженных первичной опухолью и/или метастазами костей.
2. Рентгенография органов грудной клетки.
3. Ультразвуковое исследование области локализации первичной опухоли. Этот метод позволяет определить размеры и характер мягкотканного компонента опухоли, а также может оказаться решающим при проведении дифференциального диагноза саркомы Юинга и остеомиелита. В случае саркомы Юинга мягкотканный компонент выглядит как гипоэхогенная муфта, прилежащая широким основанием к кортикальному слою, тогда как
анэхогенные затеки гноя в мягких тканях при остеомиелите чаще всего имеют неправильную форму и сопровождаются дорсальным усилением.
4. Компьютерная или магнитнорезонансная томография органов грудной клетки, брюшной полости и малого таза для определения степени распространения опухолевого процесса, поражения сосудов, суставов и т.п.
5. Сканирование костей для оценки распространения опухолевого поражения в пределах первичного очага, а также для выявления метастазов в других костях. По данным большинства авторов, остеосцинтиграфия позволяет обнаружить метастазы саркомы Юинга у 8-10% больных.
Билатеральная трепанобиопсия костного мозга (из крыла подвздошной кости). Важно помнить, что больные саркомой Юинга и PNET могут иметь изолированное опухолевое поражение костного мозга при отсутствии метастазов в костях. Поэтому выполнение билатеральной трепанобиопсии костного мозга необходимо для полноценного стадирования заболевания вне зависимости от первичной локализации или размера опухоли.
Остановимся подробнее на рентгенологической картине саркомы Юинга, которая имеет ряд характерныхособенностей.
В первую очередь, в рентгенологической картине наблюдается сосуществование деструктивного и реактивного процессов костеобразования.
По рентгенологической картине саркому Юинга следует дифференцировать с первичной лимфомой кости, миеломой, остеогенной саркомой, центральной хондро саркомой, эозинофильной гранулемой, остеомиелитом.
Следует помнить, что практически все больные саркомой Юинга и PNET имеют микрометастазы, которые не определяются клинически во время установления первичного диагноза. Значительное совершенствование различных методов диагностики, достигнутое в последние годы, привело к увеличению числа больных, имеющих метастатическую форму заболевания на момент начала лечения. В результате возникают трудности при попытке оценить значение современных методов лечения посравнению с историческим контролем.
5. Прогностические факторы
Исторически определение прогноза у больных саркомой Юинга базируется на выявлении таких основных факторов, как размер первичной опухоли, ее локализация и степень распространения опухолевого процесса.
Наиболее значимым фактором неблагоприятного прогноза является клиническая манифестация метастазов. Безрецидивная и общая выживаемость больных, имеющих метастатическое поражение легких, несколько выше по сравнению с больными, у которых выявляются метастазы в костях и костном мозге.
Независимыми факторами плохого прогноза являются размер первичной опухоли более 8 см в диаметре или объем более 100-200 см3. Большой объем опухолевой массы коррелирует с уменьшением вероятности достижения локального контроля после лучевой терапии или
оперативного вмешательства. Так, 3 летняя безрецидивная выживаемость больных составила 78% при объеме опухоли менее 100 см3, и лишь 17% - при объеме более
100 см3. Наличие экстраоссального мягкотканного компонента также сопряжено с увеличением риска местного рецидива.
К неблагоприятным локализациям саркомы Юинга и PNET относятся кости таза (по сравнению с костями конечностей), а также мягкие ткани забрюшинного пространства, брюшной полости и полости малого таза. По видимому, это обусловлено большими размерами опухоли и, следовательно, меньшей ее резектабельностью и чувствительностью к лекарственному и лучевому воздействию.
К неблагоприятным прогностическим факторам относится детский возраст. У пациентов старше 10 лет показатели выживаемости достоверно выше.
Отчетливым фактором прогноза служит подтвержденный рентгенологически и гистологически регресс опухолевых очагов в результате проведенной цитостатической
терапии. По данным ряда авторов, некроз всей или большей части опухоли коррелирует с высокой, достигающей 85 - 95%, 5летней выживаемостью больных.
Читайте также:

