Линия раковых клеток это
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
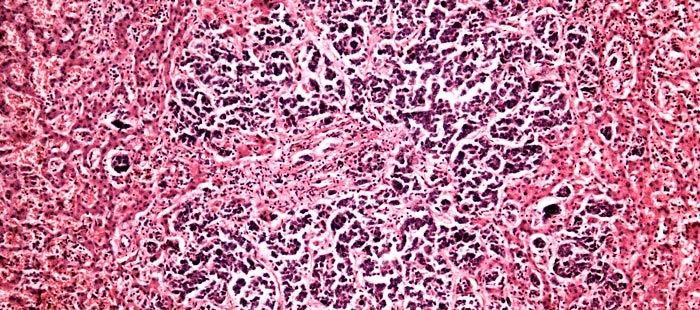
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.

МОСКВА, 7 авг — РИА Новости. Расшифровка генома "бессмертных" раковых клеток HeLa, которые исследователи используют для изучения множества заболений и тестирования лекарств, вызвала скандал, когда исследовали выложили расшифровку в открытый доступ, говорится в статье, опубликованной в журнале Nature.
Эта история может привести к изменениям в американском законодательстве и сделать условия использования биологических тканей человека в научных исследованиях более строгими, полагают авторы публикации.
В 1951 году медики из больницы Джона Хопкинса в Балтиморе (штат Мэриленд, США) взяли образец опухоли у Генриетты Лакс (Henrietta Lacks) — афроамериканки, страдавшей раком шейки матки. Лакс умерла от рака, а ее клетки дали начало первой "бессмертной" линии человеческих клеток, известной как HeLa. До тех пор все попытки вырастить человеческие клетки в культуре заканчивались их гибелью, а HeLa продолжают жить по сей день.
Эти клетки стали "полигоном" для многочисленных исследований по всему миру, которые начались с испытания вакцины от полиомелита. С их помощью изучают рак, СПИД и множество других болезней, а также воздействие радиации и токсичных веществ на человеческие клетки. В 1960 году HeLa отправились в космос на советском спутнике. Сейчас упоминание о них можно найти в примерно 74 тысячах научных статей.
В 2013 году две группы ученых расшифровали геном "бессмертных" клеток. Сначала это сделали немецкие исследователи под руководством Ларса Штайнмеца (Lars Steinmetz) из Европейской лаборатории молекулярной биологии в Гейдельберге (Германия). Проанализировав полученные данные, они обнаружили, что геном HeLa существенно отличается от генома обычных человеческих клеток: в них много мутаций, лишних копий генов и перестановок. Отчасти это объясняется тем, что клетки HeLa — раковые, а часть изменений накопилась за годы культивирования в лабораторных условиях.
"Это, наверное, самый худший вариант того, как папилломавирус мог встроиться в ее геном", — пояснил один из авторов исследования Эндрю Эдей (Andrew Adey) из Университета Вашингтона.
В середине XX века ученым не требовалось разрешение самой Генриетты или ее родственников на использование клеток в исследованиях. Поэтому долгое время члены семьи Лакс не подозревали, какую роль сыграли клетки Генриетты в развитии науки. Однако узнав об использовании клеток HeLa в исследованиях, ее родственники были возмущены тем, что все это происходило без их ведома.
Новый виток развития тема получила в марте 2012 года, когда Штайнмец и его коллеги выложили расшифровку генома клеток HeLa в базы данных, доступные научному сообществу.
Результаты расшифровки геномов обычных людей нельзя публиковать вместе с их личными данными. Но в случае HeLa ученые не нарушили никаких законов и не увидели в этом ничего предосудительного: эти клетки давно стали привычным объектом исследований. Однако семья Лакс была возмущена. Несмотря на отличия HeLa от здоровых человеческих клеток, они могут выявить некоторые наследственные черты семьи. Расшифровка генома была удалена из баз данных, однако это не решило проблему.
Результаты исследования генома клеток HeLa, проведенные группой Шендура, были приняты к печати в журнале Nature. Это подразумевает обязательную публикацию данных исследования. Проблема конфиденциальности расшифровки генома HeLa снова стала актуальной.
Чтобы найти выход из этой ситуации, Фрэнсис Коллинз (Francis Collins), директор, и Кэти Хадсон (Kathy Hudson), замдиректора Национального института здоровья США встретились с представителями семьи Лакс. Вместе они решили опубликовать расшифровку генома HeLa, ограничив к ней доступ. Ученые, которые захотят ознакомится с этими данными, должны будут обратиться в Национальный институт здоровья, где их запрос будут рассматривать, в том числе, представители семьи Лакс. Таким образом Лаксы будут знать, кто и для каких целей использует эти данные, и смогут определять условия их использования. Исследование Шендура стало первым, которое опубликовано с согласия Лаксов.
Конечно, остается возможность восстановить геном HeLa по данным, опубликованным за годы исследования клеток, или расшифровать его заново и снова выложить в интернет. Национальный институт здоровья США не сможет повлиять на тех исследователей, работу которых он не финансирует, пишут руководители института в том же выпуске Nature, где опубликовано исследование Шендура. Однако они призвали научное сообщество уважать права семьи Лакс.
Этот случай — уникальный, подчеркивает руководство Национального института здоровья, и поэтому рассматривается в индивидуальном порядке. Однако он привлек внимание общественности к условиям использования биологических образцов в научных исследованиях.
Действующие законы США оставляют возможность получить на основании такого образца полную расшифровку генома человека без его ведома. Единственное ограничение — образец должен быть анонимным. Однако в век компьютерной обработки данных такая защита весьма условна, признает руководство Национального института здоровья.
"Кроме того, взаимоотношения между учеными и участниками исследований развиваются: запрос разрешения подчеркивает, что участники — это партнеры (ученых), а не просто предмет изучения", — пишут Коллинз и Хадсон.
Сейчас руководство Национального института здоровья готовит предложения поправок в американские законы. Если эти изменения будут приняты, ученым придется получать у "доноров" биологических тканей разрешение на использование материала вне зависимости от анонимности исследования.

В большую науку эти клетки попали совершенно неожиданно. Они были взяты у женщины по имени Генриетта Лакс (HEnrietta LAcks), которая вскоре после этого умерла. Но культура клеток убившей ее опухоли оказалась незаменимым инструментом для ученых.
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта обратилась в госпиталь Джонса Хопкинса — ее беспокоили странные выделения, которые она периодически обнаруживала на своем нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала.

Невольный вклад Генриетты Лакс в медицину неоценим: клетки, оставшиеся после ее смерти, уже более полувека спасают человеческие жизни
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать всё новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили исследователей культивировать сотни других линий раковых клеток. И хотя в последние годы приоритет в этой области смещается в сторону культур клеток нормальных тканей и индуцированных плюрипотентных стволовых клеток (за открытие метода возвращения клеток взрослого организма в эмбриональное состояние японский ученый Синья Яманака получил Нобелевскую премию по физиологии и медицине 2012 года), тем не менее раковые клетки остаются общепринятым стандартом в медико-биологических исследованиях. Основное преимущество HeLa — неудержимый рост на простых питательных средах, что позволяет проводить масштабные исследования при минимуме затрат.

Клетки HeLa, сфотографированные с помощью электронного микроскопа (увеличение примерно в тысячу раз)
С момента смерти Генриетты Лакс клетки ее опухоли непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В мире биомедицины клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Даже сегодня поражает размах экспериментов, проводившихся тогда советскими генетиками в космосе. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком. Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надежности своего лекарства вколол вакцину себе, своей жене и троим детям.
С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке клеточных ядер перед клонированием знаменитой овцы Долли проводились на HeLa), для отработки методов искусственного оплодотворения и тысяч других исследований (некоторые из них приведены в таблице).
Сегодня в молекулярной биологии и фармакологии, как правило, используют следующие стадии:
-
HeLa (или любая другая лабораторная клеточная линия).
Нетрансформированные короткоживущие клеточные линии — клетки кожи, клетки крови и т. п. Работать с ними в разы тяжелее, они быстро гибнут, однако, если эксперимент отработан на HeLa, ученые знают, что и где искать, и не тратят время на широкий поиск.
Модельные организмы — мыши, крысы, обезьяны. Тут уже эксперименты длятся месяцами и стоят на порядки дороже. Однако это обязательный этап перед проверкой потенциальных лекарств или изучением причин человеческих болезней на людях.
Многостадийные клинические исследования на людях.
Личность самой Генриетты Лакс долгое время не афишировалась. Для доктора Гея, конечно, происхождение клеток HeLa не было тайной, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 году.
Напомним, что стандарты стерильности и техники работы с клеточными линиями в то время только зарождались, и некоторые ошибки всплывали лишь спустя годы. Так и в случае с клетками HeLa — через 25 лет ученые выяснили, что множество используемых в исследованиях клеточных культур, происходящих из других типов тканей, включая клетки рака молочной и предстательной желез, оказались зараженными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.
Кстати, американцы и сейчас переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. По сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры предсказуемо не желают обсуждать эту тему.


Посмертные подвиги живых клеток
11 марта 2013 года масла в огонь подлила новая публикация, где были представлены результаты полного сиквенса генома клеточной линии HeLa. Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во-первых, HeLa, несмотря на все изменения, всё еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во-вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.


Генриетта Лакс
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта обратилась в госпиталь Джонса Хопкинса — ее беспокоили странные выделения, которые она периодически обнаруживала на своем нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.

Невольный вклад Генриетты Лакс в медицину неоценим: клетки, оставшиеся после ее смерти, уже более полувека спасают человеческие жизни.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала.


Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
Четыре этапа эксперимента

Сегодня в молекулярной биологии и фармакологии, как правило, используют следующие стадии:
1.HeLa (или любая другая лабораторная клеточная линия).
2.Нетрансформированные короткоживущие клеточные линии — клетки кожи, клетки крови С ними работать в разы тяжелее, они быстро гибнут, однако если эксперимент отработан на HeLa, ученые знают что и где искать, и не тратят время на широкий поиск.
3.Модельные организмы — мыши, крысы, обезьяны. Тут уже эксперименты длятся месяцами, и стоят на порядки дороже. Однако это обязательный этап перед проверкой потенциальных лекарств или изучением причин человеческих болезней на людях.
4.Многостадийные клинические исследования на людях.
Почему ее клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать все новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили исследователей культивировать сотни других линий раковых клеток. И хотя в последние годы приоритет в этой области смещается в сторону культур клеток нормальных тканей и индуцированных плюрипотентных стволовых клеток (за открытие метода возвращения клеток взрослого организма в эмбриональное состояние японский ученый Синья Яманака получил Нобелевскую премию по физиологии и медицине 2012 года), тем не менее раковые клетки остаются общепринятым стандартом в медико-биологических исследованиях. Основное преимущество HeLa — неудержимый рост на простых питательных средах, что позволяет проводить масштабные исследования при минимуме затрат.

С момента смерти Генриетты Лакс клетки ее опухоли непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В мире биомедицины клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Даже сегодня поражает размах экспериментов, проводившихся тогда советскими генетиками в космосе. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком. Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надежности своего лекарства вколол вакцину себе, своей жене и троим детям.
С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке клеточных ядер перед клонированием знаменитой овцы Долли проводились на HeLa), для отработки методов искусственного оплодотворения и тысяч других исследований (некоторые из них приведены в таблице).
Hela использована как модель для изучения сальмонеллеза
На модели Hela доказано, что вирус папилломы может вызывать рак
На модели Hela показан механизм заражения клеток вирусом иммунодефицита человека
В клетках Hela открыт неизвестный ранее фермент теломераза
На модели Hela исследован механизм заражения туберкулезом
Клетки Hela используются для изучения потенциальных опасностей наноструктур
Секвенирование генома клеточной линии Hela
Помимо науки…
Личность самой Генриетты Лакс долгое время не афишировалась. Для доктора Гея, конечно, происхождение клеток HeLa не было тайной, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 году.
Напомним, что стандарты стерильности и техники работы с клеточными линиями в то время только зарождались, и некоторые ошибки всплывали лишь спустя годы. Так и в случае с клетками HeLa — через 25 лет ученые выяснили, что множество используемых в исследованиях клеточных культур, происходящих из других типов тканей, включая клетки рака молочной и предстательной желез, оказались зараженными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.

Кстати, американцы и сейчас переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. По сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры предсказуемо не желают обсуждать эту тему.
11 марта 2013 года масла в огонь подлила новая публикация, где были представлены результаты полного сиквенса генома клеточной линии HeLa. Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Клеточные рекордсмены

Реальное бессмертие?

Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во‑первых, HeLa, несмотря на все изменения, все еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во‑вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.
Читайте также:

