Линии химиотерапии при рецидиве рака яичников
Рак яичников является одной из наиболее частых злокачественных гинекологических опухолей и составляет 4-ю причину смертности от рака у женщин. Половина всех случаев заболевания приходится на возраст старше 65 лет. Приблизительно 5-10% рака яичников является семейным заболеванием в 3-х наиболее частых вариантах: только рак яичников, рак яичников и молочной железы, рак яичников и толстой кишки. В первую очередь прослеживается наследственность у родственников по 1-й степени (мать, дочь, сестра). Меньший риск существует для женщин 2-й степени родства (бабушка, тетя). При генетических исследованиях обнаруживаются мутации связей в локусе BRCA-1 хромосомы 17g21.
BRCA -2, также отвечающий за возникновение семейного рака яичников и рака молочной железы, расположен в хромосоме 13g12.
Для женщин, имеющих повышенный риск заболевания, старше 35 лет, имеющих детей, может рассматриваться вопрос о профилактической овариэктомии, однако ее значимость до сих пор окончательно не установлена. Описаны случаи заболевания после профилактической операции, первоначально начинающиеся с перитонеальных опухолевых разрастаний, подобных раку яичников.
Особенностью рака яичников являются распространение в брюшную полость путем имплантации клеток и локальная инвазия в мочевой пузырь и кишечник. Частота поражения лимфоузлов составляет 24% при стадии I, 50% — при II, 74% — при III и 73% — при IV стадии. Тазовые лимфоузлы вовлекаются так же часто, как и парааортальные. Опухоль путем трансдиафрагмального распространения может блокировать диафрагмальный лимфоотток, что является причиной асцита и плеврита.
Для больных с I стадией наиболее важна степень морфологической дифференцировки опухоли. Проточный цитометрический анализ ДНК при I и IIA стадиях может выявить группу повышенного риска.
Поскольку в ранних стадиях рак яичников является бессимптомной болезнью, он диагностируется главным образом в поздних стадиях, результатом чего является ранняя смертность примерно у 65% заболевших. При субоптимально операбельной III и IV стадиях 5-летняя выживаемость составляет менее 10% даже при использовании цисплатинсодержащих режимов химиотерапии.
После оптимальных операций при III стадии медиана выживаемости составляет 52-63 мес.
Классификация рака яичников (по FIGO)
I Опухоль ограничена яичниками
IA Опухоль ограничена одним яичником, асцита нет. Нет опухолевых проявлений на внешней поверхности яичника, капсула интактна.
IB Опухоль ограничена двумя яичниками, нет асцита. Нет опухоли на внешней поверхности, капсулы интактны.
IC Опухоль такая же, как в стадиях IA и IB, но с наличием опухоли на поверхности одного или обоих яичников, или нарушением капсулы, или имеется асцит, и/или обнаруживаются опухолевые клетки в перитонеальном смыве.
II Опухоль вовлекает один или оба яичника и распространяется в полость малого таза.
IIA Опухоль характеризуется распространением в матку и/или маточные трубы.
IIB Распространение на другие ткани малого таза.
IIC Опухоль такая же, как в стадиях IIA и IIB, но имеется опухоль на поверхности одного или обоих яичников, или отмечается разрыв капсулы, или асцит, и/или обнаруживаются опухолевые клетки в перитонеальном смыве.
IV Опухоль одного или обоих яичников с отдаленными метастазами. Плеврит с цитологически обнаруживаемыми опухолевыми клетками, паренхиматозные метастазы в печени.
Для диагностики и контроля над эффективностью лечения при эпителиальных опухолях используются такие опухолевые маркеры, как раково-эмбриональный антиген и опухолево-специфический антиген СА-125. Имеется высокая корреляция уровня СА-125 через месяц после 3 курса химиотерапии при III и IV стадиях и выживаемости. В случаях нормализации этого маркера в процессе лечения, повторное повышение маркера определяет активизацию процесса, хотя и не означает необходимость незамедлительного лечения.
Повышенный уровень СА-125 указывает на высокую вероятность рака яичников, в то же время отрицательный ответ не исключает наличие остаточной опухоли. Уровень СА-125 может быть повышен как при других злокачественных опухолях, так и при разных заболеваниях половых органов, например при эндометриозе.
Методы лечения зависят от стадии процесса. Ключевым моментом в лечении является операция. В отличие от других опухолей женских половых органов, стадия процесса при раке яичников устанавливается после хирургического вмешательства. Несмотря на то, что лишь незначительное число больных может быть излечено одной операцией, успех терапии определяется объемом первоначального вмешательства. Возможность достижения в последующем полной ремиссии, подтвержденной морфологически, зависит от размеров остаточных опухолей. Радикальной операцией при раке яичников считается двусторонняя овариосальпингэктомия с экстирпацией матки и удалением большого сальника. У молодых женщин, настаивающих на сохранении репродуктивной функции, при I стадии и 1-й степени злокачественности (G1) возможна односторонняя овариэктомия. Во время операции для уточнения стадии и морфологического варианта берут биопсию из латеральных каналов, тазовой брюшины и диафрагмы, связки, подвешивающей яичник, парааортальных, общих подвздошных, наружных и внутренних подвздошных лимфатических узлов, серозы прямой кишки и мочевого пузыря.
Тактика лечения
Больным с опухолями в IA-IB стадии с высокой или средней степенью дифференцировки (т.е. I-II степенью злокачественности G1 и G2) после операции не требуется дополнительного лечения.
При 3-й степени злокачественности (G3) IC стадии высока вероятность рецидива (до 20%), что требует дополнительных методов лечения.
Возможна системная химиотерапия; внутрибрюшинное введение радиоактивного фосфора 32Р или облучение брюшной полости малого таза. Однако введение 32Р оказалось более токсичным при одинаковой эффективности при сравнении с проведением 6 курсов цисплатина.
Экстирпация или надвлагалищная ампутация матки с придатками с резекцией большого сальника и удалением всех или большинства опухолей. При отсутствии видимых опухолей производят множественные биопсии и смывы из брюшной полости. Дальнейшее лечение включает:
-
При минимальных остаточных опухолях (
Злокачественные эпителиальные опухоли яичников — солидные новообразования, чрезвычайно чувствительные к химиотерапии (ХТ) первой линии (70—80 %) с высокой частотой полных ответов. Однако у большинства больных раком яичников (РЯ) возникает рецидив, и в конечном итоге они умирают при явлениях резистентности к химиотерапии (ХТ).
Даже при применении препаратов платины 5-летняя выживаемость больных с первоначально выявленной поздней стадией заболевания составляет менее 25 %. До настоящего времени результаты химиотерапии (ХТ) второй линии при всех морфологических вариантах рака яичника (РЯ) остаются неутешительными.
При наличии эффекта от полихимиотерапии (ПХТ) первой линии после развития лекарственной резистентности практически нет шансов на существенный успех второго, третьего препаратов или их сочетаний. Иногда имеют место частичные ответы и исчезают опухолевые выпоты, но это длится недолго. Тем не менее большинство онкогинекологов применяюттерапию второй линии активными препаратами, не использовавшимися в первой схеме лечения.
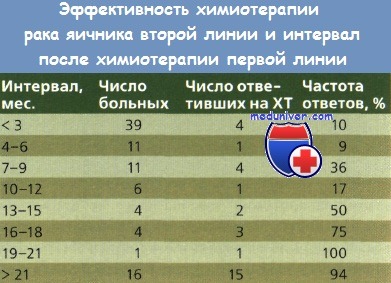
Чувствительность к производным платины (устойчивая реакция на терапию первой линии на основе препаратов платины) — прогностический показатель ответа на терапию второй линии, содержащую цитостатик с этим элементом. Ответ на первичное лечение и безрецидивный промежуток более 6 мес. — показатель чувствительности к препаратам платины.
При прогрессировании или стабилизации заболевания, а также при возникновении рецидива в течение 6 мес. после начала первичной XT на основе препаратов платины опухоли расценивают как платинорезистентные. Эффективность терапии в этих двух группах пациенток различна. Blackledge и соавт. проанализировали данные обследования 92 пациенток, получавших пять разных режимов терапии второй линии, и установили, что перерыв в лечении препаратами платины был устойчивым фактором прогноза эффективности лечения.
Это наблюдение было одинаково верным для схем второй линии как на основе препаратов платины, так и без них. У пациенток с перерывом в лечении менее 6 мес. частота противоопухолевого ответа составила менее 10 %, с ростом этого промежутка до более 21 мес. этот показатель увеличился до 90 %.
Seltzer и соавт. сообщили, что у 11 пациенток с полным ответом на химиотерапию (XT) первой линии на основе платины эффективность терапии второй линии составила 72 %, включая 36 % полных ответов. Согласно данным Markman и соавт., у больных, не получавших химиотерапию (XT) более 24 мес, частота ответа на цисплатин равняется 77 %, а при перерыве влечении втечение 5—12 мес. — 27 %.

Eisenhauer и соавт. сообщили о частоте объективного ответа на карбоплатин 43 % у пациенток, не получавших химиотерапию (XT) более 2 мес, а при перерыве в лечении до 2 мес. — 10 %. Эти данные указывают на необходимость тщательного отбора пациенток для проведения химиотерапии (XT) второй линии. Для II фазы исследования требуется достаточная выборка пациенток с чувствительностью и резистентностью к препаратам платины.
Кроме того, нужно стратифицировать больных в зависимости от протяженности интервала между химиотерапией (XT) первой и второй линий. В целом для II фазы исследования ожидаемая эффективность активных средств химиотерапии (XT) в группе пациенток, чувствительных к препаратам платины, составляет более 25—30 %, а в платинорезистентной — более 10 — 15 %.
Эффективность карбоплатина в качестве второй линии терапии рака яичника (РЯ) составила 14—38 % с частотой полных ответов 25—50 %. У пациенток с рефрактерностью к цисплатину и алкилирующим препаратам частота ответов равнялась 6—13 %, в случаях предшествующей эффективной терапии цисплатином — 31 %, у нелеченных больных (неудачная ЛТ) — 45 %. Если болезнь прогрессирует во время лечения цисплатином, то объективный ответ на карбоплатин не наблюдается.
Стандартная доза паклитаксела эффективна у 22—23 % пациенток с платинорезистентной опухолью. Kohn и соавт. изучали эффективность высоких доз паклитаксела, требующих поддержки гемопоэза, у пациенток с платинорезистентным заболеванием: частота ответов отмечалась в 48 % случаев. Но, как и при применении других препаратов, длительность их была короткой. Тем не менее паклитаксел — основной препарат терапии второй линии при платинорезистентном раке яичника (РЯ).
Значимость интенсивности дозы анализируют в рандомизированных исследованиях во всем мире; полученные результаты позволят точно определить дозировку паклитаксела для комбинированных режимов лечения первой и второй линий.
В последние 10 лет для лечения рецидивного рака яичника (РЯ) наибольший интерес представляют три препарата: гемцитабин, пегилированный липосомный доксорубицин и топотекан. Поскольку эти препараты оказались эффективными, их также включили в клинические исследования терапии первой линии.
GOG сообщила о положительных результатах II фазы исследования эффективности лечения топотеканом (5 дней по 1,5 мг/м 2 с интервалом 21 день): частота ответов составила 33 %, медиана выживаемости — 11,2 мес. Основными побочными эффектами были недомогание, анемия и тромбоцитопения. Сейчас большинство онкологов используют недельный режим применения топотекана, назначая 3,5—4 мг/м2 в 1, 8 и 15-й дни 28-дневного цикла.
Gordon и соавт. сообщили о III фазе исследования эффективности пегилированного липосомного доксорубицина (Доксил) по 50 мг/м 2 каждые 28 дней и топотекана по 1,5 мг/м2 в сутки в течение 5 дней каждые 21 день при лечении рефрактерного РЯ. В группе пациенток с резистентностью к препаратам платины различий в выживаемости не отметили. При лечении пегилированнным липосомным доксорубицином больных, чувствительных к препаратам платины, риск смерти снизился на 30 %; медиана выживаемости равнялась 108 и 70 нед. соответственно.
Эффективность монотерапии рефрактерных опухолей гемцитабином невелика, при комбинации с препаратом платины, обычно цисплатином, она возрастает. Nagourney и соавт. сообщили о результатах лечения цисплатином (30 мг/м 2 ) и гемцитабином (600—750 мг/м 2 ) в 1-й и 8-й дни каждые 21 день: частота полных ответов составила 26 %, частичных — 44 % (общая частота ответов 70 %), медиана времени до возникновения прогрессирования у больных, ответивших на лечение, — 7,9 мес. (диапазон 2,1 — 13,2 мес). Токсичность проявлялась в виде нейтропении, анемии, тромбоцитопении, тошноты, рвоты и периферической нейропатии. Имеются данные о способности гемцитабина устранять резистентность к цисплатину.
В настоящее время главная проблема лечения рефрактерного рака яичника (РЯ) заключается в выборе режима лечения: последовательная монотерапия или ПХТ. По данным двух европейских отчетов, ПХТ предпочтительнее. В одном исследовании (ICON4/AGO-OVAR 2,2) участвовало более 800 пациенток. Вся группа была с высокой платиночувствительностью, более чем у 75 % больных перерыв в лечении превышал 12 мес. При медиане наблюдения 42 мес. анализ показал, что 2-летняя выживаемость при ПХТ составила 57 %, при лечении только препаратом платины — 50 %, медиана общей выживаемости — 29 и 24 мес. соответственно.
Это исследование, представляющее множество параллельных клинических испытаний, проведенных разными группами в 119 клиниках 5 стран, подвергли критике. В качестве препарата платины использовали цисплатин или карбоплатин; лечение проводили ежемесячно. Немало больных раньше не получали таксаны. Исход заболевания, как оказалось, не зависел от того, получали они таксаны во время химиотерапии (XT) первой линии или нет.
В США большинство больных раком яичника (РЯ) получают первичное лечение таксанами и карбоплатином, поэтому перенос результатов и опыта этого исследования на женщин США сомнителен. По данным других, менее крупных исследований, в т. ч. испанского (GEICO), ПХТ рефрактерного рака яичника (РЯ) может улучшить результат. Тем не менее пациенткам с безрецидивным промежутком более 12 мес. предпочитают назначать химиотерапию (XT) второй линии с комбинацией таксанов и препаратов платины.
Другая стратегия удлинения перерыва в применении препаратов платины состоит в лечении рецидивов другими препаратами, например пегилированный липосомным доксорубицином и топотеканом. Сейчас широко применяется повторное лечение производным платины, часто в комбинации с гемцитабином, либо таксанами в сочетании с таргетным средством.
Другие препараты (гексаметилмеламин, 5-фторурацил, этопозид) редко вызывают умеренные кратковременные ответы на терапию.
Рак яичников – хроническое, фатальное, практически неизлечимое заболевание – большая проблема современной онкологии. Диагностика злокачественных новообразований яичников на ранних стадиях онкологического процесса затруднительна, в настоящий момент не существует специфических диагностических тестов, позволяющих выявить заболевание на начальных этапах развития.
Малосимптомное течение болезни, возможно, объясняется тем, что прогрессирование рака яичников происходит в основном путем диссеминации по париетальной и висцеральной брюшине. У 2/3 пациенток болезнь диагностируется на III–IV стадии заболевания, когда процесс распространяется за пределы малого таза, с вовлечением органов брюшной полости, отмечаются массивное поражение брюшины, асцит, опухолевый плеврит, гематогенные метастазы в печени, легких и костях [1]. Предлагаемые диагностические программы, включая лучевые способы диагностики и определения уровня онкомаркеров для выявления злокачественных новообразований яичников, не отвечают требованиям ВОЗ к скринингу в онкологии [2].
При эпителиальном раке яичников обладают противоопухолевой активностью около двух десятков химиопрепаратов. Однако лечение согласно существующим стандартам основывается на двух постулатах: основой терапии являются препараты платины, при этом цисплатин и карбоплатин в составе полихимиотерапии равноэффективны [3].
Цель исследования: оценить эффективность и безопасность химиопрепаратов, используемых в лечении первичного и рецидивирующего рака яичников. Проследить этапы эволюции современного стандарта лечения эпителиальных злокачественных новообразований яичников.
Появление таксанов (в первую очередь паклитаксела) радикально изменило взгляд на тактику лечения больных эпителиальным раком яичников. С 1989 по 1994 гг. паклитаксел входил во вторую линию ПХТ, так как препарат давал высокую частоту объективных ответов у платинорезистентных больных [6]. В рандомизированном евро-канадском исследовании фазы III сравнивали 2 дозы паклитаксела (135 и 175 мг/м 2 ) и два режима введения: 3-часовую и 24-часовую инфузию [6, 7]. Выявлено, что время до прогрессирования болезни оказалось достоверно большим при дозе 175 мг/м 2 в режиме трехчасовой инфузии (19 недель против 14 недель в других группах). При этом отмечено, что 24-часовые инфузии ассоциировались с более выраженной нейтропенией (74% против 17%). Таком образом, применение в виде трехчасовой инфузии в дозе 175 мг/м 2 паклитаксела один раз в три недели было признано оптимальным при раке яичников. Учитывая тот факт, что препарат инактивируется большей частью в печени, доза паклитаксела должна быть снижена при нарушениях функции печени до 135 мг/м 2 . При почечной недостаточности снижения дозы не требуется ввиду низкой нефротоксичности.
С 1992–1998 гг. начался следующий этап клинических исследований по изучению паклитаксела в терапии 1-й линии у пациенток с диссеминированным раком яичников. In vitro было установлено, что очень большое значение имеет последовательность введения химиопрепаратов: паклитаксел должен быть введен до производных платины [8]. Дело в том, что препараты платины увеличивают число клеток в S-фазе клеточного цикла, в то время как паклитаксел, действующий в G2/M фазе, оказывается неэффективным [9]. Кроме того, цисплатин, введенный перед паклитакселом, за счет уменьшения его плазменного клиренса значительно увеличивает токсичность последнего [6, 10]. В рандомизированном исследовании GOG-111 продемонстрировано значительное преимущество схемы ТР по сравнению с режимом СР: медиана выживаемости составила 38 месяцев по сравнению с 24 месяцами [11]. В исследовании OV-10 получены аналогичные результаты. В итоге режим ТР стал широко внедряться в повседневную клиническую практику онкологов.
При сравнении эффективности паклитаксела и доцетаксела (2004 г.) различий в выживаемости без прогрессирования, общей выживаемости, частоты объективных ответов не выявлено [6], при этом доцетаксел показал достоверно более высокую частоту нейтропении 3–4-й степени. Паклитаксел ассоциировался с более частым развитием нейропатии 2–4-й степени [6].
Ожидаемых результатов не дали исследования трехкомпонентных и последовательных режимов химиотерапии рака яичников, так же как и попытки улучшить результаты лечения за счет увеличения общего числа курсов [6].
Платформой для интеграции бевацизумаба в режимы лечения рака яичников стали исследования III фазы GOG 218 (2010 г.), которые сравнивали три варианта лечения: стандартная ХТ (паклитаксел + карбоплатин), стандартная ХТ + бевацизумаб на протяжении 6 курсов ПХТ, стандартная ХТ с бевацизумабом на протяжении 15 месяцев либо до прогрессирования заболевания. Медиана выживаемости без прогрессирования процесса составила 10,3 месяца, 11,2 месяца, 14,1 месяца соответственно, однако это не влияло на общую выживаемость больных [12].
По результатам анализа ICON 7 было показано, что при подключении бевацизумаба на фоне химиотерапии и потом в качестве поддерживающей терапии в течение года можно увеличить медиану продолжительности жизни на 9,5 месяцев у нерезектабельных больных, а также больных с III–IV стадиями после неоптимальных циторедуктивных операций [13].
Безопасность добавления бевацизумаба к еженедельным введениям паклитаксела оценили в представленном на ASCO 2012 г. однорукавном исследовании OCTAVIA. Наиболее частыми нежелательными явлениями III–IV степени была нейтропения (60%), анемия (8%), тромбоцитопения (7%).
Побочные эффекты бевацизумаба связаны с прямым нарушением взаимодействия рецептора и лиганда сосудистого эндотелиального фактора роста (VEGFR/VEGF). Так, артериальная гипертензия отмечена в 4,2%, тромбозы – в 6,3%, кровотечения из слизистых и опухоли, так же как и перфорация желудочно-кишечного тракта, – в 0,5% случаев. Примечателен тот факт, что, несмотря на низкий уровень перфорации на фоне лечения (не более 4% по данным разных исследователей), этот показатель за счет развивающихся осложнений может увеличить общую летальность больных до 21,7%, снижая общий эффект от применяемого лечения. Продолжительность гипертензии определяется временем подавления VEGF, а влияние бевацизумаба на уровень артериального давления является дозозависимым. Сочетание ингибитора VEGF и химиотерапии (проанализированы результаты у 1745 пациенток) приводит к двукратному увеличению риска тромбозов по сравнению только с химиотерапией без включения бевацизумаба. Показанием для отмены таргетных препаратов являются клинические проявления тромбоза [14]. Помимо этого, в преклинических исследованиях показано дозозависимое нарушение заживления ран на фоне терапии бевацизумабом за счет нарушения неоваскуляризации и развития гипоксии. В связи с этим бевацизумаб не рекомендован в качестве неоадъювантного препарата в лечении рака яичников.
Прежде чем говорить о химиотерапии, применяемой при лечении рецидивов рака яичников, необходимо сказать, что данное заболевание, в отличие от других солидных опухолей, имеет ряд особенностей: исходное выявление распространенных стадий в 2/3 случаев; высокую чувствительность к цитостатикам; чрезвычайную склонность к возникновению рецидивов (практически 100%). В связи с этим не так важно, какая по счету линия химиотерапии назначена больной. Более существенным будет разделить рецидивы рака яичников на 2 подгруппы: платиночувствительные и платинорезистентные рецидивы. Такая градация обусловлена временем возникновения рецидива и, как следствие, потенциальным ответом на препараты платины. Как известно, платинорезистентным называется рецидив, зарегистрированный в течение первых шести месяцев после завершения первой линии химиотерапии. Наиболее неблагодарными и тяжелыми в лечении являются так называемые платинорефрактерные рецидивы, когда на фоне терапии первой линии наступает возврат болезни. Благоприятными в прогностическом отношении считаются платиночувствительные рецидивы, где интервал между окончанием предыдущей линии химиотерапии и возвратом заболевания составляет 6 месяцев и более.
Тем не менее лечение любого рецидива является паллиативным и направлено на устранение симптомов заболевания и улучшение качества жизни больных. Положительно зарекомендовали себя следующие схемы, используемые для лечения платиночувствительных рецидивов: гемцитабин + карбоплатин (отличается высокой гематологической токсичностью, в связи с чем далеко не всегда удается ввести гемцитабин в 15-й день), карбоплатин + пегилированный липосомальный доксорубицин (на первый план выходит кожная токсичность – ладонно-подошвенный синдром), цисплатин + пероральный этопозид (лейкопения, тромбоцитопения). Во всех исследованиях показано достоверно значимое увеличение времени до прогрессирования заболевания на фоне отсутствия достоверных различий в общей продолжительности жизни [4, 15]. Выбор схемы лечения во второй линии зависит от переносимости, удобства введения и токсичности цитостатиков, и, как ни банально это звучит, наличия лекарственного препарата в лечебном учреждении. Если интервал между завершением первой линии химиотерапии и возникновением рецидива составил более 1 года, можно вернуться к схеме карбоплатин – паклитаксел (исследование AGO-OVAR).
При платинорезистентных интервалах ожидаемая продолжительность жизни (при учете назначения второй линии химиотерапии) в среднем менее года. Применяют паклитаксел в монорежиме и в комбинации с эпирубицином, топотеканом, трабектидином, пегилированным липосомальным доксорубицином [4]. Важно отметить, что комбинированная терапия в этих случаях не приводит к улучшению отдаленных результатов, при этом значимо увеличивается выраженность токсических реакций. Большинство из перечисленных цитостатиков имеют примерно одинаковую эффективность. В результате стандартом лечения платинорезистентного рака является монохимиотерапия неплатиновым агентом. В исследовании AURELIA показано, что добавление бевацизумаба к монотерапии паклитакселом (еженедельное введение), топотеканом или пегилированным липосомальным доксорубицином значимо увеличивает медиану времени до прогрессирования от 3,4 месяца до 6,7 месяца [16]. Анализируя полученные данные, исследователи пришли к выводу, что бевацизумаб – эффективный препарат как при рецидивах заболевания, так и в первой линии лечения [17, 18]. При лечении рецидивов заболевания бевацизумаб достоверно увеличивает как выживаемость без прогрессирования, так и общую выживаемость больных [19]. В первой линии лечения бевацизумаб увеличивает выживаемость без прогрессирования, не оказывая существенного влияния на общую выживаемость.
Согласно клиническим рекомендациям от 2018 г. применение бевацизумаба рекомендовано при лечении первичного рака яичников, а также при рецидивах в дозе 7,5 или 15 мг/кг с интервалом в три недели, в течение 18–22 курсов (или до прогрессирования, но только в том случае, если оно не наступит раньше), начиная с 1-го или 2-го курса химиотерапии [20].
При рецидивах после окончания второй или третьей линии химиотерапии применять бевацизумаб следует до прогрессирования заболевания или возникновения неприемлемой токсичности.
Из перспективных агентов направленного действия необходимо отметить уже включенный в рекомендации олапариб (PARP-ингибитор). Этот препарат наиболее эффективен у больных с наследственными мутациями генов BRCA1/2. По данным исследований III фазы SOLO2/ENGOT-Ov21 поддерживающая терапия олапарибом достоверно (более чем в 3 раза) увеличила время без прогрессирования [21]. Важно отметить удобство применения препарата – пероральная форма и амбулаторное применение позволяют пациентке вести обычный образ жизни без ограничений, накладываемых регулярными госпитализациями. Наиболее частыми нежелательными явлениями являются анемия, астения или усталость, нейтропения 3-й и 4-й степени. У 2% больных зарегистрирована кишечная непроходимость. Олапариб одобрен для клинического применения и рекомендован при серозной аденокарциноме высокой степени злокачественности, наличии герминальной или соматической мутации BRCA, при платиночувствительных рецидивах [22].
Заключение. Подводя итог, можно сделать вывод, что поиски и разработки эффективных схем лечения как первичного, так и рецидивирующего рака яичников остаются актуальными и требуют дальнейшего изучения. Успехи в достижении большего времени без прогрессирования заболевания с применением таргетных препаратов нивелируются отсутствием увеличения общей продолжительности жизни больных и частотой и выраженностью побочных эффектов. Согласно клиническим рекомендациям в случае неэффективности двух режимов химиотерапии дальнейшее проведение химиотерапии сомнительно ввиду прогнозируемой низкой эффективности. В данном случае рекомендованы либо симптоматическая терапия, либо включение в клинические исследования.
В России, Израиле, Германии рак яичников начинают лечить с операции. Удаляется матка с придатками, большой сальник, а также видимые проявления опухоли. Если выполнение операции маловероятно, т о начинают с химиотерапии. Это связано с тем, что рак яичников плохо отвечает на химию. Особенно низкую эффективность химиотерапии наблюдают при муцинозном и светлоклеточном раке яичников.

Операция при раке яичников
Хирургическое вмешательство – всегда всплеск опухолевого роста и метастазирования. Опухолевые клетки механически (скальпелем) разносятся по брюшине, попадают в кровоток. От избытка кислорода раковые клетки активизируются. Это чревато рецидивом и метастазами.
Если злокачественную опухоль до операции задавить химиотерапией, то это снизит активность клеток к росту и метастазированию, увеличит радикальность операции.
Простое введение химиопрепаратов малоэффективно. Поэтому в клинике “К-тест” химиотерапию усиливают, вводя препараты под нагревом методом общей электромагнитной гипертермии. В конечном счете предоперационная терапия по данной схеме улучшает результаты и выживаемость.
Общая гипертермия – перспективный метод лечения онкологии, который исследуется более полувека. Ученые разных стран пробуют возможные способы нагрева (в воде, в специальных камерах и т.д.). Разработками советских ученых в 80-х годах был предложен нагрев в электромагнитных полях. Нижегородские медики и физики объединились и была разработана и апробирована общая электромагнитная гипертермия. Ведущим онкологом этих исследований был профессор Карев. Сейчас он возглавляет клинику “К-тест”. Установки общей электромагнитной гипертермии в постперестроечный период не получили распространения в стране. Причина – высокая стоимость и сложность процедуры. В Нижнем Новгороде как начали лечить, так и лечат более 25 лет. Более простая и дешевая локальная гипертермия используется в ведущих онкоцентрах страны.
Если после 2-3 курсов проводимой химиотерапии в рамках стандартного лечения по ОМС нет заметной положительной динамики, улучшения самочувствия, уменьшения размеров опухоли и метастазов, то следует задуматься о необходимости усиления химиотерапии нагревом. Дальнейшее продолжение стандартной химиотерапии при отсутствии динамики, даже со сменой химиопрепаратов, приведет только к устойчивости рака яичников к лекарствам.
Лечение рака яичников после операции
После операции рекомендована курсовая общая электромагнитная гипертермия с химиотерапией. Для окончательного подавления опухоли и клеток, которые разнеслись по организму в ходе операции.
Введение химиопрепаратов на фоне разогрева тела до температуры гибели опухолевых клеток (42,5 °С и выше) решает проблему устойчивости опухоли к препаратам платины. Также до минимума снижает риск рецидивов.
Число курсов и выбор химиопрепаратов зависит от гистологической классификации опухоли и степени рака. С целью улучшения результата лечения может назначаться таргетная терапия (бевацизумаб).
Рецидив рака яичников можно остановить
Когда к нам обращались пациентки с прогрессированием опухоли яичников после химиотерапии первой линии (платинорефрактерный рак), введение этих же препаратов в условиях общей гипертермии давало ощутимый эффект: опухоль и метастазы уменьшалась уже после первого курса.
Такая картина наблюдалась даже у больных, которые до поступления к нам уже получали множество курсов химиотерапии второй и третьей линий (до 30 курсов) и их переводили на симптоматическую терапию.
Клинический пример:
Больная П., 44 года. Диагноз: Рак яичников T3cNoMo
В 2014 году больная в Екатеринбурге получала комбинированное лечение (экстирпация матки с придатками + адъювантная химиотерапия). Гистология и иммуногистохимия – аденокарцинома, метастазы в большой сальник. В январе 2019 года выявлен асцит. На ПЭТ КТ от 17.01.19 – рецидив опухоли в малом тазу. Проведена химиотерапия – 4 курса. На ПЭТ/КТ от 5.07.2019 выявлена отрицательная динамика – появились уплотнения и инфильтрация (канцероматоз) брюшины (SUV max 7.26), жидкость в малом тазу и брюшной полости. В надключичной области лимфоузлы 9х6 мм (SUV max 1,83). Субплеврально – очаг (SUV max 1,90).
Рак яичников 4 стадии
Применяемая схема позволяет добиться пятилетней выживаемости у 15-20 % пациенток с запущенным и рецидивирующим раком.
При платинорефрактерном раке яичников или рецидиве заболевания переход на химиотерапию в условиях нагрева предпочтительнее, чем химиотерапия второй или третьей линии, которая зачастую не увеличивает продолжительность жизни и ухудшает ее качество в связи с возникновением побочных эффектов.
Хорошие результаты при лечении внутрибрюшинных и отдаленных метастазов рака яичника в легкие и печень.
Под действием критической температуры происходит их резорбция. Становится возможно выполнение метастазэктомии (удаление крупных метастазов).
Лечебное действие электромагнитной гипертермии наряду с противоопухолевым эффектом снимает боли, стимулирует иммунитет, улучшает качество жизни больных.
Клинические примеры:
Сравнение схем лечения по стандарту ОМС и в клинике “К-тест”:
Читайте также:



