Лимфоваскулярная инвазия при раке молочной железы
Рак является одним из самых страшных и в то же время распространенных заболеваний. При своевременном обнаружении онкология хорошо поддается терапии.
Однако если патология не была диагностирована на начальной стадии, то раковые клетки начинают распространяться по всему организму, развивается инвазивный рак.
Что такое инвазия в онкологии знают далеко не все люди. А ведь от данного процесса метастазирования зависит течение онкологии, возможные осложнения.

Понятие инвазии опухоли
Инвазия опухоли – что это такое? Это патологический процесс, при котором раковые клетки отсоединяются от первичного новообразования и распространяются по организму, прорастая сквозь ткани других органов. Так формируются вторичные опухолевые очаги.
Некоторые считают, что инвазия и метастазирование – это одинаковые понятия, на самом деле – это различные вещи. В нормальном состоянии клетки обладают способностью к инвазивному росту. Это проявляется в ситуациях:
- в период вынашивания ребенка (плацента врастает в стенку матки);
- период роста, развития эмбриона;
- регенерация крупных ран.
Инвазия в онкологии является начальным процессом развития метастаз в разных частях организма. Инвазивный рак очень сложно поддается лечению. Объясняется это тем, что раковые клетки, будучи за пределами базальной мембраны, усиленно питаются и насыщаются кислородом, вследствие этого иммунитет ослабляется и происходит обширное поражение организма.
Если терапия не была проведена своевременно, то рак перейдет в запущенную фазу и вероятность излечения будет минимальной.
Этапы инвазивного процесса
Инвазия опухоли протекает постепенно. Весь процесс развития инвазивного рака происходит в несколько этапов:
- Первая стадия . Межклеточные контакты ослабляются, мембранные белки, которые связывают между собой раковые клетки, отдаляются друг от друга, их количество уменьшается. В это же время концентрация клеток, обеспечивающих мобильность новообразований, повышается. При инвазионном раке размеры опухоли не превышают 2 см,
- Вторая стадия . Раковые клетки крепятся к тканям матрикса (межтканевый барьер организма, состоящий из соединительнотканных структур и базальных клеточных мембран). Размеры опухоли на данном этапе инвазивного рака достигают 2-5 см.
- Третья стадия . Раковые клетки вырабатывают особые ферменты, способствующие ослаблению матрикса. В результате это провоцирует разрушение тканевых барьеров. На этом этапе новообразование не обладает четкими границами, наблюдается склеивание патологических клеток в лимфоузлах.
- Четвертая стадия . Запущенная форма инвазионного рака, при которой патологические клетки мигрируют в соседние структуры, все больше поражая организм пациента. Наблюдаются метастазы в отдаленных органах.
Стандартный процесс инвазии в онкологии состоит из 4 этапов, их длительность в каждом случае может отличаться. И если у одного человека инвазивный рак развивается в течение нескольких лет, то у других переход с первой стадии в последнюю может занять всего пару месяцев.

Как развивается в разных органах
Инвазия опухоли – патологический процесс, способный поражать абсолютно любой орган человеческого организма. Наименее подвержены инвазивному раку органы с плотной фиброзной тканью, плотными артериальными стенками и хрящевой структурой. Редко патология затрагивает почки и печень. Часто диагностируется инвазия шейки матки или молочных желез.
Инвазия шейки матки является распространенным онкологическим заболеванием, которое чаще всего диагностируется у женщин 45-55 лет. Вероятность развития патологии повышается при наличии предрасполагающих факторов:
- заражение папилломавирусом человека;
- венерические заболевания;
- беспорядочные половые связи;
- прием гормональных средств;
- перенесенная онкология мочеполовой системы;
- множественные роды;
- некоторые женские заболевания;
- ранее начало сексуальной жизни;
- курение.
Заподозрить развитие инвазивного процесса в шейке матки можно по симптомам:
- нерегулярные менструации;
- кровотечения во время полового акта;
- водянистые выделения;
- зловоние;
- нарушение мочеиспускания;
- боли внизу живота.
Помимо этого могут присутствовать неспецифические признаки, как гипергидроз, потеря аппетита, головокружение и слабость.
Инвазия молочной железы (инвазивная карцинома) представляет собой быстропрогрессирующий тип раковой опухоли, который при попадании в лимфотоки разносится по всему организму. Такая разновидность онкологии развивается по ряду причин:
- мастопатия;
- фиброаденома;
- отказ от грудного вскармливания;
- аборт при первой беременности;
- хронические патологии репродуктивной системы;
- нерегулярная половая жизнь;
- генетическая предрасположенность.
Проявляется инвазивный рак молочной железы по-разному. Если раковые клетки не распространяются за пределы груди, то пациентка может изредка ощущать дискомфорт и болезненность при ощупывании молочных желез. При развитии патологии возникают симптомы:
- болезненность сосков;
- кровянистые выделения из сосков;
- изменение формы груди;
- уплотнения в груди, не имеющие точных границ.
При данном заболевании наблюдаться покраснение, побледнение или сморщивание кожи в области грудной клетки.

Факторы инвазивности процесса
Для того чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие таких предрасполагающих факторов:
- Давление. Чем больше атипичных клеток, тем выше сила давления в тканях первичного ракового очага. В результате оказывающегося давления имеющиеся межтканевые барьеры разрушаются, происходит поражение соседних тканей.
- Подвижность клеток. Раковые клетки мигрируют в направлении тканей, которые обладают высоким уровнем pH, а также большей концентрацией кислорода и питательных веществ.
- Контакты между клетками. Раковые клетки имеют слабые связи, из-за чего вероятность их попадания в кровоток и соседние структуры существенно возрастает.
- Лизосомальные ферменты. Раковые новообразования продуцируют литические ферменты, которые способствуют разрушение здоровых клеток, провоцируя развитие инвазии.
- Пролиферативное свойство. Благодаря данному свойству ткани увеличиваются в размерах. При разрастании ткани, окружающей опухоль, раковые клетки могут свободно перемещаться по организму.
- Особенности иммунитета. От состояния иммунной системы во многом зависит течение патологии. Если иммунная система ослаблена, то скорость распространения раковых клеток за пределы первичного очага существенно увеличивается. Сильный иммунитет, напротив, максимально затормаживает процесс инвазии.
Процесс инвазии также зависит и от таких факторов, как травмы и повреждения, воспалительные процессы, отеки и клеточная пролиферация.
Способы диагностики
На начальной стадии развития инвазивного рака специфические симптомы отсутствуют, из-за чего появляются трудности со своевременным обнаружением проблемы. Чтобы выявить инвазию необходимо проходить регулярные скрининговые обследования. И поскольку инвазионные опухоли чаще всего диагностируются в молочных железах и шейке матки, женщины после 20 лет должны каждый год проверяться у гинеколога и маммолога.
При появлении подозрений на инвазию опухоли следует пройти детальное обследование, включающее в себя проведение таких методов диагностики:
- общие анализы крови и мочи;
- ультразвуковое исследование;
- рентгенография;
- КТ, МРТ.
Потребуется прохождение позитронно-эмиссионной томографии, дуктографии, пиелографии, ректороманоскопии. Обязательно проводится гистологическое обследование, иммуногистохимические тесты.

Методы лечения
Лечение инвазивного рака зависит от степени патологического процесса, особенностей протекания онкологии, расположения опухоли и многого другого. В зависимости от стадии онкологического процесса врачи могут назначать терапию следующего типа:
- нулевая, первая стадия – хирургическое вмешательство;
- вторая – лучевая терапия в сочетании с операцией;
- третья – химиотерапия, комбинированная с радиационной терапией;
- четвертая – лучевая, паллиативная терапия.
Могут проводиться и другие методики лечения, в том числе и экспериментальные. Курс терапии подбирается только опытным специалистом, после прохождения летального обследования.
Прогноз при инвазии опухоли зависит от того, на каком этапе была обнаружена проблема. Если лечение было начато на первой стадии, то выживаемость составляет 90%. При поздней диагностике срок жизни пациента не превышает 1 года.
Кроме 6 признаков, входящих в систему AJCC, существуют и другие предикторы исхода:
- гистологический подтип. 30-летняя выживаемость женщин со специфическим типом карциномы молочной железы (тубулярной, муцинозной, медуллярной, дольковой и папиллярной) составляет > 60%, а женщин с инвазивной протоковой карциномой — 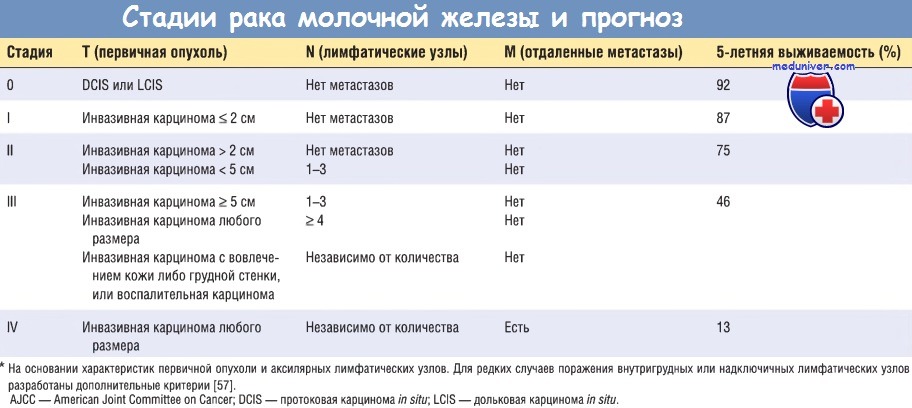
- лимфоваскулярная инвазия. В 50% инвазивных карцином выявляют опухолевые клетки в лимфатических пространствах (мелких сосудах и капиллярах), что коррелирует с метастазами в лимфатических узлах. Лимфоваскулярная инвазия — неблагоприятный прогностический фактор при оценке общей выживаемости женщин без метастазов в лимфатических узлах. Как уже было отмечено, выраженное поражение лимфоваскулярных пространств опухолевыми клетками (воспалительная карцинома) свидетельствует об очень неблагоприятном прогнозе;
- пролиферативная активность. Пролиферативную активность можно измерить, подсчитав количество митозов (например, при определении степени дифференцировки), иммуногистохимически выявив белки, продуцируемые во время клеточного цикла (например, циклины, Ki-67), определив S-фазу с помощью проточной цитометрии или выявив тимидин с помощью радиоактивной метки. Опухоли с высокой пролиферативной активностью имеют худший прогноз, но могут лучше отвечать на химиотерапию;
- состояние ДНК. Количество ДНК в опухолевых клетках можно измерить с помощью проточной цитометрии или анализа срезов ткани. Опухоли с индексом ДНК, равным 1, имеют то же количество ДНК, как и нормальные диплоидные клетки, однако могут содержать выраженные изменения хромосом. Анеуплоидные опухоли характеризуются несколько худшим прогнозом;
- ответ на неоадъювантную терапию. В большинстве случаев выполняют хирургическое вмешательство с последующим системным лечением (адъювантной терапией). Неоадъювантная терапия — альтернативный вариант, когда пациентки получают лечение до операции. Такой подход не улучшает выживаемость, но реакция злокачественной опухоли на лечение является важным прогностическим фактором.
Для контроля изменений во время лечения используют клинические и рентгенологические методы, однако часто объем остаточной опухоли недооценивают или переоценивают. Опухоли, хорошо реагирующие на терапию, обычно низкодифференцированные, ER-негативные и содержат очаги некроза. У пациенток, у которых удалось достичь полного морфологического регресса опухоли (т.е. отсутствует остаточная опухоль в молочной железе и лимфатических узлах) отдаленная выживаемость составляет более 95%, если сравнивать с низкодифференцированными опухолями в целом.
Патоморфологический регресс можно использовать в клинических исследованиях в качестве конечной точки (что может способствовать получению полезной информации при меньшем количестве больных и за меньший период времени) и в молекулярных исследованиях чувствительности или резистентности опухоли к лечению;
- профиль экспрессии генов. Определение экспрессируемых генов используют для прогнозирования общей выживаемости и интервала без рецидива. Определение профиля экспрессии генов позволяет выявить пациенток, у которых эффективность определенного варианта химиотерапии будет наибольшей. Методы исследований замороженных тканей сложно воспроизводимы в клинической практике, но начинают применять альтернативные подходы, использующие парафиновые блоки.
Хотя иммунофенотип содержит большой объем информации, он плохо коррелирует с размером злокачественной опухоли или статусом лимфатических узлов — двумя важнейшими прогностическими факторами.
Местный и регионарный контроль патологического процесса основан на хирургическом методе (мастэктомии или органосохраняющих операциях), в то время как системный контроль заболевания — на гормональной терапии и/или химиотерапии. Для определения прогноза удаляют подмышечные лимфатические узлы или сторожевой лимфатический узел, однако сами по себе метастазы в подмышечных лимфатических узлах можно лечить исключительно лучевым методом. Новые методы терапии включают ингибиторы мембранных факторов роста (например, HER2/Neu), стромальных протеаз и ангиогенеза.
Методы лечения основаны на модели распространения рака молочной железы, которая менялась вместе с изменениями наших представлений о биологии заболевания. Раньше считали, что рак молочной железы распространяется непосредственно из железы в лимфатические узлы (первая модель), поэтому его можно вылечить блоковой резекцией. Однако выполнение радикальной резекции (мастэктомии с резекцией пекторальной мышцы, внутригрудных узлов и надключичных лимфатических узлов) не снизило смертность.
Исследования показали, что органосохраняющие операции и облучение по эффективности идентичны радикальной мастэктомии, поскольку на момент диагностики все опухоли уже имеют отдаленные метастазы (вторая модель). Таким образом, применение методов местного или системного лечения не влияет на выживаемость. В нынешнюю эпоху ранней диагностики злокачественной опухоли с помощью маммографии формируется третья модель, которая совмещает первые две и считается более подходящей для разработки лечения.
В последние годы взгляд на объем хирургического вмешательства при первичных операбельных опухолях изменился. Радикальная мастэктомия была стандартной процедурой, с тех пор как Холстед опубликовал первую серию своих работ в 1894 г. Его концепция удаления единым блоком первичной опухоли вместе с подмышечными лимфоузлами была признана во всем мире. Этот метод лечения преобладал в течение приблизительно 50 лет, несмотря па недостаточно высокие показатели эффективности.
В дальнейшем неудовлетворенность стандартной радикальной мастэктомией усиливалась, и в последние два десятилетия возросла тенденция к менее радикальным хирургическим вмешательствам.
В 1992 г. American Colleges of Surgeons, Radiologists and Pathologist вместе с ACS и Society of Surgical Oncology начали изучать методики органосохраняющего лечения рака молочной железы (РМЖ). Многие ретроспективные, а также проспективные рандомизированные исследования подтвердили одинаковую эффективность результатов лечения больных с ранним РМЖ с помощью мастэктомии или органосохраняющей операции.
Результаты обсуждений были опубликованы в 1998 г. В 6 современных проспективных рандомизированных исследованиях мастэктомия сравнивалась с органосохраняющим хирургическим вмешательством в комбинации с лучевой терапией (ЛТ) при раке молочной железы (РМЖ) I и II стадий. ЛТ молочной железы (45—50 Гр) применялась во всех 6 исследованиях с бустом на ложе первичной опухоли в 5 из них.
Обязательным условием для органосохраняющей операции и лучевой терапии (ЛТ) было отсутствие опухолевых клеток в краях резекции. На протяжении более 18 лет ни в одном из исследований не обнаружены значимые различия между общей и безрецидивной выживаемостью при двух типах лечения. В исследованиях Milan I и NSABP В-06 у больных с наличием метастазов в лимфоузлах после мастэктомии и XT выживаемость не улучшалась.
В 5 из 6 исследований не было значительных различий в частоте рецидивов в оперированной молочной железе или грудной стенке после мастэктомии. В исследовании NCI отмечен значительно более высокий уровень местного рецидивирования при органосохраняющей лечении, но для включения в исследование требовалась резекция видимой опухоли.
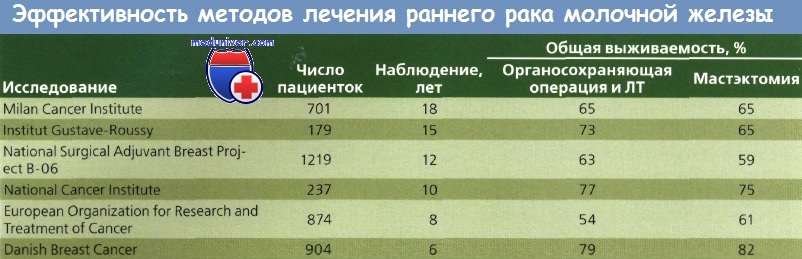
При метаанализе 7 из 9 проспективных рандомизированных исследований, сравнивавших органосохраняющее хирургическое вмешательство и ЛТ с мастэктомией, различий в выживаемости выявлено не было. Местное рецидивирование отмечено у 6,2 % больных после мастэктомии и у 5,9 % — после органосохраняющей операции. Различия в частоте рецидивов в противоположной молочной железе или вторичных злокачественных опухолей в оперированной железе не обнаружены.
Частота рецидивов в оперированной молочной железе после лечения колебалось от 3 до 19 %. В большинстве случаев при неэффективности органосохраняющего лечения может применяться мастэктомия, при этом 5-летняя выживаемость составляет 70 %. Мастэктомия не предотвращает местных рецидивов, частота которых может составлять 4 — 14 %.
Было проведено 6 рандомизированных исследований, сравнивавших органосохраняющее хирургическое вмешательство и такое же вмешательство в сочетании с ЛТ. Выбор терапии, объем хирургического вмешательства и ЛТ, использование адъювантной системной терапии в разных исследованиях варьировали. Несмотря на различия, общий коэффициент уменьшения частоты рецидивирования в молочной железе составил 84 % (диапазон 73—97 %) после лучевой терапии (ЛТ). Не удалось провести анализ подгруппы больных без эффекта от ЛТ.
Для оптимальной органосохраняющей операции на молочной железе необходим тщательный отбор больных, осуществляемый бригадой специалистов разного профиля. Выбор метода лечения должен основываться на данных анамнеза, физикального исследования, маммографии, гистологической оценке биоптата молочной железы и пожеланиях пациентки. Возраст (ни молодой, ни пожилой) не может быть противопоказанием к сохранению молочной железы. Втяжение кожи, соска или молочной железы может и не быть признаком локального прогрессирующего РМЖ и необязательно служит противопоказанием к сохранению молочной железы.
Для уточнения возможности проведения органосохраняющей операции необходимо предоперационное маммографическое исследование. Должно использоваться высококачественное, сертифицированное, специализированное маммографическое оборудование, определяющее объем поражения и возможное наличие нескольких очагов. Необходимо провести двустороннюю маммографию. При непальпируемых образованиях и микрокальцификатах органосохраняющие операции выполняются все чаще. Размер патологических очагов (по крайней мере, двух) должен быть указан.
Кожу молочной железы над опухолью нужно обследовать на предмет утолщения, по которому можно предположить поражение ее раком. Если есть микрокальци-фикаты, необходимо определить их протяженность в пределах или вне образования, описать их расположение и распределение, особенно если они — единственный признак опухоли.
Необходимо оценить различные патологические находки, которые могут быть факторами риска рецидива рака молочной железы (РМЖ). Инвазия в кровеносные или лимфатические сосуды, некроз опухоли и воспалительный инфильтрат повышают риск рецидивирования (10—15 % в течение 5 лет). У больных с метастазами в лимфоузлах нет повышенного риска рецидивирования РМЖ после органосохраняющей операции и ЛТ; однако у больных после мастэктомии число метастазов в лимфоузлах коррелирует с частотой рецидивирования опухоли в грудной стенке.
Более низкая частота рецидивирования при органосохраняющей операции и облучении может быть следствием комбинированного эффекта XT и тамоксифена. Крупный внутрипротоковый очаг может быть связан с высоким риском рецидивирования. Риск может быть увеличен при наличии значительной остаточной опухоли после удаления видимых очагов. Риск рецидивирования у этих больных уменьшается при отсутствии опухолевых клеток в краях резекции. По-видимому, крупный внутрипротоковый очаг служит показателем того, что заболевание более тяжелое, чем предполагалось до операции.
При наличии опухолевых клеток в краях резекции следует расширить объем операции. В случае повторного обнаружения опухолевых клеток наиболее целесообразно провести мастэктомию. Gage и соавт. показали различную частоту рецидивирования опухоли в течение 5 лет после резекции: 3 % при отсутствии опухолевых клеток в краях резекции, 9 % при наличии отдельных опухолевых клеток и 28 % при наличии опухолевых клеток по всей линии резекции.
Последние данные подтверждают, что системная терапия может уменьшить 5-летний уровень рецидивирования рака молочной железы (РМЖ) у пациенток с наличием опухолевых клеток в краях резекции. Состояние краев резекции — вероятно, самый важный аспект гистологической оценки операционного материала, если изначально планировалась орга-носохраняющая операция.
LCIS — это случайная находка (в противоположность DCIS); он считается маркером повышенного риска рака молочной железы (РМЖ) в будущем, но не служит показанием для расширения объема операции при наличии опухолевых клеток в краях резекции. Повышенный риск относится к обеим молочным железам и остается па протяжении жизни.

Очевидно, что есть как абсолютные, так и относительные противопоказания к органосохраняющим операциям и лучевой терапии (ЛТ). Беременность считается абсолютным противопоказанием к ЛТ. Альтернативой может быть послеродовая ЛТ, что зависит от срока беременности во время установления диагноза. Женщины с двумя или более первичными опухолями в разных квадрантах либо с диффузными характерными микрокальцификатами не рассматриваются как возможные кандидатки для органосохраняющего хирургического вмешательства. Наличие опухолевых клеток в краях резекции после расширения объема операции, а также предшествующая ЛТ молочной железы служат абсолютным противопоказанием к органосохраняющей операции.
Относительными противопоказаниями могут быть коллагенозы в анамнезе (склеродермия или системная красная волчанка), т. к. эти больные плохо переносят ЛТ. Ревматоидный артрит не считается противопоказанием. Размер опухоли не есть абсолютное противопоказание, хотя крупная опухоль в небольшой молочной железе, адекватная резекция которой может привести к косметическому дефекту, может быть относительным противопоказанием. Семейный РМЖ не влияет на выживаемость.
Тенденции проведения менее радикальных операций появились после введения метода удаления молочной железы и подмышечных лимфоузлов без грудных мышц. Было показано, что простая мастэктомия с последующей ЛТ приводит к таким же результатам выживаемости, как и радикальная мастэктомия. В настоящее время проходит много рандомизированных исследований, но ограничения этического и юридического характера затрудняют получение значительного количества данных. В большинстве исследований графики выживаемости сравнивались с исследованиями, основанными на радикальной мастэктомии по Холстеду.
Важно, что все менее травматичные процедуры приводят к подобным конечным результатам, но ни один не превзошел результаты, полученные при радикальной мастэктомии. Соответственно, многие сторонники радикальной мастэктомия по Холстеду будут продолжать применять этот метод до появления альтернативы, при которой 10-летняя выживаемость будет лучше.
В некоторых исследованиях продемонстрированы благоприятные результаты органосохраняющего лечения рака молочной железы (РМЖ), но не всем больным показан этот метод, заключающийся в минимальном хирургическом вмешательстве и послеоперационной ЛТ. Hellman описал 255 больных РМЖ I и II стадий, получающих такое лечение. У 97 % женщин с I стадией заболевания и 87 % — со II стадией проведена резекция опухоли. Частота выживаемости составила 93 % при I стадии и 84 % — при II.
После удаления опухоли проводили лучевую терапию (ЛТ) всей молочной железы (45—50 Гр), всего 23 сеанса в течение 5 нед., и дополнительное облучение области первичной опухоли (20—22 Гр) с использованием интерстициального 192Ir. Удаление опухоли рекомендуется при ее диаметре более 2 см. Послеоперационная ЛТ предположительно должна приводить к 80—85%-й частоте локального контроля со сравнимой выживаемостью.
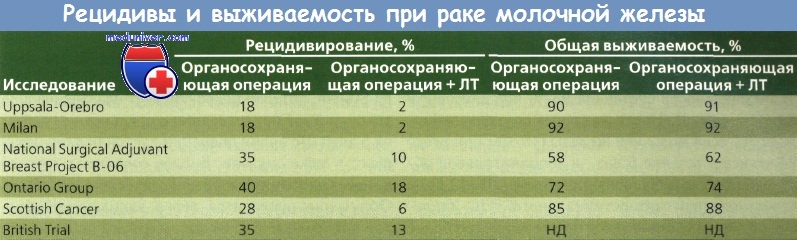
Montague описал 1073 пациентки с благоприятным результатом лечения рака молочной железы (РМЖ), получавших лечение в M.D. Anderson Hospital между 1955 и 1980 г. У 355 больных этой группы проведено органосохраняющее хирургическое вмешательство и ЛТ, а у 728 — только радикальная или модифицированная радикальная операция. Частота местного регионарного рецидивирования при органосохраняющей операции составила 4,9 %, после радикальной или модифицированной радикальной мастэктомии — 5,6 %. В целом значимых различий в уровне безрецидивной выживаемости в течение 10 лет в двух группах не обнаружено.
Хотя это исследование не было рандомизированным, его результаты согласуются с данными других исследований.
Lichter и соавт. из NCI сообщили о рандомизированном исследовании, проведенном в 1992 г., в котором мастэктомия сравнивалась с органосохраняющей операцией при РМЖ I и II стадий. 237 женщин были разделены на две группы: в одной проведена мастэктомия, в другой — эксцизионная биопсия опухоли и ЛТ. Всем женщинам в обеих группах выполнена полная подмышечная лимфодиссекция; больные с метастазами в лимфоузлах в обеих группах дополнительно получали циклофосфамид и доксорубицин каждые 28 дней в течение 1 года и тамоксифен 40 мг/сут в течение 5 лет.
Общая и безрецидивная выживаемость при двух видах лечения значительно не отличались. Авторы также суммировали результаты 6 крупных проспективных рандомизированных исследований с участием более 3800 пациенток, в которых сравнивали мастэктомию и лампэктомию в комбинации с ЛТ при лечении РМЖ I и II стадий. В результате этих исследований были сделаны такие же выводы в отношении безрецидивной выживаемости. Таким образом, врачи могут теперь смело рекомендовать лампэктомию в сочетании с ЛТ больным РМЖ I и II стадий, т. к. этот метод лечения оказался эквивалентным мастэктомии по выживаемости и оптимальному локальному и регионарному контролю.
В мае 2002 г. Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) одобрило MammoSite Radiation Therapy System, которая подразумевает назначение внутриполостной брахитерапии в предписанных дозах на 5 дней. Во время операции пустой баллон помещают в ложе опухоли. Баллон соединен с трубкой и может наполняться физиологическим раствором. Облучение проводится через наполненный баллон в течение 1—5 дней, затем баллон опорожняют и извлекают. Время ЛТ сократилось с традиционных 6 нед. до 5 дней. Эта технология находится в стадии разработки, и критерии включения больных для этого метода ЛТ пока изучаются.
Каждый пациент на приёме у врача больше всего боится, что у него заподозрят или, что хуже, найдут новообразование. Однако мало кто знает о механизме развития опухоли и за счет чего конкретно данный диагноз является настолько страшным. В этой статье мы разберёмся, что именно делает онкологические заболевания такими опасными для жизни.
- Строение тканей с точки зрения формирования опухолевого процесса
- Доброкачественные и злокачественные опухоли: в чем разница?
- Что такое инвазия опухоли?
- Факторы, определяющие степень инвазивности опухоли
- Инвазия раковых клеток в сосуды
- Циркуляция раковых клеток в системе кровотока и экстравазация
- Резюме
Строение тканей с точки зрения формирования опухолевого процесса
Чтобы разобраться в механизме образования и развития опухоли, необходимо иметь представление о принципе строения тканей в организме. Большинство тканей, независимо от места их расположения, имеют сходный план строения:
- Базальная мембрана — это неклеточная структура, отграничивающая ткани друг от друга;
- Ростковый слой — группа активно делящихся клеток, расположенных на базальной мембране, которые обеспечивают обновление ткани. Именно изменение генетического материала клеток росткового слоя влечёт за собой развития опухоли;
- Слой созревающих клеток — клетки ростового слоя, которые постепенно продвигаются в верхние слои в процессе дифференцировки (приобретения формы и свойств, характерных для данной ткани);
- Поверхностный слой — группа клеток, которая и обеспечивает выполнение тканью определённой функции.
Между ростковым и поверхностным могут располагаться дополнительные слои в зависимости от конкретного вида ткани. Но принцип строения всегда один и тот же: клетки, способные делиться, находятся на базальной мембране. В процессе созревания они перемещаются в верхние слои, утрачивая способность к делению и приобретая специфические свойства.
Доброкачественные и злокачественные опухоли: в чем разница?
Исходя из того, клетки какого слоя подверглись мутации, выделяют два типа неоплазий — доброкачественные и злокачественные. Их отличия заключаются в том, что первый тип формируется из высоко дифференцированных клеток созревающего слоя. При доброкачественных опухолях клетки не будут сильно отличаться от здоровых клеток данной ткани. Такая неоплазия считается неагрессивной и растет медленно, а также не даёт метастазы. Патогенное действие доброкачественного новообразования заключается главным образом в сдавлении окружающих её тканей. Иногда такие опухоли полностью или частично закрывают просвет какого-либо полого органа.
В процессе развития рака выделяют 4 стадии:

Что такое инвазия опухоли?
Инвазия обуславливает способность опухолей давать метастазы — вторичные очаги онкологического процесса вдали от материнской опухоли, возникшие из-за миграции раковых клеток. Обязательное условие метастазирования — наличие у опухоли собственной капиллярной сети. Она формируется, когда количество неопластических клеток достигает 103 (1-2 мм).
- Разрыв межклеточных связей, соединяющих раковые клетки между собой;
- Прикрепление клеток опухоли к базальной мембране;
- Разрушение базальной мембраны лизирующими (расщепляющими) ферментами;
- Миграция клеток в соседние ткани и органы.
Раковые клетки, находящиеся в процессе инвазии, более устойчивы к облучению и химеотерапии, чем стационарные. Во многом это связано с временной утратой мигрирующими клетками способности к делению. Также движущиеся опухолевые клетки проявляют повышенную активность антиапоптотических генов (гены, препятствующие запрограммированной смерти клетки — апоптозу). И, поскольку химиотерапевтические препараты направлены на стимуляцию апопоза, их устойчивость к лечению возрастает.
Факторы, определяющие степень инвазивности опухоли
Чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие следующих факторов:
- Быстрое деление и давление. Механическое воздействие опухолевой массы на базальную мембрану способствует её разрушению и, как следствие, инвазии раковых клеток;
- Подвижность клеток. Клетки новообразования способны к миграции, причем их движение не является хаотичным. Они движутся в направлении большей концентрации кислорода, питательных веществ, а также в сторону более нейтрального показателя кислотности (рН);
- Межклеточные связи. Чем прочнее эти контакты, тем меньше шансов, что опухоль начнет инвазивный рост. У злокачественных клеток связи слабые, поэтому клетки легко отрываются от новообразования и попадают в кровоток или в лимфатическую систему;
- Действие лизосомальных ферментов. Злокачественная опухоль вырабатывает вещества, способные разрушать здоровые клетки и межклеточное вещество, что будет способствовать инвазии;
- Иммунная система человека. В организме существует собственная противоопухолевая защита, которую обеспечивает наш иммунитет. Её активность у каждого человека индивидуальна. Она зависит от генетической предрасположенности и состояния всего организма в конкретный момент. Так, при заболеваниях, сопровождающихся угнетением иммунной системы (например, при ВИЧ), пациенты могут погибать от онкологических заболеваний, возникших из-за отсутствия противоопухолевой активности.
Инвазия раковых клеток в сосуды
Вслед за прорастанием в базальную мембрану наступает интравазальная (внутрисосудистая) инвазия опухоли. Чаще раковые клетки мигрируют в артерии. Это связано с тем, что стенки артерий более упругие и эластичные, в то время как у вен они тонкие и легко спадаются в опухолях. Однако раковые клетки могут быть занесены в вены из лимфатических сосудов.
Циркуляция раковых клеток в системе кровотока и экстравазация
Экстарвазация представляет собой выход опухолевых клеток из сосудов для формирования метастатического очага. В этом процессе задействованы те же ферменты, что и в инвазии через базальную мембрану.
Резюме
Вот что следует знать об инвазии опухолей:
- Инвазия — это проникновение раковых клеток через базальную мембрану ткани, из которой развилась опухоль;
- Инвазия свойственна только злокачественным новообразованиям;
- В инвазии участвуют лизирующие ферменты, которые способны разрушать как неклеточные структуры, так и связи между здоровыми клетками (например, выстилка сосудов);
- Явление инвазии лежит в основе метастазирования;
- Инвазия бывает индивидуальной и групповой, и последняя чаще обуславливает появление метастазов,
- Самые распространенные виды инвазивных опухолей — рак шейки матки и рак молочной железы.
Читайте также:

