Лимфомы желудка эндоскопическая картина
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%). Лимфомы толстой кишки наблюдаются в 5–10% случаев. Самыми редкими признаны первичные неходжкинские лимфомы пищевода [1].
В 1983 году Brooks и Enterline [2] провели клинико-морфологическое исследование, где показали, что нодальные и экстранодальные лимфомы отличаются по биологическим свойствам и что экстранодальные варианты лимфомы имеют более благоприятный прогноз.
Brooks и Enterline впервые отметили патогенетическую связь между хроническим воспалением слизистой оболочки желудка и развитием лимфомы. Было высказано предположение, что многие типы лимфом желудка представляют собой злокачественную трансформацию доброкачественных и длительно текущих лимфоцитарных поражений желудка. Авторы пришли к тому заключению, что длительная антигенная стимуляция вместе с аутоиммунным феноменом в клетках слизистой оболочки желудка в целом приводят к появлению злокачественного клона. Эта гипотеза была подтверждена результатами клинико-морфологических исследований, проведенных при лимфомах слюнной и щитовидной желез. Было показано, что лимфомы этих желез могут возникнуть на фоне хронического тиреоидита и сиалоаденита с синдромом Шегрена или без него.
P. Isaacson и D. H. Wright [3] обратили внимание на то, что большая часть первичных лимфом желудка развивается на фоне хронических гастритов. Более того, было показано, что другие варианты экстранодальных лимфом также связаны с хроническими воспалительными процессами. Доказано, что Нelicobacter pylori — грамотрицательная спиралевидная бактерия, впервые выделенная из гастробиоптата австралийскими исследователями Warren и Marschall в 1983 году, является причиной подавляющего большинства случаев хронических гастритов. Она приводит к возникновению язвенной болезни желудка, 12-перстной кишки, является одним из факторов риска аденокарциномы желудка.
Показано, что при эрадикации этого микроорганизма симптомы хронического воспаления становятся менее интенсивными и снижается степень лимфоцитарной инфильтрации. В 1993 году были представлены доказательства, что Н. pylori играет важную роль в возникновении подгруппы лимфом желудка MALT-типа [4]. Рядом авторов [5] было высказано мнение, что Н. pylori вызывает нарушение физиологических и иммунологических процессов, окислительное повреждение ДНК и пролиферацию как гемапоэтических, так и клеток слизистой оболочки желудка. В дальнейшем было установлено, что 90% больных MALT-лимфомой инфицированы Н. pylori [6, 7, 8]. Было показано также, что Н. pylori непосредственно и посредством цитотокина вызывает пролиферацию Т-клеток и макрофагов, что сопряжено с высвобождением цитокинов (интерлейкина-2 и интерлейкина-6). Последние, в свою очередь, вызывают пролиферацию В-клеток, способствуют развитию лимфоидных фолликулов и агрегатов лимфоцитов в толще слизистой оболочки желудка [9].
Материалы и методы исследования
Эндоскопическая картина лимфом желудка изучена нами у 250 пациентов, при этом поражение у 160 (64%) больных расценено как первичное, а у 90 (36%) — как вторичное, наблюдаемых в РОНЦ с 1995 года, из которых было 99 пациентов с MALT-лимфомой желудка. Разработаны эндоскопические и эндосонографические критерии диагноза MALT-лимфомы, ее дифференциально-диагностические признаки, проведена оценка лекарственной терапии.
Результаты и их обсуждение
При тщательном анализе развития болезни нами установлено, что в группе с первичными лимфомами желудка практически одна треть (32%) пациентов имели гастроэнтерологический анамнез: язвенную болезнь желудка, хронический атрофический, гипертрофический или смешанные гастриты, зачастую ассоциированные с инфекцией H. pylori.
Согласно нашим наблюдениям длительность существования гастроэнтерологической патологии до установления наличия опухоли в группе с первичной лимфомой желудка весьма вариабельна: в течение первых трех месяцев диагноз установлен у 30,6% (49 больных), в течение 6 месяцев у 18,1% (29 больных), в срок от 6 до 12 месяцев у 15,6% (25 больных). Отдельно следует отметить, что практически у трети пациентов (27,5% — 44 пациента) диагноз первичной лимфомы желудка был установлен спустя год (табл. 1).
Также отдельно необходимо отметить, что диагноз первичной лимфомы желудка у 8% пациентов выявлен при плановом обследовании по поводу сопутствующей патологии и оказался диагностической находкой, так как заболевание у части больных протекало бессимптомно.
В группе пациентов со вторичным поражением желудка от момента установления диагноза первичной локализации процесса до времени выявления поражения желудка сроки были различны и представлены в табл. 2.
Как видно из представленных в таблице данных, поражение желудка в большинстве случаев развилось в первые два года от начала заболевания, что диктует нам необходимость обязательных периодических эндоскопических исследований желудка с целью своевременного выявления метастатического поражения его при лимфомах.
В нашей работе чаще всего при лимфомах желудка имело место инфильтративно-язвенное и инфильтративное его поражение — 28,4% и 21,6% соответственно, затем в 14,8% встречается язвенная форма роста опухоли. Гастритоподобный вариант опухоли отмечен в 14,4%. Реже встречались смешанная и экзофитная формы роста опухоли — 12,0% и 8,8% соответственно.
Причем, как показывает анализ наших данных, при MALT-лимфоме преобладала гастритоподобная форма роста, которая составила 34,3%.
Эндоскопическая картина гастритоподобной формы лимфомы желудка является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
Естественно, такое деление является относительно условным, и эти формы выделяются нами по преобладанию наиболее выраженных указанных признаков, симулирующих ту или иную форму гастрита (табл. 3).
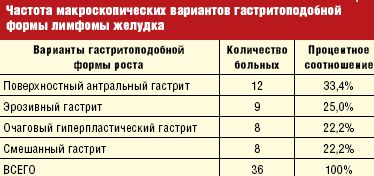
Анализируя полученные данные, чаще всего, в 33,4%, отмечался поверхностный антральный гастрит, вторым по частоте стал эрозивный гастрит — 25,0%, с одинаковой частотой в 22,2% встречается очаговый гиперпластический гастрит и смешанный гастрит.
При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка, которые отмечены нами в 33,4%. При сохраненной эластичности стенок желудка отмечается пастозность, разрыхленность и очаговая гиперемия слизистой антрального отдела желудка, чередующаяся с участками белесоватого цвета, ее повышенная контактная кровоточивость. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность слизистой оболочки снижена, отмечается ее фрагментация.
Изменения при лимфоме желудка в виде эрозивного гастрита отмечаются в 25,0% случаев и характеризуются наличием множественных поверхностный острых эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной слизистой с усиленным сосудистым рисунком. Участки эрозий могут локализоваться в различных отделах желудка, чередуясь с неизмененной слизистой, либо занимать изолированную, ограниченную зону. Эластичность стенок остается, как правило, сохраненной или снижена незначительно.
Лимфома желудка в виде локального гиперпластического гастрита. Этот тип лимфомы отмечается в 22,2% случаев и характеризуется умеренным неравномерным утолщением складок на ограниченном участке чаще по большой кривизне и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Эластичность стенки сохранена, подвижность складок может быть сохраненной или сниженной. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки слизистой пораженного участка, как правило, не расправляются полностью.
В нашем исследовании инфицирование H. pylori было выявлено практически у всех больных при мелкоклеточном варианте и составило 96,7%, при промежуточном варианте MALT-лимфомы желудка — 90%, в отличие от смешанно-клеточных MALT-лимфом, при которых частота инфицирования составила только 53,8%.
При выявлении инфицирования H. pylori мы также определяли степень обсемененности. Оказалось, что при мелкоклеточных MALT-лимфомах высокая частота инфицирования сочетается с выраженной степенью обсемененности чаще (75,9%), чем при других подвариантах. Так, у больных с промежуточным вариантом наличие H. pylori-инфекции сопровождается выраженной степенью обсемененности достоверно реже и выявлено в 38,9%, при смешанных MALT-лифмомах выраженная степень обсемененности установлена у 57,1% пациентов.
Умеренная степень обсемененности при мелкоклеточных опухолях выявлена у 20,7%, при промежуточном варианте чаще — у 61,1%, а при смешанной MALT-лимфоме — у 14,3%.
Слабая степень обсемененности H. pylori встречается у больных MALT-лимфомой желудка крайне редко, она была определена лишь у трех пациентов.
Терапия больных первичной MALT-лимфомой представляет ряд особенностей. Это обусловлено тем, что в мировой практике накоплен относительно небольшой опыт использования всех видов лечебного воздействия — антихеликобактерной терапии, химиотерапии, лучевой терапии, хирургического лечения и их сочетаний.
Антихеликобактерная терапия использовалась нами только при I стадии (классификация Lugano, 1993) MALT-лимфомы желудка мелкоклеточного строения. Лечение проводилось в соответствии с рекомендациями Международного протокола LY03 по изучению MALT-лимфом желудка низкой степени злокачественности [10]. Нами применялась трехкомпонентная схема первой линии эрадикационной терапии, включающая одновременное применение в течение 10–14 дней следующих препаратов:
В результате проведенного лечения у 14 пациентов (87,5%) из 16 больных была достигнута полная ремиссия, у 2 больных (12,5%) констатирована стабилизация заболевания.
Терапевтический эффект антибиотикотерапии реализовался постепенно. Нами установлена последовательность исчезновения проявлений болезни. Первыми ликвидировались клинические симптомы: боль, изжога, тошнота, желудочный дискомфорт.
Вслед за эрадикацией H. pylori постепенно уменьшались визуальные эндоскопические проявления опухолевого поражения: сокращались размеры опухолевого поражения, подслизистой инфильтрации, уменьшался калибр складок слизистой, происходило рубцевание специфических язвенных дефектов, затем восстанавливалась нормальная архитектоника слизистой, исчезала деформация стенок желудка.
Необходимо акцентировать внимание на том, что сроки наступления полного терапевтического эффекта весьма вариабельны. Полная ремиссия, подтвержденная гистологическим и иммунологическим исследованием гастробиоптатов, была диагностирована у больных, получавших антихеликобактерное лечение, в сроки от 2 до 10 месяцев (медиана 5,5 месяцев).
Это означает, что лечение мелкоклеточных MALT-лимфом с применением антихеликобактерных препаратов — это терапия, осуществленная всего за 10–14 дней, но требующая в последующем взвешенного динамического наблюдения и корректной оценки происходящих изменений. Темп наступления полного клинического благополучия является косвенным признаком прогнозирования терапевтического эффекта.
Из 14 больных с подтвержденной полной ремиссией вследствие антихеликобактерной терапии только у одной больной в возрасте 51 год был констатирован рецидив заболевания при контрольном обследовании через 7 месяцев после окончания лечения без каких-либо клинических проявлений. Трактовка эндоскопической картины была сложной: осуществлялась дифференциальная диагностика между эрозивным гастритом и минимальными проявлениями лимфомы. Рецидив был подтвержден иммуноморфологическими исследованиями. В последующем больная получала последовательное лечение Лейкераном (хлорамбуцил), COP с эффектом, который расценен нами как стабилизация заболевания. Учитывая клиническое благополучие, а также наличие тяжелой сопутствующей патологии, было решено хирургическое лечение не применять, а больную оставить под динамическим наблюдением. В течение последующих 36 месяцев больной проводится регулярное обследование (каждые 4–5 месяцев). За этот период наблюдения прогрессирования заболевания не наступило по настоящее время.
Это наблюдение демонстрирует особое свойство мелкоклеточной MALT-лимфомы. Сочетание клинического благополучия с объективными данными стабилизации позволяет длительно наблюдать за больными на фоне проведения регулярного полноценного обследования.
Таким образом, антихеликобактерная терапия правомочна и эффективна при первичных MALT-лимфомах желудка, но при обязательном строгом соблюдении показаний к ее использованию — I стадия процесса с небольшим локализованным поражением слизистого и подслизистого слоев при H. pylori-позитивных опухолях. Обязательным является динамическое исследование опухолевого субстрата на наличие H. pylori, эрадикация которого необходима для реализации противоопухолевого эффекта. Отсутствие эрадикации H. pylori требует использования химиотерапии с повторными курсами антибиотикотерапии.
- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Предстоящие мероприятия
- Прошедшие мероприятия
- Фотоотчеты
- Информация
- С чего начать
- Новости
- Последние публикации
- Приказы
- СОП
- Протоколы
- Клинические рекомендации
- Клинические случаи
- Статьи
- Видео
- Вопрос-ответ
- Опросы
- Все для работы
- Вакансии и работадатели
- Обучение
- Классификации
- Азбука Эндоскописту
- Академия EndoExpert.ru
- Атлас Эндоскопии
- Викторина EndoQuizTime
- Тесты, клинические задачи
- Вебинары
- НМО, Аккредитация
- Проект StandUp
- Проект EndoEnglish
- Проект Liversurgery.ru
- Дайджест
- О Дайджесте EndoExpert.ru
- Новый номер
- Подписка на Журнал EndoExpert.ru
- Архив журнала
- QuaCol
- О проекте
- Образовательные модули
- Брошюра с материалами
- Видеозаписи лекций
- МОВИПРЕП
- Разделы
- Атлас
- Пациенту
- О Эндоскопии
- О Гастроэнтерологии
- Подготовка к колоноскопии
- Подготовка к гастроскопии
- Подготовка к исследованию
- Полезные статьи
- Найти врача
- Записаться на операцию
- Анализы перед операцией
- Задать вопрос
- Записаться на прием
Просмотренные публикации









QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Случайный выбор
данная функция, случайным образом выбирает информацию для Вашего изучения,
запустите выбор нажав кнопку ниже

Случайный выбор
Обратная связь
Напишите нам
| Авторы: | Агапов М.Ю. 2002г. |
Эпидемиология
Лимфома составляет 1-5 % всех злокачественных заболеваний желудка [3] . Однако заболеваемость этой патологией растет, так в США она за период с 1973 по 1989 годы она возросла на 60 % [1] . На основе анализа 94 случаев первичной лимфомы желудка Amer E.M. и el-Akkad S. сообщали, что средний возраст больных с этой патологией составлял 54,5 лет, а 10 летная выживаемость составила 53 % [2] .
Этиология
Буквально два слова по этиологии. Большинство лимфом исходит из лимфоидной ткани ассоциированной со слизистой оболочкой, что и отражено в их названии MALT-омы (mucosa-associated lymphoid tissue). В настоящее время основную роль в развитии MALT-омы отводят НР инфекции. В норме лимфоидные фоликулы в слизистой желудка отсутствуют. Появление их обусловлено хроническим гастритом вызываемым НР. Существует множество доказательств этой теории. Эпидемиологические исследования выявили НР инфекцию у 90 % - 100 % пациентов с данным заболеванием [1, 14] . В районах с высокой частотой встречаемости данного типа лимфом высока и встречаемость НР и наоборот. Лабораторные исследования так же продемонстрировали способность НР к индукции MALT-омы, было показано, что пролиферация опухолевых В-лимфоцитов наступает только в присутствии сенсибилизированных НР Т-лимфоцитов [4] . Наконец их регрессия в ответ на эррадикационную терапию еще более подтверждает данную теорию. Причины возникновения лимфомы в ответ на НР инфекцию у одних пациентов и отсутствие ее у других видимо заключаются в индивидуальных характеристиках генетической и иммунной систему хозяина, факторах окружающей среды и степени вирулентности различных штаммов НР.
Что касается В клеточных лимфом высокой степени злокачественности, то существует предположение об их образовании в результате прогрессии MALT-ом, одним из доказательств чего является одновременное выявления этих двух видов у одного пациента.
Диагностика
Клиническая картина заболевания достаточно не специфична, более того, у пациента может не наблюдаться вообще ни каких симптомов. Считается, что для первичной лимфомы желудка характерен болевой синдром в эпигастрии и рвота. В некоторых случаях появление болей на 3 года предшествовала точной диагностике [9] . Так же может присутствовать анемия и потеря веса.
Важна дифференциальная диагностика между первичной и вторичной лимфомами желудка (т.к. тактика их ведения и прогноз совершенно разные). Было проведено исследование ставящее задачу обнаружить эндоскопические признаки позволяющие дифференцировать эти два вида лимфом. Было выявлено, что для первичной лимфомы характерен более крупный (более 5 см) опухолевый очаг и унифокальный рост в теле или антральном отделе, тогда как для вторичной лимфомы было характерна локализация процесса в дне желудка [5] .
Для морфологической верификации диагноза необходима множественная биопсия (возможно даже петлевая биопсия) из различных отделов желудка. Прекрасное описание особенностей морфологической картины при MALT-омах дается в доступной монографии "Морфологическая диагностика болезней желудка и кишечника" [1] и мы не будем останавливаться на этом вопросе.
Необходимо помнить, что при подозрении на лимфому надо обязательно проводить уреазный тест с множественными биопатами из различных отделов желудка т.к. выявление НР значительно влияет на дальнейшую тактику. При отрицательном результате эндоскопического тестирования необходим серологический тест.
В установлении стадии процесса важнейшую роль играет эндоскопическое УЗИ. Лимфома выглядит как диффузная гипоэхогенное образование. Например выявление такой картины под обнаруженным эндоскопически изъязвлением значительно облегчает диагностику. Разработана классификация лимфом по глубине поражения согласно данным этого метода [6] .
- Т1а - поверхностный слой слизистой: в пределах первого (гиперэхогенного) слоя.
- Т1b - глубокие слои слизистой: в пределах второго (гипоэхогенного) слоя.
- Т2 - подслизистый слой: в пределах третьего (гиперэхогенного) слоя.
- Т3 - выходит за пределы подслизистого слоя: включает четвертый слой (мышечный) и пятый (сероза).
Определенную роль в диагностике распространенности лимфомы играет МРТ и КТ. Как будет сказано ниже, глубина инвазии играет определяющую роль в выборе метода лечения.
Лечение
Основой лечения ограниченных слизистой и подслизистым слоем (стадия EI1) MALT-ом является эррадикационная терапия. Множество исследований подтвердило полную регрессию опухолей при таком подходе в 50-100 % случаев [11] . Назначается стандартный тип терапии эффективность которого проверяется через 1-2 месяца, при отсутствии эррадикации необходимы повторные курсы (конечно с использованием других схем). Некоторые авторы достигали 100 % результата после терапии первой линии [8] , некоторые добивались эррадикации в 79,2 % после первого, 12,5 % после второго и 6, 2 % после третьего курсов, у одного из 48 пациентов (2, 1 %) эррадикации достигнуто не было [7] . Интересно отметить, что в последнем исследовании полная ремиссия лимфомы через 6 месяцев была достигнута у 28 пациентов, частичная у 5 и отсутствие результата у 15 больных .
Что касается скорости регрессии опухоли поле такого лечения то немецкие исследователи на основе результатов, полученных от 120 больных через 48 месяцев получили полную ремиссию в 81 % наблюдений, частичную в 9 % и отсутствие ответа в 10 % случаев [11] . Т.е. надо помнить, что процесс регрессии достаточно долог. Для отслеживания этого процесса рекомендуется выполнять эндоскопическое исследование и биопсию каждые 6 месяцев.
MALT-омы высокой степени злокачественность или с инвазией глубже подслизистого слоя или с неэффективной эррадикацией или без ответа на нее должны лечиться с помощью радиационной или химиотерапии или хирургически. Применяется и комбинированная терапия. Но это удел онкологов и хирургов.











Роль новейших технологий в эндоскопической диагностике лимфом желудка
- " onclick="window.open(this.href,'win2','status=no,toolbar=no,scrollbars=yes,titlebar=no,menubar=no,resizable=yes,width=640,height=480,directories=no,location=no'); return false;" rel="nofollow"> Печать
Роль новейших технологий в эндоскопической диагностике и оценке эффективности лечения лимфом желудка
О.А.Малихова, Б.К.Поддубный, Ю.П.Кувшинов, И.П.Фролова
ГУ Российский Онкологический Научный Центр им. Н.Н.Блохина РАМН
Проблема своевременной диагностики лимфом желудка до настоящего времени остается одной из наиболее актуальных в современной онкологии. Желудочно-кишечный тракт (ЖКТ) является наиболее частой экстранодальной локализацией неходжкинских лимфом (НХЛ).
С наибольшей частотой поражается желудок (50–75%), менее часто – тонкая кишка (20–35%). Наиболее редко опухоли возникают в толстой кишке [6].
Ведущая роль в диагностике патологических изменений в желудке принадлежит эндоскопическому методу, который позволяет произвести их визуальную оценку, определить распространенность поражения, получить материал для морфологического и иммунологического исследований.
Постоянное техническое совершенствование эндоскопической аппаратуры позволяет надеяться, что существенный вклад в разрешение данной проблемы может внести внедрение в повседневную практику новых уточняющих методик прижизненной окраски, эндоскопической резекции слизистой оболочки, эндоскопии с увеличением, эндосонографического исследования желудка [1–4].
При эндоскопическом исследовании с применением современных методик остаются значительными трудности в диагностике и дифференциации лимфом желудка, обусловленные как значительным полиморфизмом макроскопических проявлений опухоли в желудке, так и редкостью подобных пациентов в общелечебной сети.
Изучение макроскопических форм поражения органов пищеварительного тракта при лимфомах имеет большое значение, так как данные визуального проявления заболевания положены в основу его эндоскопической диагностики, а также для последующего выявления достоверных дифференциально-диагностических критериев, позволяющих установить правильный диагноз [5].
Начало 40-летнего опыта диагностики лимфом в РОНЦ им. Н.Н.Блохина РАМН датируется 1965 г., когда было основано отделение гематологии центра. С 1976 г. благодаря открытию отделения эндоскопии стала возможной эндоскопическая диагностика данной патологии.
Среди всех пациентов РОНЦ им. Н.Н.Блохина РАМН с лимфопролиферативным поражением при эндоскопическом исследовании верхних отделов ЖКТ был обнаружен 501 случай лимфом желудка.
На основании многолетнего опыта нами разработана эндоскопическая классификация, систематизирующая все многообразие визуальных макроскопических проявлений лимфом желудка.
Эндоскопическая классификация лимфом желудка
1. Экзофитная
– бляшковидная
– полиповидная
– узловая
2. Инфильтративная
– плоско-инфильтративная
– бугристо-инфильтративная
– гигантоскладочная
– инфильтративно-язвенная
3. Гастритоподобная
4. Язвенная
5. Смешанная
Представленная классификация, не являясь, конечно, бесспорной, вполне оправдывает себя на практике, хотя может показаться излишне детализированной. Однако в оправдание такой детализации можно представить естественное стремление отразить все многообразие макроскопических вариантов, на знании которых и базируется дифференциальная диагностика этой патологии.
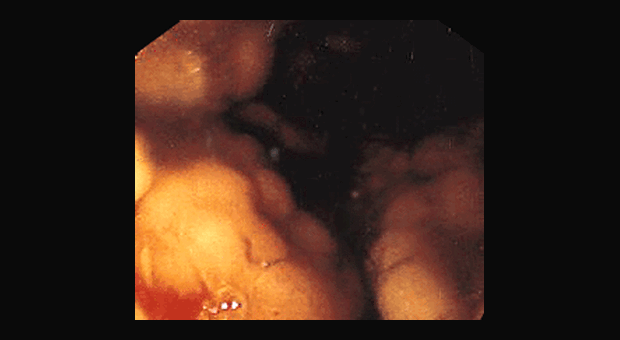
Наиболее распространенные формы лимфом желудка представлены на эндофотографиях (рис. 1–9).
Особенностью макроскопической характеристики лимфом желудка является полиморфизм и часто встречающаяся множественность ее проявлений. Одновременное наличие в различных отделах желудка и сочетание нескольких макроскопических форм является дифференциально-диагностическим критерием отличия лимфом от другой опухолевой патологии. Так, множественные (2–3 язвенных дефекта) язвенные изменения могут определяться наряду с наличием полиповидных, узловых образований и участков опухолевой инфильтрации стенок желудка.
Вследствие распространения опухоли в желудке при лимфопролиферативном процессе, преимущественно по подслизистому слою, результаты морфологического исследования материала нередко оказываются неудовлетворительными. По данным морфологического исследования материала, взятого в процессе эндоскопического исследования, традиционным методом щипцовой биопсии, верификацию диагноза лимфомы желудка удается достичь только в 65–75%, что также подтверждают результаты нашей работы [7].
В связи с этим большое значение должно придаваться методам забора биопсийного материала, которые повышают результаты морфологической верификации лимфом желудка до 100%. Хочется подчеркнуть всю важность и необходимость множественного забора материала различными методиками. К наиболее результативным методам следует отнести ступенчатую биопсию, эндоскопическую резекцию слизистой желудка.
Эндоскопическая резекция слизистой оболочки желудка является самой современной, наиболее эффективной, безопасной и информативной методикой диагностики лимфопролиферативного поражения, так как позволяет удалить участок опухолевой ткани с подслизистым слоем, что обеспечивает достоверную морфологическую диагностику полученного фрагмента ткани, облегчает проведение дифференциальной диагностики между лимфомой, раком и другими неопухолевыми поражениями желудка.
С учетом полиморфизма эндоскопической картины лимфом желудка, в случаях затруднений постановки диагноза лимфомы, дифференциации его с другими заболеваниями в настоящее время необходимо в повседневной практике более широко использовать уточняющие методы эндоскопической диагностики, такие как:
1) хромогастроскопия,
2) эндоскопия с увеличением,
3) эндосонография,
4) эндоскопическая резекция слизистой оболочки желудка.
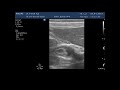
Хромогастроскопия
При лимфомах желудка метод прижизненной окраски слизистой оболочки помогает определить четкие границы опухоли, а в сочетании с увеличительной эндоскопией нарушение типичной структуры слизистой оболочки (рис. 10, 11). При лимфопролиферативном поражении желудка слизистая оболочка длительное время остается неизмененной, поэтому целесообразно применять только контрастные красители, такие как раствор индигокармина в концентрации 0,1–0,4%, который подчеркивает границы желудочных полей, тем самым выявляя неправильность архитектоники слизистой оболочки при ее инфильтрации [3].
Увеличительная эндоскопия
Метод увеличительной эндоскопии позволяет визуализировать слизистую оболочку желудка, увеличенную в 115 раз [2]. Эндоскопическое исследование с применением увеличительной функции проводится с использованием видеосистемы фирмы OLYMPUS Evis-160 и гастроскопа GFQ 160Z. При лимфомах желудка хромогастроскопия с последующим применением метода увеличительной эндоскопии позволяет более четко определить границы опухолевого поражения, характерные для лимфопролиферативного заболевания изменения архитектоники слизистой оболочки. Увеличительная эндоскопия при лимфопролиферативном процессе в желудке визуализирует расширение границ желудочных полей, инфильтрированные участки слизистой оболочки, выступающие над уровнем неизмененной слизистой оболочки желудка (см. рис. 11). Даже при наличии язвенных дефектов архитектоника слизистой оболочки остается интактной, прослеживается вплоть до краев и соответствует тем типам ямок, которые встречаются в разных отделах желудка. Так же увеличительная эндоскопия визуализирует специфический характер сосудистого рисунка при лимфопролиферативном процессе.
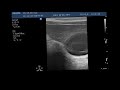
Эндоскопическое ультразвуковое исследование желудка
В основу работы положен опыт применения ультразвукового исследования желудка у 29 пациентов с предположительным диагнозом лимфомы: из них в 11 случаях эндосонография выполнена зондовой методикой с частотой сканирования 12,5 Мгц и у 18 больных – с помощью эхоэндоскопа фирмы OLYMPUS GF-UM 160 с переменной частотой сканирования от 5 до 20Мгц.
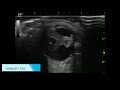
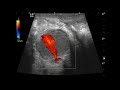
Лимфома желудка при эндосонографическом исследовании отображается в виде гипоэхогенного образования, исходящего из подслизистого слоя. При этом определяется нарушение дифференцировки слоев стенки желудка, утолщение подслизистого слоя (рис. 12). Этот факт подтверждает, что опухолевая инфильтрация при лимфопролиферативном заболевании желудка преимущественно распространяется по подслизистому слою.
Метастатически пораженные парагастральные лимфатические узлы имеют следующие эндосонографические характеристики: овальную форму, четкие ровные контуры, гипоэхогенную структуру, увеличенные размеры (более 8 мм в диаметре) [1, 4] (рис. 13).
Эндосонографическое исследование желудка позволяет проводить дифференциальную диагностику между воспалительными изменениями и лимфомой и другой опухолевой патологией, такой как рак, лейомиома, лейомиосаркома.
При наличии воспалительных изменений стенка желудка остается равномерно 5-слойной, дифференцировка слоев не нарушена, во всех отделах имеется утолщение только слизистого, а в отдельных случаях и подслизистого слоев.
Так, при инвазивных формах рака верхних отделов ЖКТ при эндоскопическом ультразвуковом исследовании в зоне опухолевых изменений определяется гипоэхогенное образование, исходящее из слизистого слоя и распространяющееся на глубокие слои стенки желудка в зависимости от стадии процесса.
При лейомиоме визуализируется гипоэхогенное образование, зачастую исходящее из мышечного слоя, реже – из мышечной пластинки слизистой оболочки овальной формы с четкими ровными контурами. Поражение региональных лимфатических узлов при данной патологии не определяется. Однако в случае лейомиосаркомы опухоль имеет неправильную форму, неровные и нечеткие контуры, определяются метастатически измененные лимфатические узлы.
Таким образом, эндосонография желудка позволяет своевременно установить диагноз лимфомы, провести дифференциальную диагностику между воспалительными и опухолевыми изменениями, оценить глубину инвазии, точно произвести оценку протяженности, определить границы опухолевого поражения и, что очень важно, состояние парагастральных лимфатических узлов. Таким образом, эндоскопическое ультразвуковое исследование желудка при диагностике лимфом позволяет проводить Т- и N-стадирование опухолевого процесса.
Также с помощью эндосонографического исследования более качественно оценивается эффективность проведенной лекарственной терапии.
Дифференциальная диагностика лимфом желудка
Многообразие визуальных проявлений различных форм лимфомы в желудке приводит к необходимости проводить дифференциальную диагностику с широким спектром заболеваний, таких как различные типы гастритов, болезнью Менетрие, доброкачественными неэпителиальными опухолями желудка (лейомиома, лейомиосаркома) и, конечно, раком желудка.
Наибольшие трудности возникают при дифференциации рака желудка и лимфомы, которая возникает и развивается преимущественно в подслизистом слое органов ЖКТ. Эндоскопическая диагностика лимфомы сопряжена со значительными трудностями, так как зачастую эндоскопические признаки, характерные для лимфопролиферативного поражения, наблюдаются и при раке желудка. Принципиальная возможность такой дифференциальной диагностики обусловлена в первую очередь различиями опухолевого роста лимфомы и рака. Лимфомы довольно долго сохраняют тенденцию к диффузному инфильтративному росту по подслизистому слою в пределах пораженного органа, что проявляется утолщенными, расширенными, прерывистыми, гиперемированными, отечными и разрыхленными складками. Поскольку поражение собственно мышечного слоя стенки желудка при лимфоме происходит на сравнительно поздних стадиях опухолевого роста, то перистальтика и эластичность стенок сохраняется в течение длительного времени. Сохранение сократительной способности стенок желудка на фоне их выраженного и обширного поражения – важный дифференциальный эндоскопический признак, отличающий лимфому и рак желудка. В отличие от лимфомы рак желудка уже на ранних этапах своего развития имеет склонность к инвазивному росту, довольно быстро поражает мышечный слой, что ведет к прекращению перистальтики и ригидности стенок в зоне опухолевого поражения. При эндоскопическом исследовании в этих случаях определяется сглаженность или полное отсутствие складок. При сохранении отдельных складок определяется их ригидность и малоподвижность. Учет визуально определяемых различий в характеристике рака и лимфомы имеет большую диагностическую значимость. Но есть все же случаи, когда только морфологи могут подтвердить или опровергнуть тот или иной диагноз. Повышению результатов морфологического изучения биоптатов способствует метод эндоскопической резекции слизистой оболочки желудка, который позволяет получить большой массив ткани, включающий опухоль, для детальной оценки ее морфологического строения, глубины инвазии, что является определяющим в дальнейшей тактике лечения.
Другим дифференциально-диагностическим признаком служит мультицентричность процесса, когда пораженные участки чередуются с участками неизмененной слизистой оболочки, возможно и сочетание различных макроскопических форм лимфомы, что также способствует правильной постановке диагноза.
Как отмечалось ранее, лимфому желудка зачастую необходимо дифференцировать от таких воспалительных состояний, как гипертрофический гастрит, смешанный гастрит, болезнь Менетрие, так как визуальные эндоскопические проявления идентичны.
Гигантоскладочный тип инфильтративной формы лимфомы желудка схож по макроскопической картине с гигантским гиперпластическим гастритом (болезнь Менетрие), в основе которого лежит выраженная гиперплазия слизистой оболочки желудка.
При выраженных формах болезни Менетрие также можно наблюдать картину, аналогичную лимфопролиферативному процессу, что делает дифференциальную диагностику по визуальным критериям чрезвычайно затруднительной. В данной ситуации существенную помощь в установлении правильного диагноза может оказать эндоскопическое ультразвуковое исследование стенки желудка, которое при наличии болезни Менетрие показывает сохранность 5-слойной структуры стенки желудка, в то время как специфическая опухолевая инфильтрация при лимфоме визуализируется как однородное гипоэхогенное образование, исходящее из подслизистого слоя стенки и распространяющееся вплоть до адвентиции, дифференцировка слоев при этом нарушена.
В ряде случаев узловая форма лимфомы может выглядеть как лейомиома или лейомиосаркома желудка. Определяется типичное поражение стенки желудка в виде песочных часов с эндогастральными и интрамуральными компонентами. Дифференциально-диагностическими критериями, характерными для лимфомы и редко встречающимися при лейомиоме, могут служить неподвижность слизистой оболочки над образованием и изменение сосудистого рисунка (извитые, полнокровные мелкие сосуды). Дифференциальными признаками, дополняющими характерную эндоскопическую картину, могут служить также мультицентричность поражения и сочетание узловой формы с другими макроскопическими типами лимфомы. Как уже отмечалось, при дифференциации неэпителиальных опухолей желудка с лимфопролиферативным заболеванием существенный вклад вносит эндоскопическое ультразвуковое исследование.

Рис. 1. Бляшковидная форма лимфомы. Единичное бляшковидное опухолевидное образование верхней трети тела желудка с углублением и поверхностной эрозией на верхушке.
Читайте также:

