Лимфодиссекция при раке шейки матки
Нет сомнений в том, что хирургическое определение стадии позволяет более точно идентифицировать истинное распространение заболевания. Среди пациенток с клинической I стадией рака эндометрия (РЭ) примерно у 25% выявляют распространение заболевания за пределы органа; среди пациенток с предполагаемой II стадией не менее чем у 75 % будет установлена либо более низкая стадия, либо выход процесса за пределы матки.
Важно не только подобрать адекватное лечение (например, с учетом поражения лимфоузлов), но и предотвратить необоснованную терапию. Высказывалось мнение о возможном увеличении осложнений, связанных с более широким использованием хирургического стадирования. По данным Moore и Larson и соавт., уровень послеоперационных осложнений после хирургических вмешательств с лимфаденэктомией и без нее был одинаковым.
На примере 80 пациенток Fanning и Firestein проанализировали объем кровопотери и осложнения, обусловленные лимфаденэктомией. Среднее количество удаленных тазовых лимфоузлов равнялось 21, парааортальных — 7. Средняя продолжительность лимфаденэктомии составляла 24 мин, средний объем кровопотери — 25 мл. Процент осложнений был низким и был обусловлен абдоминальной гистерэктомией с двусторонней аднексэктомией.
Childers и соавт. рекомендовали лапароскопический метод удаления лимфоузлов в сочетании с влагалищной гистерэктомией и двусторонней аднексэктомией. В руках специалистов, владеющих данной хирургической техникой, исходы заболевания сопоставимы с результатами после стандартных абдоминальных операций.
Имеются некоторые преимущества предлагаемого метода: короткий срок госпитализации и быстрая реабилитация после операции. Приближается к завершению крупное исследование GOG, сравнивающее лапароскопические и абдоминальные операции при раке эндометрия (РЭ).
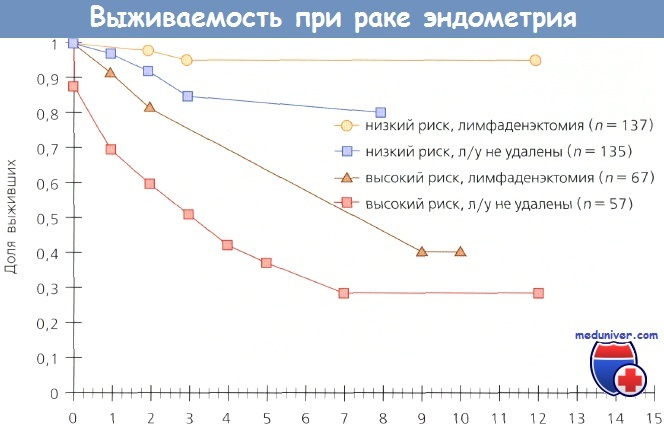
Вопрос о влиянии метода хирургического стадирования рака эндометрия (РЭ) на выживаемость постоянно в поле зрения исследователей, т. к. информация об истинной распространенности заболевания существенным образом влияет па исход отдельных случаев. Kilgore и соавт. (шт. Алабама) опубликовали данные, свидетельствующие о том, что лимфаденэктомия не только обеспечивает терапевтический эффект, но и улучшает выживаемость больных раком эндометрия (РЭ).
Они обследовали и лечили 649 больных раком эндометрия (РЭ); у 212 пациенток выполнили полную тазовую лимфаденэктомию, у 205 — селективную, у 208 — лимфоузлы не удаляли. Выживаемость больных, которым выполнили полную тазовую лимфаденэктомию, была выше, чем у пациенток, которым эта операция не проводилась (р = 0,0002). Выживаемость больных из группы низкого риска (опухоль ограничена маткой) после лимфаденэктомии была более высокой по сравнению с теми, кому лимфаденэктомия не проведена (р = 0,026).
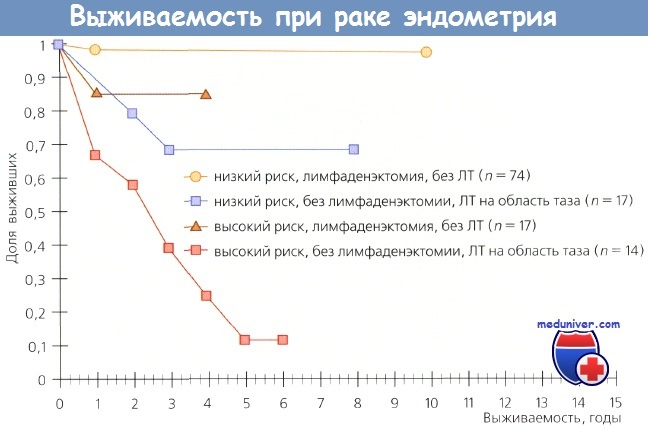
Больные раком эндометрия (РЭ) из группы высокого риска (распространение заболевания на шейку, придатки и серозную оболочку матки, положительные результаты смывов из брюшной полости), которым была выполнена лимфаденэктомия, также имели более высокий показатель выживаемости (р = 0,0006). Даже при оценке отдельных подгрупп больных терапевтическое преимущество лимфаденэктомии было очевидным.
Выживаемость больных из групп как низкого, так и высокого риска, которым была выполнена лимфаденэктомия, но они не получили послеоперационную ЛТ, была выше по сравнению с выживаемостью пациенток из тех же групп, которым лимфаденэктомию не выполнили, но провели облучение. Авторы не сомневаются в терапевтической ценности лимфаденэктомии и отмечают, что объем этого вмешательства зависит от количества пораженных метастазами лимфоузлов.
По данным Chung, при раке эндометрия (РЭ) существует взаимосвязь между ретроперитонеальным рецидивом и состоянием лимфоузлов на момент первичного хирургического вмешательства. Если они поражены метастазами, то забрюшинный рецидив не представляется необычным. И наоборот, рецидивы в забрюшинном пространстве не возникают, если и тазовые, и парааортальные лимфоузлы интактные.
По данным многофакторного анализа, только наличие метастазов в ретроперитонеальных лимфоузлах было значимым для прогноза выживаемости.
Лимфаденэктомия – это операция, во время которой удаляются лимфатические узлы. Данный вид хирургического вмешательства не является самостоятельной операцией и проводится в рамках хирургического противоопухолевого лечения. Собственно лимфаденэктомия является одним из главных критериев, который отличает обычную хирургическую операцию от онкологической.
- Показания к лимфаденэктомии
- Противопоказания к лимфаденэктомии
- Виды операции
- Подготовка к операции
- Методика проведения лимфаденэктомии
- Реабилитация после лимфаденэктомии
- После лимфаденэктомии
- Прогноз
Показания к лимфаденэктомии
Особенностью злокачественной опухоли является способность к метастазированию – распространению за пределы очага первичной локализации. Большинство злокачественных опухолей эпителиального происхождения распространяются с током лимфы, перемещаясь по лимфатическим сосудам. Сначала поражаются близлежащие узлы, их называют лимфоузлами первого порядка. Затем процесс распространяется дальше, захватывая более отдаленные коллекторы.
Удаление лимфатических узлов позволяет сдержать или даже предотвратить метастатическое распространение рака, поэтому такие вмешательства проводятся в рамках радикальных хирургических операций. Это очень кропотливая и скурпулезная работа, которая может занять больше времени, чем непосредственное удаление первичного опухолевого очага.
Все удаленные лимфоузлы направляются в лабораторию, где подвергаются морфологическому исследованию на предмет наличия метастазов. Эти данные необходимы для окончательного определения стадии заболевания, поскольку от этого может зависеть план дальнейшего лечения.
Противопоказания к лимфаденэктомии
Лимфаденэктомия – это обширная травматичная операция, которая может привести к тяжелым осложнениям. Поэтому ведутся исследования, которые позволят более избирательно подходить к отбору пациентов, которым она показана в обязательном порядке.
Одной из таких разработок является биопсия сторожевого лимфатического узла. Сторожевой узел – это лимфатический узел, который первым оказывается на пути распространения опухоли. Его определяют с помощью процедуры картирования, например, вводя пораженные ткани красящее вещество или меченные изотопы. Выявленный сторожевой узел удаляют и отправляют на морфологическое исследование. Если данных о его злокачественном поражении не обнаружено,
то вероятность наличия метастазов минимальна, и лимфодисекция не показана. В противном случае проводят операцию в полном объеме.
Виды операции
Лимфаденэктомии классифицируются в зависимости от локализации первичного опухолевого очага:
- При раке молочной железы проводится подмышечная лимфодиссекция.
- При раке половых органов удаляют тазовые лимфоузлы.
- При раке наружных половых органов удаляют паховые.
- Медиастинальные ЛУ удаляются при раке легких или раке пищевода.
- Парааортальные лимфоузлы удаляются при раке кишечника и половых органов.
Подготовка к операции
Лимфаденэктомии редко проводятся как самостоятельное хирургическое вмешательство, традиционно она является этапом радикального хирургического удаления опухоли. В рамках подготовки к операции пациент проходит обследование, направленное на определение стадии заболевания. Как правило, для этого используются лучевые методы визуализации — УЗИ, КТ, МРТ, ПЭТ КТ. Также может применяться биопсия сторожевого лимфоузла. Кроме того, необходимо стандартное обследование, как перед любой операцией — анализы, ЭКГ, консультации узких специалистов.
Методика проведения лимфаденэктомии
Лимфаденэктомии могут выполняться открытым и эндоскопическим доступом. При открытом способе рассекаются ткани, удаляются лимфоузлы с окружающей их жировой клетчаткой, и полученный материал отправляется для морфологического исследования. Рану послойно ушивают. При эндоскопической технике все манипуляции производятся через небольшие проколы, в которые вставляются видеокамера и манипуляционные инструменты.
При удалении лимфоузлов используются следующие принципы:
- Принцип зональности — лимфатические узлы удаляются в пределах одной анатомической зоны.
- Принцип футлярности — узлы удаляются в пределах анатомических футляров. Это предотвращает метастазирование.
- Принцип моноблочности — лимфоузлы удаляются совместно с окружающими тканями. Это предотвращает интраоперационное метастазирование.
Реабилитация после лимфаденэктомии
Главными функциями лимфатической системы является борьба с чужеродными для организма агентами и выведение лишней жидкости. При удалении лимфатических узлов могут возникнуть проблемы с удалением жидкости, что приводит к развитию лимфедемы — лимфатическому отеку или лимфостазу.
Чтобы этого избежать, пациентам дается ряд рекомендаций, которых следует неукоснительно придерживаться:
- Выполнять лечебную гимнастику в соответствии с полученными инструкциями.
- Приподнимать конечность со стороны которой была выполнена лимфаденэктомия во время сна.
- Избегать повреждения кожи.
- Возвращаться к повседневной активности постепенно, по мере восстановления работоспособности.
После лимфаденэктомии
Главным осложнением после удаления лимфатических узлов является лимфедема — лимфатический отек. Он может образоваться на конечностях или туловище с той стороны, где выполнялось удаление лимфатических узлов.
При этом в пораженном сегменте возникает чувство тяжести, ломота, нарушение подвижности, изменение кожи (отечность, появление вдавлений и ямок). В тяжелых случаях возможно образование слоновости конечности.
К сожалению, не существует правил, которые могли бы полностью предотвратить развитие лимфедемы, но есть рекомендации, которые уменьшают такую вероятность:
- Предотвращение развития инфекций. При инфекционных процессах происходит активация иммунной системы и увеличение продуцирования лейкоцитов и лимфатической жидкости, соответственно важно не допускать развития таких событий. Нужно следить за состоянием кожи, избегать порезов, проколов, ожогов, не использовать обрезной маникюр, травматичные методы эпиляции.
- Регулярное выполнение физических упражнений.
- Поддержание здорового веса тела.
- Отказ от использования ювелирных украшений на стороне поражения, часов и других предметов, которые могут повредить кожу.
При развитии отечности, покраснения и локальном повышении температуры необходимо обратиться к врачу.
Прогноз
Удаление лимфатических узлов проводится по жизненным показаниям. Это позволяет снизить вероятность распространения злокачественной опухоли и провести радикальное хирургическое вмешательство. Для многих пациентов это единственный способ избавиться от рака.
Врачи Европейской клиники проводят лимфаденэктомию в соответствии с современными стандартами лечения с учетом особенностей конкретного клинического случая.
Лимфодиссекция и лимфаденэктомия в современной онкологии считаются взаимозаменяемыми терминами, обозначающими хирургическое удаление лимфатических узлов при злокачественном процессе. В последние годы шире употребляется термин лимфодиссекция, который полнее отражает техническую суть операции — удаление единым блоком группы лимфоузлов с окружающей клетчаткой.

Показания к лимфодиссекции
Лимфодиссекция — стандартная манипуляция при хирургическом лечении рака любой локализации, при некоторых злокачественных процессах брюшной полости и забрюшинного пространства обязательно выполняется вместе с операцией на пораженном первичной опухолью органе, то есть это один из этапов радикального хирургического лечения.
Цель лимфаденэктомии — удаление пораженных злокачественными клетками лимфатических узлов. С одной стороны, это полноценное лечение с ликвидацией метастаза в лимфоузле, с другой — диагностическая процедура, определяющая степень ракового поражения для оптимального планирования дальнейшего лечения.

Лимфаденэктомия с удалением поверхностно располагающихся лимфатических коллекторов, к примеру, в паху, в подмышке или на шее не проходит бесследно, осложняясь застоем лимфы ниже места операции — лимфедемой. Вызванные лимфедемой физические страдания, особенно нарушение движений конечности, не оправданы, если в лимфоузлах не было метастазов и лимфаденэктомия проводилась с профилактической целью.
Во избежание избыточного хирургического лечения в виде лимфаденэктомии при отсутствии метастатического поражения, сегодня выполняется биопсия сторожевого лимфоузла. Если срочное гистологическое исследование во время операции выявляет раковые клетки, то лимфоузлы удаляются. При отсутствии раковых клеток лимфоколлектор не трогают.
От биопсии сторожевого лимфоузла часто отказываются по техническим соображениям: нет специалиста, невозможно провести срочное морфологическое исследование, качество анестезии не позволяет. В клинике Медицина 24/7 всегда есть всё необходимое для высокотехнологичного лечения.
Оставьте свой номер телефона
При каких заболеваниях выполняется лимфаденэктомия
Необходимость иссечения лимфоколлекторов зависит от степени распространения первичной опухоли и её прогностических характеристик, то есть от агрессивности рака.
При раке молочной железы, плоскоклеточной карциноме кожи, меланоме, новообразованиях головы лимфаденэктомия выполняется только при метастазах, диагностируемых при биопсии сторожевого лимфоузла. Свободные от раковых клеток лимфоколлекторы не трогают, во избежание развития лимфедемы.
При панкреатической карциноме лимфодиссекция тоже неотъемлемой этап радикальной операции на поджелудочной железе, при сомнениях в возможности удаления метастазов пациенту назначается только консервативное лечение.
По аналогичным принципам проводится лимфодиссекция и при злокачественных процессах мочеполовой системы.
Виды лимфаденэктомии
Вмешательства на лимфоколлекторах классифицируют по анатомическому принципу — в зависимости от области удаления, например, шейная, подмышечная, , подколенная, средостенная (медиастинальная) лимфаденэктомия и так далее.
По объему вмешательства лимфодиссекцию разделяют на региональную, то есть удаление ближайшей группы узлов, селективную — выборочную, расширенную — несколько уровней лимфатических коллекторов.
Описание операции
- убирается не отдельный метастаз, а опухоль вместе с окружающей клетчаткой — одним блоком;
- иссечение проводят с учётом анатомических границ — по зональному принципу, когда нельзя иссечь один метастатический узелок из подмышки и ещё два из подлопаточной зоны, необходимо удалять весь подмышечный коллектор и последовательно иссечь все группы лимфоузлов соседних областей;
- футлярный принцип обязывает не вылущивать метастаз, а удалять его с учетом анатомических взаимоотношений с соседними структурами.
Техника лимфодиссекции при удалении поверхностных лимфоколлекторов включает рассечение кожи, отделение скальпелем от прилежащих мышечных массивов всей жировой клетчатки вместе с лимфоузлами, перевязку и пересечение сосудов, и зашивание операционной раны.
Внутри брюшной, грудной или тазовой полости последовательно, но также единым блоком удаляется пораженный опухолью орган и внутренняя клетчатка с лимфоузлами. Всё удаленное отправляется на гистологическое исследование.
Послеоперационный период и восстановление
Различается послеоперационное течение лимфодиссекции при внутренней карциноме и наружных злокачественных процессах. После удаления лимфоузлов брюшинной или грудной полости внутреннее давление предотвращает истечение лимфы из рассеченных лимфатических сосудов. При удалении наружных лимфоколлекторов невозможно сразу прекратить истечение лимфы из поврежденных сосудов, лимфорея может продолжаться много дней, создавая благоприятные условия для развития инфекции и мешая приживлению кожи. Именно по причине сложности заживления раны истечения лимфы из мелких сосудиков, после операции на молочной железе швы снимают не раньше, чем через 2–3 недели. Для профилактики развития инфекции проводится лечение антибиотиками.
Одна из самых сложных задач послеоперационного периода лимфаденэктомии — эффективно и быстро прекратить послеоперационную лимфорею. Специалисты клиники Медицина 24/7 имеют самые современные возможности для качественного выполнения операции и обладают огромным практическим опытом по лечению осложнений.
После диагностирования рака шейки матки проводятся анализы для определения стадии заболевания и степени его распространения на другие органы, если рак начал метастазировать. Данный процесс называется стадирование.
В зависимости от локализации опухоли, стадии процесса и клинических особенностей больных показаны различные по объему оперативные вмешательства.
КРИОХИРУРГИЯ
Непосредственно на шейку матки накладывается металлический зонд, охлажденный с помощью жидкого азота.

Уничтожение патологических клеток происходит при их замораживании.
Криохирургия применяется при предраковых изменениях шейки матки (стадия 0), но не при инвазивном раке.
ЛАЗЕРНАЯ ХИРУРГИЯ
Лазерная хирургия применяется при предраковых изменениях шейки матки (стадия 0). Для лечения инвазивного рака не используется.
Через влагалище на шейку матки направляется сфокусированный пучок лазерных лучей, который испаряет (выжигает) раковые клетки или используется для удаления небольшого кусочка ткани для исследования.
Из шейки матки удаляется конусовидный участок ткани. Это производится хирургическим скальпелем, либо в ходе криоконизации или при использовании тонкой проволоки, нагретой электрическим током (процедуры петлевой электроконизации шейки матки [LEEP], или широкой петлевой эксцизии зоны трансформации [LLETZ]).
Клиновидная биопсия (конизация шейки матки) также применяется для диагностики рака перед назначением дополнительного хирургического или лучевого лечения.
Это единственное необходимое лечение при ранних стадиях рака (стадия IA1) для женщин, которые желают сохранить фертильность, то есть возможность иметь детей в будущем.
После проведения биопсии полученный конусовидный образец ткани изучается под микроскопом. Если наружные участки образца содержат раковые или патологически измененные клетки, то необходимо дальнейшее лечение, которое поможет полностью избавиться от опухоли.
Применение электро и криотерапии показано при ограничении распространении процесса на цервикальный канал и глубине инвазии не более 1 мм.
Криодеструкция опухоли может быть выполнена у больных с анатомическими особенностями строения влагалища и шейки матки, а электроконизация при сопутствующей истмико-цервикальной недостаточности.
Все пациенты после функционально щадящей терапии должны находиться в группе риска, поскольку в настоящее время мы не располагаем этиопатогенетическим лечением больных раком шейки матки. Вместе с тем, органосохраняющее лечение обуславливает полноценную медико-социальную реабилитацию пациенток.
Сейчас не являются редкостью беременности и роды после органосохраняющих операций. Однако, следует помнить о большей, чем в популяции, частоте невынашивания беременности, в связи с чем необходимо проводить соответствующие профилактические и лечебные мероприятия.
ГИСТЕРЭКТОМИЯ
В ходе данной хирургической операции проводится удаление, как тела, так и шейки матки, однако сохраняются рядом расположенные структуры (ткани околоматочного пространства и крестцово-маточные связки).
Влагалище и лимфатические узлы малого таза не иссекаются. Также сохраняются яичники и маточные трубы, если только какая-либо причина не заставляет хирурга удалить и их.
Открытая (или абдоминальная) гистерэктомия – это удаление матки через хирургический разрез на передней брюшной стенке называется.
Влагалищная гистерэктомия – это если матка удаляется через влагалище.
Лапароскопическая гистерэктомия – это удаление матки с помощью лапароскопических приспособлений.
Иногда проводится роботизированной гистерэктомия с помощью специальных инструментов, которые контролируются хирургом и позволяют ему лучше видеть происходящее на операционном поле.
При всех операциях используется общий наркоз или эпидуральная (проводниковая) анестезия.
При лапароскопической или влагалищной гистерэктомии восстановительный период и длительность пребывания в больнице обычно меньше, чем при открытом доступе к матке. При данных операциях необходимо нахождение в больнице в течение 3-4 дней с последующим 2-3-х недельным восстановительным периодом.
После абдоминальной гистерэктомии женщина остается в больнице на 4-6 дней, а полное восстановление занимает 4-6 недель.
Осложнения возникают редко, однако иногда отмечается выраженное кровотечение, раневые инфекции или повреждение мочевыводящих путей или кишечника.
Гистерэктомия применяется для лечения рака шейки матки стадии IA1. Также она используется в некоторых случаях при опухоли стадии 0 (карцинома in situ), если раковые клетки обнаруживают на краях образца ткани, полученного при клиновидной биопсии (так называемые положительные края). Гистерэктомия возможна и при аденокарциноме in situ. Кроме этого, она применяется для лечения некоторых доброкачественных состояний. Чаще всего это лейомиомы - вид доброкачественных опухолей, также известный как фиброма или фиброид.
Любая гистерэктомия приводит к бесплодию (невозможности рождения ребенка).
Способность женщины испытывать сексуальное удовлетворение после гистерэктомии не меняется. Для того чтобы достичь оргазма, матка или шейка матки не нужны. Область клитора и слизистая оболочка влагалища остаются такими же чувствительными, как и раньше.
РАДИКАЛЬНАЯ ГИСТЕРЭКТОМИЯ
В ходе операции хирург удаляет матку вместе с тканями, которые находятся рядом с органом (параметрий и крестцово-маточные связки), а также верхнюю треть влагалища, прилегающую к шейке матки.
Яичники и маточные трубы обычно сохраняются, если только какая-либо причина не заставляет хирурга удалить и их.
Операция обычно проводится через разрез на передней брюшной стенке. Нередко иссекаются и некоторые лимфатические узлы малого таза – эта процедура называется лимфодиссекция.
Другим хирургическим подходом является радикальная влагалищная гистерэктомия с лапароскопической ассистенцией.
Данная операция предполагает сочетание радикальной влагалищной гистерэктомии и лапароскопического иссечения лимфатических узлов малого таза.
При лапароскопии используется тонкая трубка, которая вводится через небольшой разрез, что помогает хирургу осмотреть изнутри брюшную полость и малый таз.
Трубка (лапароскоп) позволяет вводить небольшие инструменты. А поэтому хирург может иссечь лимфатические узлы непосредственно через лапароскоп, без обширного разреза на передней брюшной стенке. Лапароскоп также облегчает удаление матки, яичников и маточных труб при проведении влагалищной гистерэктомии.
Иногда при проведении радикальной гистерэктомии используется роботизированная лапароскопическая хирургия.
Преимуществами данного метода является меньшая кровопотеря и длительность нахождения в больнице после операции. Тем не менее, такой подход к лечению рака шейки матки является относительно новым, а поэтому его роль в терапии пока изучается.
При радикальной гистерэктомии удаляется существенно больше ткани, чем при стандартной операции, следовательно, требуется более длительное пребывание в больнице: от 5 до 7 дней. Данная операция приводит к бесплодию, поскольку удаляется матка.
Осложнения возникают редко, однако иногда отмечается выраженное кровотечение, раневые инфекции или повреждение мочевыводящих путей или кишечника.
Радикальная гистерэктомия и иссечение лимфатических узлов малого таза (лимфодиссекция) используется при раке шейки матки стадий IA2 и IB, реже – при опухоли стадии IIА, особенно у молодых женщин.
Способность женщины испытывать сексуальное удовлетворение после радикальной гистерэктомии не меняется. Несмотря на укорочение влагалища, область клитора и слизистая оболочка влагалища остаются такими же чувствительными, как и раньше. Для того чтобы достичь оргазма, матка или шейка матки не нужны.
На самом деле, гистерэктомия может улучшить сексуальную жизнь женщины, если рак шейки матки вызывает боли или кровотечение после полового акта, так данные симптомы устраняются.
ТРАХЕЛЭКТОМИЯ (АМПУТАЦИЯ ШЕЙКИ МАТКИ)
Большинству женщин с раком шейки матки стадии IA2 и IB показана гистерэктомия.
Однако некоторым молодым женщинам проводится другая операция под названием трахелэктомия, что позволяет им в будущем забеременеть.
Радикальная трахелэктомия – это операция, которая заключается в удалении шейки матки вместе с комплексом лимфатических узлов.
Данная процедура включает удаление шейки и верхней части влагалища с сохранением тела матки.
Хирург накладывает особый кисетный шов, который создает искусственное отверстие шейки в полость матки. Прилегающие лимфатические узлы удаляются лапароскопически.
перация проводится влагалищным или открытым (абдоминальным) доступом.
После трахелэктомии некоторые женщины могут полноценно выносить ребенка. Роды проводятся через кесарево сечение.
В одном исследовании было показано, что частота наступления беременности через пять лет после операции составляет более 50%. Однако, по сравнению со здоровыми женщинами, риск невынашивания (выкидышей) оказался высоким.
Риск рецидива рака после данной операции небольшой.
ЭКЗЕНТЕРАЦИЯ ОРГАНОВ МАЛОГО ТАЗА
Это самая обширная операция, которая назначается для лечения рецидивов рака шейки матки.
В ходе операции проводится удаление тех же органов, что и при радикальной гистерэктомии, в сочетании с иссечением лимфатических узлов малого таза (лимфодиссекция). Кроме этого, в зависимости от распространенности опухоли, возможно удаление мочевого пузыря, влагалища, прямой кишки и участка толстого кишечника.
При удалении мочевого пузыря требуется создание новых путей оттока и хранения мочи. Обычно при этом используется короткий сегмент толстой кишки, который формирует новый мочевой пузырь. Искусственный мочевой пузырь затем подшивается к передней брюшной стенке, что позволяет по мере его наполнения выводить мочу с помощью катетера, который помещается в уростому (небольшое отверстие). Также моча может отводиться в небольшой пластиковый мешок, который прикрепляется к передней брюшной стенке в области уростомы.
Удаление прямой кишки и части толстого кишечника требует создание новых путей выведения каловых масс. При этом оставшийся кишечник подшивается к стенке брюшной полости, а каловые массы выводятся через колостому (небольшое отверстие) в пластиковый мешок, который прикрепляется к передней брюшной стенке.
Кроме этого, возможно удаление пораженного участка кишечника (рядом с шейкой матки) и восстановление его целостности, что не требует ношения колостомного мешка и других приспособлений.
При удалении влагалища проводится хирургическая пластика: новое влагалище формируется из кожи, участка кишки или мышечно-кожного лоскута.
Восстановление после полной экзентерации органов малого таза обычно протекает долго.
Большинство женщин начинают чувствовать себя нормально лишь спустя 6 месяцев после операции. Некоторые бывшие пациентки говорят, что полное восстановление заняло у них 1-2 года.
Как бы то ни было, прооперированные женщины могут жить полноценной и счастливой жизнью. Решительность и активные действия позволяют восстановить сексуальную функция, испытывать сексуальное удовлетворение и достигать оргазма.
ИССЕЧЕНИЕ ЛИМФАТИЧЕСКИХ УЗЛОВ МАЛОГО ТАЗА (ЛИМФОДИССЕКЦИЯ)
Раковая опухоль, берущая начало в шейке матки, может распространяться на лимфатические узлы малого таза, которые представляют собой образования бобовидной формы с важными иммунными функциями.
Для того чтобы оценить присутствие раковых клеток, хирург удаляет часть лимфатических узлов. Данная процедура носит название лимфодиссекции или лимфаденэктомии.
Она проводится одновременно с гистерэктомией (или трахелэктомией).
Удаление лимфатических узлов может нарушать отток лимфы и жидкости от нижних конечностей. Это приводит к появлению выраженных отеков на ногах, что называется лимфедема.
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2018
Профессиональные ассоциации
- Ассоциация онкологов России Российское общество клинической онкологии
Оглавление
1. Краткая информация
Рак шейки матки (РШМ) – злокачественная опухоль, исходящая из слизистой оболочки шейки матки.
РШМ имеет спорадический характер.
Не связан с известными наследственными синдромами.
Причина - онкогенные подтипы ВПЧ 16/18.
- при высокой частоте РШМ в государстве - у 10-20% женщин;
- при низкой частоте РШМ в государстве - у 5-10%.
В мире ежегодно РШМ:
- диагностируется 528 тысяч;
- смертность 266 тысяч.
В России в 2012 году:
- 15 427 новых случаев;
- доля в структуре ЗНО 5,3% (5 место);
- прирост с 2007 г. 12,2%;
- максимальный прирост в группе 15-39 лет - 22,3%;
- в структуре смертности от ЗНО 4,7% (8 место);
- 1-годичная летальность 17%;
- максимальная смертность группе 15-39 лет 21,1%.
C53 Злокачественное новообразование шейки матки
C53.0 Внутренней части
C53.1 Наружной части
C53.8 Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций
C53.9 Шейки матки неуточненной части
Опухоли из плоского эпителия:
Плоcкоклеточные интраэпителиальные поражения (поражение плоского эпителия (SIL)):
- 8077/0 поражение плоского эпителия легкой степени (LSIL))
- 8077/2 поражение плоского эпителия тяжелой степени (HSIL))
8070/3 Плоскоклеточный рак
- 8071/3 ороговевающий;
- 8072/3 неороговевающий;
- 8052/3 папиллярный;
- 8083/3 базалоидный;
- 8051/3кондиломатозный;
- 8051/3веррукозный;
- 8120/3 плоскоклеточно-переходноклеточный;
- 8082/3 лимфоэпителиальный;
Опухоли из железистого эпителия:
- 8140/2 Аденокарцинома in situ;
- 8140/3 Аденокарцинома:
- 8140/3Эндоцервикальная аденокарцинома, обычный типа;
- 8480/3 Муцинозная:
- 8482/3 желудочного типа;
- 8144/3 кишечного типа;
- 8490/3 перстневидноклеточного типа;
- 8263/3 Виллогландулярная;
- 8380/3Эндометриоидная;
- 8310/3 Светлоклеточная;
- 8441/3Серозная;
- 9110/3Мезонефральная;
- 8574/3 Аденокарцинома смешанная с нейроэндокринной карциномой;
Другие эпителиальные опухоли:
- 8560/3 Железисто-плоскоклеточный рак;
- 8015/3стекловидноклеточный рак;
- 8096/3 Аденобазальный рак;
- 8200/3 Аденокистозный рак;
- 8020/3 Недифференцированный рак
- Нейроэндокринные опухоли:
- Нейроэндокринные опухоли низкой степени злокачественности
- 8240/3карциноид;
- 8249/3 атипичный карциноид;
Нейроэндокринные опухоли высокой степени злокачественности
- 8041/3 мелкоклеточный нейроэндокринный рак;
- 8013/3 крупноклеточный нейроэндокринный рак;
Степени дифференцировки РШМ:
- G1 – высокодифференцированная
- G2 – умереннодифференцированная
- G3 – низкодифференцированная или недифференцированная
- Gх – невозможно определить степень дифференцировки
Диагноз устанавливается только на основании гистологического исследования.
РШМ стадируется клинически до начала специальной терапии и никогда не изменяется.
При затруднении точного определения стадии устанавливается более ранняя.
Морфологические находки при хирургии не изменяют клиническую стадию, но отмечаются в TNM.
Стадирование по классификации FIGO (2009г.) и TNM (7 изд, 2009г.)
2. Диагностика
Сбор жалоб и анамнеза для выявления факторов, влияющих на выбор тактики.
Дисплазия и преинвазивный РШМ не имеют патогномоничных клинических проявлений и диагностируются только морфологически.
- физикальный осмотр,
- гинекологический осмотр,
- ректовагинальное исследование.
- Развернутый клинический анализ крови
- Развернутый биохимический анализ крови с показателями функции печени, почек
- Анализ крови на онкомаркер SCC (при плоскоклеточном раке)
- Исследование свёртывающей системы крови
- Общий анализ мочи.
Биопсия всех подозрительных участков шейки матки, одной цитологии для диагноза недостаточно.
Выскабливание цервикального канала
Конизация при необходимости.
Расширенная кольпоскопия для определения наиболее измененного участка шейки и его биопсии.
Цистоскопия:
- при опухоли шейки более 4 см,
- при переходе опухоли на передний свод влагалища,
- при наличии жалоб.
Ректороманоскопия:
- при опухоли шейки матки более 4 см,
- при переходе опухоли на задний свод влагалища,
- при наличии жалоб.
УЗИ брюшной полости, забрюшинного пространства, малого таза и шейно-надключичной области.
Рентгенография грудной клетки.
МРТ малого таза с контрастированием (точность определения глубины инвазии 71-97%)
КТ малого таза и забрюшинного пространства с контрастированием при невозможности МРТ.
ПЭТ или ПЭТ-КТ наиболее информативна для выявления метастазов.
Рентгенография костей скелета или остеосцинтиграфия при подозрении на метастазы.
МРТ или КТ головного мозга с контрастированием при подозрении на метастазы в ЦНС.
Морфологическое заключение после удаления:
1. Гистологический тип опухоли;
2. Степень дифференцировки опухоли
3. Размеры опухоли;
4. Глубина инвазии опухоли
5. Толщина шейки матки в месте наибольшей инвазии опухоли
6. Опухолевые эмболы в кровеносных и лимфатических сосудах
7. Опухоль в крае резекции влагалища, параметриев, по границе резекции шейки матки (при конизации/ампутации или трахелэктомии)
8. Переход опухоли на влагалище
9. Опухолевое поражение параметрия справа, слева
10. Общее число удаленных и поражённых тазовых лимфоузлов справа, слева;
11. Общее число удаленных и поражённых лимфоузлов параметрия справа, слева
12. Общее число удаленных и поражённых поясничных лимфоузлов
13. Переход опухоли на тело матки
14. Метастатическое поражение яичников
15. Прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов)
16. Степень лечебного патоморфоза первичной опухоли и метастазов в лимфоузлах в случае предоперационной терапии.
Дополнительное обследование при подготовке к лечению:
- эхокардиография,
- холтеровское мониторирование,
- исследование ФВД,
- УЗДГ сосудов шеи и нижних конечностей,
- забор мазков с шейки матки и из канала шейки матки,
- забор аспирата из полости матки,
- цервикогистероскопия,
- раздельное диагностическое выскабливание полости матки и цервикального канала,
- экскреторная урография,
- МРТ / КТ брюшной полости с контрастным усилением,
- ирригоскопия,
- колоноскопия,
- диагностическая лапароскопия,
- ренография,
- консультации специалистов (уролога, терапевта, эндокринолога, невролога и др.).
3. Лечение
Тяжелая дисплазия (CIN III) и внутриэпителиальный РШМ (рак in situ)
- Конизация шейки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки.
РШМ IA1 ст. (инвазия ≤ 3 мм и ≤7 мм по горизонтали)
- Конизация шейки матки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки.
- Экстирпации матки I типа при сопутствующей гинекологической патологии или отсутствии необходимости сохранения репродуктивной функции.
- Реконизация при дисплазии или клетках рака в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала.
- При невозможности реконизации лечат как IB1 ст. РШМ.
- Модифицированная расширенная экстирпация матки II типа при глубине инвазии в строму до 3 мм, раковых эмболах в сосудах.
РШМ IA2 ст. (инвазия>3 мм и ≤ 5 мм и ≤ 7 мм по горизонтали)
- Модифицированная расширенная экстирпации матки II типа.
- ЛТ при противопоказаниях к хирургическому лечению.
- Широкая конизация шейки матки с экстраперитонеальной или лапароскопической тазовой лимфаденэктомией либо расширенная трахелэктомия тип II при необходимости сохранения детородной функции.
РШМ IB1 и IIА1 ст. (опухоль
- Расширенная экстирпация матки III типа.
- ЛТ / химиолучевая терапия по радикальной программе.
- Комбинации операции с ЛТ достоверно увеличивает частоту осложнений, поэтому не показана.
- Обязательная поясничная лимфодиссекция при метастазах в тазовых лимфоузлах.
- Адъювантное лечение проводят в зависимости от факторов риска прогрессирования.
- Расширенная трахелэктомия тип III при необходимости сохранить детородную функцию.
- ЛТ/ химиолучевая терапия по радикальной программе не более 6-7 недель. при невозможности хирургии.
Группы риска прогрессирования после расширенной экстирпации матки:
- высокий - при одном факторе высокого риска (метастазы в ЛУ, поражение параметрия или опухоль в краях резекции влагалища) адъювантное ХЛТ с ЛТ + еженедельно цисплатин 40 мг/м 2 ; при метастазах в поясничных ЛУ - облучение расширенным полем
- промежуточный - при отсутствии факторов высокого риска, но при 2-х из 3-х факторов (инвазия более 1/3 миометрия шейки; инвазия сосудов; опухоль более 4 см) - адъювантная ЛТ.
- низкий -при отсутствии факторов высокого риска, но при 1 из 3 факторов (инвазия более 1/3 миометрия шейки; инвазия сосудов; опухоль более 4 см) адъювантное лечениене показано.
IB2 и IIА2 стадий РШМ
- Расширенная экстирпация матки III типа - стандарт.
- Поясничная лимфодиссекция при метастазах в тазовых лимфоузлах.
- Адъювантное лечение как при IB1 и IIА1 ст. РШМ.
- Облучение расширенным полем при метастазах в поясничных лимфоузлах.
- Химиолучевое лечение по радикальной программе: сочетанная ЛТ + еженедельно цисплатин 40 мг/м 2 – альтернатива экстирпации.
- Адъювантная гистерэктомия после химиолучевой терапии не рекомендуется.
- Неоадъювантная ХТ препаратами платины с последующей расширенной экстирпацией матки III типа – альтернатива стандарту.
IIВ–IVA стадий РШМ
- Химиолучевое лечение по радикальной программе не более 6-7 недель: сочетанная ЛТ + еженедельно цисплатин 40 мг/м2 – стандарт.
- Хирургического вмешательства при IIB ст. РШМ - 1 этап комбинированного лечения или после неоадъювантной ХТ при благоприятном прогнозе. При метастазах в ЛУ транспозиция яичников из зоны облучения.
- Экстраперитонеальная лимфаденэктомиия с последующим ХЛТ по радикальной программе при метастазах в тазовые и/или поясничные ЛУ.
- Облучение расширенным полем при метастазах в поясничных лимфоузлах.
- Альтернатива ХЛТ при IVA ст. – экзентерация малого таза и редко - передняя/задняя экзентерация.
Отдаленные метастазы (IVВ ст. РШМ)
- Системная платиносодержащая ХТ.
- Возможна ЛТ по индивидуальному плану.
Рецидив
Экзентерация малого таза и редко передняя/задняя экзентерация при центральном рецидиве:
- вовлекающем мочевой пузырь и/или прямую кишку,
- не переходящем на стенку таза,
- при отсутствии диссеминации по брюшине,
- без регионарных и отдаленных метастазов.
Расширенная экстирпация матки после ЛТ/ХЛТ по радикальной программе, если размер рецидивной опухоли в шейке матки не превышает 2 см.
Паллиативное лечение при триаде - односторонние отек нижней конечности, ишиалгия и блок мочеточника в большинстве случаев диагностируется переход опухоли на стенку таза, не подлежащий хирургическому лечению.
Конформная ЛТ - стандарт при проведении курса дистанционного облучения.
Планируемый объем облучения включает:
- первичную опухоль (при отсутствии хирургического этапа);
- параметральную область;
- крестцово-маточные связки;
- оптимальный уровень резекции влагалища – более 3 см от опухоли;
- группу тазовых лимфатических узлов;
- при отсутствии метастазов в подвздошных ЛУ облучаются группа наружных, внутренних подвздошных и запирательные лимфатические узлы;
- при метастазах в подвздошных и/или парааортальных ЛУ - верхняя граница поля достигать уровня L1–L2, или с учетом уровня поражения группы параортальных лимфатических узлов, соответственно, верхняя граница поля может достигать уровня Th12.
При микроскопических метастазах в региональных ЛУ при РОД 2 Гр достаточна СОД до 46 Гр.
При поражении региональных ЛУ увеличение СОД на 10-15 Гр в виде локального буста.
При облучении парааортальной областиIMRT и другие методологии конформного облучения помогают уменьшению дозовых нагрузок на кишечник и другие органы риска.
Конформное облучение (IMRT) при распространенных формах РШМ не заменяет брахитерапии.
Для конформного облучения и методологии IMRT определены:
- GTV - определяемый опухолевый объем,
- CTV - клинический объем мишени, включающий GTV,
- PTV - планируемый объем мишени,
- OAR - органы риска,
- DVH - гистограммы доза-объем.
Внутриполостное облучение (брахитерапия) - определяющий и обязательный этап лечения, проведение контактного облучения - основной прогностический фактор в локальном контроле РШМ.
Внутриполостное облучение проводят после полного курса ДГТ, при хорошей регрессии опухоли и формировании шейки - на 4-5 неделе облучения в дни, свободные от дистанционного облучения.
Методика сочетанной лучевой терапии по радикальной программе, СОД сочетанной ЛТ:
- в точке А 80–90 Гр,
- в точке В 60 Гр.
1. Дистанционная лучевая терапия
Конформная ЛТ малого таза и зон регионарного метастазирования СОД 46-50 Гр при РОД 2 Гр ежедневно 5 раз в неделю.
1. Внутриполостная лучевая терапия (на брахитерапевтических аппаратах): HDR ( 192 Ir, 60 Co)
Дозиметрическое планирование исходя из технического оснащения клиники:
- Осуществляемое по 2D изображениям.
- Осуществляемое по 3D изображениям.
- Ни один режим фракционирования не показал преимуществ.
Через 21–28 дней после хирургического вмешательства методика послеоперационной СЛТ:
1. ДГТ на ложе опухоли и зоны регионарного метастазирования РОД 2 Гр ежедневно 5 раз в неделю, СОД 46-50 Гр (4-польное, IMRT).
1. Внутриполостная лучевая терапия (на брахитерапевтических аппаратах): HDR ( 192 Ir, 60 Co) РОД 3–5 Гр. 2–3 раза в неделю, СОД 21–25 Гр.
АХТ при IB—IIВ ст. в группе высокого риска прогрессирования – цисплатин 40 мг/м 2 1 раз в неделю до 6 недель на фоне ЛТ.
ХЛТ по радикальной программе при IB—IVA ст. - цисплатин 40 мг/м 2 1 раз в неделю до 6 недель на фоне ЛТ.
Роль АХТ после химиолучевого лечения по радикальной программе не ясна, возможны на фоне ЛТ по радикальной программе цисплатин 40 мг/м 2 + гемцитабин 125 мг/м 2 еженедельно и 2 курса АХТ после окончания ЛТ цисплатин 50 мг/м 2 1 день + гемцитабин 1000 мг/м 2 1 и 8 дни с интервалом в 3 недели.
При IB2 и IIА2 (опухоль >4 см) и IIB ст. возможна 2-3 курса неоадъювантной ХТ: паклитаксел 175 мг/м² + цисплатин 75 мг/м² или карбоплатин AUC 6 в 1 день с интервалом 3 недели.
При IVВ ст. РШМ или при прогрессировании заболевания - системная ХТ до 6 курсов по режимам:
- цисплатин 50 мг/м 2 1 раз каждый 21 день (не проводится при анамнезе ХЛТ);
- цисплатин 50 мг/м 2 1 день + 5-фторурацил 500 мг/м 2 1-3 дни с интервалом в 21 день;
- паклитаксел 175 мг/м² + цисплатин 75 мг/м² 1 день с интервалом 3 недели, (при анамнезе ЛТ на малый таз возможна редукция цисплатина до 60 мг/м 2 и паклитаксела до 150 мг/м 2 , с последующим повышением при удовлетворительной переносимости);
- паклитаксел 175 мг/м 2 + карбоплатин AUC 5–6 1 день с интервалом 3 недели;
- цисплатин 50 мг/м 2 1 день + топотекан 0,75 мг/м 2 1– 3 дни с интервалом 3 недели;
- цисплатин 50 мг/м 2 1 день + ифосфамид 5000 мг/м 2 24-часовая инфузия с месной 400 мг/м 2 3 раза в день в 1 день каждые 3 недели;
- цисплатин 50 мг/м 2 1 день + гемцитабин 1000 мг/м 2 1 и 8 дни с интервалом 3 недели;
- цисплатин 40 мг/м 2 1 и 8 дни + иринотекан 60 мг/м 2 1 и 8 дни с интервалом 3 недели;
- паклитаксел 175 мг/м 2 1 день + топотекан 0,75 мг/м 2 1-3 дни с интервалом 3 недели (при невозможности применения платины).
Добавление к ХТ бевацизумаба 15 мг/кг с интервалом 3 недели до прогрессирования.
При прогрессировании РШМ на одной линии ХТ возможна 2-я линия:
- митомицин 7,5 мг/м 2 1 раз в 6 недели;
- иринотекан 125 мг/м 2 1, 8, 15 дни с интервалом 3 недели;
- гемцитабин 1000 мг/м 2 1, 8, 15 дни с интервалом 3 недели;
- доцетаксел 75 мг/м 2 с интервалом 3 недели;
- капецитабин 2500 мг/м 2 1-14 дни с интервалом 3 недели.
При интервале от последней ХТ более 6 месяцев возможны платиносодержащие режимы.
Возможно добавление бевацизумаба 15 мг/кг к режимам ХТ.
При рецидиве в малом тазу (без отдаленных метастазов) с анамнезом ЛТ, возможны:
1. системная ХТ;
2. экзентерация малого таза;
3. симптоматическая терапия.
При рецидиве в малом тазу (без отдаленных метастазов) без ЛТ, возможны:
1. химиолучевая терапия;
2. экзентерация малого таза.
При прогрессировании РШМ (при наличии отдаленных метастазов) с анамнезом ХЛТ монотерапия цисплатином менее эффективна, чем комбинация цитостатиков.
4. Реабилитация
Общие принципы реабилитации после хирургических вмешательств и/или ХТ и/или ЛТ.
5. Профилактика
1 раз в 3 месяца в течение первых 2 лет, каждые 6 месяцев в течение 3-го и 4-го года, затем ежегодно:
- анализ крови на SCC (при плоскоклеточном раке),
- осмотр гинеколога и взятие мазков на цитологическое исследование,
- УЗИ брюшной полости, забрюшинного пространства и малого таза
ежегодно рентгенография органов грудной клетки;
при росте SCC, появлении жалоб или находок при гинекологическом осмотре или УЗИ – углубленное обследование (КТ/МРТ брюшной полости и малого таза, рентгенография/КТ грудной клетки).
Читайте также:





