Криотерапия при раке почек
- English
- Русский







































Главное меню
- Редакционная коллегия
- Редакционный совет журнала
- Архив
- База авторов
- Порядок рецензирования статей
- Информация для авторов
- Информация для рекламодателей
- Издательский дом
- Политика редакции
- Обратная связь
Главное меню
- Редакционная коллегия
- Редакционный совет журнала
- Архив
- База авторов
- Порядок рецензирования статей
- Информация для авторов
- Информация для рекламодателей
- Издательский дом
- Политика редакции
- Обратная связь
Криоабляция в урологии
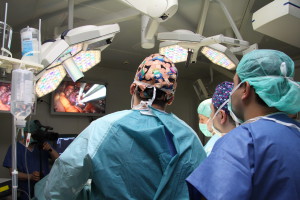
В урологии первые попытки применения криохирургии были осуществлены в 60-х годах XX века с целью лечения рака предстательной железы. Однако первые процедуры криоабляции были несовершенны – громоздкая конструкция криомашины, толстые криозонды, отсутствие контроля за проведением процедуры. Поэтому методика не получила широкого развития (Loening S.A., 1984). Сейчас аппаратура подверглась значительным усовершенствованиям – появились криомашины III поколения, которые используются в операционных ведущих клиник. С целью криоабляции используются газы аргон и гелий (аргон, расширяясь, способен охладиться до -850С, а гелий, расширяясь, наоборот, нагревается). Также используются тонкие, диаметром 17G иглы, что сравнимо с иглой для биопсии (рисунок 1).

Рисунок 1. Аппаратура для проведения криоабляции – III поколение
Для того чтобы выполнить криоабляцию опухоли почки, достаточно достичь температуры -40оС. Физическое и биологическое воздействие криоабляции заключается в чередовании фаз замораживания и оттаивания, которое вызывает следующие эффекты.
1. Цитотоксический эффект – при достижении температуры -150С в межклеточном пространстве образуются кристаллы льда. Это повышает осмолярность межклеточного пространства и способствует выходу в него внутриклеточной жидкости. Во внутриклеточном пространстве, наоборот, развивается гиперосмолярность. При дальнейшем понижении температуры до -400С кристаллы льда начинают образовываться и во внутриклеточной жидкости, что ведет к разрушению мембран органелл клетки и самой клеточной мембраны. До 90% клеточных мембран необратимо разрушаются уже после первой заморозки. При последующем оттаивании, клетки с гиперосмолярным содержимым, чьи мембраны еще способны к транспорту воды, набирают жидкость, и разрушаются либо под воздействием гипергидратации, либо от формирования внутриклеточного льда в следующем цикле заморозки. Таким образом, температура -400С является летальной, причем особенно цитотоксический эффект выражен именно у опухолевых клеток, так как для них характерен более высокий обмен веществ. Такие сосудистые реакции, как повышенная отечность тканей и стаз с последующим тромбозом мелких
сосудов, приводят к дальнейшему некрозу тканей и индуцированию апоптоза (Baust J.G., 2005) .
2. Сосудистые реакции. Впервые корреляцию между замораживанием и повреждающей сосудистой реакцией выявил Cohnheim в 1877 г.
Он предположил, что некроз в замороженной, а затем оттаявшей ткани был вызван тромбозом после оттаивания. Позднее, его предположения были подтверждены Lewis (1926 г.) и другими учеными, доказавшими, что именно такие явления, как повышенная отечность тканей, стаз и дальнейший тромбоз мелких сосудов приводят к некрозу после цикла заморозки/оттаивания опытного образца ткани.
L. Marzella на экспериментах с замораживанием ушей кроликов обратил внимание на важную роль холодового повреждения эндотелия в развитии дальнейшей сосудистой реакции (Marzella L., 1989). Эндотелий разрушался при заморозке, а при оттаивании отмечалась немедленная тромбоцитарная агрегация, одновременно с которой начиналось накопление межклеточной жидкости и активация нейтрофилов. Через 6 часов начиналась экстравазация эритроцитов, а через сутки – расслоение эндотелия.
3. Активации иммунной системы (ИС) в результате криоабляции.
Первая теория активации ИС – это образование антител к опухоли в результате высвобождения внутриклеточных антигенов, которые захватываются антиген-представляющими клетками иммунной системы и запускают трансформацию В-лимфоцитов в плазматические клетки, а также хемотаксис нейтрофилов и макрофагов (Grana L., 1969).
Другая теория предполагает развитие иммунной реакции посредством индуцирования цитотоксических T-лимфоцитов. Предполагается, что замораживание тканей сенсибилизирует цитотоксические Т-лимфоциты, или усиливает презентацию антигенов (Eskandari H., 1982).
Третья теория описывает стимуляцию natural killer клеток в результате действия сверхнизкой температуры, хотя корреляция между этими процессами еще не достаточно исследована (Matsumura K., 1982).
Криоабляция уже давно не является экспериментальной методикой. Американская урологическая ассоциация (AUA) исключила криоабляцию из списка экспериментальных методов в 1996 г., а в 2009 г. к этому мнению присоединилась Европейская ассоциация урологов.
Криоабляция может проводиться различными доступами – лапароскопически, перкутанно под контролем УЗИ или КТ и открытым способом (таблица 1).
Таблица 1. Число рецидивов после криоабляции (сводные данные)
| Источник | Доступ | Число пациентов | Среднее время наблюдения (мес.) | % рецидивов (число пациентов) |
|---|---|---|---|---|
| Matin et al., 2006 | лапароскопический | 204 | 24 | 3,9%(8) |
| Hegarty et al., 2006 | лапароскопический | 164 | 36 | 1,8%(3) |
| Lawatsch et al., 2006 | лапароскопический | 59 | 26,8 | 3,3%(2) |
| Gill et al., 2007 | лапароскопический | 60 | 72 | 6,7%(3) |
| Turro et al., 2007 | лапароскопический | 119 | 39,7 | 0,8%(1) |
| Miki et al., 2006 | перкутанный | 13 | 35 | 15%(2) |
| Pormpongkosol et al., 2006 | перкутанный | 21 | 12,3 | 9,5% (2) |
Показанием для криоабляции опухоли почки является размер опухоли не более 4 см, отсутствие региональных и отдаленных метастазов, множественные опухоли почек, единственная почка или снижение функции почек, двустороннее поражение. Также криоабляции могут подлежать пациенты с высоким риском хирургического вмешательства, либо пациенты, которые временно воздерживаются от открытого оперативного вмешательства. Криоабляция может рассматриваться в качестве паллиативного, циторедуктивного лечения при метастатических опухолях почек.
Противопоказанием являются опухоли ворот почки или центральной зоны (близкое расположение сосудов), контактирующие с лоханкой или в/3 мочеточника, наличие метастазов, кроме случаев, когда криоабляция проводится с паллиативной целью, пациенты, получающие антикоагулянтную терапию, которую нельзя отменить (Kunkle D.A., 2008).
Если сопоставить открытую резекцию почки, парциальную нефрэктомию и остальные методы, то при достаточно большом количестве пациентов, участвующих в исследовании, несколько авторов показали относительно небольшое количество местных рецидивов, даже по сравнению с радиочастотной абляцией (РЧА) – 4,6% и 11,8% соответственно (Kunkle D.A., 2008, Stephen Jones, 2010). Необходимость повторных процедур при криоабляции составляет 1,3%, при РЧА – 8,5%, что говорит об абсолютном преимуществе криоабляции в отношении местных рецидивов и необходимости повторных лечебных процедур. Получены данные об общей выживаемости – от 88 до 98% (таблица 2). Процент безрецидивной выживаемости составляет 90,6%, при среднем наблюдении 19,5 месяцев (Stephen Jones, 2010). Процент канцерспецифической выживаемости составляет 95% при среднем периоде наблюдения 20 месяцев.
Таблица 2. Общая выживаемость после криоабляции (сводные данные)
| Год | Средний размер опухоли | Число больных | Наблюдения (месяцы) | % | |
|---|---|---|---|---|---|
| Davol et al. | 2006 | 2,5 | 40 | 36 | 88 |
| Bandl et al. | 2007 | 2,5 | 78 | 15 | 94 |
| Cestari et al. | 2004 | 2,6 | 35 | 20 | 97 |
| Schwartz et al. | 2006 | 2,6 | 55 | 10 | 98 |
| Aron et al. | 2008 | 2,3 | 88 | > 60 | 93 |
| Silverman et al. | 2005 | 2,6 | 26 | 14 | 92 |
| Gupta et al. | 2006 | 2,4 | 16 | 6 | 94 |
Самое главное преимущество криоабляции по сравнению с другими малоинвазивными методами – это наибольшая сохранность функции почки. Процент снижения почечной функции при криоабляции опухоли почки составляет 6%, при радиочастотной абляции – 13% и открытой резекции – 26% (AUA Guidelines, 2009).
Криоабляция характеризуется невысоким количеством осложнений. Осложнения, требующие конверсии, составляют не более 3,5% случаев. Другие серьезные осложнения, но не требующие конверсии, встречаются не более чем в 2% пациентов. Осложнения в виде болей в месте оперативного вмешательства, инфекций мочевыводящих путей, инфицирования раны, наблюдаются чаще, но они не имеют существенного значения (AUA Guidelines, 2009).
Клинический случай


Рисунок 3. Выполнение лапароскопической криоабляция опухоли левой почки

Рисунок 4. Контрольное КТ-исследование на 6-е сутки после выполнения
лапароскопической криоабляции
Спустя год после операции в области ранее расположенной ангиомиолипомы визуализируется рубцовая ткань.
Выводы
Криоабляция – это малоинвазивная процедура, имеющая достаточно высокую эффективность и низкий риск осложнений. Ее можно проводить повторно, она является методом выбора для больных с тяжелой сопутствующей патологией и оказывает, по сравнению с другими малоинвазивными методами, минимальное влияние на функцию почки.
Ключевые слова: криоабляция, рак почки.
Keywords: cryoablation, kidney cancer.
Криотерапия не уступает радикальному удалению простаты в эффективности, но имеет меньший риск осложнений
Криотерапия рекомендована пациентам с серьезными сопутствующими (сердечными, неврологическими) заболеваниями. При низком или умеренном онкологическом риске). В случае повторного возникновения после удаления опухоли другим способом.
В сравнении с простатэктомией в шесть раз меньше риск недержания мочи
Эффективность криоаблации при низком онкологическом риске достигает 90%, при среднем – 75%, при высоком – 60%.
- большой объем предстательной железы (>50 см3);
- затрудненное мочеиспускание (при урофлоуметрии максимальная скорость мочеиспускания Q max импотенцию , она не рекомендована мужчинам, заинтересованным в сохранении эректильной функции.
Опухоль замораживают до состояния ледяного шара, происходит криодеструкция – разрушение опухолевой ткани
Сначала опухолевый очаг охлаждают Аргоном до -40-60 °C, затем восстанавливают естественную температуру Гелием. В результате смены температур происходит разрыв мембран раковых клеток. Газ вводят через криозонды – специальные иглы диаметром с вязальную спицу. Ультразвуковой контроль помогает сформировать ледяной шар без вреда прилегающим органам.
В течение полуторачасовой операции заморозку выполняют дважды. В завершение устанавливают уретральный катетер, который удаляют на 5 день. На следующий день после восстановления мочеиспускания пациента выписывают домой без ограничений в физической нагрузке.
Операция минимально инвазивная, занимает меньше времени, чем традиционное пособие и легче переносится пациентами.
Развитие технологии отражает общую тенденцию: современная хирургия все меньше использует скальпель. Поле битвы с болезнью смещается на клеточный уровень.
Суть технологии заключается в разрыве клеточной мембраны опухолевой клетки путем резкой смены температур. Первоначально в опухолевый очаг вводится аргон, который охлаждает опухоль до -40-60 градусов по Цельсию. И затем вторым этапом в опухолевый очаг вводится газ Гелий, который восстанавливает температуру до естественных цифр.
На сегодняшний день криоабляцию возможно выполнять при открытой и лапаросокпической операции, выделив опухолевый узел. И наименее инвазивно - чрескожным доступом. Говоря о чрескожной криоабляции, чаще всего эта операция выполняется с помощью КТ-навигации. Также возможно выполнение под контролем МРТ. Мы в клинике урологии Первого МГМУ используем наиболее технически простой, доступный, не сопровождающийся лучевой нагрузкой метод, это метод ультразвуковой навигации.
Важно отметить два момента. Первый - это визуализация. Второй - локализация. Не любая опухоль может быть подвержена чрескожной криоабляции. Опухоли среднего и нижнего сегмента почки, располагающиеся по задней или латеральной поверхности.
Криоабалация относится к высокотехнологичным операциям, поэтому несколько слов о техническом обеспечении. Мы используем для ультразвуковой навигации аппарат экспертного класса BK medical Flex Focus 800. Непосредственно криомашина третьего поколения The SeedNet Gold. На рынке уже представлены криомашины четвертого поколения, однако этот аппарат полностью отвечает всем предъявляемым к нему требованиям. Сами газы - аргон и гелий. И криозонды. В настоящее время на российском рынке представлено два вида зондов, с помощью которых газ вводится в опухолевый очаг. Это - IceSeed и IceRod. Их отличие друг от друга только в диаметре формирования ледяного шара.
Наше исследование было выполнено в 2015 году, это наш первый опыт. За этот период было прооперировано 8 пациентов. Семь пациентов были со стадией Т1а, размер опухоли около 3 см. Одна пациентка - со стадией Т1б, размер опухоли составлял около 4,5 см. Пять операций были выполнены под спинальной анестезией, три крайне - под местной анестезией.
Всем пациентам на доопреационном этапе выполняли ультразвуковое исследование почек в сочетании с допплерографией. Хорошо визуализировали опухолевый узел. Также выполняли мультиспиральую томографию почек с констатированием. Все образования активно накапливали контрастный препарат. Градиент накопления составлял около 200 ед Хамсвильда.
Всем пациентам выполняли компьютерное 3D-моделирование патологического процесса. Определяли распространение опухолевого процесса, соотношение внутренней поверхности опухолевого узла к элементам чашечной-лоханочной системы.
Сама операция включала в себя несколько этапов. Первый этап - это ультразвуковая навигация и планирование. Второй этап - пункционная биопсия. Отмечу, что в этом вопросе нет единого мнения среди мировых специалистов. В ряде центров биопсию предпочитают выполнять заранее, недели за две-три до предполагаемой операции. И идти на нее уже морфологически верифицированным диагнозом. Иные доверяют заключениям лучевых методик и выполняют биопсию интраоперационно.
Тестирование зондов - это стандартная процедура, предусмотренная протоколом. Прежде чем ввести зонд в опухолевый очаг, мы должны быть уверены в его функционировании. исправности.
Непосредственно сам этап проведения зонда. Здесь мы видим очень хорошую визуализацию, установку зондов. В среднем, на установку одного зонда уходит от 5 до 8 минут.
Далее ультразвуковой мониторинг повторно. Проверка установки криозондов. На схеме представлено каким образом зоны должны быть установлены, чтобы полностью покрывать опухоль зоной ледяного шара. И дальше следует два процесса. Сам процесс абляции, он включает два цикла заморозки, которые следуют друг за другом. Каждый по 10 минут. Заключаются они в подаче Аргона в опухолевый очаг. Далее следуют два цикла пассивной разморозки. Каждый по 6 минут, заключающиеся в том, что мы перестаем подавать Аргон и выжидаем. И два цикла активной разморозки. Они идут по две минуты и заключаются в том, что мы начинаем подавать Гелий в опухолевый очаг.
Все операции прошли без особенностей. Послеоперационный период тоже был спокойным. пациентов, которых оперировали под местной анестезией, мы отпускали на следующий день. А пациентов, которые были прооперированы под спинальной анестезией, спустя 2-3 дня после операции, учитывая особенности анестизиолгоического пособия.
Всем пациентам спустя 6 месяцев после операции мы выполняли контрольную мультиспиральную компьютерную томографию почек с контрастированием. У 7 пациентов со стадией Т1а с размером опухоли 3 см, мы отмечали в зоне первоначального расположения опухоли трубцовые изменения, в этой зоне отсутствовало накопление контрастного вещества либо градиент не превышал его 10 ед Хамсфильда. У одной пациентки со стадией Т1б и размером опухоли 4,5 см произошло уменьшение опухоли на 8 мм. Однако в опухоли оставался очаг до 1,5 см, который активно накапливал контрастный препарат. Этой пациентке в дальнейшем мы выполнили лапароскопическую резекцию, которая прошла у нас без каких-либо технических особенностей.
Подводя итог нашему исследования, мы пришли к выводу, что чрескожная криоабляция - это безопасный и эффективный метод лечения больных с опухолью почки размером до 3 см, с локализацией в среднем или нижнем сегменте почке по задней или латеральной поверхности.
Уважаемые коллеги, наша современная наука достигла высоте волшебства. С детства мы помним замечательную историю Кая - мальчика с ледяным сердцем. Однако в нашем случае наука - добрая фея, а процесс замораживания позволяет предотвратить прогрессирование онкологии и продлить человеку жизнь.
Я уверен, что за малоинвазимными методикам, они безусловно являются трендом современной медицины, путь их освоения непростой, но безусловно за ними будущее.
Стоимость криоабляции в Москве – бесплатно по федеральной квоте
Сложностей с получением квоты, обычно, не возникает. Наши врачи помогут заполнить необходимые документы. Цена криоабляции рака простаты по каналу платных медицинских услуг, в том числе для иностранных граждан, составит 400 тыс рублей.
Криоабляция простаты доступна в двух медицинских центрах России
В нашей клинике криотерапию выполняет кандидат медицинских наук Дмитрий Еникеев . Он прошел стажировку в клинике Барзилай (Израиль) под руководством одного из основателей метода профессора Шмуэля Цитрона.
Криоабляция — это терапевтический метод, применяемый с целью стимулирования гибели раковых клеток с помощью холода. Метод используется в противораковых схемах, когда оперативное вмешательство невозможно или неэффективно. В некоторых случаях криоабляцию применяют в качестве первичного лечения рака почек, печени, легких и простаты, после которого показано хирургическое вмешательство. Кроме того, метод эффективен в целях облегчения болевых ощущений при различных типах рака, который распространился в виде метастазов на кости или другие органы. Синонимы метода — чрескожная абляция, криодеструкция или криотерапия.
- Для чего применяют криоабляцию
- Необходимое оборудование
- Криоабляция различных органов
- Ощущения пациента
- Преимущества и осложнения
- Когда криоабляция неэффективна
Для чего применяют криоабляцию и при каких заболеваниях
Во время процедуры жидкий азот или аргон поступает в игольчатой аппликатор (криозонд), создавая условия низких температур от 90 до 150 градусов со знаком минус. Пораженные клетки тканей замораживаются и разрушаются. Кроме того, за счет замерзания локальных кровеносных сосудов, исключается трофика (питание) патологических участков. Затем, в зависимости от величины пораженных площадей, их могут подвергнуть хирургическому удалению. Более мелкие участки рассасываются самостоятельно.
Корректировка вхождения криозонда осуществляется с помощью визуальных методов.
- УЗИ.
- Компьютерная томография (КТ).
- Магнитно-резонансная томография (МРТ).
Криотерапия может применяться местно на поверхности кожи, чрескожно или хирургически. Местная криотерапия обычно используется в случае кожных и глазных заболеваний. При патологических состояниях, возникающих ниже поверхности кожи, игольчатый зонд или аппликатор проводится вглубь. Иногда в таких случаях может потребоваться хирургический разрез наружных кожных покровов.
Криотерапия применяется с целью лечения разных состояний.
- Опухоли на коже.
- Предраковые кожные невусы.
- Другие образования на коже неуточненной этиологии и генеза.
- Веснушки.
- Ретинобластомы — редкий рак сетчатки детского возраста.
- Злокачественные новообразования простаты, печени, сердца, шейки матки, особенно если хирургическая резекция по показаниям невозможна.
Криотерапия также используется для лечения опухолей различного качества в других частях тела, таких как почки, кости, чаще — на позвоночнике, легких и молочных железах. Эта методика, хотя и необходимы еще дальнейшие исследования с целью определения долгосрочной эффективности метода криотерапии, на сегодняшний день показывает хорошие результаты у многих пациентов.
Необходимое оборудование для проведения криоабляции
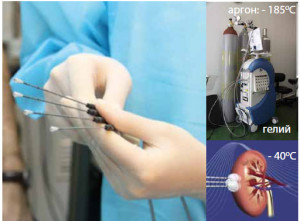
Процедура криоабляции не представляет особой сложности для пациента, но требует хорошего мастерства от специалиста, проводящего замораживание. Пару десятков лет назад с целью замораживания живых тканей применялся комплекс отдельного оборудования, требующего тщательного ухода и частого ремонта. На сегодняшний день медицинская промышленность выпускает монолитные консоли, снабженные всем необходимым оборудованием для проведения точных и эффективных манипуляций.
В зависимости от стоимости консолей, контролирующими элементами ввода криозонда могут быть УЗИ, компьютерная томография (КТ) или магнитно-резонансная томография, которые визуально помогают специалисту ориентироваться во внутренних тканях. Стоит отметить, что дозировки хладагентов, временные экспозиции и другие расчеты проводятся электронными цифровыми устройствами , что сводит к минимуму ошибочность, допускаемую часто из-за человеческого фактора.
Криозонд представляет из себя тонкую прочную трубку, напоминающую авторучку или набор из серии мелких игл. Криозонд соединен с помощью трубопровода с источником азота или аргона. Большинство консолей используют газ аргон, как более лояльный к живым тканям хладагент, одобренный Министерством здравоохранения.
Бронхоскоп — тонкая трубка с видеокамерой и освещением на рабочем конце, используется с целью визуального исследования внутренних полостей трахеи и бронхов. Этот инструмент часто используется при криоабляции на верхних дыхательных путях.
Система криотерапии, как правило, размещается в отдельной процедурной комнате. Компьютерная система используется с целью корректировки расчетов, в том числе управления потоком хладагента, который обычно хранится в близлежащих газовых баллонах.
Другое оборудование, которое может быть использовано во время процедуры, включает в себя капельницу, ультразвуковые ручные аппараты и устройства, контролирующие частоту сердечного и дыхательного ритма, а также другие физиологические показатели жизнедеятельности.
Криоабляция сердца, почек, простаты и при заболеваниях других органов: в чем отличия и механизм проведения
Основа процедуры криодеструкции при терапии в любых органах всегда одинакова. Как уже отмечалось, суть метода заключается в стимулировании гибели патологических клеток с помощью глубокого замораживания и прерывания их кровеобеспечения. Разница между использованием на различных органах заключается лишь в температуре хладагента, времени воздействия на клетки и использовании дополнительного оборудования, которое может потребоваться при работе на отдельных органах. Кроме того, в некоторых случаях может потребоваться применение общего наркоза, особенно при обработке внутренних органов.
Криоабляция простаты умеренно эффективна, но, как и любой процесс вмешательства в функциональность железы, может привести к импотенции.
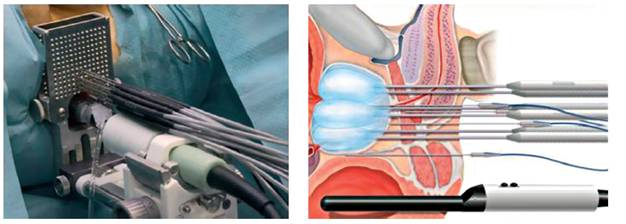
Замораживание участков тканей простаты используется среди трех категорий пациентов.
Почечная криоабляция также умеренно эффективна в борьбе против небольших опухолей, обнаруженных в почках и надпочечниках. В 2010 году была представлена кульминация 8-летнего исследования по результатам почечной криоабляции — общая частота рецидивов рака почек была снижена на 14 %. Другому ряду исследователей удалось добиться показателей в 11 % и 13 %.
Криоабляция на сердечных тканях используется для восстановления нормальной электрической проводимости путем замораживания тканей или сердечных путей проводимости, которые мешают нормальному распределению импульсов сердца, что часто проявляется в виде симптома аритмии.
Процедура в данном случае применяется в двух видах вмешательства — использовании катетера и предварительного хирургического рассечения тканей. Криокатетер в виде очень тонкой трубки вставляется в вену на ноге пациента и постепенно проводится к сердцу. В хирургической процедуре гибкий зонд применяется непосредственно на открытом сердце.
Замораживание областей проводится точечно и выборочно с целью достижения максимального эффекта, а также исключения сбоев в работе сердечной мышцы.
Метод замораживания в настоящее время широкого используется для лечения фиброаденомы молочной железы. Фиброаденомы представляют собой доброкачественные опухоли, образованные из разных тканей, чаще — из железистой, пропитанной фиброзными нитями. Заболевание встречается примерно у 10 % женщин, в возрасте 15-30 лет.
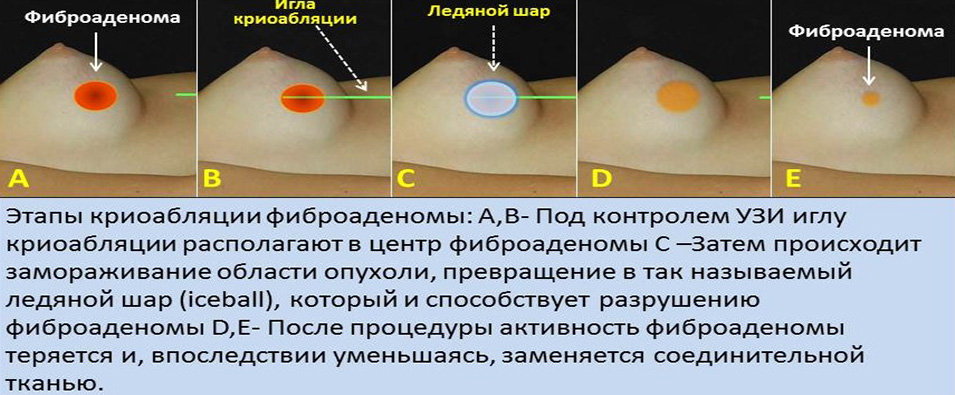
Аномальные клетки фиброаденомы уничтожаются замораживанием средними температурами, остаточные структуры которых со временем поглощаются иммунными клетками. Процедура может быть выполнена в условиях амбулатории с применением местной анестезии. Характерным отличием такого метода терапии является исключение образования крупных грубых рубцов по сравнению с открытой хирургической процедурой.
Ощущения пациента при проведении криобляции
Процедура криодеструкции, как уже отмечалось, для пациента не представляет особой тяжести, за исключением методов, обуславливающих работу на открытых органах.
В процессе проведения к телу пациента подключаются устройства для контроля частоты сердечных сокращений, артериального давления и частоты дыхательных движений.
Во время первого прохода криозонда пациент может ощутить небольшой контактный укол в области введения. Применение местной анестезии, как правило, снимает более серьезные болевые эффекты в момент проведения процедуры. Большинство ощущений, напоминающих зуд, приходится на место разреза кожи. Использование общей анестезии обуславливает полное отсутствие каких-либо ощущений в процессе.
При определенных показаниях используется общая седация в качестве обезболивания. Ее отличие от полной общей анестезии заключается в неполном отключении сознания. Пациент находится в сознательном состоянии, напоминающем возникающее во время ночного пробуждения в момент фазы глубокого сна.
- После зондовой криотерапии пациент в состоянии возобновить свои обычные действия в течение одного-трех дней.
- При использовании открытых способов доступа к тканям на восстановление требуется от семи до десяти дней.
- В течение следующего месяца пациент должен избегать подъема тяжестей и других физических нагрузок. О точных сроках расскажет лечащий специалист.
Возможные преимущества и осложнения при лечении данным методом
Как и любое инвазивное вмешательство в живые ткани, процедура криотерапии может обусловить разное соотношение положительных и отрицательных результатов. Особенно это касается лечения злокачественных новообразований — результат может быть непредсказуем. Поэтому в данном случае на чашу весов всегда кладутся преимущества возможного излечения и риска осложнений. Стоит отметить, что подобная процедура проводится только с разрешения пациента или лиц, его опекающих, с предварительным подробным ознакомлением.
- Восстановление организма даже при открытом хирургическом подходе будет всегда быстрее, чем при оперативном удалении опухоли.
- При использовании методик чрескожной криотерапии пациент, как правило, выписывается через несколько часов после процедуры, максимум — на вторые сутки. Реабилитация после других методов лечения рака может занимать от недели до полугода.
- Криотерапия — менее болезненная процедура, по сравнению с тепловыми и лучевыми методами лечения, например, в сравнении с радиочастотной абляцией.
- Чрескожная криотерапия менее травматична, чем открытые операции. Как правило, только небольшой разрез необходим для прохождения зонда через кожу. Следовательно, такая методика является менее дорогостоящей и приводит к меньшим количествам побочных эффектов, чем это случается при открытой операции.
- При лечении фиброаденомы молочной железы криотерапия вызывает минимальное количество рубцовой ткани без видимого эффекта кальцификации.
- Как и любая чрескожная процедура, криоабляция может провоцировать кровотечение как из места прокола, так и в областях замораживания тканей паренхиматозных органов, таких как печень, почки или легкие.
- Возможно повреждение нормальных здоровых структур. Например, во время криотерапии печени нередки случайные повреждения желчных протоков. При работе на почках мочеточниках могут быть задеты окружающие ткани. Прямая кишка может быть повреждена во время криотерапии простаты. Любое лечение живота может привести к повреждению кишечника и вызвать прободное отверстие в кишке, через которое содержимое кишечника проникнет в брюшную полость, что может привести к потенциальным, угрожающим жизни, инфекциям.
- Если замораживание происходит вблизи диафрагмы, жидкость может накапливаться в пространстве вокруг легких.
- Если процедура на легких, возможно их спадение.
- Возможны повреждения нервов. Полностью замороженные нервы могут вызвать моторную слабость или онемение в иннервируемой области.
- Осложнения, связанные с лекарствами, в том числе от анестезии.
- Женщины должны всегда сообщать своему врачу или рентгеновскому технику о возможной, но неподтвержденной беременности.
Кроме того, возможны осложнения, связанные непосредственно с работой на простате (в случае криоабляции именно этого органа).
Когда криоабляция неэффективна
Криотерапии является альтернативой для лечения рака в случае, когда хирургическое удаление опухоли может быть затруднено или для некоторых пациентов невозможно. Но долгосрочная эффективность метода еще изучается. В настоящее время мало опубликованных данных с долгосрочными результатами чрескожной криотерапии, но есть информация о том, что метод гораздо эффективнее по времени отсутствия рецидивов относительно хирургических способов или лучевой терапии.
Криотерапия считается локализованным методом терапии. Это значит, что она способна лечить болезни только в одном месте, на отдельном участке. Поэтому метод неэффективен для лечения рака, который распространился на другие части тела в виде метастазов.
На сегодняшний день криотерапевтические процедуры находятся на стадии изучения, периодически публикуется информация о новых методах и способах использования. Стоит отметить, что противопоказаний для проведения этой методики не отмечается. По сути, это — самый лояльный способ противораковой терапии, в сравнении с другими методиками химиотерапии и радиоактивного облучения.
Читайте также:

