Ковалентная неполярная связь образуется между хлором и

Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
3. Только ионной связью образовано каждое из веществ, формулы которых
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
11. Длина химической связи Э–Н уменьшается в ряду веществ
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это

Химическая связь и строение вещества.
1. Ковалентная связь – это связь между атомами неметаллов.
2. Полярная ковалентная связь образуется, если вещество сложное (HCl, H2O) а ковалентная неполярная связь образуется если вещество простое (Н2, О2).
3. Ковалентная связь образуется посредством образования общих электронных пар или по донорно-акцепторному механизму.
4. Ионная связь образуется между атомами, сильно отличающимися по электроотрицательности. Как правило, когда соединяются атомы металлов и неметаллов (NaCl, CaO). Это связь между разноименно заряженными ионами.
5. Металлическая связь образуется между атомами металлов за счет свободных электронов, удерживающих положительно заряженные ионы в кристаллической решетке. Это связь между положительно заряженными ионами металлов и электронами
6. Типы кристаллических решеток
А) атомная – образуется у веществ с ковалентной неполярной связью (С, В, Si), в узлах решетки находятся атомы, эти вещества являются самыми твердыми и тугоплавкими в природе.
Б) молекулярная – образуется у веществ с ковалентной полярной и ковалентной неполярной связями, в узлах решетки находятся молекулы, эти вещества обладают небольшой твердостью, легкоплавкие и летучие.
В) ионная – образуется у веществ с ионной связью, в узлах решетки находятся ионы, эти вещества твердые, тугоплавкие, нелетучие, но в меньшей степени, чем вещества с атомной решеткой.
Г) металлическая – образуется у веществ с металлической связью, эти вещества обладают теплопроводностью, электропроводностью, ковкостью и металлическим блеском.
Химическая связь и строение вещества.
1. В соединении калия с хлором химическая связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) металлическая
2. В соединении калия с кислородом химическая связь
1) металлическая 2) ковалентная полярная 3) ковалентная неполярная 4) ионная
3. Тип связи в молекуле азотной кислоты
1) ковалентная полярная 2) ионная 3) металлическая 4) ковалентная неполярная
4. Химическая связь соответственно: ионная, ковалентная полярная, ковалентная неполярная
1) NaCl, NH3, Br2 2) H2O, CaO, KCl 3) Cl2, MgO, HCl 4) NaOH, H2S,CO
5. Ковалентная неполярная связь в веществе
1) аммиак 2) сероводород 3) хлор 4) железо
6. Молекулярная кристаллическая решетка у
1) оксида серы (VI) 2) магния 3) кислорода 4) хлорида натрия
7. Формула вещества с ковалентной полярной связью
1) KNO3 2) HNO3 3) Cl2 4) NaCl
8. Формула вещества с ионной связью
1) K2S 2) NH3 3) O2 4) CaO
9. Ионная кристаллическая решетка у
1) углекислого газа 2) нитрата натрия 3) воды 4) графита
10. Атомная кристаллическая решетка у
1) алмаза 2) поваренной соли 3) аммиака 4) кристаллической соды
11. Наибольшую температуру плавления имеет вещество
1) с ионной кристаллической решеткой
2) с атомной кристаллической решеткой
3) с молекулярной кристаллической решеткой
4) с металлической кристаллической решеткой.
12. Схема электронного строения А: В: А соответствует веществу, формула которого
1) NH3 2) CH4 3)H2S 4) CaCl2
13. Какое из веществ образовано металлической связью?
1) SO3 2) N2O 3) Br2 4) Fe
14. Вещество, не образованное ионной связью
1) хлорид калия
2) оксид натрия
3) нитрат магния
4) оксид серы (IV)
15. Высокая электропроводность и теплопроводность характерны для веществ с
1) металлической связью
2) ионной связью
3) ковалентной полярной связью
4) ковалентной неполярной связью
16. Какое из указанных веществ образовано ионной связью?
1) NH3 2) K2O 3) H2O 4) CH4
17. Какое из указанных веществ имеет ковалентную неполярную связь?
1) Br2 2) NO2 3) CO 4) NaCl
18. Какое из указанных веществ имеет ковалентную полярную связь?
1) Na2S 2) N2 3) H2S 4) CaO
19. Тип связи в веществе, формула которого H2CO3
1) ковалентная неполярная 3) металлическая
2) ионная 4) ковалентная полярная
20. Тип связи в веществе, формула которого CuO
1) металлическая 3) ковалентная полярная
2) ионная 4) ковалентная неполярная
21. Тип кристаллической решетки у вещества СaCl2
1) ионная 3) атомная
3) молекулярная 4) металлическая
22. Ковалентная полярная связь характерна для каждого из двух веществ
1) алмаз и хлорид калия
2) кислород и метан
3) сероводород и вода
4) калий и аммиак
23. Ионная связь характерна для каждого из двух веществ
1) магний и хлорид натрия
2) оксид кальция и бромид калия
3) вода и азот
4) графит и сульфат натрия
24. Ковалентная неполярная связь характерна для каждого из двух веществ
1) оксид углерода (II) и хлорид калия
2) аммиак и углекислый газ
3) кислород и азот
4) бромид калия и бром
25. Ионная и ковалентная полярная связи соответственно у веществ
1) NaBr, CH4 2) NH3, O2 3) KBr, CO 4) Br2, Cl2
26. Ковалентная неполярная и ковалентная полярная связи соответственно к веществ
1) O2, NaCl 2) N2, CH4 3) KBr, CO 4) Br2, Cl2
Вспомним, как образуется ионная связь . Вы уже знаете, что атомы химических элементов стремятся завершить свои внешние электронные слои до устойчивого состояния. Так, атомы металлов отдают электроны с последнего электронного слоя атомам неметаллов, при этом образуются разноименно заряженные ионы, которые притягиваются. Именно так в соединениях образуется ионная связь.
Образование химической связи между одинаковыми неметаллами

Рис. 1. Атом водорода
Если в состав молекулы вещества входят атомы одного химического элемента, например, два атома водорода Н 2, то, очевидно, связь между ними не может образовываться по ионному механизму. Механизм образования связи в молекулах простых веществ-неметаллов отличается от образования ионной связи.
В соответствии с моделью Нильса Бора, атом подобен солнечной системе – электроны вращаются вокруг ядра атома по строго определенным орбитам. Например, в соответствии с этой моделью, атом водорода будет выглядеть, как показано рис.1. Заряд ядра атома водорода равен +1. Вокруг ядра вращается всего один электрон.


Рис. 2. Электронная орбиталь атома водорода
Модель атома была уточнена немецким физиком Гейзенбергом.
Он выдвинул принцип неопределенности, в соответствии с которым можно говорить лишь о вероятности нахождения электрона в околоядерном пространстве. Таким образом, электрон не вращается вокруг ядра, а находится около него с определенной вероятностью.
Область пространства, в которой нахождение электрона наиболее вероятно, называют электронным облаком, или электронная орбиталь. Например, электронная орбиталь водорода имеет форму сферы. (см. Рис. 2.)
Образование связи между двумя атомами водорода в молекуле водорода Н 2

Рис. 3. Ковалентная неполярная связь в молекуле водорода
Рассмотрим образование связи между двумя атомами водорода. Рис.3. Химическая связь образуется в результате перекрывания атомных орбиталей. В этом случае между ядрами двух атомов образуется область повышенной электронной плотности. Такое состояние энергетически выгодно для обоих атомов, так как в данном случае оба электрона в равной степени принадлежат обоим атомам.
Образование связи в молекуле водорода можно показать как с помощью перекрывания атомных орбиталей, так и с помощью формул Льюиса. Два электрона стали общими для обоих атомов водорода.
Так как в атоме водорода всего один электронный слой, и он завершен, если на нем два электрона, такое состояние выгодно для обоих атомов – образовалась химическая связь.
Химическая связь, образующаяся в результате перекрывания атомных орбиталей, при котором пара электронов становится общей для обоих атомов, называется ковалентной связью
Обратите внимание: при ковалентной связи пара электронов становится общей для обоих атомов. Образование молекулы водорода – это пример ковалентной связи. При этом область повышенной электронной плотности находится посередине относительно центров ядер атомов, то есть пара электронов в равной степени принадлежит обоим атомам водорода. Такая связь называется ковалентной неполярной связью .
Химическую связь между атомами элементов, в результате которой электроны в равной степени принадлежат обоим атомам, называют ковалентной неполярной связью .
Ковалентная неполярная связь в молекуле хлора
Образование ковалентной неполярной связи в молекуле хлора Cl 2

Рис. 4. Образование связи в молекуле хлора
Атом хлора находится в седьмой группе, главной подгруппе периодической системы. Значит, на внешнем электронном слое у него семь электронов. До устойчивого, энергетически выгодного состояния ему не хватает всего одного электрона. Таким образом, образовав одну общую электронную пару, два атома хлора получат в свое распоряжение так необходимый каждому из них электрон.
Если заменить общую электронную пару черточкой, а электроны, не участвующие в образовании связи, не учитывать, то получим графическую формулу хлора. В молекуле хлора атомы соединены одинарной ковалентной неполярной связью. Рис.4.
Образование ковалентной неполярной связи в молекуле азота N 2

Рис. 5. Образование связи в молекуле азота
Азот находится в пятой группе, главной подгруппе таблицы Менделеева. Значит, на внешнем электронном слое каждого атома азота находится пять электронов. До устойчивого, энергетически выгодного состояния каждому атому азота не хватает трех электронов. Если каждый из этих атомов предоставит по три электрона на образование общих электронных пар, то приобретет энергетически выгодное состояние. Рис.5. Таким образом, в молекуле азота образуется тройная ковалентная неполярная связь.

Образование химической связи в молекуле Cl2
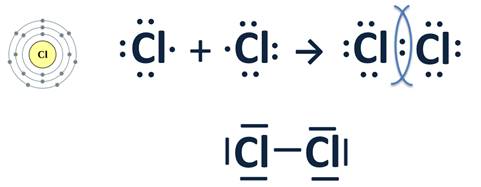
Ковалентная связь, или атомная, – это химическая связь, возникающая в результате образования общих электронных пар.
Эта химическая связь образуется между атомами одного и того же неметалла, при этом общие электронные пары, которые образовались, принадлежат обоим атомам в равной степени и ни на одном из них не будет ни избытка, ни недостатка отрицательного заряда, поэтому эта ковалентная связь называется неполярной.
Образование химической связи в молекуле Н2
Аналогично, образуется и молекула Н2. Однако атом водорода находится в IA группе, поэтому у каждого атома водорода только один электрон и до завершения внешнего энергетического уровня ему не хватает всего одного электрона (для атомов водорода и гелия уровень считается завершенным, если на нем 2 электрона). Каждый атом водорода имеет по одному электрону и эти неспаренные электроны объединяются, образуя общую электронную пару, которую также можно обозначить в виде черточки.
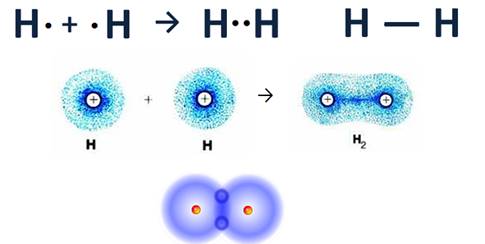
Кроме того, при сближении двух атомов водорода, каждый из которых имеет по одному s-электронному облаку сферической формы, происходит перекрывание этих электронных облаков. При этом образуется область, где плотность отрицательного заряда велика, положительно заряженные ядра притягиваются к ней, и образуется молекула.
Механизм образования более сложной молекулы О2
Кислород находится в VIA группе, следовательно, у него 6 электронов на внешнем уровне. А для того чтобы определить число неспаренных электронов, можно использовать формулу 8 – N, где N – номер группы. Поэтому у каждого атома кислорода будет по 2 неспаренных электрона, которые и будут участвовать в образовании химической связи. Эти два неспаренных электрона объединяются с двумя другими неспаренными электронами другого атома и образуется две общие электронные пары, что условно можно изобразить в виде двух чёрточек.
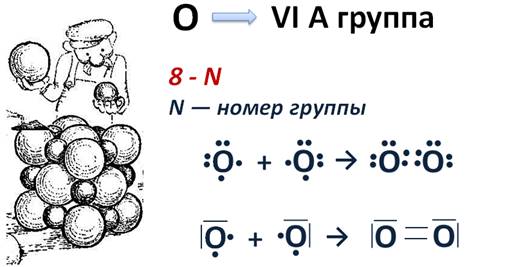
Так как, связь в молекуле кислорода состоит из двух электронных пар, ее называют еще двойной, она будет буде более прочной, чем одинарная, как в молекуле водорода. Чем прочнее связь между атомами в молекуле, тем меньше расстояние между ядрами атомов. Это расстояние называется длиной связи. Тройная связь еще короче двойной, но гораздо прочнее. Например, в молекуле азота тройная связь, для того чтобы разделить молекулу на два атома необходимо затратить в семь раз больше энергии, чем для разрыва одинарной связи в молекуле хлора.
Ковалентная неполярная связь-это связь, образованная между одинаковыми элементами неметаллами за счет образования общей электронной пары.
Данная связь характерна для простых веществ неметаллов. Пример: H2, O2, Cl2, P4, S8, C и т.д.
Вещества с данной связью имеют в твердом состоянии молекулярную либо атомную кристаллическую решетку.
Рассмотрим схему образования ковалентной неполярной связи для этого воспользуемся формулой Льюиса.
Американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками, которые необходимо располагать по сторонам света относительно символа элемента. Одна точка обозначает один электрон.
Возьмём на примере образования молекулы H2.

На рисунке мы видим атомы водорода с их атомными орбиталями, которые при образовании связи образуют молекулярную орбиталь. Чтобы показать схему Льюиса необходимо найти электроны внешнего электронного уровня и число неспаренных электронов. Число электронов на внешнем электронном уровне показывает группа химического элемента (для главных подгрупп). Электроны внешнего электронного уровня называют валентными. Число неспаренных электронов находим по формуле 8 — № группы.
Например, для азота 8-5 = 3, то есть 3 неспаренных электрона.
У атома водорода один электрон, то есть в молекуле между атомами может образоваться только одна связь. Схеме будет выглядеть так:

Для азота необходимо распределить электроны внешнего уровня одну пару и три неспаренных электрона относительно символа в схеме Льюиса.
При образовании связи каждый атом окружается электронами согласно числу электронов, на завершённом уровне, то есть два или восемь – правило дуплета или октета.
Схема будет такая:

Число связей между атомами зависит от количества общих электронных пар.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна черточка в структурных формулах.
Двойные и тройные связи имеют общее название – кратные связи. О молекуле азота говорят, что она имеет порядок связи, равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Ковалентная полярная связь-это связи образованная между разными элементами неметаллами, где более электроотрицательный элемент оттягивает ближе к себе электронную пару от менее электроотрицательного.
Характерна для сложных веществ образованных элементами неметаллами. Примеры: NH3, H2O, CO2 и т.д. вещества с данной в твёрдом состоянии имеют также молекулярную либо атомную кристаллическую решётку.
Электроотрицательность свойство атома притягивать к себе электроны от атомов других элементов.
Электроотрицательность -это мера неметалличности элементов. Высокая электроотрицательность характерна для неметаллов и низкая для металлов. Самый электроотрицательный элемент фтор. Электроотрицательность в периодической системе изменяется: в группе с верху вниз – уменьшается, в периоде с лева на право- возрастает. Можно запомнить так чем дальше отдаляемся от фтора, тем меньше становиться электроотрицательность элемента (так как фтор самый электроотрицательный).
Рассмотрим образование связи между водородом и хлором в молекуле хлороводорода.
У водорода один электрон на внешнем уровне, а у хлора семь из которых один неспаренный участвующий в образовании связи.
Так как хлор более электроотрицательный элемент, он оттягивает электронную пару к себе ближе при образовании молекулярной орбитали. При смещении на хлоре образуется частичный отрицательный заряд, а на водороде частичный положительный заряд, возникает полярность. При составлении формулы Льюиса общую электронную пару необходимо рисовать ближе к более электроотрицательному элементу.


Если рассмотреть аммиак, то в данной молекуле азот имеет три неспаренных электрона и образует три связи с тремя атомами водорода у которых по одному электрону. И все пары оттягивает азот ближе к себе.
Электроны, находящиеся на перекрывающихся электронных орбиталях, поступают в общее пользование. При этом создаётся ситуация, при которой внешние электронные уровни атомов оказываются заполненными, то есть образуется 8-ми или 2-х электронная внешняя оболочка.
Состояние, при котором электронная оболочка заполнена полностью, характеризуется наименьшей энергией, а соответственно, и максимальной устойчивостью.
Механизмов образования два:
- донорно-акцепторный;
- обменный.
В первом случае один из атомов предоставляет свою пару электронов, а второй — свободную электронную орбиталь.
Во втором — в общую пару приходит по одному электрону от каждого участника взаимодействия.
В зависимости от того, к какому типу относятся — атомному или молекулярному, соединения с подобным видом связи могут значительно различаться по физико-химическим характеристикам.
Молекулярные вещества чаще всего газы, жидкость или твёрдые вещества с низкими температурами плавления и кипения, неэлектропроводные, обладающие малой прочностью. К ним можно отнести: водород (H 2), кислород (O 2), азот (N 2), хлор (Cl 2), бром (Br 2), ромбическую серу (S 8), белый фосфор (P 4) и другие простые вещества; диоксид углерода (CO 2), диоксид серы (SO 2), оксид азота V (N 2 O 5), воду (H 2 O), хлороводород (HCl), фтороводород (HF), аммиак (NH 3), метан (CH 4), этиловый спирт (C 2 H 5 OH), органические полимеры и другие.
Вещества атомные существуют в виде прочных кристаллов, имеющих высокие температуры кипения и плавления, не растворимы в воде и прочих растворителях, многие не проводят электрический ток. Как пример можно привести алмаз, который обладает исключительной прочностью. Это объясняется тем, что алмаз представляет собой кристалл, состоящий из атомов углерода, соединённых ковалентными связями. В алмазе нет отдельных молекул. Также атомным строением обладают такие вещества, как графит, кремний (Si), диоксид кремния (SiO 2), карбид кремния (SiC) и другие.
Ковалентная связь может быть образована как между двумя атомами одного элемента (неполярная), так и между атомами различных химических элементов (полярная).
Указать формулу соединения с ковалентной полярной связью не представляет труда, если сравнить значения электроотрицательностей, входящих в состав молекул атомов. Отсутствие разницы в электроотрицательности определит неполярность. Если же разница есть, то молекула будет полярна.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Ковалентная неполярная химическая связь
Характерна для простых веществ неметаллов. Электроны принадлежат атомам в равной степени, и смещения электронной плотности не происходит.
Примером могут служить следующие молекулы:
H2, O2, О3, N2, F2, Cl2.
Исключением являются инертные газы. Их внешний энергетический уровень заполнен полностью, и образование молекул им энергетически не выгодно, в связи с чем они существуют в виде отдельных атомов.
Также примером веществ с неполярной ковалентной связью будет, например, РН3. Несмотря на то, что вещество состоит из различных элементов, значения электроотрицательностей элементов фактически не различаются, а значит, смещения электронной пары происходить не будет.
Ковалентная полярная химическая связь
Рассматривая ковалентную полярную связь, примеров можно привести множество: HCl, H2O, H2S, NH3, CH4, CO2, SO3, CCl4, SiO2, СО.
Ковалентная полярная связь образуется между атомами неметаллов с различной электроотрицательностью. При этом ядро элемента с большей электроотрицательностью притягивает общие электроны ближе к себе.
В зависимости от механизма образования общими могут становиться электроны одного из атомов или обоих.
Пара электронов принадлежит и одному атому, и второму, у обоих, таким образом, внешние уровни заполнены. Но более электроотрицательный хлор притягивает пару электронов чуть ближе к себе (при этом она остаётся общей). Разница в электроотрицательности недостаточно большая, чтобы пара электронов перешла к одному из атомов полностью. В результате возникает частичный отрицательный заряд у хлора и частичный положительный у водорода. Молекула HCl является полярной молекулой.
Физико-химические свойства связи
Связь можно охарактеризовать следующими свойствами: направленность, полярность, поляризуемость и насыщаемость.
Содержание:
Ковалентная связь – определение, характеристика. Что такое ковалентная связь?
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
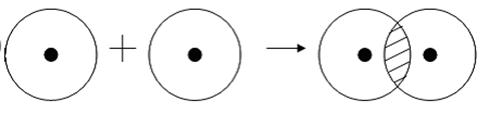
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
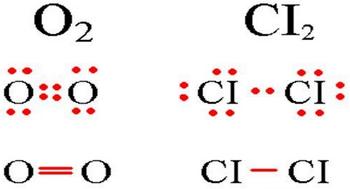
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Эта статья доступна на английском языке – Covalent Bond.
Читайте также:

