Кортикостероиды при опухолях мозга
Стероиды, продуцируемые корой надпочечников, получили название кортикостероидов.
В связи с тем что выработка гормонов коры надпочечника стимулируется адренокортикотропным гормоном гипофиза (АКТГ), последний также применяют в онкологической практике.
Известно, что среди большого числа гормонов коры надпочечников часть обладает свойствами половых гормонов андрогенного и эстрогенного действия.
После овариэктомии, производимой у молодых женщин по поводу рака молочной железы, обычно развивается гиперплазия коры надпочечников, и временно понизившийся уровень эстрогенов вновь повышается, чем, по-видимому, и объясняется непродолжительный эффект после овариэктомии. Следовательно, для усиления эффекта овариэктомии необходимо подавление функции коры надпочечников и дополнительной интерреналовой ткани с тем, чтобы добиться угнетения их эстрогенной функции. Это достигается путем либо адреналэктомии и гипофизэктомии, либо систематического введения кортикостероидов в течение длительного времени. Кортикостероиды угнетают продукцию АКТГ и опосредствованно через гипофиз приводят к угнетению функции интерреналовой ткани, включая кору надпочечников.
в случае их использования после орхиэктомии и терапии эстрогенами.
Кортикостероиды тормозят процессы пролиферации и благоприятно влияют на процессы созревания клеточных элементов кроветворной системы. Они подавляют митозы преимущественно в родоначальных клетках лимфоретикулярной ткани. В связи с этими свойствами кортикостероиды применяют при острых лейкозах. Данные об использовании кортикостероидов в терапии острых лейкозов представлены в монографии М. С. Дульцина, И. А. Кассирского, М. О. Раушенбаха (1965) и ряде других работ.
Однако полная гематологическая ремиссия под влиянием одних кортикостероидов наблюдается редко. В современной химиотерапии острого лейкоза кортикостероиды входят в качестве обязательного компонента в различные комбинации лекарственных средств.
При хроническом лимфолейкозе использование кортикостероидов нередко позволяет длительное время контролировать течение заболевания. Эффект кортикостероидов при лимфопролиферативных заболеваниях, в том числе при лимфолейкозе, объясняется лимфотропным действием, угнетающим влиянием на пролиферацию патологической незрелой ткани, стимулирующим влиянием на эритропоэз и гранулоцитопоэз и, наконец, способностью глюкокортикоидов подавлять аллергические и иммунные процессы, что делает эти препараты особенно ценными в борьбе с аутоиммунными осложнениями, характерными для течения лимфолейкоза.
Они входят также во многие схемы комбинированной химиотерапии солидных опухолей, например ангиогенных сарком. Кроме того, кортикостероиды используют для симптоматической терапии инкурабельных онкологических больных.
снимая явления отека вещества мозга; их назначают при гиперкальциемии, вызванной метастазами в кости, в более низкой дозе (10—40 мг) кортикостероиды нормализуют температуру тела, снижают опухолевую интоксикацию.
При назначении кортикостероидов с целью улучшения общего состояния необходимо помнить о возможности получения нежелательных эффектов. Wolf (1966) обнаружил, что применение кортикостероидов у больных неоперабельным раком легкого ведет с сокращению продолжительности их жизни по сравнению с контрольной группой, не получавшей никакого лечения.
Побочные явления при применении препаратов этой группы сводятся к нарушениям водного и солевого обмена, развитию алкалоза, повышению содержания сахара в крови, неврозу с возбуждением, бессоннице, иногда гирсутизму. Возможно развитие синдрома Кушинга, образование пептических язв желудка и двенадцатиперстной кишки.
Для предупреждения побочных явлений рекомендуется ограничить введение хлорида натрия, вводить соли калия и белковые вещества. Необходим контроль за содержанием сахара крови и изменениями психики. При длительном приеме высоких доз кортикостероидов с целью предохранения от распада белка целесообразно одновременно назначать анаболические средства, например метиландростендиол (25—50 мг в день), метандростенолон (дианабол, неробол).
Наибольшую опасность для ослабленных онкологических больных представляет присоединение вторичной инфекции, в частности грибковых заболеваний, так как глюкокортикоиды, подавляя реакции иммунитета, создают известную беззащитность организма. После длительного применения кортикостероидов может развиться угнетение функции надпочечников, поэтому в случае отмены лечения дозу кортикостероидов следует снижать постепенно, а для стимуляции коры надпочечников за 5—7 дней до прекращения приема кортикостероидов назначают АКТГ (10—20 единиц).
Наиболее распространенными препаратами группы кортикостероидов являются кортизон, гидрокортизон, преднизон, преднизолон, дексаметазон и триамцинолон.

выпускается обычно в виде кортизон-ацетата и представляет собой прегнен-4-диол-17а, 21-триона3,11,20-21-ацетат.
Применяется внутрь или внутримышечно. При острых лейкозах могут быть использованы высокие дозы: в начале лечения в течение 3—5 дней назначают по 75—100 мг 3 раза в сутки, затем по 50—75 мг 3 раза в сутки до наступления терапевтического эффекта. После этого препарат применяют по 50 мг 3 раза в сутки. Длительность лечения и дозы устанавливают индивидуально.
ежедневная суточная доза препарата составляет 50 мг, лучше вводить ее в 3—4 приема.
Выпускается в виде суспензии во флаконах по 5 мл (1 мл суспензии содержит 25 мг гидрокортизона) и применяется внутримышечно при тех же заболеваниях, что и кортизон. В связи с большой активностью гидрокортизона его доза обычно составляет 2/3 дозы кортизона.
представляет собой дегидрокортизон.
Эти синтетические препараты обладают эффектом кортизона, однако в 3—5 раз более активны и, что особенно важно, побочные явления при их применении менее выражены. Их применяют обычно внутрь при тех же заболеваниях, что и кортизон.
Дозы преднизолона и преднизона составляют 1\3 - 1\5 дозы кортизона. При острых лейкозах преднизон и преднизолон применяют в начальной дозе до 50—80 мг в сутки (дают за 2—3 приема). Длительность курсов и величина доз варьируют в зависимости от течения лейкоза. При применении методики средних доз до получения ремиссии принимают по 50—80 мг преднизолона в сутки, при наступлении терапевтического эффекта лечение не прекращают, а назначают поддерживающую дозу (15—30 мг в сутки). В случае выраженного угнетения интерреналовой системы через каждые 20—30 дней интенсивного лечения кортикостероидами надо вводить АКТГ в небольших стимулирующих дозах (15—20 единиц) в течение 4—5 дней.
— от 200—250 мг в сутки и даже до 1000 мг в сутки. Терапию кортикостероидами, даже в случаях отсутствия непосредственного эффекта, следует продолжать 4—5 нед. Обычно ее проводят в комбинации с лечением противоопухолевыми препаратами, в частности с антиметаболитами.
Учитывая возможность осложнений при длительной и массивной стероидной терапии целесообразно использовать прерывистый метод лечения, предусматривающий прекращение применения стероидных препаратов на время ремиссии.
— 9а-фтор-16а-метилпреднизолон в 8—10 раз активнее преднизона и преднизолона и в 35 раз активнее кортизона, в то же время в терапевтических дозах он, в отличие от кортизона, не вызывает задержки воды и хлорида натрия в организме. Выпускают препарат в таблетках по 0,0005 г (0,5 мг). Суточная доза 3—6 мг; принимают ее за 3—4 приема во время или после еды. Поддерживающая доза дексаметазона— 1 —1,5 мг в сутки.
Триамцинолон (Triamcinolonum) — 9а-фтор-16а-оксипреднизолон. Более активен, чем преднизолон; не вызывает задержки в организме воды и хлорида натрия, не оказывает влияния на калиевый баланс. Выпускают препарат в таблетках по 4 мг. Принимают внутрь в суточных дозах 16—40 мг. Поддерживающие дозы 2—10 мг (для. взрослых).
БАД "Фотостим" предназначен для:
- онкологических больных, имеющих злокачественные опухоли разных стадий;
- лиц с риском перерождения доброкачественных дерматозов (родинок, бородавок, папиллом) и предраковых состояний (лейкоплакий, дисплазивных очагов) в онкологические заболевания;
- лиц пожилого возраста для повышения сопротивляемости организма онкологическим заболеваниям;
- лиц, перенесших тяжелые хирургические, лучевые, химиотерапевтические* воздействия, в реабилитационный период для скорейшего восстановления организма;
- кроме того, "фотостим" рекомендуется к применению лицами с ослабленным иммунитетом.
Показания к применению фотостима.Существует несколько показаний для применения "Фотостима" : Механизм действия фотостима."Фотостим" усиливает гуморальный иммунитет в 60-70% случаев за счет роста популяции лимфоцитов, а в 30-40% случаев - популяции нейтрофилов в крови. Стимуляция клеточного иммунитета при употреблении "Фотостима" достигается за счет роста абсолютного количества фагоцитов а у 35% лиц также и за счет роста активности фагоцитов и NK-клеток. NK-клетки активируются под влиянием дисплазивных (аномальных) клеток, бактерий, их токсинов или продуктов метаболизма. В целом, " Фотостим" специфически стимулирует пролиферацию клонов В-клеток костного мозга и продукцию вилочковой железы. "Фотостим" стимулирует формирование антител к опухолевым клеткам, активирует регенерацию пораженных тканей и, таким образом, увеличивает продолжительность жизни (или предотвращает ее сокращение) и значительно улучшает качество жизни онкологических больных. Кроме того, во многих случаях тормозится рост первичного очага опухоли и предотвращается появление метастазов. "Фотостим" способен не только тормозить рост опухолей и вызывать их разрушение, усиливать и активировать имеющиеся механизмы защиты организма, но и уничтожать предшественников раковых клеток - дисплазивные (аномальные) клетки. Образно выражаясь, фотостим является "разведывательно-диверсионной группой", задачей которой является обнаружение врага - клеток, отличающихся от нормальных, передача информации в центр (в мозг) и осуществление скоординированных мероприятий по их уничтожению. Клинические исследования фотостима.Клинические исследования показали, что "Фотостим" :
"ФОТОСТИМ" Его уникальность заключается в том, что 1) Онкологическая клетка поглощает фотосенсибилизатор, например, "ФОТОСТИМ".
2) Орган освещается светом. Онкологическая клетка погибает.
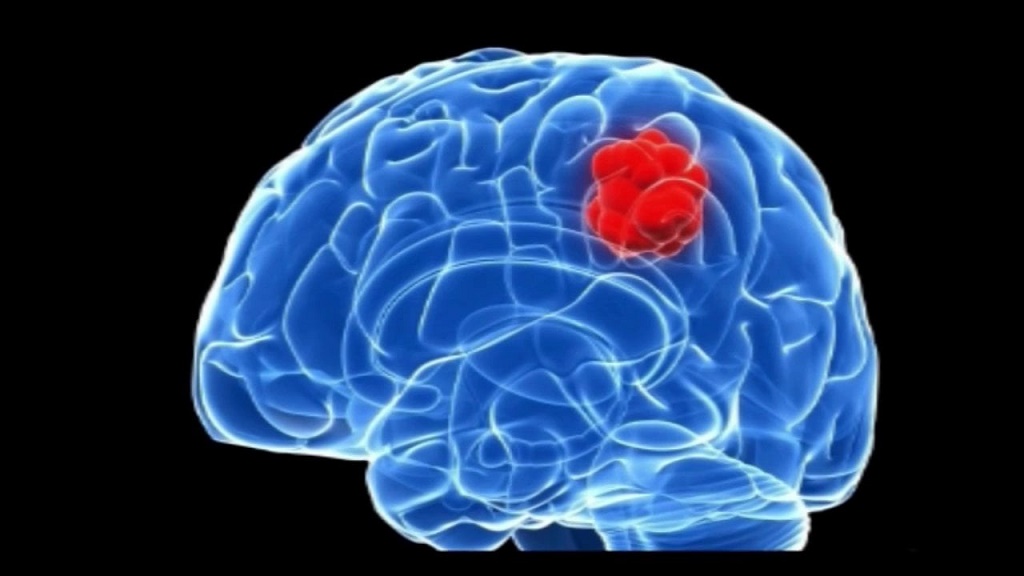
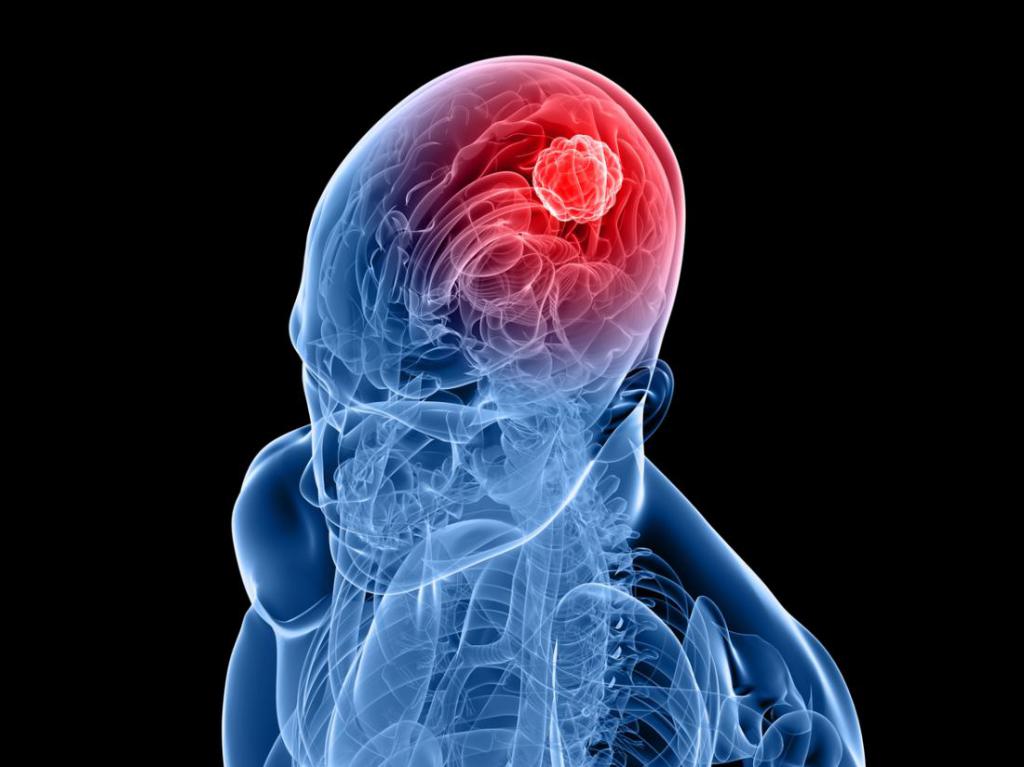
Заключение института Геронтологии. Анализ полученных результатов свидетельствует о том, ВЫВОДЫ (фрагмент из заключения института геронтологии): "Фотостим" оказывает положительное влияние В статье рассмотрим симптомы доброкачественной опухоли головного мозга. Это патологическое формирование, в процессе развития которого принимают участие зрелые клетки, из которых состоит мозговая ткань. Каждому виду ткани соответствует конкретный тип опухоли. К примеру, шваннома формируется из шванновских клеток. Они начинают образовывать оболочку, которая покрывает поверхность нервов. Эпендимома формируется клетками, из которых состоит желудочек мозга. Менингиому образуют клетки мозговой оболочки или ткани, которая окружает мозг. Аденома формируется из железистых клеток, остеома - из костных структур черепной коробки, гемангиобластома - из клеток кровеносных сосудов.
Какие бывают опухоли?Существуют доброкачественные опухоли мозга, которые имеют врожденную этиологию, к ним относятся следующие:
Симптомы доброкачественной опухоли головного мозга важно распознать своевременно. МенингиомаЭто доброкачественное образование, которое характеризуется вторичностью, причем оно наблюдается даже после оперативного удаления. Зачастую оно поражает женщин разных возрастных категорий. От размеров опухоли, скорости ее роста и локализации зависит симптоматика, терапевтические приемы, а также последствия данной разновидности патологии для здоровья. Слишком большой размер доброкачественного новообразования мозга значительно ухудшает его функции. Такие виды опухолей не имеют онкологических клеток. Для них характерно медленное развитие, однако такой факт совсем не успокаивает, поскольку при увеличении размеров патологических формирований сдавливаются некоторые участки мозга, что способствует развитию отечности, воспалительного процесса в здоровых нервных тканях, а также повышению внутричерепного давления. При этом перерождение доброкачественной опухоли в злокачественную является весьма редким явлением.
ГемангиобластомаКаковы симптомы доброкачественной опухоли мозжечка головного мозга? Это опухоль, которая берет начало в кровеносных сосудах мозга с локализацией в мозжечке. Симптомы зависят от расположения и включают головные боли, тошноту, головокружения, астению, мозжечковый синдром, застойные диски зрительных нервов, чувствительные и двигательные нарушения, изменение функций черепно-мозговых нервов и органов таза. Гемангиобластома составляет примерно 2 % от всех опухолей, локализующихся в черепной коробке. Зачастую такое новообразование наблюдается у людей в возрасте от 45 до 60 лет. Подобно другим новообразованиям (краниофарингиоме, ганглионевроме, астроцитоме головного мозга, менингиоме, ганглионейробластоме и др.), гемангиобластома может возникать в результате действия различных канцерогенных факторов, к которым относятся:
Данная опухоль имеет генетическую этиологию и связана с мутациями в третьей хромосоме, что приводит к нарушению выработки супрессора опухолевого роста. Виды гемангиобластомПо макроскопическому строению выделяется 3 вида гемангиобластом:
Солидная гемангиобластома состоит из клеток, собранных в единый узел, имеющий темно-вишневый цвет и мягкую консистенцию. Кистозная опухоль является гладкостенной кистой. В большинстве случаев на ее стенке имеется солидный узелок небольших размеров. Примерно в 5 % случаев наблюдаются гемангиобластомы смешанного вида, которые характеризуются присутствием солидного узла, внутри которого расположено множество кист.
По гистологическому строению выделяются следующие гемангиобластомы:
Ювенильная состоит из тонкостенных капилляров, близко примыкающих друг к другу. Переходная гемангиобластома в равном соотношении содержит стромальные клетки и капилляры. Чистоклеточная отличается многочисленными клетками, которые расположены на измененных сосудах. Симптомы доброкачественной опухоли головного мозга могут быть очень неприятными. АденомаЭто доброкачественная опухоль, которая может формироваться из клеток гипофиза по причине нейроинфекций, хронических отравлений, черепно-мозговых травм, влияния ионизирующей радиации. Хотя в данном виде новообразований мозга не наблюдаются признаки озлокачествления, при увеличении они способны механически сдавливать окружающие структуры мозга. Это способствует развитию нарушений зрения, неврологических и эндокринных заболеваний, кистозных образований, апоплексии. Аденома мозга может расти в пределах своего местоположения, а может выходить за него.
КлассификацияНа этом основывается классификация аденом:
По размеру различают макроаденому и микроаденому. В половине случаев такая доброкачественная опухоль является гормонально неактивной. Гормональные формирования — это:
ШванномаВнешняя оболочка ганглиев и нервных волокон состоит из шванновских клеток. Доброкачественная опухоль, которая развивается из этих тканей – шваннома. Заболевание в 7 % клинических случаев приобретает злокачественный характер. Мутация может поражать все нервные окончания тела человека. Данная опухоль развивается в форме одиночного узла. В некоторых случаях болезнь протекает в виде множественных узлов, но это наблюдается крайне редко. Главным способом терапии данной патологии считается оперативное вмешательство, которое обеспечивает хороший прогноз выздоровления. Симптомы доброкачественной опухоли головного мозга зависят от ее размеров. Основная часть шванном локализуется в зоне восьмой пары мозговых нервов, в области слухового нерва. Подобное расположение патологического формирования чревато глухотой и опасно своей неоперабельностью. При ее развитии наблюдается поражение лицевого и тройничного нервов, что сопровождается параличом мимических мышц и сильным болевым синдромом. Типично при этом то, что отсутствует опухолевый рост в области обонятельного и зрительного нервов.
Требуется ли удаление доброкачественной опухоли головного мозга? Шванномы представляют опасность для жизни, особенно при достижении крупных размеров. В подобных случаях патологические ткани оказывают давление на мозг и могут повреждать мозговые центры, имеющие важность для жизни больного. Пациенты также ощущают выраженные болевые ощущения в зоне роста новообразования. Характерной чертой для этого доброкачественного формирования является медленный рост и поражение пациентов старше 60 лет. Многих интересует продолжительность жизни при доброкачественной опухоли головного мозга после ее обнаружения. ДиагностикаПеред тем, как четко диагностировать доброкачественные опухоли мозга, больному рекомендуют пройти множество неврологических исследований, проверить зрение, что включает в себя обследования глазного дна. Так исследуется вестибулярный аппарат, проверяются функции равновесия, органы обоняния, вкуса и слуха. Состояние кровеносных сосудов глаз показывает уровень внутричерепного давления. Применение функциональных методик является залогом точного диагноза. Диагностические методики при доброкачественных опухолях мозга:
Лечение доброкачественной опухоли головного мозгаЛечение доброкачественного новообразования в мозге не предусматривает химиотерапевтических методик. Симптомы болезни требуют индивидуального плана для отдельных больных. На лечение влияет самочувствие пациента и наличие сопутствующих патологических процессов в организме. Один из основных способов, которые предусматривает лечение доброкачественных опухолей головного мозга, - операция под названием краниотомия. Это вмешательство, в процессе которого открывается черепная коробка и новообразование вырезается. После удаления доброкачественной опухоли головного мозга используется лучевая терапия, при которой устраняются последствия заболевания. Чаще всего применяют традиционные формы лучевой терапии, но в некоторых случаях используется протонная терапия или радиохирургия, лечение гамма-ножом. Медикаментозные терапевтические приемы предусматривают назначение кортикостероидов, которые способны снижать отечность мозговых тканей. Использование протонной терапии - наиболее эффективный метод воздействия на доброкачественное новообразование, поскольку она позволяет устранить некоторые формы опухолей полностью, не повреждая соседние ткани, и для такого лечения не характерно развитие осложнений. После завершения процедуры пациент может сразу вести нормальный образ жизни. Протонная терапия снижает используемые дозы облучения до половины, что позволяет минимально повредить нейрокогнитивные и гормональные функции. Практически вдвое снижается вероятность возникновения опухоли вторично, меньше облучаются органы слуха, глаза и ЦНС.
ПрогнозСколько живут с симптомами доброкачественной опухоли головного мозга? Чаще всего речь идет о пяти годах. О результативном исходе хирургического вмешательства можно говорить в том случае, если пациент миновал эту отметку. Однако бывает, что люди живут и более продолжительное время. Это зависит от скорости роста новообразования в головном мозге. Влияние кортикостероидов на эстрогенную функцию коры надпочечников больных раком молочной железы после овариэктомии В настоящее время в большинстве онкологических клиник для лечения больных раком молочной железы как репродуктивного возраста, так и находящихся в менопаузе, вместо адреналактомии используют кортикостероиды. Кортикостероиды вводят после овариэктомии для снижения выработки АКТГ, что. в свою очередь угнетает эстрогенную функцию коры надпочечников. Persson и Risholm (1964) выявили, что кортизон по 50 мг ежедневно снижает продукцию эстрогенов у овари-эктомированных больных раком молочной железы примерно в 3 раза (табл. 9). После отмены кортизона (больные в менопаузе) экскреция эстрогенов быстро возрастает. При гормонотерапии рака молочной железы у менструирующих или находящихся в ранней менопаузе женщин после овариэктомии в клинике применяли 10 мг преднизолона или 50—100 мг кортизона ежедневно. К. С. Шароухова с сотрудниками (1973) определяли экскрецию эстрогенов и ФСГ у 30 больных раком молочной железы многократно в различные сроки лечения кортикостероидами. При благоприятном эффекте лечения экскреция эстрогенов у больных не превышала 5 мкг/сут. На рис. 24 представлены результаты наших исследований экскреции эстрогенов у больных репродуктивного возраста в различные периоды менструального цикла до лечения и в разные сроки после овариэктомии и применения кортикостероидов. В процессе лечения кортикостероидами больных раком молочной железы выделение ФСГ колебалось в больших пределах, но в большинстве случаев его количество было больше, чем у здоровых женщин даже в период максимальной экскреции (в начале и конце менструального цикла). Segaloff (1957) также обнаружил, что под влиянием лечебных доз кортизона экскреция гонадостимулирующего гормона увеличивается почти в 3 раза. Lorain (1959) считает, что увеличение экскреции ФСГ после адреналэктомии указывает на радикальное удаление коры надпочечников и коррелирует с успехом терапии. Механизм противоопухолевого действия кортикостероидов у мужчин, больных раком молочной железы. Иначе реагирует система гипофиз — кора надпочечников на орхэктомию и введение кортикостероидов при лечении рака молочной железы у мужчин. Мы (Н. И. Лазарев и др., 1969) определяли экскрецию эстрогенов и ФСГ у 9 больных до лечения и многократно после орхэктомии в процессе лечения кортикостероидами (10 мг преднизолона или 50—100 мг кортизола ежедневно). Как видно из рис. 25, до лечения суточная экскреция эстрогенов у обследованных больных не превышала 10 мкг/сут. Через 1—3 мес после орхэктомии и лечения кортикостероидами содержание эстрогенов в моче несколько увеличивается, главным образом за счет фракций эстрона или эстриола. Иногда высокая экскреция наблюдается и в более отдаленные сроки лечения (через 1х1ч мес). Однако, если больные в это время находились в состоянии ремиссии, то экскреция ФСГ значительно снижалась (иногда до нуля). При рецидиве или отсутствии лечебного эффекта наблюдалась высокая экскреция как эстрогенов, так и ФСГ. Если в течение года и более лечение кортикостероидами .было успешным, то экскреция эстрогенов, как правило, снижается и при благоприятном течении заболевания не превышает 5 мкг/сут, но увеличивается при прогрессировании болезни. Наглядное представление об этом дает рис. 26. Следовательно, если у женщин введение кортикостероидов после овариэктомии сразу снижает уровень эстрогенов, продуцируемых корой надпочечников, то у мужчин после орхэктомии, видимо, возникает стойкая активация адренокортикотропной функции гипофиза и как следствие — гиперфункция коры надпочечников, с трудом подавляемая, кортикостероидами. Moss (1964) на основании наблюдений 507 случаев рака молочной железы у мужчин отмечает значительно худшие отдаленные результаты терапии, чем у женщин. Автор считает, что эту разницу можно объяснить особенностями эндокринной системы мужчин. В последние годы появились работы, которые свидетельствуют о том, что эндокринная система мужчин реагирует на введение гормонов иначе, чем у женщин. Так, Zumoff (1966), изучая выделение метаболитов эстрадиола, обнаружил у больных мужчин значительное увеличение экскреции эстриола и снижение 2-гидрокси- и 2-ме-токсиэстрона. У больных женщин авторы нашли значительно менее выраженные отклонения от нормы. По данным Nillius и Wide (1970), те дозы эстрогенов, которые способны подавить продукцию ФСГ у женщин в менопаузе или страдающих олигоменореей, недостаточны, чтобы снизить продукцию этого гормона у мужчин. Обнаруженная нами гиперфункция надпочечников, возникающая после орхэктомии, может быть также одной из причин особенно неблагоприятного течения рака молочной железы у мужчин. При введении в организм кортизона увеличивается экскреция с мочой 17-оксикортикостероидов (см.табл. 9). Кроме того, при введении глюкокортикоидов изменяются количество и состав экскретируемых 17-КС. Экскреция 17-кетостероидов в сумме снижается, так как уменьшается выработка их основных компонентов: де-гидроэпиандростерона и его производных — андростеро-на и этиохоланолона, но увеличивается выделение с мочой 11-окси-17-кетостероидов и 11-кето-17-кетостероидов, источником которых главным образом являются 17-ок-сикортикостероиды. Преднизолон в 17-кетостероиды не превращается. Показатели экскреции эстрогенов при лечении кортикостероидами женщин после овариэктомии или мужчин после орхэктомии являются показателем функции коры надпочечников, так как кортикостероиды в эстрогены не превращаются. Кроме того, эстрогены совместно с ФСГ непосредственно стимулируют пролиферацию эпителия молочных желез. Следовательно, показатели их экскреции могут иметь прогностическое значение при лечении больных раком молочной железы кортикостероидами. Результаты применения кортикостероидов при раке простаты Изложенные выше данные и вытекающие из них выводы о том, что при эстрогенотерапии рака простаты лечебный эффект зависит не от цитостатического действия эстрогенов, а от относительного и абсолютного содержания в организме андрогенов, требуют еще дальнейшего выяснения. Прежде всего необходимо изучение динамики экскреции биологически активных андрогенных гормонов. Но такое представление уже кажется настолько обоснованным, что при лечении рака простаты стали применять кортизон, который использовали для подавления андрогенной функции коры надпочечников (А. П. Фрумкин, 1958). Надо оговориться, что при напрашивающемся казалось бы сочетании хирургической и химической кастрации мужского организма без подавления функции коры надпочечников может возникать даже ухудшение в течении болезни. Это можно объяснить тем, что в отсутствии яичек эстрогенотерапия будет направлена на угнетение фолликулостимулирующей функции гипофиза, что в свою очередь может стимулировать продукцию АКТГ и соответственно андрогенную функцию коры надпочечников. А в таком случае можно ожидать даже стимуляцию роста метастазов рака простаты. Действие гормонов на меланому В последнее время появляется все больше данных, свидетельствующих о зависимости развития и роста меланом от гормонов. Давно было отмечено, что злокачественное перерождение невусов чаще всего наступает в период полового созревания или во время беременности, а само заболевание во время беременности протекает наиболее злокачественно. Исследование гормонального баланса у больных меланомами свидетельствует о значительных гормональных нарушениях: снижение уровня общих и свободных 17-оксикортикостероидов, уменьшение экскреции 17-ке-тостероидов у женщин, повышение выделения эстрогенов у некоторых больных (И. Т. Шевченко и др., 1968). Зависимость роста меланомы от гормонов отмечена и в эксперименте. Удалось проследить стимулирование роста меланом у мышей интермедином, АКТГ и МСГ. Известны попытки лечения меланом гормонами или удалением эндокринных желез. Хорошие результаты получены при лечении меланом кортикоидами, а также у некоторых больных после гипофизэктомии. Очень интересные данные получила В. Л. Григорьян (1968). На перевиваемой меланоме Гардинг—Пасси автор изучала влияние некоторых эндокринных факторов на рост этой опухоли и установила, что кортизон, гидро-корзон и преднизолон значительно тормозили рост меланомы Гардинг — Пасси. На основании этих данных можно предположить, что механизм действия кортикостероидов при лечении меланомы сводится прежде всего к подавлению продукции АКТГ, а также, возможно, и меланостимулирующего гормона. Как известно, от этих гормонов зависят пролиферативные процессы в опухолевых меланоцитах. Использование кортикостероидов при экспериментальных опухолях желудка. К настоящему времени накопилось довольно много исследований взаимосвязи нарушения функций эндокринных желез и различных нарушений функции желудка (О. С. Радбиль, С. Г. Вайнштейн, 1967; С. М. Липовский, 1969, и др.). Кроме того, появляются данные о взаимосвязи рака желудка и нарушения экскреции гормонов. Л. А. Орловская с сотрудниками (1973) считают, что рак желудка развивается на фоне снижения экскреции гормонов щитовидной железы. Авторы отмечают, что с генерализацией процесса нарушение синтеза тиреоидных гормонов усугубляется. Установлена взаимосвязь между частотой зобной болезни и раком желудка. А. К. Панков с сотрудниками (1973) установили, что у больных раком желудка снижена экскреция гормонов надпочечников, а резервные возможности коры надпочечников резко снижаются при генерализации процесса. Экспериментальные возможности изучения рака желудка и методов его лечения до последнего времени были весьма ограничены, так как отсутствовала экспериментальная модель этой болезни. Только в последнее десятилетие многочисленные экспериментальные работы в этом направлении увенчались успехом. Г. Н. Архипов (1967) получил у 20—30% крыс рак желудка, создавая депо канцерогена на слизистой оболочке либо путем фиксации ампулы с канцерогеном, либо создавая искусственный желудочный карман с сохранением иннервации и кровоснабжения. Следовательно, в терапии рака желудка должны быть использованы методы, которые способствуют повышению функции желудочных желез. При гормонотерапии, очевидно, должны применяться прежде всего кортикостероиды и, может быть, небольшие дозы тиреоидина, которые стимулируют функциональные процессы в слизистой оболочке'. А. П. Чебышев при изотрансплантации железистой части желудка мышей с пилюлей 3-метилхолантрена под кожу получил плоскоклеточный рак, а затем изучал влияние гидрокортизона и преднизолона на рост 3-й генерации этой опухоли (неопубликованные данные). Гидрокортизон в дозе 150 мкг в день и преднизолон в дозе 2 мг в день вызывали торможение роста опухоли на 58 и 85% соответственно. Клинические наблюдения и экспериментальные данные свидетельствуют о том, что рост рака желудка зависит от гормонов. Очевидно, изучение экскреции гормонов у больных раком желудка в клинике и. разработка методов терапии на индуцированных опухолях желудка в эксперименте помогут создать принципиально новые методы терапии рака желудка. Противоопухолевое действие преднизолона Очень часто преднизолон и другие кортикостероидные гормоны используют при химиотерапии опухолей как цитостатик наряду с другими цитостатиками по прописям химиотерапии. Уже отмечалось, что противоопухолевое действие цитостатиков принципиально отличается от противоопухолевого действия гормонов несмотря на то, что некоторые цитостатики, кроме местного действия на раковые клетки, влияют еще и на эндокринную систему. Некоторые гормональные препараты могут оказывать непосредственное местное действие на раковые клетки, кроме воздействия на эндокринную систему. Поскольку же любая лекарственная терапия метастазов рассчитывается на длительное применение препаратов (а при длительном воздействии и проявляются особенности противоопухолевого эффекта химиотерапии и гормонотерапии), то правильное использование противоопухолевых препаратов приобретает первостепенное значение. Если при применении преднизолона не учитывать его гормональные свойства, то больному можно нанести ущерб. Известно, что кортикостероиды угнетают выработку АКТЕ гипофиза, но АКТГ-функция адаптируется к постоянному введению кортикостероидов и возобновляется несмотря на продолжающееся их воздействие (Е. И. Жарова, М. О. Раушенбах, 1959; М. С. Дульцин, М. О. Раушенбах, 1963). Факт адаптации тройных функций гипофиза к гормональным ингибиторам относится к иммунологическим явлениям, а мы установили, что такую адаптацию можно преодолеть, если один гормон, который вызывал адаптацию, заменить другим, иного химического строения (А. К. Кураласов, 1964). Наоборот, гормон, вызвавший такую адаптацию, в дальнейшем не проявляет никакой биологической активности и, следовательно, дальнейшее назначение этого гормона не только бессмысленно, но и вредно хотя бы потому, что создается только видимость лечения, которого в действительности нет. Проявляет ли преднизолон свойства цитостатика? Имеются ли указания, что и при гормононезависимых опухолях, например лейкозах, он проявляет свое противоопухолевое действие как гормон? Следует отметить, что когда химиотерапия лейкозов еще только начинала применяться при остром лейкозе у детей, преднизолон вызывал ремиссию в 57% случаев. Считают, что в этом случае преднизолон действует как цитостатик. Но Huggins (1972) установил, что лейкемия у крыс после гипофизэктомии также регрессирует в 50%' случаев, причем это доказано гистологически. Однако известно, что преднизолон как гормон угнетает продукцию АКТГ, и можно допустить, что преднизолон лечит лейкемию не как цитостатик, а как гормональный препарат. Но еще надо доказать, угнетает ли преднизолон продукцию АКТГ при лейкемии. Если это предположение подтвердится, то надо испытать препараты другого химического строения, но того же биологического действия. Читайте также:
|