Колоректальный рак список литературы
Med-books.by - Библиотека медицинской литературы . Книги, справочники, лекции, аудиокниги по медицине. Банк рефератов. Медицинские рефераты. Всё для студента-медика .
Скачать бесплатно без регистрации или купить электронные и печатные бумажные медицинские книги (DJVU, PDF, DOC, CHM, FB2, TXT), истории болезней, рефераты, монографии, лекции, презентации по медицине.
Реферат: Колоректальный рак
Эпидемиология.
Колоректальный рак составляет 15% от всех впервые диагностированных злокачественных опухолей все локализаций, и 30% из этого числа составляет рак прямой кишки. Каждый год в США отмечается около 150 тысяч новых случаев колоректального рака.
Большинство пациентов с раком прямой кишки старше 50 лет. У лиц с семейным полипозом толстой кишки и неспецифическим язвенным колитом рак прямой кишки может развиваться раньше. Средний возраст возникновения рака прямой кишки - 60 лет.
Некоторые авторы указывали, что рак правых отделов толстой кишки встречается чаще, однако по данным Рh.Rubin это связано с тем, что 50% диагнозов колоректального рака ставится на основании ректороманоскопии. 24% колоректального рака приходится на восходящую ободочную кишку, 16% - поперечно ободочную кишку, 7% - на нисходящую кишку, 38% - на сигмовидную, 15% - прямую кишку.
Факторы риска возникновения колоректального рака:
Диета
1. Высокое содержание в рационе мяса (росту случаев колоректальных карцином в развитых странах способствуют увеличение в пищевом рационе содержания мяса, особенно говядины и свинины, и уменьшение клетчатки) и животного жира ускоряет рост кишечных бактерий, вырабатывающих канцерогены. Это процесс способны стимулировать соли желчных кислот. Природные витамины А, С и Е инактивируют канцерогены, а турнепс и цветная капуста индуцируют экспрессию бензпирен гидроксилазы, способной инактивировать поглощенный канцерогены.
2. Отмечено резкое снижение случаев заболевания среди вегетарианцев.
3. Высока частота колоректальных карцином среди работников абсестных производств, лесопилок.
Генетические факторы:
Возможность наследственной передачи доказывает наличие семейных полипозных синдромом и возрастание (в 3-5 раз) риска развития колоректальной карциномы среди родственников первой степени родства больных с карциномой или полипами.
Прочие факторы риска.
1. Язвенный колит, особенно панколит и заболевание давностью более 10 лет (10% риск).
2. Болезнь Крона
3. Рак, аденома толстой кишки в анамнезе
4. Синдром полипоза: диффузный семейный полипоз, одиночные и множественные полипы, ворсинчатые опухоли.
5. Рак женских гениталий или молочной железы в анамнезе.
6. Синдромы семейного рака.
7. Иммунодефициты.
ТNM классификация.
Т Первичная опухоль
ТХ Недостаточно данных для оценки первичной опухоли
Тis Преинвазивная опухоль не определяется
Т1 Опухоль инфильтрирует стенку кишки до подслизистой
Т2 Опухоль инфильтрирует мышечный слой стенки кишки
Т3 Опухоль инфильтрирует субсерозу или ткань неперитонизированных участков ободочной и прямой кишок
Т4 Опухоль прорастает висцеральную брюшину или непосредственно распространяется на соседние органы и структуры
Примечание: прямое распространение при Т4 включает распространение на другие сегменты ободочной и прямой кишок путем прорастания серозы, например, врастание опухоли слепой кишки в сигмовидную.
N Регионарные лимфатические узлы.
NХ Недостаточно данных для оценки регионарных лимфатических узлов
N0 Нет признаков метастатического поражения регионарных лимфоузлов
N1 Метастазы в 1-3 -х периколических или периректальных лимфатических узлах
N2 Метастазы в 4 и более периколических или периректальных лимфатических узлах
N3 Метастазы в лимфатических узлах, расположенных вдоль любого из указанных сосудов
М отдаленные метастазы
Группировка по стадиям.
По Dukes
Стадия 0 Тis N0 М0
Стадия 1 Т1 N0 М0 А
Т2 N0 М0
Стадия 2 Т3 N0 М0 В1
Т4 N0 М0
Стадия 3 Любая Т N1 М0 С1
Любая Т N2, N3 М0
Стадия 4 Любая Т Любая N М1
Примечание: стадия В по Dukes больше коррелирует с Т3 N0М0 и меньше с Т4 N0М0, так же как стадия С по Dukes (любая Т N1М0 и любая Т N2М0)
Анальный канал.
Т Первичная опухоль
ТХ Недостаточно данных для оценки первичной опухоли
Т0 Первичная опухоль не определяется
Тis Преинвазивная карцинома
Т1 Опухоль до 2-х см в наибольшем измерении
Т2 Опухоль до 5 см в наибольшем измерении 1.
Т3 Опухоль более 5 см в наибольшем измерении
Т4 Опухоль любого размера, прорастающая соседние органы: влагалище, мочеиспускательный канал, мочевой пузырь (вовлечение одного мышечного сфинктера не классифицируется как Т4)
N Регионарные лимфатические узлы.
NХ Недостаточно данных для оценки регионарных лимфатических узлов
N0 Нет признаков метастатического поражения регионарных лимфатических узлов
N1 Метастазы в периректальных лимфатических узлах
N2 Метастазы в подвздошных или паховых лимфатических узлах с одной стороны
N3 Метастазы в периректальных и паховых лимфатических узлах и (или) в подвздошных и (или) паховых с обеих сторон.
М - отдаленные метастазы
Группировка по стадиям
Стадия 0 Тis N0 М0
Стадия 1 Т1 N0 М0
Стадия 2 Т2 N0 М0
Т3 N0 М0
Стадия 3 А Т4 N0 М0
Т1 N1 М0
Т2 N1 М0
Т3 N1 М0
Стадия 3Б Т4 N1 М0
Любая Т N2 N3 М0
Стадия 4 Любая Т Любая N М1
Макроскопические формы рака ободочной и прямой кишки.
• Экзофитная - опухоли, растущие в просвет кишки
• Блюдцеобразная - опухоли овальной формы с приподнятыми краями и плоским дном.
• Эндофитная - опухоли, инфильтрирующие стенку кишки, не имеющие четких границ.
Гистологическая классификация.
Злокачественные опухоли Встречаемость
Аденокарцинома 90-95%
Муцинозная аденокарцинома 10%
Перстневидно-клеточная карцинома 4%
Сквамозно-клеточная карцинома Менее 1%
Аденосквамозная карцинома Менее 1%
Недифференцированная карцинома Менее 1 %
Неклассифицируемая карцинома Менее 1%
Метастазирование.
1. Поражение лимфатических узлов стенки кишки
2. Поражение внутритазовых лимфатических узлов
3. Гематогенное метастазирование: чаще в печень и легкие.
Симптоматика ректального рака.
1. Кровотечение - 65-90%. Кровотечение проявляется примесью крови и слизи в стуле. При геморрое кровотечение, как правило, в конце акта дефекации, "струйкой".
2. Боль - 10-25%
3. Кишечный дискомфорт 45-80% и нарушение функции кишки - запор.
4. Изменение стула и тенезмы.
Диагностика.
1. Ректальное исследование помогает установить диагноз ректального рака в 65-80% случаев. Пальцевое исследование позволяет определить наличие опухоли, характер ее роста, связь со смежными органами.
2. Ирригоскопия (контрастное исследование толстой кишки с барием) позволяет установить локализацию, протяженность опухоли и ее размеры.
3. Эндоскопия с биопсией:
• Ректороманоскопия с биопсией опухоли обязательна для верификации диагноза
• Колоноскопия
4. Эндоректальное УЗИ (при раке прямой кишки) позволяет определить прорастание опухоли в смежные органы (влагалище, предстательную железу).
5. КТ и УЗИ, сцинтиграфия печени. Проводят для исключения часто встречающихся метастазов в этот орган.
6. При подозрении на острую кишечную непроходимость необходима обзорная рентгенография органов брюшной полости.
7. Лапароскопия показана для исключения генерализации злокачественного процесса.
8. Проба на скрытую кровь. У больных с высоким риском следует часто проводить двойную пробу на скрытую крови в кале и тщательно обследовать при необъяснимой кровопотере.
9. Определение Кэаг не применяют для скрининга, но метод может быть использован при динамическом наблюдении больных с карциномой толстой кишки в анамнезе; повышенный титр указывает на рецидив или метастазирование.
Скрининговые тесты.
1. Среди всего населения: ректальное исследование, клинический анализ крови, после 40 лет ректороманоскопия каждые 3-5 лет.
2. Среди населения с колоректальным раком у родственников: ректороманоскопия каждые 3-5 лет начиная с 35 лет, контрастное исследование толстой кишки каждые 3-5 лет.
3. Пациенты с язвенным колитом более 10 лет нуждаются в резекции толстой кишки, и ежегодной колоноскопии с биопсией.
4. Пациенты с семейным полипозом - резекция толстой кишки, исследование кишки через каждые 6 месяцев.
Лечение.
Хирургическое вмешательство при раке толстой кишки - метод выбора. Выбор характера хирургического вмешательства зависит от локализации опухоли, наличия осложнений или метастазов, общего состояния больного. При отсутствии осложнений (перфорация или непроходимость) и отдаленных метастазов выполняют радикальную операцию - удаление пораженных отделов вместе с брыжейкой и регионарным лимфатическим аппаратом.
Виды операций при раке прямой кишки.
1. При расположении опухоли в дистальной части прямой кишки и на расстоянии менее 7 см от края заднего прохода в любой стадии заболевания (вне зависимости от анатомического типа и гистологического строения опухоли) - брюшно-промежностная экстирпация прямой кишки (операция Майлса).
2. Сфинктеросохраняющие операции можно выполнить при локализации нижнего края опухоли на расстоянии 7 см от края заднего прохода и выше.
• Брюшно-анальная резекция прямой кишки с низведением дистальных отделов ободочной кишки возможна при опухоли, расположенной на расстоянии 7-12 см от края заднего прохода.
• Передняя резекция прямой кишки производится при опухолях верхнеампуллярного и ректосигмоидного отделов, нижний полюс которых располагается на расстоянии 10-12 см от края заднего прохода.
• При малигнизированных полипах и ворсинчатых опухолях прямой кишки выполняют экономные операции: трансанальное иссечение или электрокоагуляцию опухоли через ректоскоп, иссечение стенки кишки с опухолью с помощью колотомии.
Комбинированное лечение.
• Дооперационная радиотерапия рака прямой кишки снижает биологическую активность опухоли, уменьшает ее метастазирование и количество послеоперационных рецидивов в зоне оперативного вмешательства.
• Роль химиотерапии в лечении рака толстой кишки до конца не изучена.
Прогноз.
Общая 10-летняя выживаемость составляет 45% и за последние годы существенно изменилась. При раке, ограниченном слизистой оболочкой (часто выявляют при проведении пробы на скрытую кровь или при колоноскопии), выживаемость составляет 80-90%; при опухолях, ограниченных региональными лимфатическим узлами, - 50-60%. Основные факторы, влияющие на прогноз хирургического лечения рака толстой кишки: распространенность опухоли по окружности кишечной стенки, глубина прорастания, анатомическое и гистологическое строение опухоли, регионарное и отдаленное метастазирование.
После резекции печени по поводу изолированных метастазов 5-летняя выживаемость составляет 25%. После резекции легких по поводу изолированных метастазов 5-летняя выживаемость составляет 20%.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
В статье представлен обзор препаратов для лечения метастатического колоректального рака, находящихся в фазе клинических исследований. Представлены данные о возможных комбинациях, перспективах использования в различных линиях терапии. Помимо новых вариантов ингибиторов VEGFи EGFRрассматриваются молекулы с принципиально новыми механизмами действия, которые могут значительно расширить арсенал лекарственного лечения и потенциально увеличить число возможных линий терапии.
Забелин Максим Васильевич.
125284, Москва, 2-й Боткинский проезд, 3.
115478, Москва, Каширское шоссе, 24.
115478, Москва, Каширское шоссе, 24.
125284, Москва, 2-й Боткинский проезд, 3.
125284, Москва, 2-й Боткинский проезд, 3.
249036, Обнинск, ул. Королева, 4.
125284, Москва, 2-й Боткинский проезд, 3.
1. Лукашина М.И., Смирнова А.В., Алиев В.А. и др. Дендритные вакцины в терапии колоректального рака. Вестник РОНЦ им. Н.Н. Блохина РАМН 2008;19(3):35–42.
2. Акылбекова Г.А., Абдылаев Г.А. Современные возможности химиотерапии колоректального рака (обзор литературы). Известия вузов 2013;5:53–7.
3. Смагулова К. Оценка качества жизни при лечении метастатического рака толстой и прямой кишок. Успехи современной науки 2017;1(6):81–3.
4. Федянин М.Ю., Трякин А.А., Тюляндин С.А. Таргетные препараты в терапии рака толстой кишки. Онкология, гематология и радиология 2012;3:30–6.
5. Hoff P.M., Ansari R., Batist G. et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 2001;19(8):2282–92. PMID: 11304782. DOI: 10.1200/JCO.2001.19.8.2282.
6. Colucci G., Gebbia V., Paoletti G. et al. Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell’Italia Meridionale. J Clin Oncol 2005;23(22):4866–75. PMID: 15939922. DOI: 10.1200/JCO.2005.07.113.
7. Díaz-Rubio E., Tabernero J., Gómez-España A. et al. Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J Clin Oncol 2007;25(27):4224–30. PMID: 17548839. DOI: 10.1200/JCO.2006.09.8467.
8. Kuipers E.J., Grady W.M., Lieberman D. et al. Colorectal cancer. Nat Rev Dis Primers 2015;1:15065.
9. Трякин А.А. Таргетная терапия колоректального рака, рака желудка и поджелудочной железы. Практическая онкология 2010;11(3):143–50.
10. Amado R.G., Wolf M., Peeters M. et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008;26(10):1626—34. PMID: 18316791. DOI: 10.1200/JCO.2007.14.7116.
11. Douillard J.Y., Oliner K.S., Siena S. et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013;369(11):1023—34. PMID: 24024839. DOI: 10.1056/NEJ-Moa1305275.
12. Bokemeyer C., Bondarenko I., Makhson A. et al. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009;27:663-71. PMID: 19114683. DOI: 10.1200/JCO.2008.20.8397.
13. Susman E. Rash correlates with tumour response after cetuximab. Lancet Oncol 2004;5(11):647. PMID: 15536688.
14. Van Cutsem E., Kohne C.H., Hitre E. et al. Cetuximab and chemotherapy as ini¬tial treatment for metastatic colorectal cancer. N Engl J Med 2009;360(14): 1408-17. PMID: 19339720. DOI: 10.1056/NEJMoa0805019.
15. Владимирова Л.Ю., Абрамова Н.А., Сторожакова А.Э. Таргетная терапия аши-EGFR-моноклональными антителами в лечении колоректального рака. Злокачественные опухоли 2016;4(спецвыпуск 1):87—91.
16. Горчаков С.В., Правосудов И.В., Васильев С.В. и др. Мультидисциплинарный подход в лечении больных колоректальным раком с метастазами в печень — взгляд онколога сегодня. Поволжский онкологический вестник 2015;4;70—8.
17. Горчаков С.В., Правосудов И.В., Васильев С.В. и др. Современные подходы к лечению больных колоректальным раком с метастазами в печень: обзор литературы. Вестник СПбГУ 2015;11(3):55—68.
18. Burqdorf S.K. Dendritic cell vaccination of patients with metastatic colorectal cancer. Dan Med Bull 2010;57(9):B4171. PMID: 20816019.
19. Burris H.A., Infante J.R., Ansell S.M. et al. Safety and activity of varlilumab, a novel and first-in-class agonist anti-CD27 antibody, in patients with advanced solid tumors. J Clin Oncol 2017;35(18):2028—36. PMID: 28463630. DOI: 10.1200/JCO.2016.70.1508.
20. Elez E., Hendlisz A., Delaunoit T. et al. Phase II study of necitumumab plus modified FOLFOX6 as first-line treatment in patients with locally advanced or meta¬static colorectal cancer. Br J Cancer 2016;114:372—80. PMID: 26766738. DOI: 10.1038/bjc.2015.480.
21. Артамонова Е.В. Цетуксимаб в терапии метастатического колоректального рака толстой кишки: кожная токсичность и пути решения проблемы. Онкологическая колопроктология 2011;3:21—7.
22. Доброва Н.В. Цетуксимаб в лечении метастатического колоректального рака. Онкология, гематология и радиология 2012;2:24—9.
23. Переводчикова Н.И. Таргетные препараты и их место в современной терапии опухолевых заболеваний. Клиническая онкогематология 2009;2(4):367—73.
24. Sobrero A.F., Maurel J., Fehrenbacher L. et al. EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with meta¬static colorectal cancer. J Clin Oncol 2008;26(14):2311—9. PMID: 18390971. DOI: 10.1200/JCO.2007.13.1193.
25. Karapetis C.S., Khambata-Ford S., Jonker D.J. et al. KRAS mutations and be-nefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008;359(17):1757—65. PMID: 18946061. DOI: 10.1056/NEJMoa0804385.
26. Воронцова К.А., Доброва Н.В., Вышинская Г.В. Вторая линия противоопухолевой терапии метастатического колоректального рака: стратегия лечения. Медицинский совет 2015;8:55—9.
27. Воронцова К.А., Черноглазова Е.В., Вышинская Г.В. Таргетные препараты во второй линии противоопухолевой терапии диссеминированного колоректального рака. Медицинский совет 2015;8:91—6.
28. Кузнецова О.М., Хадашева З.С., Смир-нова И.П. Ингибиторы фактора роста эндотелия сосудов и тирозинкиназных рецепторов как направление антиангиогенной терапии опухолей. Вестник Чеченского государственного университета 2007;4(24):60—6.
29. Феоктистова П.С., Загинайко А.В., Карасева В.В., Хайленко В.А. Таргетная терапия метастатического колоректального рака. Здравоохранение Югры: опыт и инновации 2016;C:76—84.
30. Price T.J., Peeters M., Kim T.W. et al. Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT): a randomised, multicentre, open-label, non-inferiority phase 3 study. Lancet Oncol 2014;15(6):569—79. PMID: 24739896. DOI: 10.1016/S1470-2045(14)70118-4.
31. Douillard J.Y., Siena S., Cassidy J. et al. Final results from PRIME: randomized phase III study of panitumumab with FOLFOX4 for first-line treatment of met¬astatic colorectal cancer. Ann Oncol 2014;25(7):1346—55. PMID: 24718886. DOI: 10.1093/annonc/mdu141.
33. Gan H.K., Seruga B., Knox J.J. Sunitinib in solid tumors. Expert Opin Investig Drugs 2009;18(6):821—34. DOI: 10.1517/13543780902980171.
34. Zhou J., Lin Sh., Jing G. A dose escala-tion study of nimotuzumab plus irinotecan as second-line treatment in metastatic colorectal cancer with wild-type KRAS. J Clin Oncol 2012:30(15 suppl):e14122. DOI: 10.1200/jco.2012.30.15_suppl.e14122.
35. Zhou Y., Shen L., Zheng J. P50 dose-es-calation study of nimotuzumab plus irinotecan as second-line treatment in meta static colorectal cancer with wild-type KRAS. EJC Supplements 2011;9:20.
36. Dienstmann R., Patnaik A., Garcia-Carbonero R. et al. Safety and activity of the first-in-class Sym004 anti-EGFR antibody mixture in patients with refrac-tory colorectal cancer. Cancer Discov 2015;5(6):598—609. DOI: 10.1158/2159-8290.CD-14-1432.
37. Lynch D., Murphy A. The emerging role of immunotherapy in colorectal cancer. Ann Transl Med 2016;4(16):305. DOI: 10.21037/atm.2016.08.29.
38. Stanculeanu D.L., Daniela Z., Lazescu A. et al. Development of new immunotherapy treatments in different cancer types. J Med Life 2016;9(3):240-8. PMID: 27974927.
39. Becerra A.Z., Probst P., Tejani M.A. et al. Evaluating the prognostic role of elevated preoperative carcinoembryonic antigen levels in colon cancer patients: results from the national cancer database. Ann Surg Oncol 2016;23(5):1554—61. PMID: 26759308. DOI: 10.1245/s10434-015-5014-1.
40. Hurwitz H., Fehrenbacher L., Novotny W. et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004;350(23):2335-42. PMID: 15175435. DOI: 10.1056/NEJMoa032691.
41. Liu K.-J., Chao T.-Y., Chang J.-Y. et al. A phase I clinical study of immunotherapy for advanced colorectal cancers using carcinoembryonic antigen-pulsed dendritic cells mixed with tetanus toxoid and subsequent IL-2 treatment. J Biomed Sci 2016;23(1):1—11. PMID: 27558635. DOI: 10.1186/s12929-016-0279-7.
42. Cremolini C., Loupakis F., Antoniotti C. et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015;16(13):1306-15. PMID: 26338525. DOI: 10.1016/S1470-2045(15)00122-9.
43. Oki E., Kato T., Bando H. et al. A multi-center clinical phase II study of FOLFOX-IRI plus bevacizumab as first-line therapy in patients with metastatic colorectal cancer: QUATTRO study. Clin Colorectal Cancer 2018;17(2):147-55. PMID: 29530335. DOI: 10.1016/j.clcc.2018.01.011.
44. Giantonio B.J., Catalano P.J., Meropol N.J. et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007;25(12):1539—44. PMID: 17442997. DOI: 10.1200/JCO.2006.09.6305.
45. Yamaguchi K., Taniguchi H., Komori A. et al. A single-arm phase II trial of com-bined chemotherapy with S-1, oral leucovorin, and bevacizumab in heavily pretreated patients with metastatic colorectal cancer. BMC Cancer 2015;15:601. PMID: 26311588. DOI: 10.1186/s12885-015-1606-1.
46. Якушева Т.А., Когония Л.М., Федо¬тов А.Ю. и др. Авастин в лечении метастатического колоректального рака. Российский биотерапевтический журнал 2010;4(9):35—8.
47. Михайлова Н.В., Файрушина А.Н. Современный подход к терапии коло-ректального рака. Таргетная терапия метастатического колоректального рага. Поволжский онкологический вестник 2016;3(25):80—4.
48. Ciprotti M., Tebbutt N.C., Lee F.T. et al. Phase I imaging and pharmacodynamic trial of CS-1008 in patients with metastat¬ic colorectal cancer. J Clin Oncol 2015;33(24):2609—616. PMID: 26124477. DOI: 10.1200/JCO.2014.60.4256.
49. Amin M. The potential role of immuno-therapy to treat colorectal cancer. Exp Opin Investig Drugs 2015;(3):329—44. PMID: 25519074. DOI: 10.1517/13543784.2015.985376.
50. Van Cutsem E., Tabernero J., Lakomy R. et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012;30(28):3499—506. PMID: 22949147. DOI: 10.1200/JCO.2012.42.8201.
51. Ruff P., van Cutsem E., Lakomy R. et al. Observed benefit and safety of aflibercept in elderly patients with metastatic colorectal cancer: An age-based analysis from the randomized placebo-controlled phase III VELOUR trial. J Geriatr Oncol 2018;9(1):32—9. PMID: 28807738. DOI: 10.1016/j.jgo.2017.07.010.
52. Pastorino A., Di Bartolomeo M., Maiello E. et al. Aflibercept plus FOLFIRI in the real-life setting: safety and quality of life data from the italian patient cohort of the aflibercept safety and quality-of-life program study. Clin Colorectal Cancer 2018. PII: S1533-0028(18)30050-1.
53. Bordonaro R., Sobrero A.F., Frassineti L. et al. Ziv-aflibercept in combination with FOLFIRI for second-line treatment of patients with metastatic colorectal cancer (mCRC): Interim safety data from the global aflibercept safety and quality-of-life program (ASQoP and AFEQT studies) in patients >65. J Clin Oncol 2014;1:545.
54. Лихова Е.А., Юкальчук Д.Ю., Пономаренко Д.М., Шевчук А.В. Клинический опыт применения препарата афлиберцепт во второй линии терапии метастатического колоректального рака. Эффективная фармакотерапия 2017;20:38-40.
55. Segelov E., Chan D., Shapiro J. et al. The role of biological therapy in metastatic colorectal cancer after first-line treatment: a meta-analysis of randomized trials. Br J Cancer 2014;111(6):1122-31. PMID: 25072258.
56. Francoso A., Simioni P.U. Immunotherapy for the treatment of colorectal tumors: focus on approved and in-clinical-trial monoclonal antibodies. Drug Des Devel Ther 2017;11:177-84. PMID: 28138221. DOI: 10.2147/DDDT.S119036.
57. Lin E.H. A randomized, phase II study of the anti-insulin-like growth factor receptor type 1 (IGF-1R) monoclonal anti-body robatumumab (SCH 717454) in patients with advanced colorectal cancer. Cancer Med 2014;3(4):988—97. PMID: 24905030. DOI: 10.1002/cam4.263.
58. Patnaik A., LoRusso P.M., Messersmith WA. et al. Phase Ib study evaluating MNRP1685A, a fully human anti-NRP1 monoclonal antibody, in combination with bevacizumab and paclitaxel in patients with advanced solid tumors. Cancer Chenother Pharmacol 2014;73(5):951—60. PMID: 24633809. DOI: 10.1007/s00280-014-2426-8.
59. Weekes C.D. A phase I study of the human monoclonal anti-NRP1 antibody MNRP1685A in patients with advanced solid tumors. Invest New Drugs 2014;32(4):653—60. PMID: 24604265.
60. Федянин М.Ю., Трякин А.А., Тюляндин С.Ю. Потенциальные предикторы эффективности анти-EGFR-терапии при метастатическом раке толстой кишки. Онкологическая проктология 2013;2:21-30.
61. Секачева М.И. Регорафениб: новый препарат для лечения метастатического колоректального рака. Злокачественные опухоли 2016;2(18):69—76.
62. Ohhara Y., Fukuda N., Takeuchi S. et al. Role of targeted therapy in metastatic colorectal cancer. World J Gastrointest Oncol 2016;8(9):642-55.
63. Yoshino T., Komatsu Y., Yamada Y. et al. Randomized phase III trial of regorafenib in metastatic colorectal cancer: analysis of the CORRECT Japanese and nonJapanese subpopulations. Invest New Drugs 2015;33(3):740—50. PMID: 25213161. DOI: 10.1007/s10637-014-0154-x.
64. Goel G. Evolution of regorafenib from bench to bedside in colorectal cancer: Is it an attractive option or merely a “me too” drug? Cancer Manag Res 2018;10:425-37. PMID: 29563833. DOI: 10.2147/CMAR.S88825.
65. Корытова Л.И., Таразов П.Г., Гопта Е.В., Поликарпов А.А. Лучевая терапия в комбинированном лечении метастазов колоректального рака в печень. Паллиативная медицина и реабилита-ция 2009;3:27-30.
66. Lassen U.N., Meulendijks D., Siu L.L. et al. A phase I monotherapy study of RG7112, a first-in-class monoclonal antibody targeting TWEAK signaling in patients with advanced cancers. Clin Cancer Res 2015;21(2):258-66.
67. Clinical Study Report CS1008-A-E203. Version 1.0, 2012. 7 p.
68. Rocha Lima C.M., Bayraktar S., Flores A.M. et al. Phase Ib study of drozitumab combined with first-line mFOLFOX6 plus bevacizumab in patients with meta-static colorectal cancer. Cancer Invest 2012;30(10):727—31. PMID: 23061802. DOI: 10.3109/07357907.2012.732163.
69. Bendell J.C., Lenz H.J., Ryan T. et al. Phase 1/2 study of KRN330, a fully hu-man anti-A33 monoclonal antibody, plus irinotecan as second-line treatment for patients with metastatic colorectal cancer. Invest New Drugs 2014;32(4):682-90. PMID: 24691674. DOI: 10.1007/s10637-014-0088-3.
70. Infante J.R., Bendell J.C., Goff L.W. et al. Safety, pharmacokinetics and pharmaco-dynamics of the anti-A33 fully-human monoclonal antibody, KRN330, in patients with advanced colorectal cancer. Eur J Cancer 2013;49(6):1169—75. PMID: 23294608. DOI: 10.1016/j.ejca.2012.11.033.
71. Deming D.A., Cavalcante L.L., Lubner S.J. et al. A phase I study of selumetinib (AZD6244/ARRY-142866), a MEK1/2 inhibitor, in combination with cetuximab in refractory solid tumors and KRAS mutant colorectal cancer. Invest New Drugs 2016;34(2):168-75. PMID: 26666244. DOI: 10.1007/s10637-015-0314-7.
72. Sobrero A.F., Bordonaro R., Bencardino K. et al. Zivaflibercept (Z) in combi-nation with FOLFIRI for second-line treatment of patients (pts) with metastatic colorectal cancer (mCRC): Interim safety data from the global Aflibercept Safety and Quality-of-Life Program in pts pretreated with bevacizumab (B). J Clin Oncol 2015;3:528. DOI: 10.1200/jco.2015.33.3_suppl.528.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Предстоящие мероприятия
- Прошедшие мероприятия
- Фотоотчеты
- Информация
- С чего начать
- Новости
- Последние публикации
- Приказы
- СОП
- Протоколы
- Клинические рекомендации
- Клинические случаи
- Статьи
- Видео
- Вопрос-ответ
- Опросы
- Все для работы
- Вакансии и работадатели
- Обучение
- Классификации
- Азбука Эндоскописту
- Академия EndoExpert.ru
- Атлас Эндоскопии
- Викторина EndoQuizTime
- Тесты, клинические задачи
- Вебинары
- НМО, Аккредитация
- Проект StandUp
- Проект EndoEnglish
- Проект Liversurgery.ru
- Дайджест
- О Дайджесте EndoExpert.ru
- Новый номер
- Подписка на Журнал EndoExpert.ru
- Архив журнала
- QuaCol
- О проекте
- Образовательные модули
- Брошюра с материалами
- Видеозаписи лекций
- МОВИПРЕП
- Разделы
- Атлас
- Пациенту
- О Эндоскопии
- О Гастроэнтерологии
- Подготовка к колоноскопии
- Подготовка к гастроскопии
- Подготовка к исследованию
- Полезные статьи
- Найти врача
- Записаться на операцию
- Анализы перед операцией
- Задать вопрос
- Записаться на прием
Просмотренные публикации
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Случайный выбор
данная функция, случайным образом выбирает информацию для Вашего изучения,
запустите выбор нажав кнопку ниже

Случайный выбор
Обратная связь
Напишите нам
| Авторы: | Джантуханова Седа Висадиевна 1 |
| Об авторах: | 1. Джантуханова Седа ВисадиевнаСтарший научный сотрудник, кмнхирург, эндоскопист Эндоскопическое Хирургическое ОтделениеНМИЦ Хирургии им. А.В.Вишневневского |
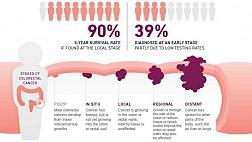
На сегодняшний день, высокие цифры заболеваемости и смертности от колоректального рака говорят о важности скрининга, который позволяет повысить процент выявления ранних форм рака и улучшить результаты хирурического лечения пациентов с этой патологией.
Во всем мире колоректальный рак (КРР) является не только актуальной проблемой современной онкологии, но и одной из главных проблем общественного здравоохранения. По данным Всемирной Организации Здравоохранения (WHO) рак ободочной и прямой кишки — третья по распространенности злокачественная опухоль после рака легких и молочной железы (1,8 млн случаев за 2018 год). На его долю приходится 10,2 % всех типов опухолей в мире, и он является второй по распространенности причиной смерти от рака (862 тыс. случаев за 2018 год).


В России отмечается высокий уровень заболеваемости и смертности от колоректального рака (более 41 тыс. новых случаев на 2018 год). В структуре онкологической заболеваемости в России рак толстой кишки занимает третье место и составляет 11,5%. Среди мужского населения показатель достигает 13%, занимая третье место после злокачественных новообразований легких (19,1%) и предстательной железы (15,8%). Среди лиц женского пола КРР составляет 13,2% и занимает третье место после опухолей молочной железы (24,7%) и кожи (14,6%).
Таким образом, общая тенденция роста заболеваемости колоректальным раком сохраняется, и данная патология по-прежнему занимает одну из лидирующих позиций по частоте возникновения среди онкологических заболеваний. Уровень смертности также продолжает оставаться высоким, поскольку большинство больных при обращении к врачу уже находятся на поздней стадии заболевания. Однако в некоторых регионах мира наблюдается тенденция к снижению данного показателя, связанная с улучшением диагностики ранних форм рака. Поэтому наиболее актуальным остается вопрос ранней диагностики КРР, которая позволит улучшить показатели выживаемости и уровень жизни больных.
Читайте также:

