Когда активизируются раковые клетки
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
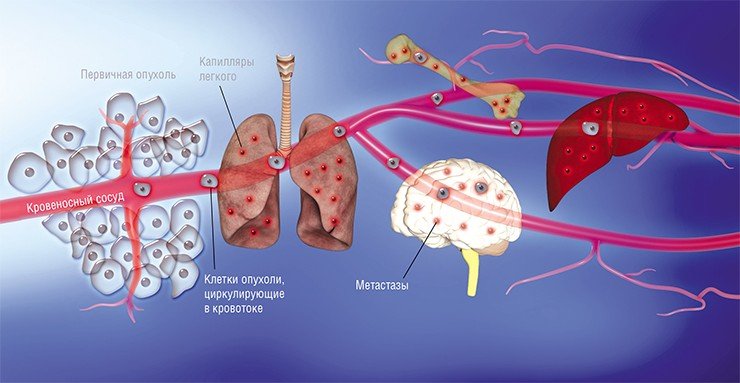
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
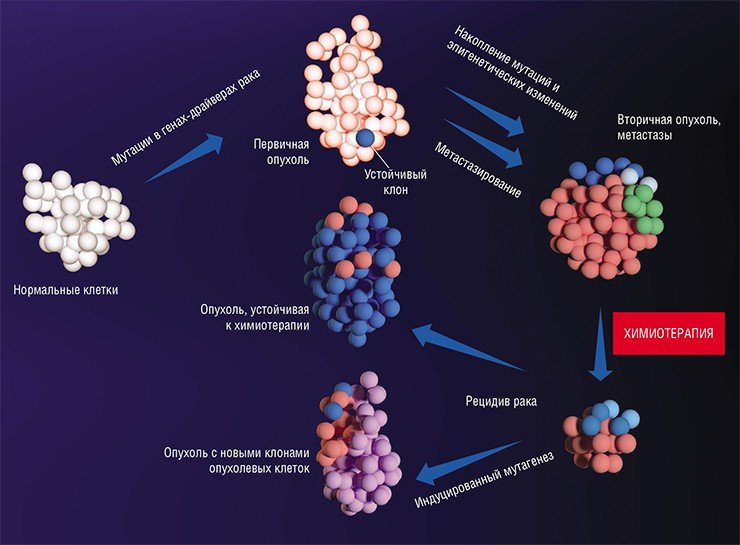
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
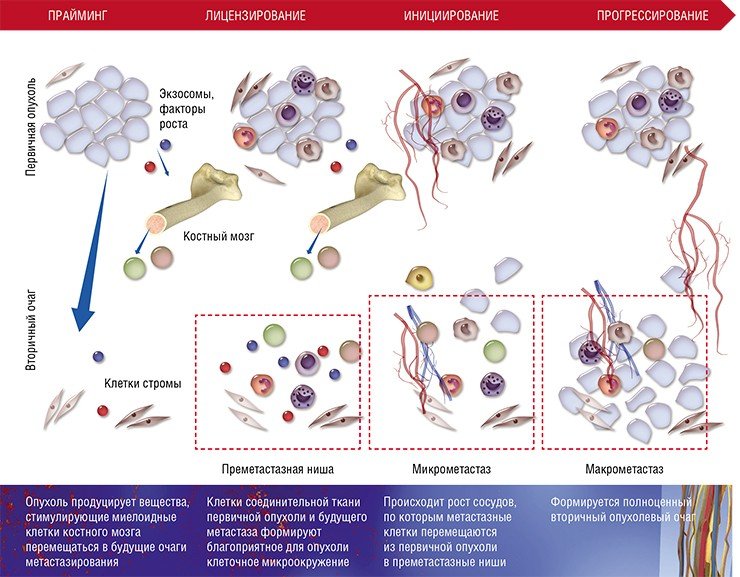
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
За последние десятилетия наука серьезно продвинулась вперед в лечении рака. И хотя полная победа над этим заболеванием еще довольно далека, у врачей с каждым годом становится все больше эффективных инструментов для борьбы с опухолями.
Один из них – активизация собственного иммунитета человека против раковых клеток. Именно в иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов.
В чем плюсы и методы механизма, за открытие которого была присвоена Нобелевская премия, беседуем с заведующей дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидатом медицинских наук Еленой Россохой.

Заведующая дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидат медицинских наук Елена Россоха. Фото: Юлия КОРЧАГИНА
- Елена Ивановна, расскажите, как в норме действует иммунный ответ на возникновение злокачественных клеток?
- Иммунитет – это уникальная способность организма защищать себя от губительного воздействия внешних и внутренних потенциально опасных факторов, каковыми являются, в том числе, и раковые клетки.
Давайте разберемся, что такое рак? В норме все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по установленным правилам, а со временем стареют и умирают. Эта запрограммированная обязательная смерть нормальных клеток называется апоптоз. Но иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной.
Опухолевые клетки ежедневно появляются в организме любого человека и отличаются от здоровых наличием аномального белка - ракового антигена. Но в норме иммунитет вовремя распознает угрозу и уничтожает чужеродные элементы с помощью Т-лимфоцитов и других компонентов.
Кстати
Доказано, что если иммунитет подавлен ( ВИЧ , терапия иммуносупрессорами после пересадки органов), то риск развития онкологических заболеваний высок. И наоборот, раковые опухоли могут проходить сами собой без какого-либо специального лечения. Это явление получило название синдрома Перегрина по имени молодого священника, жившего в Италии в конце XIII века. У него была саркома (костная опухоль), требующая ампутации ноги. Хирургия тех времен не могла ему помочь, и юноше оставалось только уповать на Бога. Спустя некоторое время опухоль чудесным образом исчезла, а Святой Перегрин прожил долгую жизнь и умер в возрасте 80 лет без признаков рецидива.
- Почему же в какой-то момент иммунитет ослабляет свою защиту?
-В настоящее время механизмы взаимодействия опухолей и иммунной системы активно изучаются.

В иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов. Фото: Юлия КОРЧАГИНА
Кстати
За открытие иммунных контрольных точек PD-1 и CTLA-4, американцу Джеймсу Эллисону и японцу Тасуко Хондзё в 2018 году была вручена Нобелевская премия. Это открытие позволило совершить прорыв в лечении некоторых ранее смертельных опухолей.
- В чем отличие иммунотерапии от других видов лекарственного противоопухолевого лечения?
- Можно сказать, что открытие принципов иммунотерапии изменило саму парадигму противоопухолевой терапии. Раньше в ее основе лежало воздействие на опухолевую клетку. Сейчас в центре внимания онкологов находится иммунная система человека, возможности ее перепрограммирования и восстановления способности самостоятельно противостоять злокачественным опухолям.
- Какие виды опухолей можно лечить с помощью иммунотерапии, и какова эффективность такого лечения?
- В первую очередь, это распространенные метастатические процессы, 3 и 4 стадии рака, когда удалить злокачественное новообразование с помощью операции невозможно. Что касается видов опухолей, то иммунотерапию можно применить практически ко всем из них. Рак легкого, мочеполовой системы у мужчин и женщин, молочной железы, различные виды лимфом, опухоли головы и шеи, меланома.
Кстати, впервые подобные препараты начали использовать именно при меланоме. Это очень агрессивные опухоли, характеризующиеся быстрым ростом и метастазированием. Еще несколько лет назад такие пациенты, даже получая специальное противоопухолевое лечение, жили максимум шесть месяцев. Сейчас благодаря иммунотерапии, медиана выживаемости для них выросла до нескольких лет.
В лечении злокачественной меланомы достигнут самый высокий прогресс. Пожалуй, самый известный онкобольной, излечившийся благодаря иммунотерапии, бывший презедент США Джимми Картер. В возрасте 90 лет он сообщил об успешно перенесенной операции по удалению опухоли печени. Однако вскоре стало известно, что это - метастаз меланомы, тогда же были выявлены и метастазы в головной мозг. Немедленно начатая иммунотерапия дала результаты - уже через год лечения сообщалось, что у экс- президента не обнаружено никаких следов онкологических образований.
Вообще, в последние годы темпы появления новых лекарств для борьбы с опухолями, ускорились в геометрической прогрессии. Сейчас любая уважающая себя фармацевтическая компания одновременно разрабатывает десятки молекул. Не факт, что из каждой из них на выходе появится новый противоопухолевый препарат, но, тем не менее, благодаря такой высокой заинтересованности производителей, в мире регулярно появляются новые эффективные лекарства.
- Если механизм иммунотерапии так эффективен, прост и органичен замыслу самой природы, почему одним пациентам назначают такие препараты, а другим, с таким же диагнозом, - нет?
- Рак настолько сложное заболевание, что вряд ли когда-нибудь будет придумано универсальное лекарство от этой болезни. Поэтому и иммунотерапия – это не панацея, а всего лишь еще одна очень хорошая лекарственная опция.
Почему мы не назначаем одинаковые препараты пациентам с одинаковыми диагнозами - а что вы считаете одинаковым диагнозом? Это раньше мы лечили рак легкого, рак груди, рак почки и так далее. Сейчас пациента с таким определением статуса болезни ни один врач не сможет лечить эффективно.

Иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной. Фото: Юлия КОРЧАГИНА
Ученые давно доказали, что не существует абсолютно одинаковых раков. Поэтому мы сейчас лечим не опухоли, а их особенности - наличие определенных биомаркеров. В иммунотерапии это уровень экспрессии рецептора PD-L1 на опухолевых клетках. И чем этот уровень этот выше, тем более результативным будет лечение. Вот почему персонализация - тренд современной онкологии.
Онкологи уже научились применять иммунопрепараты не только в монорежиме, но и эффективно использовать их в сочетании с химиопрепаратами, таргетными и даже другими иммунными препаратами. Причем, комбинация двух или нескольких средств, как правило, имеет синергетический эффект, они многократно усиливают действие друг друга.
Полностью излечить метастатический процесс, к сожалению, нельзя. Наша задача, чтобы пациент жил долго и в хорошем качестве. И сегодня мы научились переводить рак в длительное хроническое течение, назначая последовательную терапию при прогрессировании заболевания.
- Может ли человек сам, не дожидаясь лечения в стационаре, купить иммунологический препарат и начать его использовать самостоятельно? Ведь многие из них выпускаются в форме таблеток – ничего сложного.
- Ни в коем случае! Любой иммунологический препарат должен приниматься под контролем врача, имеющего опыт работы с подобными средствами.
Иммунологические препараты при неграмотном применении могут вызывать тяжелые побочные явления. Например, у пациента появилась высокая температура, кашель одышка. Что это – аутоиммунная или обычная пневмония? Знать это крайне важно, ведь при схожем названии тактика лечения будет принципиально различной.
Токсичная реакция на иммунологический препарат может развиться как через несколько дней, так и через несколько лет после его применения, может пройти почти сразу, а может сохраняться годами. Понимание первопричин каждого из явлений крайне важно для его успешного лечения.
Конечно, такие тяжелые побочные эффекты развиваются редко, поэтому мы успешно лечим наших пациентов в условиях дневного стационара, однако быть готовыми к ним просто необходимо. Тем более не понятно, зачем так рисковать собственным здоровьем, ведь все препараты есть в наличии в диспансере, и пациенты получают их абсолютно бесплатно. А это отнюдь немалые деньги – одно введение такого препарата может стоить 500 тысяч рублей, а общий курс составляет до 18 процедур.
- Почему так дорого?
- Разработка нового иммунологического препарата стоит порядка миллиарда долларов. Это многоуровневый процесс, в ходе которого сначала изучаются общие и специфические свойства препарата, потом его тестируют на животных, затем на добровольцах, следующим этапом изучают степень его токсичности, и так далее.
На входе может стартовать десять потенциальных лекарств, а лет эдак через двадцать к финишу придет лишь один препарат. И только семь лет после разработки формула защищается патентом, по истечении этого срока буквально на следующий день заранее скопированный препарат начинает продаваться гораздо дешевле. Вот производители и успевают отбить затраты и заработать на своем изобретении.
- Можно ли профилактически укрепить иммунитет конкретно против онкологии?
- К сожалению, это невозможно. Иммунитету все равно, против кого бороться, для него и раковая клетка и вирус гриппа – одинаково опасны. Он либо работает, либо нет. Чтобы увереннее противостоять, в том числе развитию злокачественных патологий, нужно укреплять свой иммунный ответ в целом. Рекомендации тут стандартные: здоровый образ жизни, отказ от вредных привычек, правильное питание, постоянный контроль за хроническими болезнями высокого онкориска. Кроме этого существуют и специфические меры профилактики, например, вакцинация против рака шейки матки.
Ну а если есть выраженные проблемы с иммунитетом – частые простуды, головные боли, усталость, упадок сил, сонливость, раздражительность – то лучше обратиться к врачу.
- Ваше мнение: действительно ли иммунотерапия – это прорыв в онкологии, как об этом сейчас говорят?
- Это несомненный прорыв. Появление современных иммунных препаратов коренным образом изменило подход к терапии злокачественных опухолей. У этой категории лекарств есть важная особенность: однажды получив полный ответ на иммунотерапию, мы сохраняем его на годы. У цитостатиков и таргетных препаратов такого нет, там этот эффект длится в среднем от полугода до года. То, что новые препараты дают возможность превратить ра нее считавшееся смертельным заболевание в контролируемую хроническую болезнь или полностью от нее излечиться, вселяет надежду в миллионы больных.
Да, мы пока не можем вылечить всех. Но можем выделить иммунозависимую популяцию и полечить ее. Например, для рака легкого это около 25% всех пациентов. Это уже немало!
Бывает, что опухоли уходят полностью, как в случае со Святым Перегрином, однако следует признать, что это случается крайне редко. Чаще – они значительно уменьшаются в размерах или полностью регрессируют и такое состояние при назначении иммунотерапии может длиться очень долго. Сейчас все эти эффекты изучаются более активно, и я уверена, что ученых ждет еще масса революционных открытий.
Комбинация ингибитора каспаз эмрикасана и антител против белка программируемой клеточной гибели может стать эффективным средством для повышения эффективности лучевой терапии.
Клетки опухолей способны избежать атаки со стороны иммунной системы после облучения, используя те же сигнальные пути, с помощью которых запуска иммунного ответа избегают погибающие клетки. Статья об этом опубликована в издании Nature Immunology.
Лучевая терапия — основа большинства протоколов лечения самых разных видов рака. Высокоэнергетическое излучение убивает опухолевые клетки, из ядер которых высвобождается ДНК: она, в свою очередь, становится триггером интерферон-опосредованного иммунного ответа. Хотя мутировавшие раковые клетки составляют большую часть опухолей, сами они выделяют очень мало интерферона. Это натолкнуло ученых на мысль, что существует определенный механизм, позволяющий опухоли избегать иммунного ответа.
Исследователи из Северо-западного медицинского центра Техаса попробовали идентифицировать этот механизм. Они протестировали 42 препарата, одобренных FDA, которые блокируют различные сигнальные пути в культуре клеток рака кишечника мышей. Ученые пытались найти среди этих лекарств то, которое могло бы побудить клетки синтезировать большие количества интерферона.
Таким препаратом оказался эмрикасан, разработанный для лечения хронической печеночной недостаточности. По своему механизму действия эмрикасан является ингибитором каспаз — ферментов, которые играют важную роль в процессах запрограммированной клеточной гибели и в то же время подавляют реакцию иммунной системы на гибнущие клетки.
Дальнейшие эксперименты показали, что один фермент из этого семейства, каспаза 9, служит ключевым веществом для подавления синтеза интерферонов. Генетические манипуляции, направленные на выключение гена СASP9, кодирующего эту каспазу, приводили к тому, что после радиационного воздействия синтез интерферонов клетками опухоли повышался в тысячи раз по сравнению с клетками дикого типа (с рабочим геном СASP9).
Когда исследователи пересаживали мышам раковые клетки с выключенными генами CASP9, их опухоли практически полностью регрессировали после сеанса облучения. Дополнительные эксперименты показали, что в процессе ликвидации клеток опухоли была задействована специфическая популяция иммунных клеток, так называемые CD8+ T-лимфоциты. Они были рекрутированы для борьбы с раковыми клетками именно посредством интерферона.
Однако вопрос о том, как именно работает защитный механизм раковых клеток, оставался открытым. Дело в том, что ядерная ДНК высвобождается уже после смерти клетки: следовательно, есть некий молекулярный триггер, который стимулирует активацию каспаз, когда клетка еще не погибла. Таким триггером оказалась митохондриальная ДНК, которая выделяется в цитоплазму клеток раньше ядерной. Когда авторы исследования удалили из опухолевых клеток всю митохондриальную ДНК, это привело к отсутствию синтеза интерферонов в ответ на облучение.
Хотя блокирование гена синтеза каспаз выглядит как многообещающий способ борьбы с онкологическими заболеваниями, этот метод имеет существенный недостаток. При потере синтеза каспазы 9 опухолевые клетки выработали новый метод ухода от иммунного ответа — посредством белка программируемой клеточной гибели PD (L)1.
Читайте также:

