Коэффициент перед формулой окислителя в уравнении натрия с хлором
Химия | 5 - 9 классы
Коэффициент перед формулой окислителя в уравнении ре¬акции натрия с хлором 1) 1 2)2 3)3 4)4 Помогите, пожалуйста!


В уравнении окислительно - восстановительной реакции FeCl2 + O2→Fe2O3 + Cl↑ коэффициент перед формулой окислителя равен?
В уравнении окислительно - восстановительной реакции FeCl2 + O2→Fe2O3 + Cl↑ коэффициент перед формулой окислителя равен?

Коэффициенты перед формулами окислителя в уравнении реакции горения серы и востановителя в уравнении реакции оксида железа с водородом соответственно?
Коэффициенты перед формулами окислителя в уравнении реакции горения серы и востановителя в уравнении реакции оксида железа с водородом соответственно.

Напишите уравнения реакций между хлором и следующими веществами : водородом, литием, алюминием, водой, гидроксидом натрия (при нагревании и без нагревания)?
Напишите уравнения реакций между хлором и следующими веществами : водородом, литием, алюминием, водой, гидроксидом натрия (при нагревании и без нагревания).
Во всех реакциях укажите окислитель и восстановитель.

Коэффициент перед формулой окислителя в уравнении окислительно - восстановительной реакции FeCL3 + Cu = FeCL2 + CuCL2 равен?
Коэффициент перед формулой окислителя в уравнении окислительно - восстановительной реакции FeCL3 + Cu = FeCL2 + CuCL2 равен.

Коэффициент перед формулой окислителя в уравнении реакции горения диметиламина равен?
Коэффициент перед формулой окислителя в уравнении реакции горения диметиламина равен.

1. Напишите уравнения реакций между веществами, расставьте коэффициенты : а)Натрий и хлор б)Водород и кислород в)Калий и сера?
1. Напишите уравнения реакций между веществами, расставьте коэффициенты : а)Натрий и хлор б)Водород и кислород в)Калий и сера.

В уравнении реакции избытка гидроксида натрия с серной кислотой сумма коэффициентов перед формулами продуктов реакции равна?
В уравнении реакции избытка гидроксида натрия с серной кислотой сумма коэффициентов перед формулами продуктов реакции равна.

Составьте уравнения окислительно - востановительных реакций : а)натрия с хлором ; б)натрия с соляной кислотой?
Составьте уравнения окислительно - востановительных реакций : а)натрия с хлором ; б)натрия с соляной кислотой.
Укажите окислитель и востановитель в каждой реакции.

Помогите, пожалуйста В уравнении реакции серы с алюминием коэффициент перед формулой окислителя равен : 1)1 2)2 3)3 4)4?
Помогите, пожалуйста В уравнении реакции серы с алюминием коэффициент перед формулой окислителя равен : 1)1 2)2 3)3 4)4.

Коэффициент перед окислительем в уравнении реакции равен Al + H2SO4 =?
Коэффициент перед окислительем в уравнении реакции равен Al + H2SO4 =.

Ca5(PO4)3F + 10NaOH = 5Сa(OH)2↓ + 3Na3PO4 + NaF FeAsO4 + 2NaOH = Fe(OH)2↓ + Na2AsO4 CaWO4 + 2NaOH = Ca(OH)2↓ + Na2WO4 MoS2 + 4NaOH = Mo(OH)4↓ + 2N2S.

СаС₂ + 2Н₂О = Са(ОН)₂ + С₂Н₂ С₂Н₂ + Н₂О = СН₃СНО СН₃СНО + Ag₂O = CH₃COOH + 2Ag CH₃COOH + Cl₂ = Cl - CH₂COOH + HCl 2NH₃ + Cl - CH₂COOH = NH₂ - CH₂COOH + NH₄Cl.

M = p * V m(кислты) = m(р - ра) * w / 100% m(кислоты) = 50 * 0, 08 * 1, 042 = 4, 168 4, 168 + 2 * 5 = 14, 168 С = m / M * V = 14, 168 / 98 * 52 = 0, 0028(моль / л).

В осадок выпадают нерастворимые вещесьва - в таблице растворимости стоит НFeSO4 в осдок не выпадает - это растворимое вещество. Из нерастворимых здесь Fe(OH)2? Который под дейсьвием серной кислоты растворяется.

НАПИСАТЬ уравнение 2C6H6 + 15O2 = 12CO2 + 6H2O.

1)Толуол > ; 3)Анизол > ; 2)Бензойная кислота.
![]()
Список вопросов теста
При взаимодействии серы с кислородом окислителем является
При взаимодействии водорода с азотом восстановителем является
В уравнении реакции алюминия с хлором коэффициент перед формулой окислителя равен
- 1
- 2
- 3
- 4
В уравнении реакции фосфора с кислородом коэффициент перед формулой восстановителя равен
- 5
- 2
- 3
- 4
В уравнении реакции горения аммиака коэффициент перед формулой окислителя равен
- 5
- 2
- 3
- 4
В уравнении реакции каталитического окисления аммиака с образованием NO коэффициент перед формулой восстановителя равен
- 5
- 2
- 3
- 4
Окислительно-восстановительный процесс происходит при взаимодействии оксида кальция с
- водой
- углеродом
- соляной кислотой
- оксидом углерода(IV)
Окислительно-восстановительный процесс происходит при взаимодействии соляной кислоты с
- оксидом магния
- гидроксидом натрия
- железом
- карбонатом кальция
Схема превращения 2Н + \(\rightarrow\) H2 0 соответствует взаимодействию
- соляной кислоты с железом
- аммиака с кислородом
- серной кислоты с медью
- воды с оксидом натрия
Схема превращения S -2 \(\rightarrow\) S +4 соответствует взаимодействию
- серной кислоты с цинком
- сероводорода с кислородом
- оксида серы(IV) с водой
- серы с железом
Установите соответствие между уравнением реакции и веществом, являющимся восстановителем в каждой из них
Установите соответствие между уравнением реакции и изменением степени восстановителя в каждом из них
Концентрированная серная кислота проявляет свойства окислителя при взаимодействии с
- железом
- оксидом меди(II)
- гидроксидом натрия
- медью
- карбонатом кальция
Окислительно-восстановительные процессы происходят при взаимодействии
- оксида кальция и воды
- гидроксида бария и серной кислоты
- оксида азота(IV) и воды
- хлорида железа(II) и цинка
- карбоната калия и серной кислоты
Выберите уравнения реакций, в которых углерод является окислителем
Выберите схемы превращений, в которых углерод является окислителем
C -2 \(\rightarrow\) С +2
C +2 \(\rightarrow\) С 0
C 0 \(\rightarrow\) С +2
C -4 \(\rightarrow\) С 0
C +4 \(\rightarrow\) С -4
Выберите уравнения реакций, в которых углерод является восстановителем
CO2 + 2Mg = 2MgO + C
Выберите схемы превращений, в которых углерод является восстановителем
C 0 \(\rightarrow\) C +2
C +2 \(\rightarrow\) C -2
C +4 \(\rightarrow\) C -4
C -2 \(\rightarrow\) C -4
C -4 \(\rightarrow\) C 0
Выберите уравнения реакций, в которых фосфор является окислителем
Выберите схемы превращений, в которых фосфор является окислителем
P +5 \(\rightarrow\) P 0
P +3 \(\rightarrow\) P +5
P 0 \(\rightarrow\) P -3
P -3 \(\rightarrow\) P 0
P +3 \(\rightarrow\) P +5
Выберите уравнения реакций, в которых азот является восстановителем
Выберите схемы превращений, в которых азот является восстановителем
N 0 \(\rightarrow\) N +2
N +1 \(\rightarrow\) N 0
N +2 \(\rightarrow\) N +4
N +3 \(\rightarrow\) N +1
N +5 \(\rightarrow\) N -3
Используя метод электронного баланса, составьте уравнение реакции:
Определите окислитель и восстановитель.
/В строке для ответа запишите через точку с запятой без пробелов:
вещество,которое необходимо поставить вместо . ; составленное уравнение реакции со всеми коэффициентами; вещество-окислитель; вещество восстановитель/
Раз в пять лет школы проходят переаттестацию, подтверждают свой статус образовательного учреждения. При этом учащиеся пишут тесты. Независимая проверка – серьезное испытание. Тесты привозит специальная комиссия. Тесты с ответами учащихся подвергают компьютерной проверке. Потом администрацию школы извещают, прошла школа тестирование или нет.
В учебном 2005/06 году учащимся 10-х и 11-х классов было предложено четыре варианта тестов по 15 заданий в каждом. В 10-м классе – три задания по органике и двенадцать по неорганике, в 11-м классе – 9 заданий по органике и 6 по неорганике. Из четырех вариантов ответа только один верный. Конечно, и учителю, и учащимся интересно знать, что и как спрашивается на такой проверке: содержание и формулировки вопросов. Мы приведем по два варианта тестов в 10-м и 11-м классах и ответы на них.
Вариант 1
1. Изомером н-пентана является вещество со структурной формулой:

* Изомеры – вещества с одинаковой молекулярной формулой, но разными структурными. У веществ 1 и 2 молекулярная формула С5Н12, причем первое вещество с линейной углеродной цепью, а второе – с разветвленной.
2. Коэффициент перед формулой углекислого газа в уравнении реакции горения этана (С2Н6) в кислороде равен:
1) 5; 2) 2; 3) 3; 4) 4.
* Проверяется умение расставлять коэффициенты в химическом уравнении, т. е. уравнивать число атомов в левой и правой частях уравнения:
3. Вещества с общей формулой СnH2n относятся к классу:
1) алкинов; 2) алкенов; 3) алканов; 4) аренов.
* Необходимо по общей формуле некоторого класса углеводородов (СnH2n) назвать этот класс (алкены).
4. Валентность углерода в соединении СН4 такая же, как у серы в соединении:
* Требуется не только определить валентность углерода в метане СН4 – С(IV), но и выбрать соединение серы с такой же валентностью атома серы S(IV) – SO2.
5. Укажите предложение, в котором речь идет о химическом явлении.
1) В духовке подрумянивался пирог.
2) Раздались раскаты грома, и полил дождь.
3) Над городом проносились темные облака.
4) За окнами раздавалась трель соловья.
* Термическая обработка при приготовлении пищи сопровождается химическими реакциями – это химическое явление.
6. Реакцией соединения является:
* В реакциях соединения из двух или нескольких веществ (у нас из трех веществ) образуется одно.
7. Коэффициент перед формулой окислителя в уравнении реакции алюминия с серной кислотой равен:
1) 6; 2) 2; 3) 3; 4) 4.
* Сначала надо расставить коэффициенты в уравнении реакции:
Потом выбрать окислитель и взять коэффициент перед ним. Элемент-окислитель понижает свою степень окисления в реакции. У нас этот элемент – водород, изменяющий степень окисления от +1 до 0.
8. При комнатной температуре с образованием водорода реагирует с водой:
1) оксид фосфора(V); 2) оксид натрия;
3) железо; 4) кальций.
* При 20 °С из воды выделяют водород щелочные и щелочно-земельные металлы. Уравнение реакции:
9. Сокращенное ионное уравнение
1) соляной кислоты с гидроксидом алюминия(III);
2) соляной кислоты с гидроксидом натрия;
3) угольной кислоты с гидроксидом натрия;
4) угольной кислоты с гидроксидом алюминия(III).
* Ионы Н + и ОН – , фигурирующие в сокращенном ионном уравнении, поступают в раствор от растворимых электролитов, причем как сильных, так и слабых. Однако сильным электролитам – кислотам и щелочам – следует отдать предпочтение.
10. Оксид железа(II) взаимодействует с каждым из веществ:
2) соляная кислота и медь;
3) гидроксид натрия и хлор;
4) углерод и кислород.
* Задание на химические свойства основных оксидов. Оксид FeO не реагирует ни с серой, ни с азотом. Невозможна и реакция FeO с медью, т.к. медь в ряду напряжений металлов расположена правее железа. Возможны реакции FeO с гидроксидом натрия и с хлором, но о таких реакциях не говорится в школьном курсе химии. Ожидаемый и наиболее логичный ответ – реакция оксида железа(II), находящегося в промежуточной степени окисления, с восстановителем (углерод) и окислителем (кислород):
11. С раствором гидроксида натрия реагируют оба вещества пары:
1) СаО и КОН; 2) СО2 и НСl;
3) NaCl и Na2O; 4) CuCl2 и CuO.
* Задание на химические свойства оснований, точнее щелочей. Щелочи взаимодействуют с кислотными оксидами и кислотами.
12. Соляная кислота может взаимодействовать с каждым веществом из пары:
1) оксид железа(III) и гидроксид меди(II);
2) медь и оксид меди(II);
3) цинк и оксид кремния(IV);
4) сера и оксид серы(VI).
* Кислоты реагируют с активными металлами, их оксидами и гидроксидами. Кислотные оксиды SiO2 и SO3 с кислотой HCl не взаимодействуют, как и неактивный металл медь.
13. Формулы основного и кислотного оксида соответственно:
1) FeO и BeO; 2) CaO и CrO3;
* Рекомендации к заданию: не назвать кислотным оксидом амфотерный (ВеО), а основным оксидом – кислотный – оксид металла в высокой степени окисления (CrО3).
14. Число электронов на внешнем энергетическом уровне атома кремния в основном состоянии равно:
1) двум; 2) четырем; 3) пяти; 4) восьми.
* Необходимо знать, как по номеру группы в таблице Д.И.Менделеева определить число электронов на внешнем энергетическом уровне элемента главной подгруппы (а-подгруппы). Кто-то может сделать ошибку, используя электронную формулу: 14Si . 3s 2 3р 2 (дать ответ 1), т.е. перепутать уровни и подуровни.
15. Масса соли, образовавшейся при взаимодействии азотной кислоты с 20 г гидроксида натрия, равна:
1) 85 г; 2) 63 г; 3) 42,5 г; 4) 40 г.
* Решение лучше всего начать с записи уравнения реакции:

Затем составить и решить пропорцию относительно х.
Ответы
| 1 – 2, 2 – 4, 3 – 2, 4 – 4, 5 – 1, 6 – 2, 7 – 3, 8 – 4, 9 – 2, 10 – 4, 11 – 2, 12 – 1, 13 – 2, 14 – 2, 15 – 3. |
Вариант 2
1. Изомером 2,2-диметилпропана является вещество, имеющее структурную формулу:

* Надо сложить число атомов С в формуле исходного вещества (2 + 3 = 5) и найти среди веществ 1) – 4) формулу с пятью атомами С.
2. В уравнении реакции полного сгорания пентана С5Н12 коэффициент перед формулой кислорода равен:
1) 5; 2) 7; 3) 3; 4) 8.
* Чтобы поставить коэффициент перед О2, необходимо составить уравнение реакции:
(Если такого уравнения нет в черновике ученика, возникают сомнения в самостоятельности его решения.)
3. К алканам относится:
4. Валентность фосфора в соединениях Р2О5 и РН3 соответственно равна:
1) III и I; 2) V и III; 3) V и II; 4) III и II.
* Поскольку индекс 2 при фосфоре в оксиде Р2О5 равен валентности кислорода(II), то и валентность фосфора равна индексу (5) при кислороде, т.е. V. В бинарных водородных соединениях вида ЭНх валентность элемента Э равна индексу при водороде, в нашем случае – III.
5. К физическим явлениям относится:
1) разложение воды электрическим током;
2) испарение воды;
3) горение свечи;
4) скисание молока.
6. Реакцией обмена является:
* В реакции обмена не участвуют простые вещества. В левой и правой частях уравнения реакции обмена – по два сложных вещества.
7. Коэффициент перед формулой восстановителя в уравнении реакции между калием и кислородом равен:
1) 1; 2) 2; 3) 3; 4) 4.
* Если ученик знаком с химической литературой (кроме учебников, адресованных школьникам, много других книг) и напишет уравнение реакции
то попадет в ловушку, подготовленную составителями тестов. Надо записать уравнение реакции так:
8. При взаимодействии бария с водой образуется:
1) гидроксид бария и водород;
2) только гидроксид бария;
3) оксид бария и водород;
4) оксид бария и кислород.
* Металлы, вступающие в реакцию с водой, вытесняют водород и образуют гидроксиды М(ОН)х. Их мы и обнаруживаем при взаимодействии с водой щелочных и щелочно-земельных металлов, магния и алюминия. Для вовлечения в реакцию с водой менее активных металлов (Zn, Fe) требуется весьма сильное нагревание. При таких условиях промежуточно образующиеся нерастворимые гидроксиды металлов разлагаются до оксидов.
9. Сокращенное ионное уравнение
1) серной кислоты с силикатом калия;
2) угольной кислоты с силикатом калия;
3) угольной кислоты с силикатом магния;
4) серной кислоты с силикатом магния.
* Если бы среди ответов не было варианта с серной кислотой и растворимым силикатом К2SiО3, можно выбрать такую реакцию:
Здесь из двух правильных ответов следует выбрать более быструю реакцию.
10. С водой взаимодействует каждое из двух веществ:
1) Cu и CuO; 2) Hg и НgO;
3) Ba и BaO; 4) Pb и PbO.
* При комнатной температуре с водой взаимодействуют только самые активные металлы (уже с магнием требуется нагревание). Металлы Cu, Hg и Pb – неактивные металлы. Кроме того, среди оксидов металлов с водой реагируют только оксиды щелочных и щелочно-земельных металлов.
11. Гидроксид бария взаимодействует с:
* Щелочь Ва(ОН)2 не взаимодействует со щелочью NаОН, основным оксидом МgО, нерастворимой солью СаСО3, зато взаимодействует с кислотным оксидом СО2.
12. Разбавленная азотная кислота взаимодействует с каждым веществом группы:
1) хлорид натрия, оксид цинка;
2) серебро, оксид фосфора(V);
3) оксид алюминия, хлороводород;
4) оксид магния, гидроксид натрия.
* Вещества, позволяющие отвергнуть соответствующую пару, – NаСl, Р2О5, НСl. Напротив, соединения основной природы – МgО и NаОН – подходят вполне.
13. Укажите название амфотерного гидроксида:
1) гидроксид магния;
2) гидроксид алюминия;
3) гидроксид натрия;
4) гидроксид кальция.
* Надо хорошо знать амфотерные оксиды и гидроксиды алюминия и цинка, быть готовым назвать таковыми оксиды и гидроксиды железа(III), бериллия, хрома(III).
14. Число электронов на внешнем энергетическом уровне атома хлора в основном состоянии равно:
1) двум; 2) трем; 3) семи; 4) восьми.
* Для элементов подгруппы а неважно, основное или возбужденное состояние атома, – число валентных (внешних) электронов от этого не меняется и равно номеру группы элемента в таблице Д.И.Менделеева.
15. При взаимодействии цинка с разбавленной серной кислотой выделилось 5,6 л водорода (н.у.). Масса цинка равна:
1) 5,6 г; 2) 32,5 г; 3) 16,25 г; 4) 65,0 г.
* Составим уравнение реакции:

Количества веществ цинка и водорода одинаковые, поэтому х/65 = 5,6/22,4. Отсюда х = 16,25 г.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
На приведенном рисунке
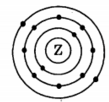
изображена модель атома
В каком ряду элементы расположены в порядке уменьшения их электроотрицательности
1) азот — углерод — бор
2) кремний — фосфор — сера
3) германий — кремний — углерод
4) фтор — бром — хлор
Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) оксид фосфора и оксид натрия
2) хлорид натрия и хлор
3) азот и сульфид натрия
4) хлорид кальция и хлороводород
Валентность каждого из элементов равна II в веществе
К кислотным оксидам относится каждое из двух веществ:
Взаимодействие алюминия с оксидом железа(III) относится к реакциям
Электролитической диссоциации ортофосфорной кислоты по третьей ступени отвечает уравнение:
1) Н3РO4 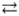
2Н + + HPO4 2-
2) Н2РО4 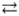
Н + + НРО4 2-
3) Н3РО4 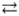
ЗН + + РО4 3-
4) HPO4 2- 
Н + + РО4 3-
Взаимодействию нитрата серебра и хлорида натрия отвечает краткое ионное уравнение:
3) Ag + + NaCl = AgCl + Na +
4) Ag + + Сl - = AgCl
Магний легко растворяется в
1) дистиллированной воде
2) аммиачной воде
Оксид цинка взаимодействует с каждым из веществ:
Сероводородная кислота реагирует с каждым из веществ:
Хлорид меди(II) не реагирует с
Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов?
А. Прежде чем поджечь водород, его необходимо проверить на чистоту.
Б. Получаемый из бертолетовой соли хлор нельзя определять по запаху.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
коэффициент перед формулой окислителя равен
Массовая доля кислорода в нитрате железа(III) равна
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов F — Сl — Вг
1) уменьшается электроотрицательность
2) увеличивается сила образуемых кислородсодержащих кислот
3) увеличивается сила образуемых бескислородных кислот
4) уменьшается радиус атомов
5) увеличивается значение высшей степени окисления
Для жиров верны следующие утверждения:
1) при обычных условиях — твердые вещества
2) входят в состав растительных и животных организмов
3) растворяются в воде
4) обладают моющими свойствами
5) являются одним из источников энергии для живых организмов
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
В) хлорид аммония
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
1. Составлен электронный баланс.
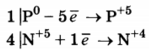
2) Расставлены коэффициенты в уравнении реакции:
Указано, что восстановителем является Р 0 , а окислителем N +5 .
При взаимодействии 30,93 г руды, содержащей карбонат железа(II), с избытком соляной кислоты выделилось 4,48 л углекислого газа. Определите массовую долю примесей в руде.
1) Уравнение реакции:
2) Рассчитываем количество вещества CO2:
а) по уравнению реакции: n(FeCO3(чист.)) = n(CO2) = 0,2 моль
б) M(FeCO3) = 116 г/моль, m(FeCO3(чист.)) = n*M = 0,2 моль * 116 г/моль = 23,2 г
4) Рассчитываем массу примесей:
m(примесей) = 30,93 г - 23,2 г = 7,73 г
5) Рассчитываем массовую долю примесей:
ω(примесей) = 7,73г/30,93г *100% = 25%
Даны вещества: Zn, НСl(разб.), NaCl, К3РO4, NaOH, CuO. Используя воду и необходимые вещества только из этого списка, получите в две стадии медь. Опишите признаки проводимых реакций. Для реакции замещения напишите сокращённое ионное уравнение.
Составлены два уравнения реакции:
Описаны признаки протекания реакций:
3) для первой реакции: растворение осадка и появление синеватозелёной окраски раствора;
4) для второй реакции: цементация на цинке красного осадка меди.
Составлено сокращённое ионное уравнение второй реакции:
1. Электронную формулу атома 1s2 2s2 2p6 3s2 3p5 имеет этот химический элемент:
а) хлор +
б) железо
в) кальций
2. Химическая связь в Н2S и Cu соответственно:
а) ковалентная неполярная и ионная
б) ковалентная полярная и металлическая +
в) ионная и ковалентная полярная
3. Металлические свойства элементов в группах с увеличением заряда ядра атома:
а) изменяются периодически
б) ослабевают
в) усиливаются +
4. Формальдегид и угарный газ относятся к классам:
а) альдегидов и оксидов
б) спиртов и оснований
в) карбоновых кислот и минеральных кислот
5. Взаимодействие бензола и фенола с бромом относится к реакциям:
а) гидрирования и присоединения
б) обмена и замещения
в) замещения +
6. Коэффициент перед формулой окислителя в уравнении реакции, схема которой N2O+ H2 = N2+ H2O, равен:
а) 3
б) 1 +
в) 2
7. Не проводят электрический ток оба вещества:
а) серная и уксусная кислоты
б) р-р анилина и карбоната кальция
в) водород и метан +
8. Суммы всех коэффициентов в полном и сокращённом ионных уравнениях реакции между гидроксидом цинка и серной кислотой равны:
а) 10 и 6 +
б) 16 и 22
в) 14 и 10
9. Сокращённо-ионное уравнение реакции Fe2+ + 2OH- =Fe(OH)2 соответствует взаимодействию веществ:
а) MnSO4 (p-p) и Fe(OH)3
б) FeSO4 (p-p) и Fe(OH)3
в) FeSO4 (p-p) и NaOH( р-р) +
10. Раствор хлорида бария реагирует с обоими веществами:
а) оксидом кальция и соляной кислотой
б) серной кислотой и нитратом серебра +
в) хлоридом железа (III) и угарным газом
11. Муравьиный альдегид реагирует с обоими веществами:
а) азотной кислотой и хлором +
б) метанолом и этиленом
в) оксидом серебра и водородом
12. Качественный состав сульфата меди (II) можно установить, используя:
а) хлорид бария (р-р) и лакмус
б) гидроксид натрия (р-р) и хлорид бария (р-р) +
в) хлорид бария (р-р) и фенолфталеин
13. Для распознавания глюкозы и ацетилена можно использовать:
а) аммиачный раствор Ag2O +
б) бромную воду
в) гидроксид натрия
14. Растворение цинка в серной кислоте будет усиливаться при:
а) уменьшении концентрации кислоты
б) добавлении ингибитора
в) увеличении концентрации кислоты +
15. Химическое равновесие в системе 2H2 + О2→ 2H2O + Q , смещается в сторону реагентов реакции при:
а) повышении температуры +
б) повышении давления
в) понижении температуры
16. Гомологом является:
а) бутадиен
б) бутан +
в) октин
17. Гомологом является:
а) бутен
б) бутадиен
в) пропан +
18. Межклассовым изомером является:
а) этанол
б) циклопропан +
в) уксусная кислота
19. Межклассовым изомером является:
а) изомасляная кислота
б) ацетон
в) пропин +
20. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%. Определите массу пропанола-2, взятую для реакции:
а) 4,8 г
б) 2,4 г +
в) 1 г
21. Состав аренов отражает формула:
а) СnН2n-6 +
б) СnН2n+2
в) СnН2n-4
22. …(ацителеновые углеводороды) – это непредельные алифатические углеводороды, молекулы которых содержат одну тройную связь:
а) алкены
б) алкины +
в) алканы
23. …(ароматические соединения) – это циклические углеводороды и их производные, которые построены из шестичленных циклов с тремя двойными связями:
а) алкины
б) алканы
в) арены +
24. Величина скорости химической реакции всегда:
а) отрицательна
б) положительна +
в) равна нулю
25. В ходе круговорота серы может образовываться серная кислота, которая, взаимодействуя с различными солями почвы и воды, переводит их в:
а) щелочи
б) фосфаты
в) сульфаты +
26. Аммиак и амины имеют общие свойства с основными:
а) оксидами
б) гидроксидами +
в) кислотами
27. Аллотропия – способность элементов образовывать несколько таких веществ – аллотропных модификаций:
а) простых +
б) сложных
в) пассивных
28. Спирты, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, называются:
а) предельными
б) ациклическими
в) непредельными +
29. Окислительно-восстановительное разложение солеподобных веществ водой относят к реакциям гидролиза, так ли это:
а) нет +
б) да
в) частично
30. Металлы побочных подгрупп являются:
а) b-элементами
б) d-элементами +
в) a-элементами
Читайте также:

