Клеточный цикл раковой клетки

- Клеточный цикл и его регуляция.
- Онкогены и гены-супрессоры опухолевого роста.
Клеточный цикл и его регуляция
Все злокачественные опухоли развиваются в результате мутации генов, регулирующих рост клеток. Деление раковых клеток во многом напоминает деление нормальных клеток, но в раковых клетках часто утрачены механизмы регуляции клеточного цикла.
Клеточный цикл в норме включает две фазы.
- S-фаза: происходит репликация ДНК; длительность S-фазы приблизительно 8 ч.
- М-фаза (митоз): в результате деления клетки образуются две дочерние; длительность этой фазы — приблизительно 1 ч.
Эти две фазы отделяются двумя другими фазами, в течение которых не происходит ни синтеза ДНК, ни деления клеток.
- G1: между М- и S-фазой; продолжительность вариабельна.
- G2: между S- и М-фазой.
Клетки могут перейти в состояние покоя и не делиться, они выходят из клеточного цикла в фазе G1 и переходят в фазу GO.
Многие молекулы, участвующие в осуществлении клеточного цикла и его регуляции, уже установлены. Одна из таких групп белковых молекул, играющих важную роль, — циклины. Они побуждают клетку к делению путем активации циклин-зависимых киназ (ЦЗК).
Регуляция клеточного цикла
Благодаря регуляции клеточного цикла в норме осуществляется точный контроль за дупликацией ДНК и последующим делением клетки и предупреждается потеря генетической информации. Клеточный цикл имеет ряд контрольных точек, играющих важную роль в защите нормального генома от повреждения.
Регуляция клеточного цикла имеет существенное значение для сохранения целостности нормальных генов.
Переход G1-S
Переход из G1-фазы в S-фазу находится под жестким контролем, осуществляемым с учетом таких факторов, как размер клетки, ее метаболическая активность, доступность факторов роста и целостность ДНК. Наиболее важная контрольная точка в клеточном цикле — точка рестрикции, она непосредственно предшествует вступлению в S-фазу. Прохождение через эту точку регулируется рядом факторов роста и важных генов, включая р53.
Раковые клетки характеризуются нарушением клеточного цикла и его регуляции.
Основные их особенности таковы:
- неконтролируемая пролиферация, не соответствующая физиологическим потребностям;
- нормальная продолжительность S- и М-фазы;
- короткая G1-фаза;
- неспособность контрольных точек оборвать клеточный цикл;
- невозможность запустить запрограммированную смерть клетки при повреждении ДНК;
- нестабильность генома и накопление многочисленных генных мутаций.
Онкогены и гены-супрессоры опухолевого роста
В большинстве случаев раковые клетки бывают моноклональными и происходят из одной клетки, в которой аккумулировалось несколько генных мутаций, приведших к неконтролируемой клеточной пролиферации. В результате генной мутации функции гена утрачиваются (ген инактивируется) или усиливается (активация гена).
Гены-супрессоры опухолевого роста. Функции этих генов при канцерогенезе утрачиваются. Для того чтобы это произошло, необходима инактивация обеих копий гена, т.е. мутация гена-супрессора рецессивна.
Онкогены. При раке функции этих генов усиливаются. Протоонкогены — немутировавшие формы этих генов, в норме играющие важную роль в регуляции клеточной пролиферации. Они кодируют молекулы факторов роста и их рецепторы, сигнальные молекулы и факторы транскрипции. Мутации онкогенов бывают доминантными.
Мутации ДНК носят случайный характер и в клетках млекопитающих происходят часто (например, в результате воздействия радиации и канцерогенных веществ, метаболических нарушений). Благодаря эффективным механизмам репарации в норме лишь одно из 1000 изменений, происходящих в основаниях ДНК, вызывает мутацию.
Различают следующие типы мутаций:
- точечные (замена одной пары оснований в молекуле ДНК на другую);
- транслокации (перестановки генов вследствие разрыва молекулы ДНК и ее повторного соединения);
- амплификация гена (появление многочисленных копий гена);
- делеции (потеря генетического материала — от одиночного основания до целого гена)
Гены-супрессоры опухолевого роста могут инактивироваться также в результате нарушения экспрессии гена без каких-либо изменений в нуклеотидной последовательности в молекуле ДНК. Одним из примеров такого механизма служит метилирование промоторной последовательности гена.
Развитие рака — многостадийный процесс, характеризующийся накоплением генетических нарушений. Особенно хорошо изучены стадии развития рака толстой кишки. Одиночная мутация может стать причиной доброкачественной клеточной пролиферации (приводящей, например, к образованию полипа или аденомы), предрасполагающей к развитию злокачественной опухоли. Мутации в генах, ответственных за репарацию ДНК, ускоряют этот процесс.
ЖИЗНЕННЫЙ ЦИКЛ КЛЕТКИ
Цель занятия:
Характеристику основных периодов жизненного цикла клетки.
Динамику структуры хромосом, функции, количества ДНК и числа хромосом в жизненном цикле клетки.
Биологическое значение митоза.
Уметь определять на микропрепаратах фазы митоза.
Ознакомиться с основными механизмами регуляции митоза и его патологией.
Внеаудиторная работа
Задание 1. Жизненный цикл клетки
Жизненный цикл клетки (ЖЦК) – период существования клетки от ее образования (путем деления материнской клетки) до собственного деления или смерти.
Жизненный цикл клеток, способных к делению, складывается из гетерокаталитической интерфазы и митотического цикла. В период гетерокаталитической интерфазы клетка растет, дифференцируется и выполняет свои специфические функции.
В митотическом цикле выделяют период подготовки клетки к делению (автокаталитическая интерфаза) и само деление – митоз. Автокаталитическая интерфаза подразделяется на периоды: G1 (пресинтетический), S (синтетический), G2 (постсинтетический).
В многоклеточном организме есть клетки, которые после своего рождения вступают в период покоя (G0), они представлены: клетками, выполняющими специфические функции в составе той или иной ткани; клетками, выходящими из митотического цикла; небольшим числом стволовых клеток (недифференцированные клетки с широкими потенциями). Все эти клетки рассеяны среди пролиферирующих клеток и практически неотличимы от них по морфологическим признакам.
Ответьте на вопросы:
Какие клетки человека очень быстро обновляются? Из каких периодов складывается их жизненный цикл?
Приведите примеры высокодифференцированных клеток человека, не способных к делению. Каковы особенности их жизненного цикла?
Способны ли к делению стволовые клетки?
На какие периоды подразделяется подготовка клетки к делению? Чем характеризуется G1-, S-, G2-периоды?
Задание 2. Типы деления клеток
Выделяют следующие типы деления клеток: митоз – непрямое деление; амитоз – прямое деление (встречается в основном в обреченных на гибель клетках); мейоз (лежит в основе гаметогенеза – образования половых клеток).
Ответьте на вопросы:
За счет какого типа деления клеток происходит дробление оплодотворенной яйцеклетки, развитие эмбриона, рост организма, регенерация тканей и органов?
Почему дочерние клетки, образовавшиеся в ходе митоза, генетически идентичны между собой и материнской клеткой?
Задание 3. Проверка усвоенного материала
Проверьте усвоение материала занятия по тестовым заданиям с выбором одного или нескольких правильных ответов (стр. 48).
Аудиторная работа
Задание 4. Митотический цикл клеток
Ответьте на вопросы:
В каком состоянии (конденсированном или деконденсированном) находятся хромосомы в период подготовки клетки к делению?
Одинакова ли продолжительность автокаталитической интерфазы и митоза делящихся клеток: а) у разных организмов, б) разных органов одного организма?
В какой период митотического цикла клетки происходит репликация ДНК и авторепродукция хромосом?
Как называются дочерние хроматиды в составе одной хромосомы, образовавшиеся в S-период?
Сколько хроматид (1) и молекул ДНК (2) в одной хромосоме в периоды и фазы митотического цикла: а) G1; б) S; в) G2; г) профазы; д) метафазы; е) анафазы; ж) телофазы.
Общая масса всех молекул ДНК в 46 хромосомах одной соматической клетки человека (2n2c) составляет
6 ∙ 10 -9 мг. Определите, чему равна масса всех молекул ДНК в сперматозоиде; яйцеклетке; в соматической клетке: а) перед началом ее деления (2n4c); б) после его окончания (2n2c).
| Фазы и периоды | nc | Цитологическая характеристика | |
| Подготовка к делению (автокаталитическая интерфаза) | Пресинтетичес-кий период – G1 | 2n2c | Хромосомы однохроматидные, деконденсированные, при световой мик-роскопии не выявляются. Накапливают-ся белки и РНК, увеличивается количе-ство митохондрий |
| Синтетический период – S | 2n4c | Репликация ДНК, хромосомы двухро-матидные, деконденсированные, при световой микроскопии не выявляются. Продолжается синтез РНК и белков | |
| Постсинтети- -ческий период – G2 | 2n4c | Остановка синтеза ДНК, хромосомы двухроматидные, деконденсированные, при световой микроскопии не выявляя-ются. Накапливается энергия, синтези-руется РНК и белки, формирующие нити веретена деления | |
| Митоз (М – фаза) | Профаза | 2n4c | Начало конденсации хромосом, они различимы при световой микроскопии, двухроматидные. Демонтаж ядерной оболочки, исчезновение ядрышка, деле-ние центриолей и расхождение их к полюсам клетки, построение веретена деления |
| Метафаза | 2n4c | Хромосомы максимально конденси-рованы, двухроматидные, располагаются в плоскости экватора клетки, хорошо различимы при световой микроскопии. К центромерам прикрепляются нити веретена деления | |
| Фазы и периоды | nc | Цитологическая характеристика | |
| Митоз (М – фаза) | Анафаза | 2n4c | Деление центромер, расхождение сес-тринских хроматид к разным полюсам клетки. Хромосомы конденсированы, однохроматидные, различимы при свето-вой микроскопии |
| Телофаза | 2n2c | Хромосомы однохроматидные, декон-денсированные, не выявляемые при световой микроскопии. Формирование ядрышка, цитотомия, образование двух дочерних клеток |
Задание 5. Митоз в растительной клетке
Изучите на слайдах и постоянном микропрепарате фазы митоза в клетках кончика корешка лука. Зарисуйте клетки на разных фазах митоза (профазы, метафазы, анафазы, телофазы).
Задание 6. Митоз в животной клетке
Ознакомьтесь с информацией.
Обычно клетки не преодолевают барьер из 20 – 90 делений. Для человека он составляет в среднем 50 ± 10. Срок жизни клеточных клонов зависит от длины теломерной ДНК на концах хромосом (А. М. Оловников, Л. Хейфлик). У большинства соматических клеток человека в автокаталитическую интерфазу теломерная ДНК не дореплицируется и с каждым новым делением клетки хромосомы укорачиваются на 50 – 60 нуклеотидов. При достижении теломерами минимальных размеров репликация ДНК прекращается, клетка перестает делиться, стареет и гибнет (запрограммированный апоптоз).
Клетки, часто делящиеся, быстрее исчерпывают свой потенциал к делению. Так, при ВИЧ-инфекции у человека возникает защитная реакция – лимфоциты, обеспечивающие иммунитет, ускоренно размножаются, быстрее стареют и через несколько лет перестают делиться. При наследственных болезнях преждевременного старения – прогериях – лимит Хейфлика снижен до 10 – 15 делений. Но ряд клеток человека (сперматогонии, клетки красного костного мозга, раковой опухоли) способны к неограниченному делению. В этих клетках высока активность фермента теломеразы, обеспечивающего синтез теломерной ДНК на матрице иРНК (обратная транскрипция), поэтому теломерные районы хромосом этих клеток способны восстанавливаться.
Ответьте на вопросы:
Какие клетки относят к одному клеточному клону: а) произошли от одной материнской клетки, б) произошли от нескольких клеток разных тканей?
Какой период жизненного цикла практически отсутствует у клеток раковой опухоли?
Как теоретически можно затормозить рост раковой опухоли?
Задание 8. Патология митоза
Ознакомьтесь с некоторыми нарушениями митоза:
нарушение процесса конденсации хромосом в профазе ведет к набуханию и слипанию хромосом;
повреждение веретена деления является причиной задержки митоза в метафазе и рассеивания хромосом;
нарушение расхождения хроматид в анафазу митоза ведет к появлению клеток с различным количеством хромосом;
отсутствие цитотомии в конце телофазы и образование двуядерных и многоядерных клеток.
В процессе эмбрионального развития человека на стадии двух бластомеров, при дальнейшем делении дробления одного из них, в анафазе митоза произошло нерасхождение хроматид одной из пары 21-х аутосом.
Напишите хромосомные наборы клеток, образующихся в процессе делений дробления после геномной мутации. Какой хромосомный набор будет в соматических клетках ребенка, родившегося при таких условиях эмбриогенеза, если учесть, что клетки с недостающим числом аутосом нежизнеспособны?
Задание 9. Амитоз
Амитоз – прямое деление клетки путем перетяжки ядра (без его перестройки как при митозе) и, в большинстве случаев, без последущего цитокинеза. В итоге могут образовываться двух- и многоядерные клетки, которые часто встречаются в высокодифференцированных тканях.
Рассмотрите на микропрепарате клетки, образовавшиеся в результате амитоза. Обратите внимание на то, что дочерние клетки имеют разный размер и морфологию.
Задание 10. Эндомитоз и политения
При эндомитозе происходит удвоение числа хромосом и их конденсация внутри ядра без образования веретена деления. В конце эндомитоза ядро принимает вид интерфазного, но размер его увеличивается в соответствии с увеличением плоидности. В организме млекопитающих и человека эндомитоз с возрастом свойственен клеткам печени.
Политения сопровождается повторяющимися циклами синтеза ДНК без митоза. В результате формируются гигантские (политенные) хромосомы, которые встречаются в клетках слюнных желез личинок ряда двукрылых насекомых (дрозофил, хирономид), простейших и растений. Политенные хромосомы по длине неоднородны – после окраски состоят из чередующихся темных дисков и более светлых междисков. Диски – более конденсированные участки, междиски – менее конденсированные. В участках с рыхло упакованными фибриллами хроматина идет активный синтез РНК.
Изучите на микропрепарате и микрофотографии политенные хромосомы хирономид (или дрозофил). Зарисуйте участок хромосомы, обозначьте темные диски, междиски.
Ответьте на вопросы:
Интерфазными или метафазными являются политенные хромосомы?
Какое значение имеют политенные хромосомы в цитогенетических исследованиях?
Учебно-исследовательская работа студентов (УИРС)
Задание 11. Митотическая активность клеток в ходе восстановительных процессов
Клетки печени, почек, надпочечников и ряда других органов обновляются медленно. Однако в процессе восстановления после повреждения (например, удаления части органа) происходит усиление клеточного деления.
Рассмотрите фотографии и постоянные микропрепараты среза печени крысы: а) в норме; б) через два дня после удаления 70% массы печени. Сделайте вывод о состоянии митотической активности клеток печени после частичной гепатэктомии.
В клинику обратился больной с жалобой на длительно незаживающую кожную рану. Цитологический анализ отпечатков, взятых с поврежденного участка кожи, выявил отсутствие делящихся клеток. Сделайте вывод о состоянии восстановительных процессов поврежденного участка кожи.
ТЕСТОВЫЕ ЗАДАНИЯ

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

- О нас
- Наши проекты
- Школа
- Волонтёрам
- COVID-19
- Что такое Open Longevity?
- Наша стратегия
- Команда
- Контакты
- Анонсы и новости
- Школа Долголетия
- Диагностика старения
- Гены
- Биотех и фарма
- Анализ стратегий
- Виртуальный НИИ
- Все статьи
- #ОдинПрекрасныйДень
- Работа с волонтёрами
- Школа долголетия
- 3–11 октября 2020
- Базовый онлайн-курс биологии
- Биология старения
- Дорожная карта исследований
- Трансгуманизм
- Оценка рисков тяжёлой формы
- КОВИДЕНИЕ: Как снизить тяжесть заболевания?
- Опись белков коронавируса
- Открытое письмо в ВОЗ
- Петиция к ВОЗ
- Аналитика потенциальных лекарств
Ключевые моменты
Рак - это болезнь неконтролируемого деления клеток. Его развитие и прогрессирование обычно связаны с серией изменений в активности регуляторов клеточного цикла. Например, ингибиторы клеточного цикла удерживают клетки от деления, когда условия не подходят, поэтому слишком низкая активность этих ингибиторов может способствовать развитию рака. Точно так же регуляторы усиливающие деление клеток могут привести к раку, если они слишком активны. В большинстве случаев эти изменения в активности происходят из-за мутаций в генах, которые кодируют белки регулятора клеточного цикла.
Здесь мы рассмотрим более подробно, что не так с раковыми клетками. Мы также увидим, как ненормальные формы регуляторов клеточного цикла могут способствовать раку.
Раковые клетки ведут себя не как нормальные клетки в организме. Многие из этих различий связаны с поведением деления клеток.
Например, раковые клетки могут размножаться в культуре (вне тела в чашке Петри) без добавления каких-либо факторов роста или стимулирующих рост белковых сигналов. В то время, как нормальным клеткам, для роста в культуре необходимы факторы роста.

Раковые клетки также игнорируют сигналы, которые должны заставить их прекратить делиться. Например, когда нормальные клетки, выращенные в чашке, окружены соседями со всех сторон, они прекращают деление -такой процесс называется контактным торможением. Раковые клетки, напротив, продолжают делиться и накапливаются друг на друге в виде комковатых слоев.
Окружающая среда в чашке отличается от окружающей среды в организме человека, но ученые считают, что потеря контактного торможения в раковых клетках, выращенных на пластинках, отражает потерю механизма, который обычно поддерживает баланс тканей в организме [2].
Раковые клетки могут делиться намного больше, в основном потому, что они экспрессируют фермент, называемый теломеразой , который устраняет истощение концов хромосом, которое обычно происходит во время каждого деления клетки [4].
Раковые клетки также имеют другие отличительные особенности, которые не связаны непосредственно с клеточным циклом. Эти отличия помогают им расти, делиться и образовывать опухоли. Например, раковые клетки приобретают способность мигрировать в другие части тела, процесс, называемый метастазированием, и стимулировать рост новых кровеносных сосудов, процесс, называемый ангиогенезом (который дает опухолевым клеткам источник кислорода и питательных веществ). В раковых клетках также не срабатывают механизмы программируемой клеточной гибели или апоптоза в условиях, когда они срабатывают у нормальных клеток (например, из-за повреждения ДНК). Кроме того, новые исследования показывают, что раковые клетки могут подвергаться метаболическим изменениям, которые поддерживают увеличение роста и деления клеток [5].

Клетки имеют множество различных механизмов, чтобы ограничивать деление клеток, восстанавливать повреждение ДНК и предотвращать развитие рака. Из-за этого считается, что развитие рака это многоэтапный процесс, при котором сразу несколько механизмов должны выйти из строя, прежде чем будет достигнута критическая масса, и клетки станут раковыми. В частности, большинство видов рака возникает, когда клетки приобретают ряд мутаций (изменений в ДНК), которые заставляют их делиться быстрее, избегать внутреннего и внешнего контроля при делении и так же избегать запрограммированной гибели клеток [6].
Как этот процесс может работать? В гипотетическом примере клетка может сначала потерять активность ингибитора клеточного цикла, что заставит потомков клетки делиться немного быстрее. Маловероятно, что они будут злокачественными, но они могут образовывать доброкачественную опухоль , массу клеток, которые делятся слишком много, но еще не способны проникать в другие ткани (метастазировать) [7].
Со временем в одной из клеток-потомков может произойти мутация, вызывающая повышенную активность положительного регулятора клеточного цикла. Эта мутация сама по себе тоже может не вызывать рак, но потомство этой клетки будет делиться еще быстрее, создавая больший пул клеток, в котором может произойти следующая мутация. В конце концов, одна клетка может получить достаточно мутаций, чтобы принять характеристики раковой клетки и образовать злокачественную опухоль, группу клеток, которые чрезмерно делятся и могут проникать в другие ткани [7].

По мере прогрессирования опухоли ее клетки обычно приобретают все больше и больше мутаций. Рак на поздней стадии может иметь серьезные изменения в своих геномах, включая крупномасштабные мутации, такие как потеря или дупликация целых хромосом. Как возникают эти изменения? По крайней мере, в некоторых случаях они происходят из-за инактивации мутаций в тех самых генах, которые поддерживают стабильность генома (то есть в генах, которые предотвращают возникновение или передачу мутаций) [8].
Эти гены кодируют белки, которые: распознают и восстанавливают повреждения ДНК, перехватывают ДНК-связывающие химические вещества, удлиняют колпачки теломер на концах хромосом и играют другие ключевые роли поддержки [9]. Если мутация нарушает работу одного из таких генов, то другие мутации могут начать накапливаться уже быстрее. Таким образом, если клетка имеет нефункционирующие факторы стабильности генома, ее потомки могут достичь критической массы мутаций, необходимых для рака, гораздо быстрее, чем нормальные клетки.
Все живые существа имеют врожденную способность размножаться и прекращают размножение по различным причинам. По-видимому, контроль обеспечивается по неизвестному механизму обратной связи, возможно, вследствие контактного феномена (при большом скоплении клеток). На основе знаний принципов роста клеток разработаны методы химиотерапии (XT); при этом использовались различия в характеристиках роста нормальных и злокачественных тканей.
Нормальные ткани преимущественно разделяются на три категории: статические, растущие и обновляющиеся. Статическая популяция клеток в основном хорошо дифференцирована и после периода пролиферации в эмбриональный период редко подвергается размножению у взрослых индивидуумов. К статическим тканям относятся нейроны и скелетная мускулатура. Вследствие редкости клеточного деления маловероятно, что эти клетки будут повреждаться при химиотерапии (XT), мишенью которой служат быстро размножающиеся клетки.
Популяции растущих тканей обычно также пассивны во взрослом состоянии, но в отличие от статической популяций они сохраняют способность к быстрой пролиферации в ответ на стресс или повреждение. Типичные примеры растущих тканей — гепатоциты и эндотелий. Обновляющиеся ткани обладают наибольшей чувствительностью к повреждениям, вызванным химиотерапевтическими препаратами.

При злокачественном росте клетки не прекращают размножение, когда достигают критической массы. Такой нерегулируемый рост появляется вследствие сочетания потери контролирования клеточного цикла и повреждения нормальных апоптотических механизмов. Несмотря на неконтролируемый рост, злокачественное клеточное деление не происходит быстрее нормального клеточного деления.
В основном рост опухолей характеризуется динамикой Гомперца: поскольку опухоль увеличивается, время, необходимое для удвоения, также постепенно увеличивается. Таким образом, по-видимому, па ранних стадиях опухолевые клетки растут экспоненциально, но как только увеличивается опухолевая масса, прогрессивно увеличивается и время удвоения, хотя у человека оно может сильно различаться. Например, эмбриональные опухоли и некоторые лимфомы имеют сравнительно короткое время удвоения (20—40 дней), тогда как аденокарциномы и плоскоклеточный рак — относительно долгое (50 — 150 дней).
Были даны три объяснения этого пролонгированного времени удвоения:
1) увеличение времени прохождения клеточного цикла (времени от одного митоза до другого);
2) уменьшение количества клеток, участвующих в процессе деления в опухоли;
3) увеличение гибели опухолевых клеток вследствие недостаточного количества питательных веществ и кровоснабжения.
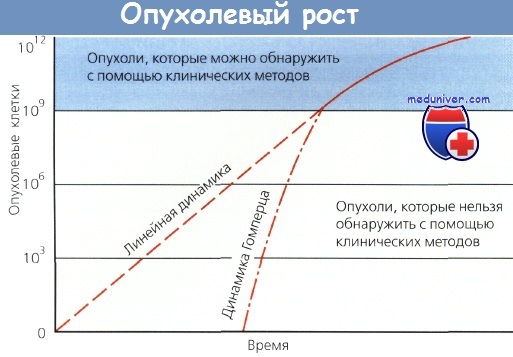
Опухолевый рост.
В основном рост опухолей характеризуется динамикой Гомперца: поскольку опухоль увеличивается, время удвоения становится длиннее.
Однако пальпируемым опухолям, чтобы достичь значительного объема, необходимо относительно небольшое количество удвоений.
Модель Гомперца имеет важное значение для понимания прогрессирования злокачественных новообразований. Во-первых, как правило, метастазы имеют более короткое время удвоения, чем первичный очаг. Если допустить, что экспоненциальный рост при злокачественном процессе наблюдается рано и злокачественное новообразование берет начало от одной-сдинственной клетки, то чтобы диаметр узла достиг 1 мм, необходимо приблизительно 20 удвоений. Опухоль диаметром 5 мм (размер, который позволяет распознать опухоль на рентгенограмме) подверглась 27 удвоениям.
Еще один вывод, сделанный на основе этой информации о кинетике: на поздних стадиях опухолевого роста небольшое количество удвоений опухолевой массы оказывает существенное влияние на размер опухоли и состояние больного. Как только опухоль становится пальпируемой (1 см в диаметре — 30 удвоений), всего лишь только 3 удвоения приведут к образованию крупной опухоли (8 см в диаметре).
Модель Гомперца имеет клиническое значение, что привело к множеству исследований эффективности химиотерапии (XT). Поскольку опухоль чувствительна к лечению (т. е. ее размер уменьшается), предполагастся, что время удвоения уменьшилось вследствие большого количества клеток, вступающих в клеточный цикл. В результате повышается процент метаболически активных клеток, поэтому увеличивается чувствительность популяции злокачественных клеток к фазоспецифическим препаратам.
Это привело к использованию после фазонеспецифических препаратов (например, циклофосфамида), уменьшающих опухолевую массу, фазоспецифических (например, метотрексата). Хотя такие последовательные комбинации теоретически были привлекательны, ни одна из них не показала значимых результатов в клинических испытаниях. Другой вывод концепции динамики роста Гомперца заключается в том, что метастазы, как ожидается, могут быть более чувствительны к химиотерапии (XT) вообще и к фазоспецифическим препаратам в частности, чем первичная опухоль, от которой они произошли.
Чем меньше размер метастатического очага, тем больше различий в его чувствительности по сравнению с первичной опухолью. Поэтому невосприимчивость первичной опухоли к назначаемой схеме препаратов не всегда предсказывает реакцию метастазов к тому же режиму химиотерапии (XT) .
Время клеточной генерации и последовательность одинаковы для всех клеток млекопитающих.
Опухолевые клетки не имеют более быстрого времени генерации, но имеют больше клеток, находящихся в активной фазе репликации
Четвертый и самый важный принцип подразумевает, что химиопрепараты оказывают воздействие в соответствии с динамикой первого порядка, т. е. они уничтожают определенную долю клеток, а не определенное их количество. Эта концепция имеет важное значение для противоопухолевого лечения. Одна доза противоопухолевого препарата может снизить численность опухолевых клеток в 10 2 —10 4 раз. При общей опухолевой нагрузке 10 12 клеток (1 кг) однократная доза сможет уничтожить большое количество клеток, но не приведет к излечению.
Таким образом, необходимы прерывистые курсы химиотерапии (XT), чтобы достичь величины клеточной гибели, необходимой для полного уничтожения опухоли. Практически, чтобы полностью уничтожить опухолевые клетки, необходимо:
• увеличить суммарную дозу препарата или препаратов до максимальной переносимой;
• начать лечение, когда количество клеток достаточно мало, что позволит уничтожить опухоль рациональными суммарными дозами препаратов.
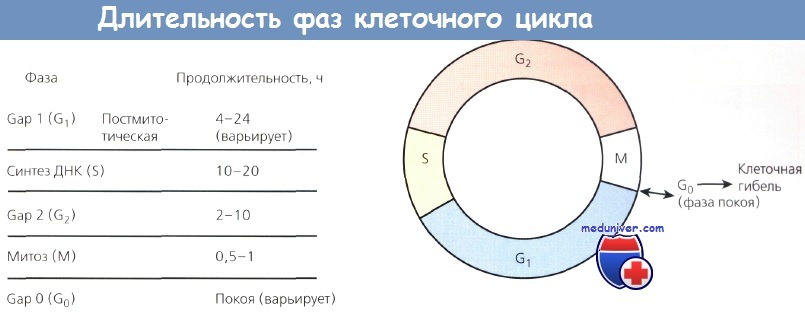
Для лучшего понимания клеточной кинетики необходимо рассмотреть клеточный цикл. Всем клеточным делениям предшествует накопление необходимых веществ для репликации. Время, за которое клетка совершает один цикл роста и клеточного деления, называют временем генерации. Существует пять основных фаз. Фаза G1 (от англ. gap — промежуток, перерыв) занимает обычно 4—24 ч. Если эта фаза длится дольше, клетка обычно переходит в фазу G0, или покоя. Фаза S — фаза синтеза ДНК и обычно продолжается 10—20 ч. Фаза G2 считается предмитотической, которая длится 2—10 ч.

И наконец, фаза М, когда происходит непосредственно митоз, занимает 0,5 — 1 ч. Опухоль не имеет более быстрого времени генерации, но имеет больше клеток в активной стадии репликации, чем в нормальных тканях. Нормальные ткани обладают огромным количеством клеток в фазе G0, из которой они медленно переходят к делению или выходят из цикла.
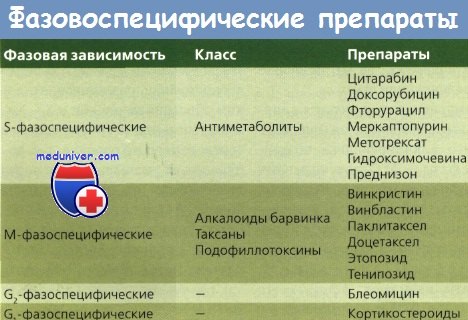
По-видимому, некоторые химиопрепараты влияют на отдельные фазы клеточного цикла. Полагают, что алкилирующие средства воздействуют на все фазы — от G0 до митоза. Их называют фазонеспецифическими средствами. Вероятно, такие препараты, как гидроксимочевина, доксорубицин (Адриамицин) и метотрексат, действуют преимущественно в фазе S. Полагают, что блеомицин действует в фазе G2, а винкристин — в фазе М. Эти препараты называют фазоспецифическими средствами, т. к. они оказывают химиотерапевтическое воздействие только на клетки, которые находятся в определенной фазе клеточного цикла размножения. Стероиды, фторурацил и цисплатин имеют сходное влияние на клеточный цикл размножения.
Теоретически, если в отдельном злокачественном новообразовании терапевтические препараты влияют только на клетки, которые делятся, а большинство опухолевых клеток делится, в отличие от клеток нормальной ткани, то правильные интервалы между химиопрепаратами и их комбинации, которые действуют в разные фазы клеточного цикла, будут способствовать уничтожению большего числа опухолевых клеток, чем нормальных. Изучение кинетики у людей и животных позволяет предположить, что опухоли, которые излечили с помощью XT, имеют огромную долю клеток в фазе пролиферации (например, гестационная хориокарцинома и лимфома Беркитта).
Стадия заболевания, а не общая масса опухоли считается самым важным фактором при использовании ЛТ или хирургического вмешательства, но при применении XT наиболее важный критерий — общая масса опухоли. Когда уменьшается объем опухоли, оставшиеся опухолевые клетки могут начать активно делиться (они переходят из фазы G0 в более восприимчивые клетки цикла размножения), таким образом становясь восприимчивыми к XT. Химиопрепараты, как и ЛТ, вызывают гибель клеток в соответствии с кинетикой первого порядка, т. е. популяция опухолевых клеток уменьшается на определенный процент, несмотря на первоначальное количество клеток. Если опухолевая нагрузка небольшая, то можно провести меньше циклов химиотерапии (XT). 1 мг опухоли, как правило, состоит из 10 6 клеток; 1 см 3 — из 10 9 клеток. Смерть больного, как правило, наступает при содержании в опухоли 10 12 клеток.
Читайте также:

