Клетки опухоли позитивны к антителам
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами - антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR - протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны - эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от 0 до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu - это рецептор эпидермального фактора роста раковой клетки. Это - ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.

Ki-67 - это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот - чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 - это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке - активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется - индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.

VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF - для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Стандартизованное иммуногистохимическое исследование: рецепторный статус при раке молочной железы (PR, ER, ki67, Her2 neu). Выполняется только при наличии готового микропрепарата на предметном стекле и образца ткани в парафиновом блоке.
ИГХ-исследование (РЭ, РП, Her2/neu, Ki-67), иммуногистохимический анализ рецепторного статуса рака молочной железы.
IHC (ImmunoHistoChemistry) Test for Breast Cancer Receptor Status (ER, PR, HER2, Ki67), HER2 Overexpression by IHC, Estrogen Receptors, Progesterone Receptors, ER and PR Status, Estrogen and Progesterone Receptor Status.
Какой биоматериал можно использовать для исследования?
Парафиновый блок с биоптатом образования молочной железы. Ткань первичной опухоли может быть получена с помощью толстоигольной биопсии, а также инцизионных и эксцизионных хирургических вмешательств. Для выявления метастазов на биопсию могут быть взяты ткани из стенки грудной клетки, регионарных лимфоузлов или отдаленных органов.
Общая информация об исследовании
Современные принципы и стратегии лечения рака молочной железы основываются, в том числе, на результатах оценки рецепторного статуса и пролиферативного потенциала опухолевых клеток. Клетки опухоли обладают способностью вырабатывать и располагать на своей поверхности специальные белки – рецепторы, стимуляция которых приводит к запуску клеточного деления и росту опухоли. Подобные рецепторы способны связываться с веществами, присутствующими в организме в норме и исходно никак не связанными с развитием злокачественного новообразования. Согласно актуальным клиническим рекомендациям, для рака молочной железы имеет значение наличие на опухолевых клетках следующих рецепторов, различные комбинации которых называются рецепторным статусом:
Рецепторы к гормонам – эстрогенам и прогестерону (ER, PR). Значительная часть опухолей молочной железы является гормонально-зависимыми, то есть их рост поддерживается и стимулируется эстрогенами и прогестероном. Опухоли с положительным гормональным рецепторным статусом хорошо отвечают на терапию аналогами гормонов (тамоксифен), которые блокируют соответствующие рецепторы – связываются с ними, но не вызывают активации внутриклеточных процессов и не дают рецептору впоследствии связаться с гормоном. Таким образом, исследование продукции опухолью ER и PR позволяет определить ее чувствительность к этим препаратам.
Рецептор второго типа к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2 – HER2/neu). В клетках некоторых опухолей молочной железы имеет место повышенная выработка данного рецепторного белка, который, соединяясь с естественным фактором роста, запускает в опухолевой клетке процесс деления. Общее число пациенток с HER2-положительным раком молочной железы составляет от 15% до 20%. Определение HER2/neu имеет не только прогностическое значение (такие опухоли обычно прогрессируют быстрее и имеют более агрессивное клиническое развитие), но и позволяет оценить возможность применения таргетных лекарственных препаратов – моноклональных антител к рецептору HER2 – трастузумаб (герцептин), лапатиниб, пертузумаб. Кроме того, HER2-позитивные опухоли резистентны к тамоксифену.
Пролиферативная активность – показатель способности опухолевых клеток к неограниченному делению, которое является основным фактором биологической агрессивности опухоли. Процесс деления сопровождается появлением в клетке определенных белков, один из которых – Ki-67. Он не продуцируется в клетках в состоянии покоя, что позволяет использовать его как маркер пролиферативной активности опухоли. Определение уровня Ki-67 имеет важное прогностическое значение, так как наибольшей пролиферативной активностью обладают опухоли из наименее зрелых и дифференцированных клеток.
Все указанные выше маркеры могут быть выявлены при иммуногистохимическом исследовании биоптата или операционного материала опухоли. Для анализа из готового парафинового блока с помощью специального микроножа нарезают тончайшие срезы, которые затем прикрепляют к предметным стеклам и красят рутинными красителями, чтобы было возможно отличить клетки друг от друга и от межклеточного вещества. Затем срезы на стеклах окрашиваются растворами антител, меченных флюоресцирующими метками, специфичных к одному из исследуемых рецепторов. Если в опухолевой клетке присутствует искомый рецептор, антитела связываются с ним и при просмотре стекла под специальным микроскопом можно увидеть флюоресценцию, что будет свидетельствовать о положительном результате теста. Кроме того, при просмотре среза врач-морфолог сможет увидеть, что окрашенный маркер располагается в ядре, клеточном веществе или на оболочке опухолевых клеток. Количество применяемых растворов с антителами соответствует количеству маркеров, которые исследуются в образце. Степень флюоресценции и процент клеток, в которых она есть, лежат в основе интерпретации результатов иммуногистохимического анализа и подробнее описаны в соответствующем разделе.
Для чего используется исследование?
- Для определения гормонорецепторного статуса и степени пролиферативной активности рака молочной железы для оценки прогноза и индивидуализации лечения, в том числе определения показаний для назначения таргетной терапии.
- По результатам детекции гормональных рецепторов определяется целесообразность использования антиэстрогенов, а рецептора HER2 – таргетных анти-HER2 препаратов. Выявленное отсутствие этих маркеров позволяет избежать назначения заведомо неэффективной терапии. Высокий индекс пролиферативной активности, а также негативность по рецепторному статусу по большей части являются показанием для добавления к лечению цитостатических препаратов.
Когда назначается исследование?
- При наличии гистологически верифицированного рака молочной железы - впервые выявленные, рецидивирующие и метастатические опухоли.
Что означают результаты?
При интерпретации результатов иммуногистохимического определения рецепторного статуса стероидных гормонов (эстрогенов и прогестерона) в опухолях молочной железы следует оценивать не только процент окрашенных антителами клеток, но и интенсивность окрашивания. Оба эти параметра учитываются в шкале Allred, где процент позитивных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3. Сумма двух показателей является итоговым баллом, по которому определяется позитивность опухоли по рецепторному статусу: 0-2 негативная, 3-8 позитивная. Общий балл 3 по этой шкале соответствует 1-10% окрашенных клеток и является минимальным позитивным результатом, когда назначение гормональной терапии может иметь эффективность.
Иногда рецепторный статус определяется исключительно по проценту клеток с окрашенными ядрами. В таких случаях NCCN рекомендует считать позитивными все опухоли, где есть более 1% позитивных клеток.
При интерпретации окраски на рецептор HER2/neu учитывают только мембранное окрашивание (окрашивание клеточной оболочки), которое оценивают по шкале от 0 до +3:
результат 0 и +1 считается HER2-негативным;
+2 – пограничный результат, при нем по данным иммуногистохимического исследования нельзя судить о наличии на поверхности клеток рецептора HER2-neu, необходимо проведение FISH- или CISH-исследования;
+3 – положительный результат – таргетная терапия анти-HER2 препаратами будет эффективна.
Согласно классификации St. Gallen Consensus (2009), низким индексом пролиферативной активности считается уровень Ki-67 менее 15%, средним – 16-30%, а высоким – более 30%.
Что может влиять на результат?
- Качество предоставленных парафиновых блоков, опыт и квалификация врача-патоморфолога, так как иммуногистохимический метод не в полной мере стандартизирован и оценка его результатов в некоторой степени субъективна.
- Интерпретация результатов исследования должна проводиться исключительно врачом соответствующей специальности, приведенные данные об эффективности и целесообразности назначения определенных лекарственных средств в зависимости от результатов исследования носят исключительно рекомендательный характер и могут быть пересмотрены с учетом индивидуальных особенностей пациентки.
- При неопределенном HER2/neu-рецепторном статусе (результат иммуногистохимического исследования 2+) рекомендуется выполнение FISH- или CISH-исследования, которые позволят выявить гиперактивацию гена, кодирующего этот рецептор. При недоступности этих исследований допускается повторное иммуногистохимическое исследование, но на другом образце опухолевой ткани.
- Существует несколько шкал оценки рецепторного статуса рака молочной железы, в лабораторном отчете должно быть указано, по какой именно проводилась оценка позитивности опухоли в данном исследовании, а также дана описательная характеристика количества позитивных клеток, особенностей окрашивания клеточных структур и морфологических особенностей клеток.
Гистологическое исследование биопсийного материала образования молочной железы
Цитологическое исследование пунктатов молочной железы
Определение HER2 статуса опухоли методом FISH
Определение HER2 статуса опухоли методом CISH
Кто назначает исследование?
Онколог, маммолог, онкогинеколог.
Литература
Dana Carmen Zaha. Significance of immunohistochemistry in breast cancer. World Journal of Clinical Oncology, 2014; 5(3): 382-392.
Клиническая лабораторная диагностика: национальное руководство: в 2 т. – T. I / Под ред. В. В. Долгова, В. В. Меньшикова. – М.: ГЭОТАР-Медиа, 2012. С. 658-660.
В. Ф. Семиглазов, Р. М. Палтуев, В. В. Семиглазов, Г. А. Дашян, Т. Ю. Семиглазова, П. В. Криворотько, К. С. Николаев. Общие рекомендации по лечению раннего рака молочной железы St. Galle- 2015, адаптированные экспертами Российского общества онкомаммологов. Опухоли женской репродуктивной системы, 2015; 3: 43-60.

- ИГХ исследования – что это такое
- Суть методики
- Кому показано
- ИГХ исследования: что это такое и как проводятся
- Расшифровка
ИГХ исследования – что это такое
ИГХ представляет собой методику, используемую в патологической анатомии для диагностики раковых и доброкачественных опухолей. Его назначают, когда установить точный диагноз стандартным гистологическим способом невозможно или необходима детализация клинически значимых параметров новообразований на молекулярном уровне.
Очень часто гистологии бывает недостаточно. В большинстве случаев причиной этому является крайне нетипичная структура патологического образования, что существенно затрудняет постановку точного диагноза. В частности, при лимфоме и лейкозе ИГХ делают практически всегда.
Нужно отметить, что всего насчитывается около 70 разновидностей лейкозов и лимфом. Верифицировать некоторые их них удается лишь путем нескольких исследований – гистологического, иммуногистохимического и молекулярно-генетического.
Суть методики
При развитии любого опухолевого процесса формируются чужеродные организму белки – антигены, в противовес которым иммунная система человека вырабатывает антитела – иммуноглобулины. Они прикрепляются к антигенам и связываются с эпитопами – основными частями антигенных макромолекул. Антитела выполняют сразу две функции: связывающую и эффекторную. Проще говоря, они напрямую мешают антигенам наносить вред и одновременно активируют комплемент, запуская ответную реакцию иммунитета.
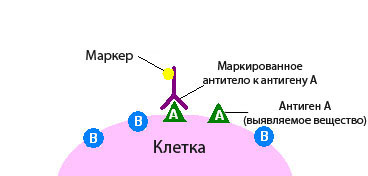
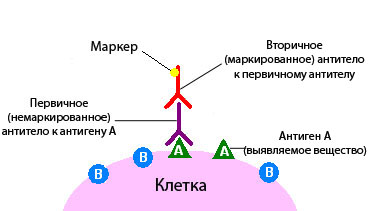
Роль антигенов в данном случае принадлежит атипичным опухолевым клеткам. Перед тем как провести иммуногистохимическое исследование, срезы биометариала маркируются специфическими антителами к ним. В целях дальнейшей визуализации эти антитела окрашиваются ферментами. Далее, используя высокоточную оптику, наблюдают за поведением испытуемых клеток.
Если белковые соединения, помеченные как антитела, связываются с опухолевыми клетками, будет видно свечение – флюоресценцию, свидетельствующую о наличии искомых веществ. Так выявляют, например, рецепторы к гормонам и онкомаркеры. При подозрении на рак молочной железы таким образом обнаруживаются рецепторы к эстрогену и прогестерону.
Кому показано
В отдельных случаях иммуногистохимический анализ позволяет установить источник метастазов, когда локализация первичного очага неизвестна, а также провести дифференциальную диагностику при нескольких новообразованиях разного происхождения.
ИГХ может назначаться при бесплодии, хронических патологиях эндометрия, матки и яичников, привычных выкидышах. Ее целесообразно делать и в том случае, если беременность не наступает после нескольких процедур ЭКО.
Иммуногистохимия поможет обнаружить наличие клеток, препятствующих зачатию, и определить дальнейшую тактику лечения бесплодия.
Методом ИГХ оценивают и лекарственную чувствительность путем выявления:
- рецепторов половых гормонов – эстрогена, прогестерона и андрогенов. Необходимо при поражении женской репродуктивной системы;
- фактора роста опухоли Her2/neu. Биомаркер и терапевтическая мишень агрессивных типов рака груди;
- соматостатиновых рецепторов 2а и 5 типа, важных при карциноидах;
- мембранного белка иммуноглобулинов PD-L1, гена ALK и рецептора тирозинкиназы ROS. Данные показатели исследуются преимущественно при немелкоклеточном раке легких;
- микросателлитной нестабильности;
- индекса пролиферативной активности.
Трудно переоценить важность микросателлитной нестабильности (MSI), которая существенно расширяет прогностические и лечебные возможности у пациентов со злокачественными поражениями ЖКТ. Новообразования с низкой MSI медленнее растут и реже дают метастазы. Поэтому своевременное выявление MSI позволяет избежать назначения агрессивной, но заведомо неэффективной терапии.
ИГХ исследования: что это такое и как проводятся
Для выполнения ИГХ необходим биоматериал, забор которого осуществляется в основном путем взятия биопсии. Несколько реже его получают в ходе эндоскопической или классической открытой операции. Способ изъятия пораженной ткани зависит от типа и локализации рака. При этом следует учесть, что брать материал на анализ следует до начала терапии. В противном случае возможно искажение результатов исследования.
Этапы проведения анализа:
- Полученный биоматериал фиксируют, обрабатывая в формалине, и отправляют в лабораторию.
- Затем его обезжиривают и подвергают повторной фиксации, после чего заливают парафином.
- Далее производится микротомирование – с готовых парафиновых блоков делаются тонкие срезы, которые помещаются на специальные стекла. Толщина среза составляет не больше 1 мкм.
Когда ткани лежат на стеклах, их обрабатывают раствором антител. Количество их видов ограничено несколькими десятками. Исследование реакций с применением до 5 разных антител проводится на малой панели. При более масштабном эксперименте нужна большая панель.
В ходе ИГХ рак любого органа проявляется эффектом свечения – флюоресценции, – благодаря чему выявляются злокачественные клетки, определяются рецепторы гормонов или другие заданные параметры.
Расшифровка
Изучением срезов биоматериала занимаются врачи-патологоанатомы. Они же первыми составляют прогноз, исходя из выявленного типа и объема онкогенных клеток. При расшифровке результатов особое внимание обращают на показатель К-67 – специфический белок, антиген ракового процесса. Он вырабатывается только при активном делении клеток, а в состоянии покоя не продуцируется.
К-67 – это именно тот онкомаркер, что показывает степень озлокачествления процесса. Если его уровень в процентном содержании составляет 85% и выше, то заболевание прогрессирует стремительно и с высокой вероятностью вскоре приведет к смерти.
Благоприятным будет прогноз при К-67=10%. В случае грамотно составленного плана терапии есть все шансы на полное выздоровление, зачастую без риска рецидива. При К=30% констатируют среднюю степень тяжести болезни, что означает достаточно быстрый рост рака. С помощью курсовой химиотерапии его можно замедлить и даже остановить.
Однако К-67 – это не единственный показатель, который указывается в медицинском заключении. Также записываются антитела, к которым выявлены соответствующие антигены, тип и количество последних.
Полученное заключение врач-патологоанатом передает лечащему онкологу, который подбирает лечение. Для оценки его эффективности иммуногистохимию проводят еще раз после завершения терапевтического курса.
Литературные данные, свидетельствующие о возможности участия В-лимфоцитов в усилении роста опухоли, можно рассматривать в двух аспектах: первый — непосредственное влияние В-лимфоцитов, второй — значение противоопухолевых антител, хотя очевидно, что оба аспекта тесно связаны между собой.
В изучение этого вопроса большой вклад внесли исследования Н. Schreiber и его коллег (Т. Wu, P. Monach, D. Rowley, D. Mumburg и др.).
По мере накопления соответствующих данных выяснилось, что как В-лимфоциты, так и антитела против опухолевых антигенов при определенных условиях могут быть факторами усиления роста опухоли.
В-лимфоциты
В одной из ранних работ на модели перевивных опухолей было показано, что у мышей, дефицитных по В-лимфоцитам, опухоли развиваются медленнее и значительно чаще наблюдается регрессия опухоли.
Согласно этим данным авторы сформулировали заключение, что В-лимфоциты супрессируют возможность регрессии опухоли, и этот факт может быть положен в основу нового направления, связанного с изучением механизмов иммунологического усиления с участием В-лимфроцитов.
Со временем появились сведения, которые давали возможность в определенной мере объяснить усиление роста опухоли под влиянием В-лимфоцитов. В опытах с использованием нормальных мышей и дефицитных в отношении В-лимфоцитов были получены данные, из которых следовало, что в присутствии В-лимфоцитов СD4+Т-лимфоциты не способны оказывать помощь цитотоксическим лимфоцитам (ЦТЛ).
Это послужило основанием для заключения об ингибирующем влиянии В-лимфоцитов на Т-зависимый противоопухолевый иммунитет. Полученные данные, согласно точке зрения авторов, могут помочь в объяснении наблюдений, из которых следует, что противоопухолевые антитела, часто появляющиеся как в опухолевой ткани, так и сыворотке крови больных раком, могут принимать участие в усилении роста опухоли.
В установление возможных причин стимулирующего влияния В-лимфоцитов на рост опухоли определенную ясность вносят данные, которые показывают, что оно может быть связано со способностью В-лимфоцитов снижать уровень IFNy и IL-12.
Такие сведения были получены при исследовании влияния различных фракций клеток селезенки мышей-опухоленосителей: нефракционированные клетки селезенки продуцировали IFNy и IL-12, при элиминации В-лимфоцитов продукция этих цитокинов усиливалась, а при добавлении В-лимфоцитов — уменьшалась.
Механизм ингибирующего влияния В-лимфоцитов авторы объясняют тем, что процесс их взаимодействия с Т-лимфоцитами (CD40/CD40L) сопровождается снижением уровня IL-12, участвующего в усилении продукции IFNy.
Механизм иммуностимулирующего действия был исследован также при обследовании больных раком кишечника. Установлено, что среди В-лимфоцитов периферической крови больных появляются клоны этих клеток с аномальным фенотипом, которые экспрессируют на своей поверхности (при снижении количества клеток, экспрессирующих CD19) CD21 и/или sTn-антиген.
Удалось также показать, что при частичном удалении В-лимфоцитов уменьшалось число CD21-положительных клеток, не изменялось содержание sTn-положительных клеток, но тяжесть течения процесса у большого количества больных снижалась.
Эти данные заслуживают особого внимания, так как они свидетельствуют о том, что не все В-лимфоииты, а лишь определенные их клоны могут быть причастны к иммуностимуляции роста опухоли. Необходимо поэтому расширение спектра исследований в этом направлении с характеристикой соотвествующего фенотипа В-лимфоцитов.
Продолжая это направление исследований, авторы указанной работы отметили еще один важный факт: после экспозиции В-лимфоцитов с опухолевыми антигенами они приобретают способность усиливать рост опухоли in vivo и in vitro.
При выяснении механизма этого усиления удалось показать, что иммунные комплексы, в состав которых входят антигены опухоли и противоопухолевые антитела, вступают во взаимодействие с опухолевыми клетками, экспрессирующими FcyRI, что сопровождается усилением их пролиферации и потерей опухолевых антигенов. Такая пролиферация, индуцированная иммунными комплексами, связана с сигналом трансдукции, обусловленным фосфатидилинозитолкиназой-3.
Из этих данных следует принципиальное предположение: иммунные комплексы и FcyRI опухолевых клеток усиливают рост и формируют метастатический фенотип.
Имеются данные, которые позволяют склоняться к точке зрения, что инфильтрация ткани В-лимфоцитами может служить благоприятным фоном для перехода предопухолевых изменений в злокачественный процесс.
Такие данные получены при исследовании гиперкератоза, дисплазий и плоскоклеточной карциномы языка. Установлено, что при инфильтрации CD4+-, CD8+-, CD14+-, CD19+- и СD20+-лимфоцитами наиболее существенно изменялись В-лимфоциты, инфильтрирующие пораженные участки; инфильтрация В-лимфоцитами была незначительной в нормальной ткани и наиболее выраженной при малигнизации.
Как отмечено в первой части монографии, В-лимфоциты могут индуцировать В-клеточную толерантность, которая является результатом их взаимодействия с Т-лимфоцитами. Наряду с этим хорошо известно, что такое взаимодействие — необходимое условие для индукции иммунологического ответа.
Для выяснения причин этих противоположных эффектов использовали модели Т-зависимой и Т-независимой В-клеточной активации. В результате исследований получены данные о снижении уровня ответа ЦТЛ при использовании различных путей активации В-клеток, что сопровождалось ослаблением пролиферации, секреции цитокинов и цитотоксической активности цитотоксических лимфоцитов.
Негативное влияние В-лимфоцитов нивелировалось антителами против TGFв1, который экспрессировался на поверхности В-лимфоцитов и мог быть причиной снижения уровня ответа ЦТЛ. Эти данные позволяют авторам предполагать существование нового механизма развития анергии ЦТЛ с участием TGFв1, экспрессируемого на поверхности В-лимфоцитов.
К настоящему времени уже на молекулярном уровне получены данные, приближающие к более полному пониманию причин неоднозначной роли В-лимфоцитов в опухолевом процессе. Такие данные получены при изучении спонтанного трансгенеза В-лимфоцитов человека, использования плазмиды ДНК, кодирующей тяжелую цепь иммуноглобулина, клеток лимфомы Беркитта, трансформированных вирусом Эпштейна-Барр, и наивных В-лимфоцитов периферической крови.
Впервые было показано, что наивные В-лимфоциты располагают программой для спонтанной интернализации ДНК, которая может обусловливать новые иммунологические функции этих клеток.
Возможные пути включения В-лимфоцитов в стимуляцию роста опухоли представлены на рис. 62.

Рис. 62. Включение В-лимфоцитов в стимуляцию роста опухоли
Противоопухолевые антитела
Наряду со способностью участвовать в стимуляции роста опухоли на клеточном уровне В-лимфоциты как предшественники плазматических клеток могут включаться в этот процесс и с помощью противоопухолевых антител.
Хорошо известно, что в сыворотке крови как больных злокачественными новообразованиями, так и животных с различными моделями опухолевого процесса обнаруживаются противоопухолевые антитела, роль которых в противоопухолевой защите обсуждалась ранее.
Противоопухолевые антитела обнаруживаются и внутри различных опухолей. Несмотря на то, что этот факт, как и инфильтрация опухоли плазматическими клетками, известен давно, четкого определения, в каких случаях они появляются и каково их значение, до настоящего времени нет.
Исследование солидных опухолей, в частности меланом, показало, что антитела находятся не только внутри опухоли, но и на поверхности опухолевых клеток. Со временем было обнаружено, что антитела могут препятствовать ответу цитотоксических лимфоцитов и усиливать опухолевый рост.
Есть основания полагать, что роль противоопухолевых антител в значительной мере предопределяется тем, какие опухолевые антигены индуцировали их синтез. При использовании гликопротеина (STGP) — опухолеассоциированного антигена, секретируемого рядом опухолей, в опытах на модели инвазивного рака отмечен высокий уровень антител класса G против этого антигена и повышение их уровня, что коррелировало с опухолевой инвазией.
Важным аспектом этих исследований является констатация того, что наличие антител против указанного антигена сочеталось с локальным выделением IL-1в, IL-6 и VEGF стромальными клетками.
Параллельно с увеличением концентрации антител в сыворотке крови выявлена интенсивная инфильтрация опухоли IgG-положительными опухолевыми клетками. Вывод, к которому приходят авторы, таков: гуморальный иммунологический ответ, индуцированный гликопротеином, секретируемым опухолью, усиливает инвазию и метастазирование путем выделения стромальными клетками провоспалительных цитокинов.
В усилении роста опухоли могут участвовать не только противоопухолевые антитела изотипа G. Такой способностью обладают также антитела класса М. При решении вопроса, могут ли анти-IgM-моноклональные антитела генерировать избирательное связывание клеток меланомы В16 сингенными фибробластами и лимфоцитами, получены следующие данные.
Установлено, что анти-IgM-антитела увеличивают колонизацию опухолевых клеток и их агрегацию — свойства, которыми не обладают интактные IgM- и IgG-подобные фрагменты. Более того, химически синтезированный IgG-подобный фрагмент противоопухолевых aнти-IgM-антител снижает уровень колонизации и агрегации опухолевых клеток.
Полученные данные ярко демонстрируют разнонаправленность эффектов анти-IgМ-антител, так как наряду с противоопухолевым действием они могут способствовать гематогенной диссеминации опухолевых клеток. На рис. 63 представлены возможности стимуляции роста опухоли под влиянием противоопухолевых антител.

Рис. 63. Стимулируюшее влияние противоопухолевых антител на рост опухоли
В настоящее время уже появляется информация, которая приближает к объяснению неравнозначности влияния на рост опухоли как В-лимфоцитов, так и противоопухолевых антител на генетическом уровне.
Фундаментальной основой подобных исследований служит установленный факт, согласно которому прогрессия опухолевого процесса часто сопровождается появлением новых антигенов, способных индуцировать синтез антител.
Многие из этих антигенов — результат генетических мутаций, которые особенно часто сопровождают поздние стадии процесса. К сожалению, об этих изменениях известно немного, однако доказано, что новые антигены не снижают своей иммуногенности, а следовательно, могут распознаваться иммунологической системой и генерировать иммунологический ответ.
Поэтому представляются очень важными и оригинальными исследования, проведенные М. Spiotto, М. Reth и Н. Schreiber, которые использовали методические подходы, позволяющие индуцировать генетические рекомбинации в стабильных опухолевых клетках.
Такая рекомбинация привела, в частности, к увеличению экспрессии белка, усиливающего зеленую флюоресценцию клетки (EGFP) с последующей выработкой антител против этого белка. Появление новых антител свидетельствовало о генетических изменениях, наступивших в процессе роста, которые могут быть предвестниками последующей прогрессии.
Хорошо известно, что появление противоопухолевых антител во многих случаях сопровождается образованием иммунных комплексов. Эти комплексы с включением различных механизмов могут как системно, так и локально способствовать усилению роста опухоли. Особенности влияния иммунных комплексов на рост опухоли представлены на рис. 64.

Рис. 64. Возможные механизмы повреждающего действия иммунных комплексов при опухолевом процессе
Роль В-лимфоцитов и противоопухолевых антител в усилении роста опухоли
Анализируя материал о роли В-лимфоцитов и противоопухолевых антител в усилении роста опухоли, нельзя не отметить, что объем данных по этому вопросу сравнительно невелик. Тем не менее возможность иммуностимуляции с участием как В-лимфоцитов, так и противоопухолевых антител очевидна.
К настоящему времени остается открытым вопрос о том, существует ли подобно CD4+CD25+- и СD8+СD28-Т-лимфоцитам субпопуляция В-лимфоцитов с негативной регуляцией. Однако весьма вероятно предполагать наличие фенотипа В-лимфоцитов, который формируется при определенных условиях и может способствовать усилению роста опухоли.
Такую способность В-лимфоциты приобретают при их взаимодействии с иммунными комплексами, в состав которых входят антигены опухолей и противоопухолевые антитела.
Оценка роли В-лимфоцитов и противоопухолевых антител в стимуляции роста опухоли тесно связана с изучением антигенов, способных индуцировать синтез противоопухолевых антител, значение которых может изменяться в зависимости от особенностей антигена и стадии процесса. Успех дальнейшего изучения роли В-лимфоцитов и противоопухолевых антител в стимуляции роста опухоли зависит от разработок соответствующих экспериментальных моделей.
Одним из центральных механизмов усиления роста опухоли с участием противоопухолевых антител является их препятствие к распознаванию и действию цитотоксических клеток.
Читайте также:

