Клетки опухоли экспрессируют что это значит
Медицинский эксперт статьи


Сегодня многие задаются вопросом, что представляют собой опухолевые клетки, какова их роль, представляют ли они опасность и приносят ли пользу, или исключительно направлены на уничтожение макроорганизма? Давайте разберемся в этом вопросе.
Трансформированные клетки, которые образуют злокачественную опухоль. Клетки претерпевают многочисленные изменения. Эти изменения ощутимы на морфологическом, химическом, биохимическом уровне. Некоторые видны даже невооруженным глазом. Обнаружение других же требует специального оборудования. Все зависит от типа и локализации.
Отличительной чертой является способность беспредельно увеличивать свою биомассу, что обусловлено нарушением апоптоза (обеспечивает программированную гибель). Заканчивается такой рост только вместе с гибелью человека.
Отличие опухолевой клетки от нормальной
Существует система клеточного апоптоза, который представляет собой запрограммированную гибель клеточного звена. Обычно клетка, прошедшая свой жизненный цикл, погибает. На ее месте со временем развивается новая субпопуляция клеточного цикла. Но при раковой трансформации такой естественный механизм нарушается, в результате чего эта клетка не погибает, а продолжает расти и функционировать в организме.
Именно такой внутренний механизм и является базовой основой формирования опухоли, обладающей тенденцией к бесконтрольному и неограниченному росту. То есть, по сути, подобного рода клеточная структура представляет собой клетку, не способную к гибели, и обладающую неограниченным ростом.

[1], [2], [3], [4], [5], [6], [7], [8]
Клеточный атипизм и атипичные клетки
Под атипичными клетками подразумевают клетки, подверженные мутации. Чаще всего атипичные клетки образуются под действием различных внешних факторов, или наследственности путем их трансформации из стволовых клеток. Чаще всего пусковым фактором развития опухолевой клетки является специфический ген, который кодирует гибель клетки. Некоторые потенциально онкогенные вирусы, например ретровирусы, герпесвирусы, способны вызывать трансформацию стволовых клеток в раковые.
Клеточный атипизм представляет собой собственно процесс трансформации, которому подвергаются здоровые клетки. Этот процесс включает в себя комплекс химических и биохимических процессов. Мутация осуществляется при условии нарушений иммунной системы, в особенности при аутоиммунных заболеваниях, при которых функция иммунной системы трансформируется таким образом, что он начинает вырабатывать антитела, направленные против клеток и тканей собственного организма. Развитию клеточного атипизма способствует ухудшение естественных защитных способностей организма, в частности, при нарушении активности Т-лимфоцитов (киллеров), нарушаются процессы гибели клеток, что приводит к их злокачественному перерождению.

[9], [10], [11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21]
Канцерогенез
Процесс потенциального разрастания тканей, что никаким образом не ассоциировано с нормальным состоянием организма. Канцерогенез подразумевает процесс перерождения нормальной клетки в опухолевую, которая есть локальным образованием, однако вовлекается весь организм. Характеристика - опухоли могут давать метастазы, бесконечно разрастаться.

[22], [23], [24], [25], [26], [27], [28], [29]
Раковая клетка под микроскопом
В основе развития раковой клетки лежит резкое увеличение ядра. Раковую клетку легко обнаружить под микроскопом, поскольку ядро в ней может занимать большую часть цитоплазмы. Также ярко выражен митотический аппарат, причем заметны его нарушения. В первую очередь обращает на себя внимание наличие хромосомных аббераций, нерасхождения хромосом. Это приводит к образованию многоядерных клеток, увеличению и утолщению ядра, переходу их в фазу митотического деления.
Также под микроскопом можно обнаружить глубокие инвагинации ядерной мембраны. При электронной микроскопии видны внутриядерные структуры (гранулы). Также в ходе световой микроскопии можно обнаружить потерю четкости контуров ядра. Ядрышки могут сохранять нормальную конфигурацию, могут увеличиваться к количественном и качественном отношении.
Происходит набухание митохондрий. При этом происходит уменьшение количества митохондрий, нарушаются митохондральные структуры. Также наблюдается диффузное расположение рибосом относительно эндоплазматической сети. В некоторых случаях возможно полное исчезновение аппарата Гольджи, но в некоторых случаях возможно и его гипертрофия. Происходит также изменение субклеточных структур, например меняется структура, внешний вид лизосом, рибосом. При этом происходит неодинаковая степень дифференциации клеточных структур.
В ходе микроскопии можно выявить низкодифференцированные и высокодифференцированные опухоли. Низкодифференцированные опухоли представляют собой бледные клетки, в состав которых входит минимальное количество органелл. Большую часть клеточного пространства занимает клеточное ядро. При этом все субклеточные структуры имеют различную степень зрелости и дифференциации. Для высокодифференцированных опухолей характерно сохранение исходной тканевой структуры.

[30], [31], [32], [33], [34], [35], [36]
Свойства и особенности опухолевых клеток
Если клетка становится опухолевой, нарушает ее генетическая структура. Это влечет за собой репрессионные процессы. В результате дерепрессии других генов происходит появление модифицированных протеинов, изоферментов, а также происходит клеточное деление. Это может изменить интенсивность генного и ферментного функционирования. Часто наблюдается репрессия белковых компонентов. Ранее они отвечали за специализацию клетки, активировались депрессией.
Элементы, выступающие в качестве триггеров, инициирующих патологический процесс. Есть предположение относительно того, что внедрение химических веществ осуществляется непосредственно в ДНК и РНК клеток. Это способствует нарушению созревания, развивается увеличение клеточной проницаемости, в результате чего потенциально онкогенные вирусы способны проникать в клетку.
Также пусковыми механизмами могут стать и некоторые физические факторы, такие как повышенный уровень радиации, облучение, механические факторы. В результате их воздействия происходит повреждение генетического аппарата, нарушение клеточного цикла, мутации.
Резко увеличивается потребление аминокислот, увеличивается анаболизм, тогда как катаболические процессы снижаются. Резко увеличивается гликолиз. Также происходит резкое снижение числа дыхательных ферментов. Наблюдается также изменение антигенной структуры опухолевой клетки. В частности, она начинает продуцировать белок альфа-фетопротеин.
Наиболее простым способом диагностики онкологического заболевания является сдача анализа крови на выявление онкомаркеров. Исследование проводится довольно быстро: 2-3 дня, в случае экстренной необходимости может выполниться за 3-4 часа. В ходе анализа выявляют специфические маркеры, которые указывают на протекание в организме онкологических процессов. По виду выявленного маркера можно говорить о том, какой вид рака протекает в организме, и даже определить его стадию.
Следует понимать, что клетка не способна к гибели. Она также может давать патологические метастазы. Также характеризуется нарушением синтетических процессов, интенсивно поглощает глюкозу, быстро расщепляет белки и углеводы, изменяет действие ферментов.

[37], [38]
Сама суть трансформационных изменений – активация синтеза нуклеиновых кислот. Стандартный комплекс претерпевает существенные изменения. Редуцируется синтез ДНК-полимеразы-3, которая отвечает за синтез новой ДНК на базе нативной структуры. Вместо этого увеличивается синтез аналогичных структур 2 типа, которая способна восстанавливать ДНК даже на основании денатурированной ДНК. Именно это и обеспечивает специфику рассматриваемых элементов.
Наиболее известным является рецептор эпидермального фактора роста, который представляет собой трансмембранный рецептор. Происходит активное взаимодействие его с эпидермальными факторами роста.
Любая трансформация влечет за собой изменение генотипа. Наглядно это выражается в изменениях, которые отражены на фенотипическом уровне. Любое изменение подобного рода является чужеродным для организма. Это подразумевает чрезмерную агрессивность иммунной системы человека, которая сопровождается атакой и разрушением собственных тканей организма.
Экспрессия опухолевых клеток
Экспрессия объясняется несколькими причинами. В первичный канцерогенез вовлекается всего одна клетка, но иногда может наблюдаться и одновременное вовлечение в этот процесс нескольких клеток. Затем развивается опухоль, происходит ее рост и размножение. Часто процесс сопровождается спонтанными мутациями. Опухоли приобретают новые свойства.
Отличительной чертой является способность к экспрессии генов, которые выступают в качестве факторов роста для опухоли. Они полностью изменяют обменные процессы исходной клетки, подчиняя ее своим потребностям, выступая своеобразным паразитом.

[39], [40], [41], [42], [43], [44], [45], [46], [47]
Для активного клеточного деления, требуется присутствие в крови, постоянная экспрессия фактора, подавляющего (репрессирующего) активность гена.

[48], [49], [50], [51], [52], [53], [54], [55], [56], [57], [58]
В ходе дифференциации мутированной ткани, она утрачивает способность к экспрессии редуцирующего гена, который отвечает за программированный аппоптоз. Утрата этой способности, лишает соответствующую структуру возможности прекратить свое существование. Соответственно, она непрерывно растет и размножается.

[59], [60], [61], [62], [63]
Пролиферация опухолевых клеток
Пролиферация - показатель разрастания, определяет тяжесть и стадию. Наблюдается функциональная анаплазия. У быстроастущих опухолей полностью утрачиваются все исходные свойства ткани.
Показатель зависит от места локализации. Определяется по экспрессии Ки – 67. Выражается в процентах путем определения соотношения между количеством нормальных клеток и количеством опухолевых клеток. Выражается в процентах, где 1 % - минимальное количество, ранняя стадия опухолевого процесса. 100% - максимальная стадия, как правило, обнаруживается при летальном исходе.
Представляют собой трансформированные клетки, которые подверглись мутационным процессам. Также в этих клетках ярко выражена способность к трансформации основных свойств исходной клетки. Отличительной чертой является неспособность к гибели и способность к неограниченному росту.
Прежде всего, необходимо знать, что этот феномен являет собой не что иное, как перерожденная клетка человеческого организма, которая в силу различных причин подверглась злокачественной трансформации. Этому процессу потенциально может подлежать практически любая здоровая клетка человеческого организма. Главное – наличие триггерного фактора, который запустит механизм трансформации (канцерогенез). В качестве таких факторов может выступать вирус, повреждение клеточной или тканевой структуры, наличие специального гена, кодирующего раковое перерождение.
Циркулирующие опухолевые клетки
Основная особенность такой клетки состоит в изменении ее биохимического цикла. Происходит изменение ферментативной активности. Также стоит отметить тенденцию к уменьшению количества ДНК – полимеразы 3, которая использует все компоненты нативной ДНК клетки. Также существенно меняется синтез. Резко увеличивается синтез белков, как в качественном, так и в количественном отношении. Также представляет определенный интерес наличие в раковых клетках крупноядерного белка веретена. В норме содержание этого белка не должно превышать 11%, при опухолях число возрастает до 30%. Происходит изменение метаболической активности.

[64], [65], [66], [67], [68], [69], [70], [71], [72], [73]
Стволовые опухолевые клетки
Можно сказать, что это первичные, не дифференцированные структуры, которые в дальнейшем будут подвергаться дифференциации функций. Если же такая клетка подвергается мутации, и превращается в раковую, она становится источников метастаз, поскольку свободно перемещается с током крови, и способна дифференцироваться в любую ткань. Живет долго и медленно пролиферируется. При пересадке имеющему низкий иммунитет (иммунодефицит), способна вызвать развитие злокачественного новоообразования
Апоптоз опухолевых клеток
Основная проблема опухолевой клетки - в ней нарушены процессы апоптоза (запрограммированной гибели, не способна к гибели, и продолжает постоянно расти и размножаться). Существует ген, который инактивирует ген, придающий клетке бессмертность. Это позволяет запустить вновь процессы апоптоза, в результате чего можно наладить нормальные клеточные процессы, и вернуть клетку в нормальное состояние, вызвать ее гибель.

[74], [75], [76], [77], [78], [79], [80], [81]
Дифференцировка опухолевых клеток
Опухолевые клетки дифференцируются в зависимости от того, в состав каких тканей она входит. Названия опухолей также зависят от названий ткани, в состав которой они входят, а также от того органа, который подвергся опухолевому превращению: миома, фибромиома, эпителиальная, соединительнотканная опухоль.

[82], [83], [84], [85], [86], [87], [88], [89], [90]
Вне зависимости от того, что заболеваемость раком желудка в России не находится на высоком уровне, в структуре смертности от злокачественных новообразований он занимает 2 место. Это свидетельствует о поздней диагностике рака желудка и агрессивном течении заболевания [1]. Процессы прогрессирования заболевания, вероятность метастазирования и развитие устойчивости к применяемой терапии определяются особенностями экспрессии определенных генов, изменением фенотипа опухолевых клеток, что сопровождается закономерными метаболическими, морфологическими и иммунологическими их изменениями [2; 3]. Кроме того, указанные свойства опухолей определяются наличием особой субпопуляции клеток – опухолевыми, раковыми стволовыми клетками (ОСК, РСК). Показано, что маркеры, выявленные на раковых стволовых клетках, представлены и на определенных типах соматических клеток организма человека, на эмбриональных и мезенхимальных стволовых клетках [4]. Несмотря на то что данные клетки достаточно трудно идентифицировать, число работ, посвященных изучению биологических и клинических особенностей ОСК при различных формах онкологических заболеваний, неуклонно растет [5].
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессии опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [6].
Одним из маркеров раковых стволовых клеток является CD44 - это адгезивный белок, который участвует во взаимодействиях клетка–клетка и клетка–межклеточный матрикс посредством своего лиганда – гиалуроновой кислоты, а также коллагена, ламинина, фибронектина, остеопонтина и некоторых гликозаминогликанов. У CD44+ опухолевых клеток описана более высокая туморогенность (пролиферативный потенциал, способность к формированию колоний), резистентность к лекарственному воздействию, меньшая склонность к апоптозу по сравнению с CD44- клетками [7].
CD44 изолированно или в комбинации с другими маркерами выявляется на ОСК в раке молочной, предстательной и поджелудочной желез, печени, колоректальном раке, опухолях головы и шеи, желудка [8].
CD133 (АС133, проминин-1) впервые был обнаружен Х. Yin и соавт. в 1997 г. на гемопоэтических стволовых клетках [9]. Это гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [10], принадлежит к семейству промининов, имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Ген (PROM1) картирован на 4р15.32. Ассоциирован с мембранными выпячиваниями, но функция его точно не известна. Было также показано, что экспрессия антигена CD133 коррелирует с выживаемостью пациентов с аденокарциномой желудка [11]. Кроме того, у пациентов с колоректальной карциномой комбинация CD133, CD44 и CD166 может успешно идентифицировать пациентов при рецидиве и метастазировании с низким, средним и высоким риском [12].
Для идентификации ОСК при раке желудка чаще всего используют фенотипический маркёр CD44+, наличие которого с высокой вероятностью может указывать на данный тип клеток. Использование же CD133 при обнаружении РСК при раке желудка отмечается не так часто, и его информативность при данной форме опухолей обсуждается.
Цель работы: исследование CD44 + , CD133 + - ОСК в различных тканях при не метастатической и метастатической форме рака желудка с использованием метода проточной цитофлюориметрии.
Материалы и методы
В исследование включено 18 больных раком желудка в возрасте от 30 до 80 лет. Больные давали письменное информированное согласие на проведение исследований, подвергались стандартному в данном случае объему обследований. Пациенты были разделены на две группы:
1 группа – М0, рак желудка без метастазов, 11 человек, степень дифференцировки опухоли – G2, средний возраст 58,9±9,7.
2 группа – М1, рак желудка с выявленными метастазами в брюшину и большой сальник, 7 человек, степень дифференцировки опухоли– G2, средний возраст 53,4±11,9.
Непосредственно после оперативного вмешательства осуществляли забор следующих образцов: опухоль (ОП), перифокальная зона (ПЗ), сальник (СА), брюшина (БР), которые ex temporae помещались в раствор CellWash и подвергались дезинтеграции с использованием BD Medimachine в течение 30–60 сек. Полученную клеточную взвесь после фильтрования центрифугировали в течение 4 мин. при 1500 об/мин. в центрифуге Еppendorf 5702 R. Осажденные клетки ресуспендировали раствором CellWash.
Фенотипирование клеток осуществляли на проточном цитометре FACSCantoII (BD, USA) после их обработки панелью антител (CD45, CD44, CD133). Аналитические процедуры осуществляли в соответствии с указаниями фирмы - производителя наборов. Результаты определения клеток, имеющих маркеры ОСК (CD44 + , CD133 + ), выражали в процентах от общего количества лимфоцитов CD45 + -клеток либо от общего числа CD45--клеток.
Статистическая обработка полученных результатов предполагала расчет средних значений и стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между группами. В случае нормального распределения использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка без метастатических поражений (М0), представленные на рисунке 1.
В группе М0 при степени дифференцировки опухоли G2 процентное содержание клеток с фенотипом CD45+CD44+ в ткани опухоли и брюшины статистически не отличалось и составило 3,4±1,4 и 3,8±1,6 соответственно. При этом отмечено увеличение клеток с данным фенотипом в сальнике - 8,4±4,5, что больше количества этих клеток в ткани опухоли на 147% (в 2,4 раза), р=0,002. В случае ПЗ не удалось определить клетки с данным фенотипом.
Определение клеток с фенотипом CD45-CD44+ позволило выявить следующие закономерности. Наибольшее количество клеток данного фенотипа выявлено в ткани БР – 1,1±0,5, что выше значений данного показателя в ОП (0,65±0,3) и СА (0,3±0,1) на 69% (в 1,7 раза) и 267% (3,7 раза) соответственно, р=0,001.
Другим маркёром опухолевых стволовых клеток является CD133+. Определение клеток, имеющих фенотип CD45+CD133+, выявило большее процентное число данных клеток в ткани ОП – 2,75±0,9. В БР и СА количество данных клеток было ниже значений в ОП соответственно на 60% (2,5 раза) – 1,1±0,4, и 93% (13,8 раз) – 0,2±0,05, р=0,02. В ПЗ клетки с данным фенотипом не определялись (рис. 1).
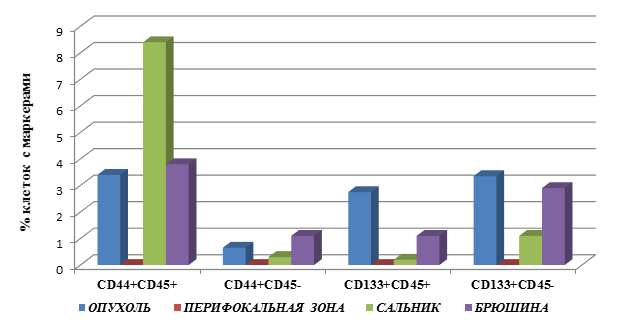
Рис. 1. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 1 (М0) – без метастатических поражений
Следует отметить, что определение процентного содержания клеток с фенотипом CD45-CD133+ имело аналогичные закономерности распределения, однако число данных клеток во всех тканях было выше, чем клеток с фенотипом CD45+CD133+. Максимальное число данных клеток выявлено в ОП – 3,35±2,7, затем в БР – 2,9±1,1 и в СА – 1,1±0,4. Полученные результаты меньше значений в ОП соответственно на 13% (в 1,2 раза) для БР и на 67% (в 3 раза) для СА, р=0,02. В ПЗ клеток с данным фенотипом не выявлено.
Таким образом, при раке желудка у пациентов без выявленных метастатических поражений в опухоли наблюдается накопление клеток с фенотипом CD45+CD133+ и CD45-CD133+, превышающее таковое в брюшине и сальнике. Кроме того, процентное содержание клеток с фенотипом CD45+CD44+ было выше в сальнике, а с фенотипом - CD45-CD44+ - в опухоли (рис. 1).
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка, стадия дифференцировки опухоли G2 с метастатическими поражениями (М1), которые представлены на рисунке 2.
Наибольшее процентное содержание клеток с фенотипом CD45+CD44+ у больных раком желудка с метастатическими поражениями выявлено в ткани ОП – 19,8±4,5, в то время как в БР – 9,7±1,5, с практически одинаковым количеством данных клеток в ПЗ, СА – соответственно 4,4±1,5 и 4,2±1,2. Полученные значения ниже данного показателя в ОП на 79% (в 4,7 раза), 78% (4,5 раза) и 51% (в 2 раза) для СА, ПЗ и БР соответственно (для всех результатов р=0,03).
Обращает внимание тот факт, что у больных с метастатическими поражениями при РЖ по сравнению с данным показателем у пациентов без метастазов количество клеток с фенотипом CD45+CD44+ в ОП было выше на 482% (в 5,8 раза), в БР – на 155% (в 2,6 раза), а в СА – ниже на 50% (в 2 раза), р=0,03. Кроме того, данный тип клеток появляется в ПЗ пациентов группы М1, в то время как у больных М0 они не определялись (рис. 2).
Наибольшее количество клеток с фенотипом CD45-CD44+ у больных с метастазами отмечается в СА и ПЗ, соответственно 3,3±1,4 и 0,9±0,05, что превышает в 11 раз показатель у пациентов без метастазов (для СА). В ОП и БР данный тип клеток не выявлен при наличии метастазов, в то время как без них они определялись.
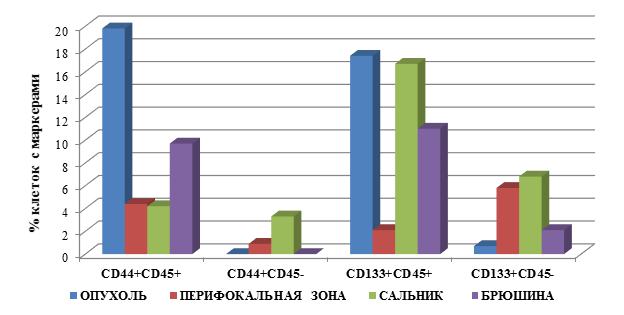
Рис. 2. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 2 (М1) – с метастатическими поражениями
При определении другого, менее часто используемого для идентификации ОСК РЖ маркера CD133, выявлены следующие особенности при наличии метастатических поражений.
Количество клеток с фенотипом CD45+CD133+ было максимальным в ОП и СА, соответственно 17,4±2,5 и 16,7±2,1, что выше значений у пациентов группы М0 в 6,3 и в 84 раза, т.е. максимальный прирост данных клеток выявлен в СА. В ПЗ у больных М1 группы количество было ниже на 37% (в 1,6 раза) по сравнению с значениями в ОП, но превышало значения данного показателя у пациентов без метастатических поражений в 10 раз. Следует отметить, что на фоне метастатических поражений данные клетки обнаруживаются и в ПЗ, чего не наблюдалось у больных РЖ без метастазов. Однако значение данного показателя было ниже на 88% (в 8,3 раза) количества данных клеток в ОП.
У больных группы М1 клетки фенотипом CD45-CD133+ в максимальном количестве определялись в СА, ПЗ и БР, соответственно 6,8±1,5, 5,8±1,8 и 2,1±0,3, в то время как в ОП их число было относительно невелико – 0,7±0,05. При этом, как правило, количество данных клеток существенно превышало данный показатель у больных без метастатических поражений в случае СА – в 6 раз (выше на 518%), в ПЗ эти клетки обнаруживались у пациентов с поражениями, в то время как без метастазов они не выявлялись. Однако количество клеток с фенотипом CD45-CD133+ снижалось у пациентов с метастазами в ОП и БР – отмечено снижение данного показателя на 79% (4,8 раза) и 28% (1,4 раза) соответственно, р=0,02.
Таким образом, у больных РЖ с метастатическими поражениями по сравнению с пациентами без метастазов (рис. 2):
- в ОП – увеличивается количество клеток фенотипа CD45+CD44+ и CD45+CD133+ и уменьшается число клеток CD45-CD44+ и CD45-CD133+;
- в ПЗ – отмечается рост числа клеток всех определяемых фенотипов CD45+CD44+ и CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в СА – снижается число клеток с фенотипом CD45+CD44+ и увеличивается число клеток остальных типов: CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в БР – увеличивается число клеток с фенотипом CD45+CD44+ и CD45+CD133+, а количество клеток CD45-CD44+ и CD45-CD133+, напротив, снижается.
Проведенное исследование позволило выявить некоторые особенности распределения клеток, имеющих маркёры ОСК в различных тканях у больных раком желудка, что может в дальнейшем быть использовано при оценке особенностей развития и прогрессирования заболевания, эффективности проводимой терапии. Полученные результаты являются основой для дальнейшего научного поиска в отношении наиболее полной характеристики гетерогенной опухолевой популяции при раке желудка, роли отдельных клеток в росте, прогрессии и метастазировании опухоли.
О раке так или иначе слышали все. Кто-то видел сообщения в социальных сетях, кто-то помогал пережить эту болезнь родным и близким, а кто-то столкнулся с ней лицом к лицу.
Что такое рак, как он развивается и почему его так трудно победить
О раке так или иначе слышали все. Кто-то видел сообщения в социальных сетях, кто-то помогал пережить эту болезнь родным и близким, а кто-то столкнулся с ней лицом к лицу.
В любом случае рак пугает. Большая часть страхов рождается из-за неправильных представлений о заболевании или просто неведения. Сегодня рассказываем, что такое рак, как он развивается и почему его так трудно победить.
Перед тем как рассказать о механизме образования опухолей, разберемся немного с терминологией и вспомним, как обновляются здоровые клетки и ткани организма. 
Почему рак так называется
То что пациенты называют раком, на языке медицины означает онкологическое заболевание или злокачественную опухоль.
Опухоль, неоплазия или новообразование — это скопление атипичных клеток, которые бесконтрольно делятся и отказываются умирать.
Позже древнеримский врач Корнелий Цельс перевел термин на латинский язык — так появилось современное название cancer.
Другой римский медик и хирург Клавдий Гален описывал доброкачественные опухоли словом oncos.
Сегодня онкология - наука, которая изучает механизм образования доброкачественных и злокачественных опухолей, методы их профилактики и принципы лечения.

Помимо карциномы к злокачественным опухолям относится саркома, меланома, лейкоз и лимфома.
Саркома — злокачественная опухоль из соединительной ткани. К соединительной ткани относятся мышцы, связки, хрящи, суставы, кости, сухожилия, глубокие слои кожи. Меланома — злокачественная опухоль из меланоцитов (клеток кожи).
Лейкоз или лейкемия — злокачественное новообразование кроветворной ткани, а лимфома — лимфатической.
Как обновляются здоровые клетки и ткани
Все органы и ткани человека состоят из клеток. Они имеют одинаковую ДНК, но принимают разные формы и выполняют разные функции. Одни клетки воюют с бактериями, вторые переносят питательные вещества, третьи защищают нас от воздействия внешней среды, из других состоят органы и ткани. При этом почти все клетки обновляются, чтобы организм человека рос, функционировал и восстанавливался после повреждений.
Обновление клеток регулируют факторы роста. Это белки, которые соединяются с рецепторами на мембране клетки и стимулируют процесс деления. Когда новая клетка отделяется от родительской, в ней запускается каскад реакций, и она получает специализацию — дифференцируется. После дифференцировки в клетке активны только те гены, которые определяют ее форму и предназначение. Можно сказать, что теперь у клетки есть персональная инструкция, что и как делать.
Все ткани обновляются с разной скоростью. Клетки центральной нервной системы и хрусталика глаза не делятся совсем, а клетки эпителия тонкого кишечника полностью меняются каждые 4–5 дней. Ткани, которые постоянно обновляются, содержат слой стволовых клеток. Эти клетки не имеют специализации, а могут только делится и создавать либо свою копию без специализации, либо дифференцированную клетку той ткани, в которой они находятся.

Как клетка становится злокачественной
Во время деления или из-за воздействия повреждающих ДНК соединений, в геноме клетки происходит примерно 10 тысяч ошибок в день. Но наш организм умеет с ними справляться. Специальные ферменты ремонтируют поломки или запускают программу апоптоза. Если изменение осталось без починки, в цепочке ДНК сохраняется мутация.
Мутация — это изменение в ДНК, которое передается другим клеткам. Мутации бывают наследственными и соматическими. Наследственные мутации случаются только в половых клетках и передаются следующему поколению.
Гораздо чаще мутации происходят в остальных клетках. Соматические мутации случаются независимо друг от друга в разных клетках организма и не передаются по наследству. Некоторые факторы заметно увеличивают частоту соматических мутации.
Сигаретный дым, ультрафиолет, радиационное излучение и ретровирусы — мощные мутагены, которые могут привести к мутациям в ДНК.
Когда клетка с мутацией делится, дефективная ДНК удваивается и передается новой клетке. Если в ней происходит еще одна мутация, она добавляется к уже имеющейся. Таким образом соматические мутации накапливаются в разных клетках тела на протяжении всей жизни. Этим объясняется старение человека и образование злокачественных опухолей.
Кстати, они тесно связаны между собой: с возрастом риск развития злокачественной опухоли увеличивается.
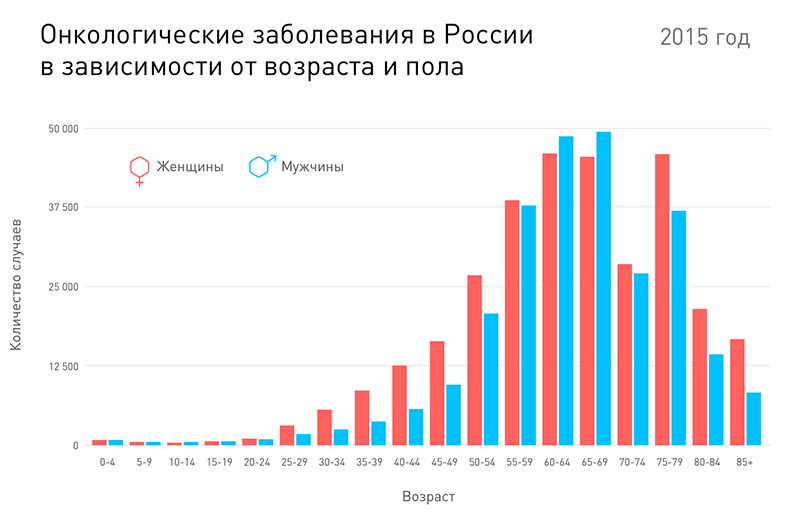
Статистика МНИОИ им. П.А. Герцена.
Какие мутации приводят к раку
Представьте, что в одной клетке случилось несколько мутаций. Первая затронула гены, которые отвечают за деление, а вторая — нарушила механизм запуска апоптоза. Если эти две мутации встретятся, то мы получим клетку, которая постоянно делится и отказывается умирать.
Гены-супрессоры опухолевого роста и протоонкогены — это гены, которые регулируют деление, дифференцировку и апоптоз. Здоровая клетка использует эти гены, чтобы определить, чем ей стать, какие функции выполнять и когда умирать. Когда эти гены повреждены, у клетки нет доступа к инструкции, и она становится неуправляемой.
Сегодня известно около 40 протоонкогенов, и 14 из них связаны с высоким риском развития опухоли. Как пример, ERBB2 (HER-2) часто мутируют при раке молочной железы, KRAS — при раке поджелудочной железы и толстой кишки, BRAF — при меланоме.
Самый известный ген опухолевой супрессии — BRCA1. Мутации этого гена повышают риск развития рака молочной железы и рака яичников. Другой известный ген-супрессор TP53: мутации в нем выявляют в половине случаев рака.

Как развивается злокачественная опухоль
Бессмертные клетки продолжают делится — и опухоль растет. Скопление клеток перерастает в дисплазию — нетипичное для ткани новообразование. Неинвазивная опухоль или рак in situ означает, что новообразование еще не проросло через тонкую границу между эпителиальной и соединительной тканью (базальную мембрану). Для этой стадии характерно равновесие, о котором мы подробнее расскажем позже. Нарушение базальной мембраны — первый признак злокачественного процесса.
Злокачественная опухоль не может расти дальше, пока не получит доступ к питательным веществам. Поэтому клетки опухоли выделяют различные факторы роста, но самый важный из них — фактор роста эндотелия сосудов (VEGF). Он стимулирует образование сети капилляров, через которые клетки получают доступ к питательным веществам. Теперь опухоль может прорастать в окружающие ткани и разрушать их.
В злокачественной клетке продолжают происходить повреждения ДНК, но они не восстанавливаются. Клетка тратит все ресурсы на бесконечное деление. Из-за постоянных мутаций в опухоли появляются клетки с самыми разными формами и свойствами.
Организм пытается бороться с опухолью, и условия среды для злокачественных клеток постоянно меняются. Выживают и делятся дальше только те злокачественные клетки, которые могут противостоять переменам. Можно сказать, что среди клеток злокачественной опухоли происходит естественный отбор.
По мере деления в новообразовании появляются стволовые клетки опухоли. Они могут копировать сами себя и производить обычные клетки злокачественного новообразования. Опухолевые стволовые клетки трудно поддаются уничтожению во время лечения, что приводит к рецидивам.
Со временем в результате отбора появляется клетка способная открепиться от опухоли, найти подходящее место для вторичного очага, чтобы начать делиться в новой среде. Так формируется метастаз.
Не все опухоли состоят из злокачественных клеток. Доброкачественные клетки отличаются тем, что частично или полностью сохраняют свою специализацию. Они медленно делятся, точно копируют ДНК и остаются похожими на клетки исходной ткани. 

В доброкачественной опухоли продолжает работать репарация ДНК, не происходит такого количества мутаций и естественного отбора, поэтому такая опухоль легко поддается хирургическому лечению. Но из-за дополнительных мутаций клетки доброкачественных образований могут превратиться в злокачественные. Например, из-за воздействия ультрафиолета родинки могут переродиться в меланому (злокачественное новообразование кожи).
Почему иммунитет не справляется со злокачественной опухолью
Еще одна особенность злокачественных опухолей — реакция на них иммунной системы.
Различают три стадии ответа иммунной системы:
Устранение. Поврежденные клетки экспрессируют на своей поверхности опухолевые антигены, на которые реагируют главные стражи иммунной системы — макрофаги и лимфоциты. Они находят и уничтожают врага. На этой стадии опухоль не может прорасти в окружающие ткани, потому она называется неинвазивной или опухолью in situ (на месте).
Равновесие. Некоторые клетки начинают маскироваться — синтезировать меньшее количество антигенов. Иммунная система не может их найти и уничтожить, но распознает остальные злокачественные клетки. В стадии равновесия иммунитет не может справиться с опухолью полностью, но ограничивает ее рост. Это состояние может длиться годами и никак себя не проявлять.
Бессилие. Из-за генетической нестабильности в опухоли постоянно рождаются клетки с разными мутациями. Поэтому рано или поздно появляются клетки-иммуносупрессоры, которые отражают атаку клеток иммунной системы и подавляют иммунитет.

Как появляется метастаз
Вторичный очаг роста злокачественной опухоли называется метастазом. Метастазирование — это сверхспособность злокачественной опухоли; сложный процесс, к которому опухоль долго готовится.
Сначала злокачественные клетки выделяют специальные пузырьки — экзосомы. Они путешествуют по всему организму, находят подходящую для метастаза ткань и готовят ее к приходу раковых клеток.
Так в нормальной ткани образуется привлекательная ниша, где злокачественные клетки могут осесть и начать делиться. Иногда раковые клетки напоминают самообучающийся исскусственный интеллект, но это не так.
Также некоторые клетки способны выделять специальные сигнальные молекулы, которые перепрограммируют макрофаги. Часть из них перестает бороться и начинает воспринимать опухоль как поврежденную ткань.

Такие макрофаги выделяют разные факторы роста, которые помогают клеткам опухоли делиться. В этой стадии иммунные клетки разделяются на два противоположных лагеря: одни продолжают разрушать опухоль, а другие помогают ей расти. Это переломный момент, после которого опухоль начинает увеличиваться и метастазировать.
Злокачественная клетка не может просто открепиться от опухоли и начать путешествовать по организму. Она должна уметь отсоединяться от других клеток, проникать в глубину окружающих тканей, выживать после попадания в кровеносные и лимфатические сосуды. Для этого злокачественные клетки выделяют специальные вещества, которые позволяют им двигаться, разрушать клетки других тканей и прятаться от иммунной системы.
Вместе с лимфой злокачественные клетки попадают в лимфатические узлы. Лимфоциты в них пытаются остановить и уничтожить врага, чтобы он не прошел дальше. Из-за воспалительного процесса, лимфоузлы увеличиваются, а большинство раковых клеток погибает. Выжившие клетки могут осесть в ткани лимфоузла и дать метастаз. Как правило, клетки злокачественной опухоли сначала поражают ближайшие лимфоузлы и только затем добираются до отдаленных.
Злокачественные клетки продолжают искать подготовленную ткань по мере продвижения по организму. Большинство из них погибает в непривычной среде, поэтому поиски могут идти долго. Но рано или поздно появляется клетка способная выйти из кровеносного или лимфатического сосуда, прикрепиться к подготовленной ткани и начать делиться на новом месте.
Так образуется вторичный очаг или метастаз.
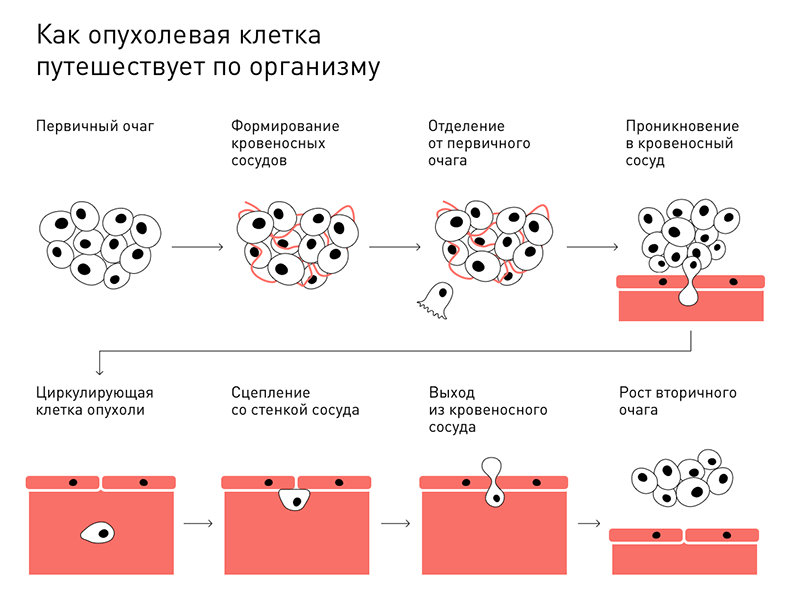
Схематичное изображение клетки злокачественной опухоли, которая может дать метастаз.
У разных видов злокачественных опухолей есть любимые места для метастазирования. Например, рак молочной железы часто метастазирует в легкие, печень, кости и головной мозг. Название болезни всегда связано с первичной опухолью и не зависит от мест метастазирования.
Что значит четвертая стадия рака и почему она самая опасная
Для диагностики крайне важно оценить тип, степень распространенности, дифференцировки и скорость роста злокачественной опухоли. Для этого существует международная классификация TNM.
T — tumor (опухоль). Рядом с буквой Т может стоять число от 0 до 4, которое характеризует распространенность первичной опухоли. T0 — опухоль нельзя определить. Чем выше число, тем больше размер опухоли и вероятность прорастания в окружающие ткани. Tis — обозначение для неинвазивной опухоли.
N — nodes (узлы). От 0 до 3. Говорит об отсутствии, наличии или степени распространенности метастазов в региональных лимфатических узлах. Если метастаз появился в отдаленном лимфоузле, он относится к критерию M.
M — metastases (метастазы). Отдаленные метастазы либо есть — M1, либо их нет — M0.
Если какой-то из компонентов системы нельзя измерить, то рядом с буквой ставится символ X.
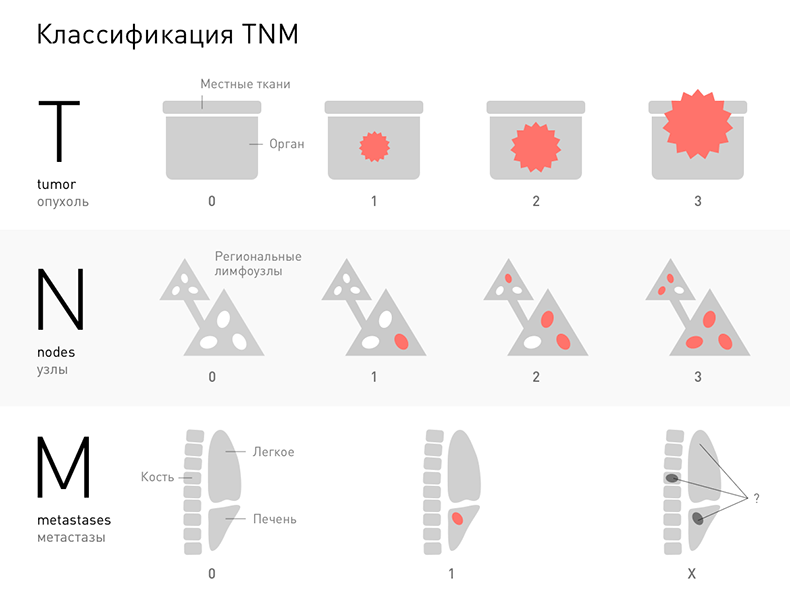
Классификация TNM позволяет определить стадию опухолевого процесса.
Первая стадия — небольшая опухоль в месте возникновения.
Вторая стадия — увеличенная опухоль, которая проросла в окружающие ткани и возможно метастазировала в ближайшие лимфатические узлы.
Третья стадия — довольно большая опухоль, которая метастазировала в ближайшие лимфатические узлы.
Ч етвертая стадия — опухоль с метастазами в других органах и тканях.
Как правило, невозможно полностью вылечить опухоль на четвертой стадии: лекарственная терапия позволяет только замедлить течение болезни. Таким больным оказывают паллиативную помощь, ее задача — повысить качество жизни пациента.
Как бороться с раком
Злокачественная опухоль кажется монстром, который использует все силы и функции организма себе во благо. Но не стоит забывать, что появление этого монстра можно предотвратить, если знать о своих рисках и мерах профилактики.

Кроме профилактики важно проходить регулярные обследования, чтобы диагностировать злокачественное новообразование на ранней стадии. Пока опухоль не успела распространиться в другие ткани и органы, она поддается лечению. опубликовано econet.ru
Автор иллюстраций Майкл Ковальски
Понравилась статья? Напишите свое мнение в комментариях.
Подпишитесь на наш ФБ:
Читайте также:

