Кислородсодержащие кислоты с хлором
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее - оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO - бромноватистая кислота (соли гипобромиты), HIO - иодноватистая кислота (соли гипоиодиты).
HIO3 - иодноватая кислота (соли иодаты), HBrO3 - бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
- Хлорноватистая кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.

В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.

Хлористая кислота может быть получена из собственных солей - хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе - хлорная кислота - может быть получение реакцией перхлората калия или натрия с концентрированной серной кислотой.

- Кислотные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная - к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.

KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Хлорноватистая кислота НС1 +1 0 (Н—О—С1) существует только в виде разбавленных водных растворов.
Получение осуществляется по реакции:

Отбеливающие свойства хлора в присутствии влаги объясняются ее образованием.
Химические свойства. НС10 — слабая кислота и сильный окислитель:
О разлагается, выделяя атомарный кислород:

О со щелочами дает соли — гипохлориты:

О в водном растворе очень медленно диспропорционирует:

О проявляет окислительные свойства:

Хлористая кислота НС1 +3 02 (Н—О—С1=0) существует только в водных растворах.
Получение. Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертолетовой соли и щавелевой кислоты в среде H2S04:

Химические свойства. НС102 — кислота средней силы:
О взаимодействует со щелочами: 
о разлагается при хранении (неустойчива):

Соли хлористой кислоты — хлориты.
Хлорноватая кислота НС1 +5 03 в свободном виде нестабильна, устойчива только в водных растворах.
Получение осуществляется действием разбавленной серной кислоты на ее соли:

Химические свойства. НСЮ3 — сильная кислота и сильный окислитель:
О взаимодействует со щелочами:

О проявляет окислительные свойства:

Соли хлорноватой кислоты — хлораты.
КС103 бертолетова соль; ее получают при пропускании хлора через подогретый раствор КОН:

Бертолетову соль используют в качестве окислителя; при нагревании она разлагается:

Хлорная кислота НС1 +7 04 — бесцветная дымящая на воздухе жидкость с /кип = 25 °С, /пл = -101 °С.
Получение осуществляется путем отгонки при пониженном давлении из смеси перхлората калия с серной кислотой:

Химические свойства. НСЮ4 — одна из наиболее сильных кислот и очень сильный окислитель:
О взаимодействует со щелочами: 
О разлагается при нагревании (как и ее соли): 
Соли хлорной кислоты — перхлораты.
При повышении ст.ок. хлора устойчивость кислот тоже растет.
Рост стабильности объясняется:
а) упрочнениемсвязей в анионах за счет уменьшения числа НЭП у хлора,
б) увеличением отношениячисла π-перекрываний к количеству σ-связей от 0/1 в ClO − до 3/4 в ClO − 4 . Сравните графические формулы кислот:
H – O - Cl , H - O - Cl = O, H – O – Cl = O Н – O – Cl = О
в) от НСlO к HClO4 растет симметрияаниона (как за счет увеличения
числа атомов кислорода, так и в результате снижения поляризующегодействия
водорода из-за ослабления его связи с анионом).
г) снижается угол атакиатома хлора (т.е. его пространственная доступность для взаимодействия).
Кислотные свойства гидроксидов галогенов.Кислотно-оснóвные свойства
любого гидроксида зависят от соотношения прочностей связей H − O и O − Э во
фрагменте H − O − Э. Очевидно, чем больше электроотрицательность элемента, тем в большей степени электронная плотность от связи H − O смещена на связь O – Э
(H − O − Э) и тем более кислотные свойства проявляет гидроксид.
Поэтому важным фактором является природагалогена. Так, при переходе от хлора к йоду в соответствие с уменьшением значения Э.О. кислотные свойства гидроксидов снижаются. Причем настолько, что йодноватистая кислота диссоциирует по кислотномутипу в меньшейстепени НIO → Н + + IO - (K d = 4 ∙10 − 13 ),
чем по основному: IOH → I + + OH − (K d = 3 ∙10 − 10 ).
Возможна даже реакция нейтрализации (но обратимая): IOH + HNO3 → INO3 + H2O .
Соли кислот хлора, как более устойчивые (чем кислоты) соединения, все
выделены в свободном состоянии, но и их активность увеличивается с понижением ст.ок. Cl. Так, KClO3 (бертолетова соль) окисляет йодид-ионы лишь в кислой среде, а KClO - и в нейтральной.
2.8.1. Хлорноватистая кислота HCl +1 O H–O–Cl (гипохлориты)
Физические свойства.Существует только в виде разбавленных водных растворов.
Получение.
Химические свойства.
HClO - слабая кислота и сильный окислитель:
1) Разлагается, выделяя атомарный кислород
HClO – на свету → HCl + O↑ HClO – об. усл. → H2O + Cl2O НClO --- t → НCl + НClO3
2) Со щелочами дает соли - гипохлориты
HClO + KOH → KClO + H2O СаОСl2 – белильная известь (хлорка)
3)с сильным восстановителем НI
2.8.2. Хлористая кислота HCl +3 O2 H–O–Cl=O (хлориты)
Физические свойства.Существует только в водных растворах.
Получение
Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертоллетовой соли и щавелевой кислоты в среде H2SO4:
Химические свойства
HClO2 - слабая кислота и сильный окислитель.
2) Неустойчива, при хранении разлагается
2.8.3. Хлорноватая кислота HCl +5 O3 (хлораты)
Физические свойства:Устойчива только в водных растворах.
Химические свойства
HClO3 - Сильная кислота и сильный окислитель; соли хлорноватой кислоты –
- KClO3 - Бертоллетова соль; ее получают при пропускании хлора через подогретый (40°C) раствор KOH: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Бертоллетову соль используют в качестве окислителя; при нагревании она разлагается:
4KClO3 – без кат → KCl + 3KClO4 2KClO3 – MnO2 кат → 2KCl + 3O2↑
2.8.4. Хлорная кислота HCl +7 O4 (перхлораты)
Физические свойства:Бесцветная жидкость, t°кип. = 25°C, t°пл.= -101°C.
Химические свойства:
HClO4 - очень сильная кислота и очень сильный окислитель;
соли хлорной кислоты - перхлораты.
2) При нагревании хлорная кислота и ее соли разлагаются:
Бромистый водород HBr (БРОМИДЫ)
Физические свойства
Бесцветный газ, хорошо растворим в воде; t°кип. = -67°С; t°пл. = -87°С.
Получение
Химические свойства
Водный раствор бромистого водорода - бромистоводородная кислота еще более сильная, чем соляная. Она вступает в те же реакции, что и HCl
1) Диссоциация: HBr ↔ H+ + Br -
2) С металлами, стоящими в ряду напряжения до водорода:
3) с оксидами металлов:
4) с основаниями и аммиаком:
5) с солями
Качественая реакция: AgNO3 + HBr → AgBr↓ + HNO3
Образование нерастворимого в кислотах желтого осадка бромида серебра служит для обнаружения аниона Br - в растворе.
6) восстановительные свойства:
Из кислородных кислот брома известны
- слабая бромноватистая HBr +1 O и
- сильная бромноватая HBr +5 O3.
Иодистый водород (йодиды)
Физические свойства:Бесцветный газ с резким запахом, хорошо растворим в воде,
t°кип. = -35°С; t°пл. = -51°С.
Химические свойства
1) Раствор HI в воде - сильная йодистоводородная кислота:
Соли йодистоводородной кислоты - йодиды (др. реакции HI см. св-ва HCl и HBr)
2) HI - очень сильный восстановитель:
3) Качественая реакция: Образование нерастворимого в кислотах темно-желтый осадка йодида серебра, служит для обнаружения аниона йода в растворе.
3.0.1. Кислородные кислоты йода (йодаты)
а) Йодноватая кислота HI +5 O3
Бесцветное кристаллическое вещество, t°пл.= 110°С, хорошо растворимое в воде.
HIO3 - сильная кислота (соли - йодаты) и сильный окислитель.
б) Йодная кислота H5I +7 O6
Кристаллическое гигроскопичное вещество, хорошо растворимое в воде,
t°пл.= 130°С. Слабая кислота (соли - перйодаты); сильный окислитель.
Хлорноватистая кислота HCl +1 O
H–O–Cl
Физические свойства
Существует только в виде разбавленных водных растворов.
Химические свойства
HClO - слабая кислота и сильный окислитель:
1) Разлагается, выделяя атомарный кислород
HClO – на свету ®HCl + O
2) Со щелочами дает соли - гипохлориты
HClO + KOH ® KClO + H2O
Хлористая кислота HCl +3 O2
H–O–Cl=O
Физические свойства
Существует только в водных растворах.
Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертоллетовой соли и щавелевой кислоты в среде H2SO4:
Химические свойства
HClO2 - слабая кислота и сильный окислитель; соли хлористой кислоты - хлориты:
2) Неустойчива, при хранении разлагается
Хлорноватая кислота HCl +5 O3
Физические свойства
Устойчива только в водных растворах.
Химические свойства
HClO3 - Сильная кислота и сильный окислитель; соли хлорноватой кислоты - хлораты:
KClO3 - Бертоллетова соль; ее получают при пропускании хлора через подогретый (40°C) раствор KOH:
Бертоллетову соль используют в качестве окислителя; при нагревании она разлагается:
4KClO3 – без кат ®KCl + 3KClO4
2KClO3 – MnO 2 кат ®2KCl + 3O2
Хлорная кислота HCl +7 O4
Физические свойства
Бесцветная жидкость, t°кип. = 25°C, t°пл.= -101°C.
Химические свойства
HClO4 - очень сильная кислота и очень сильный окислитель; соли хлорной кислоты - перхлораты.
2) При нагревании хлорная кислота и ее соли разлагаются:
БРОМ И ЕГО СОЕДИНЕНИЯ
Бром Br2 - открыт Ж. Баларом в 1826 г.
Физические свойства
Бурая жидкость с тяжелыми ядовитыми парами; имеет неприятный запах; r= 3,14 г/см 3 ; t°пл. = -8°C; t°кип. = 58°C.
Окисление ионов Br - сильными окислителями:
Химические свойства
В свободном состоянии бром - сильный окислитель; а его водный раствор - "бромная вода" (содержащий 3,58% брома) обычно используется в качестве слабого окислителя.
1) Реагирует с металлами:
2) Реагирует с неметаллами:
3) Реагирует с водой и щелочами :
Br2 + 2KOH ® KBr + KBrO + H2O
4) Реагирует с сильными восстановителями:
Бромистый водород HBr
Физические свойства
Бесцветный газ, хорошо растворим в воде; t°кип. = -67°С; t°пл. = -87°С.
Химические свойства
Водный раствор бромистого водорода - бромистоводородная кислота еще более сильная, чем соляная. Она вступает в те же реакции, что и HCl:
2) С металлами, стоящими в ряду напряжения до водорода:
3) с оксидами металлов:
4) с основаниями и аммиаком:
NaOH + HBr ® NaBr + H2O
Соли бромистоводородной кислоты называются бромидами. Последняя реакция - образование желтого, нерастворимого в кислотах осадка бромида серебра служит для обнаружения аниона Br - в растворе.
6) HBr - сильный восстановитель:
Из кислородных кислот брома известны слабая бромноватистая HBr +1 O и сильная бромноватая HBr +5 O3.
ИОД И ЕГО СОЕДИНЕНИЯ
Йод I2 - открыт Б. Куртуа в 1811 г.
Физические свойства
Кристаллическое вещество темно-фиолетового цвета с металлическим блеском.
r= 4,9 г/см 3 ; t°пл.= 114°C; t°кип.= 185°C. Хорошо растворим в органических растворителях (спирте, CCl4).
Окисление ионов I - сильными окислителями:
Химические свойства
3) с сильными восстановителями:
Иодистый водород
Физические свойства
Бесцветный газ с резким запахом, хорошо растворим в воде, t°кип. = -35°С; t°пл. = -51°С.
Химические свойства
1) Раствор HI в воде - сильная йодистоводородная кислота:
Соли йодистоводородной кислоты - йодиды (др. реакции HI см. св-ва HCl и HBr)
2) HI - очень сильный восстановитель:
3) Идентификация анионов I - в растворе:
Образуется темно-желтый осадок йодида серебра, нерастворимый в кислотах.
Кислородные кислоты йода
Йодноватая кислота HI +5 O3
Бесцветное кристаллическое вещество, t°пл.= 110°С, хорошо растворимое в воде.
HIO3 - сильная кислота (соли - йодаты) и сильный окислитель.
Йодная кислота H5I +7 O6
Кристаллическое гигроскопичное вещество, хорошо растворимое в воде, t°пл.= 130°С.
Слабая кислота (соли - перйодаты); сильный окислитель.
Сера и ее соединения
ОБЩАЯ ХАРАКТЕРИСТИКА
Общая характеристика
элементов главной подгруппы VI группы (подгруппы кислорода)
Таблица. Электронное строение и физические свойства.
| Поряд- ковый № | Элемент | Относитель- ная атомная масса | Электронная конфигурация | Атомный радиус, нм | ПИ эВ | Э.О | Степени окисления | t°пл °С | t°кип °С | r г/см 3 |
| Кислород (O) | 15,9994 | [He] 2s 2 2p 4 | 0,066 | 14,5 | 3,5 | -2, -1, +1, +2 | -218,4 | -182,9 | 1,2 (-183°C) | |
| Сера (S) | 32,06 | [Ne] 3s 2 3p 4 | 0,105 | 10,5 | 2,6 | -2, +2, +3, +4, +5, +6 | 112,8 | 444,67 | 2,07 | |
| Селен (Se) | 78,96 | [Ar] 3d 10 4s 2 4p 4 | 0,116 | 9,8 | 2,01 | -2, +4, +6 | 4,8 | |||
| Теллур (Te) | 127,60 | [Kr] 4d 10 5s 2 5p 4 | 0,143 | 8,6 | 1,9 | -3, +3, +4, +5 | 6,68 | |||
| Полоний (Po) | 208,98 | [Xe] 4f 14 5d 10 6s 2 6p 4 | 0,176 | 7,8 | 1,76 | +2, +4 | 9,32 |
КИСЛОРОД
Кислород O2
(К.В. Шееле 1772 г., Дж. Пристли 1774 г.)
Самый распространенный элемент на Земле; в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе.
Физические свойства
Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t°кип= -183°С; t°пл = -219°C; d по воздуху = 1,1.
Способы получения
1. Промышленный способ (перегонка жидкого воздуха).
2. Лабораторный способ (разложение некоторых кислородосодержащих веществ)
Способы собирания
Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
Со сложными веществами
Горение в кислороде
Озон O3
Озон -аллотропная модификация кислорода.
Физические свойства
Газ, запах свежей хвои, бесцветный, растворим в воде; t°кип= -112°С; t°пл= -193°C.
1. Во время грозы (в природе), (в лаборатории) в озонаторе
2. Действием серной кислоты на пероксид бария
Химические свойства
2. Сильный окислитель:
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
АЗОТ И ЕГО СОЕДИНЕНИЯ
Азот Аммиак Соли аммония Оксиды азота Азотистая кислота Азотная кислота
АЗОТ
:NºN:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе).
В молекуле имеются одна - и две - связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Получение
1. Промышленный способ. Перегонка жидкого воздуха.
2. Лабораторный способ. Разложение нитрита аммония:
Химические свойства
Молекула азота (:NºN:)
Очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью.
Восстановитель N2 0 ® 2N +2
Высокая температура (электрическая дуга, 3000°С)
(в природе - во время грозы)
Окислитель N2 0 ® 2N -3
1. c водородом (500°С, kat, p)
2. с активными металлами (с щелочными и щел.зем. металлами)
АММИАК
Строение
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp 3 - гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.
Физические свойства
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха.
по воздуху = MNH3 / M ср.воздуха = 17 / 29 = 0,5862
t° кип.= -33,4°C; t°пл.= -78°C.
Молекулы аммиака связаны слабыми водородными связями
Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается.
Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм).
В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
Получение
1. Промышленный способ
(p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
2. Лабораторный способ. Нагревание солей аммония со щелочами.
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония.
2. Аммиак реагирует с кислотами с образованием солей аммония.
Аммиак - восстановитель (окисляется до N2 +1 O или N +2 O)
1. Разложение при нагревании
2. Горение в кислороде
a) без катализатора
b) каталитическое окисление ( kat = Pt )
3. Восстановление оксидов некоторых металлов
3Cu +2 O + 2N -3 H3 ® 3Cu 0 + N2 0 + 3Н2O
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4 + , связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
2. Разложение при нагревании.
a) если кислота летучая
b) если анион проявляет окислительные свойства
3. С кислотами и солями (реакция обмена)
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4 + )
ОКСИДЫ АЗОТА
ОКСИД АЗОТА (I)
ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ ГАЗ"
ОКСИД АЗОТА (II)
ОКИСЬ АЗОТА
ОКСИД АЗОТА (III)
АЗОТИСТЫЙ АНГИДРИД
ОКСИД АЗОТА (IV)
ДВУОКИСЬ АЗОТА, ДИОКСИД АЗОТА
ОКСИД АЗОТА (V)
АЗОТНЫЙ АНГИДРИД
Оксид азота (I)
N2 +1 O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С. Анестезирующее средство.
Получение
Химические свойства
1. Разлагается при 700°C с выделением кислорода:
поэтому он поддерживает горение и является окислителем
Оксид азота (II)
N +2 O окись азота
Газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
Получение
1. Каталитическое окисление аммиака (промышленный способ)
N2 + O2 ®2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом и галогенами
2NO + Cl2 ® 2NOCl(хлористый нитрозил)
Оксид азота (III)
N2 +3 O3 азотный ангидрид
Физические свойства
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
Химические свойства
Все свойства кислотных оксидов.
Оксид азота (IV)
N +4 O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
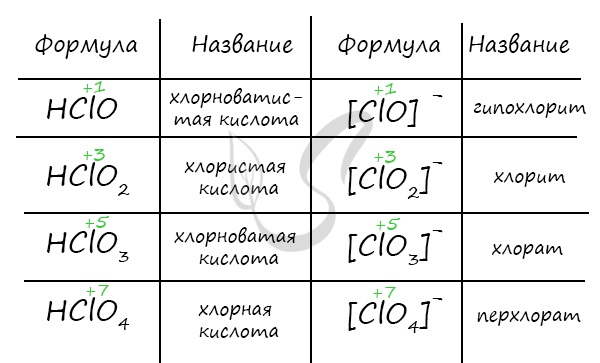
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
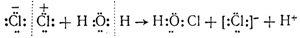
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
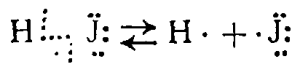
и электролитическая диссоциация иодистого водорода при растворении в воде:
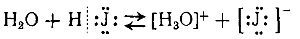
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
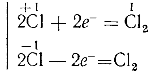
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
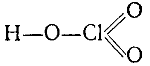
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
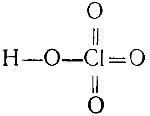
Строение хлорной кислоты выражается формулой
Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
Читайте также:

