Карцинома эрлиха что это такое
Н. В. Эль-Дин, Э. Ноаман, М. Гонеум
Аннотация
Данное исследование проводилось с целью изучения в естественных условиях противоопухолевого действия BioBran, модифицированного арабиноксилана получаемого из экстракта рисовых отрубей. Для исследования использовались швейцарские мыши-альбиносы, которым была сделана внутримышечная инъекция в правое бедро клеток асцитной карциномы Эрлиха. На 8 день мыши с солидной карциномой Эрлиха получили внутрибрюшную инъекцию с BioBran. После этого изучался рост опухоли, производство цитокина и апоптотическое действие BioBran. В результате исследования оказалось, что BioBran вызвал значительную задержку объема опухоли (63.27%) и веса опухоли (45.2%), по сравнению с контрольными особями (P 6 . Клеточная линия искусственной хромосомы дрожжей - 1 (YAC-1) (вирус мышиного Т-клеточного лейкоза Молони мышей линии A/Sn) была получена из Американской коллекции типовых культур (ATCC, Роквиль, Мэриленд) для оценки активности NK-клеток.
Полная среда
Для поддержания роста клеток использовалась среда RPMI-1640 с 10% термоинактивированной эмбриональной телячьей сывороткой, 2 молями глютамина и 100 µг\мл стрептомицина и пенициллина.
BioBran – это переработанная гемицеллюлоза, которую получают путем реакции гемицеллюлозы рисовых отрубей с множеством гидролизирующих углеводных ферментов грибов шиитаке. Основная химическая структура BioBran – это арабиноксилан, в основной цепи содержится ксилоза, в составе боковой цепи – арабиноз. Агент содержит полисахариды (ß1, 3-глюкан и активированная гемицеллюлоза). Для обеспечения чистоты и постоянства продукта BioBran в каждой партии, было измерено 9 параметров, каждый по конкретному методу и спецификации (Таблица 1). Кроме того, для определения эффективной фракции BioBran в исходном виде применялся стандартный тест на реакцию с антроном. В текущем исследовании BioBran был растворен в 0.9% солевого раствора и вводился мышам с солидной карциномой Эрлиха посредством внутрибрюшной или внутриопухолевой инъекции (40 мг\кг веса). BioBran был предоставлен компанией Daiwa Pharmaceuticals Co., Ltd, Токио, Япония.
Таблица 1
Анализ препарата BioBran в каждой партии
Параметр
Метод тестирования
Спецификация
Внешний вид
Влажность
Протеин
Зола
Углеводы
Мышьяк (As2O3)
Тяжелые металлы (свинец)
Число аэробных бактерий
Коликоподобные бактерии
Потеря при сушке
Метод определения зольности на сухую массу
Тест на реакцию с антроном
Метод применения диэтилдитиокарбамата серебра
Проверка по ограничению тяжелых металлов
Стандартный чашечный метод подсчёта
Способность образовывать газ - лактозный бульон с бриллиантовой зеленью
*КОЕ - Колониеобразующая единица
План эксперимента
Трансплантация опухоли, внутрибрюшная и внутриопухолевая инъекции BioBran.
На день 0, самкам швейцарских мышей-альбиносов было внутримышечно введено 0.2 мл клеток асцитной карциномы Эрлиха (клетки 2.5 х 10 6 ) в правое бедро задней конечности. Мыши с солидной опухолью Эрлиха массой
100 мм 3 были распределены по двум группам в случайном порядке для внутрибрюшного лечения: 1) мыши с солидными опухолями получали внутрибрюшные инъекции буферного раствора фосфата (PBS; n = 13) 2) мыши с солидными опухолями получали внутрибрюшные инъекции BioBran (n = 13). Аналогично, мыши, которые получали внутриопухолевое лечение были в случайном порядке разделены на две группы: 1) мыши, получавшие внутриопухолевые инъекции буферного раствора фосфата (n = 10) 2) мыши, получавшие внутриопухолевые инъекции BioBran (n = 10). В каждом эксперименте участвовала контрольная группа мышей без опухоли (n = 8) для установления базовой планки для всех параметров, попадающих под данное исследование. Доза BioBran была 40 мг\кг веса в одной инъекции 0.1 мл. Животные получавшие лечение посредством внутрибрюшных инъекций начали лечение на 8 день после введения клеток асцитной карциномы Эрлиха, лечение продолжалось в течение 3 недель 3 раза в неделю. Животные, получавшие лечение посредством внутриопухолевых инъекций начали лечение на 11 день после ввода клеток асцитной карциномы Эрлиха, лечение продолжалось в течение 5 недель 2 раза в неделю.
Анализ объема опухоли и вес опухоли.
Измерения временных интервалов объема опухоли при помощи цифровых калиперов проводились с 8 по 35 дни или с 11 по 45 дни после введения клеток асцитной карциномы Эрлиха. Собранные данные были применены к следующей формуле, чтобы получить значение объема опухоли: Объем опухоли (мм 3 ) = 0.52 АВ 2 , где А – это малая ось, а В – основная ось. На 35 день после получения внутрибрюшных инъекций препарата BioBran, мыши подверглись эвтаназии, опухоли были вырезаны для определения их веса. Были сделаны фотографии для определения регрессии опухоли и проведения гистопатологических исследований.
Изменения веса тела
Животные с солидной карциномой Эрлиха, получавшие лечение посредством внутрибрюшных инъекций препаратом BioBran или буферным раствором фосфата наблюдались на предмет изменений массы тела: (начальная масса тела замерялась на 0 день, а конечный чистый вес замерялся на 35 день). Чистый конечный вес = (конечный вес – вес опухоли). Прибавление веса тела определялось, как разница между начальным весом тела и чистым конечным весом тела.
Апоптоз определяемый проточной цитометрией
Проточная цитометрия применялась для измерения процента апоптотических опухолевых клеток у мышей с опухолью, которые получали лечение внтурибрюшной инъекцией либо буферным раствором фосфата, либо BioBran. Мертвые клетки были выявлены при помощи флуоресцеин-конъюгированного аннексина V и иодида пропидия (набор для выявления апоптоза Annexin V-FITC, BioVision Research Products, Маунтин-Вью, Калифорния). Клеточные суспензии были подготовлены по методу, описанному в исследовании Трибукайта и коллег. Клетки были получены с использованием аппарата FACSCAN (Компания Becton-Dickinson, Сан-Хосе, Калифорния) и проведен анализ при помощи программного обеспечения Cell-Quest.
Гистопатологические исследования. Гистопатологические исследования проводились с целью оценить цифры апоптоза у мышей с опухолью, которые получали лечение посредством внутрибрюшной инъекции препаратом BioBran или буферным раствором фосфата. Опухолевые ткани были помещены в 10% нейтральный формалиновый буфер на минимальное количество времени - 24 часа, парафиновые срезы опухоли были обработаны (толщина 4 µm) и окрашены гематоксилином и эозином. Срезы оценивались на предмет апоптотических изменений под оптическим микроскопом.
Анализ цитокинов
На 35 день после введения опухолевых клеток была собрана плазма у трех групп животных: мыши без опухоли (контрольная группа), мыши с опухолью и методом лечения при помощи PBS (буферный раствор фосфата) и мыши с опухолью и методом лечения посредством внутрибрюшных инъекций BioBran. За 16 часов перед забором образца мыши ничего не ели. Плазма применялась для оценки уровней фактора некроза опухоли-альфа, интерферона–гамма и интерлейкина 10 (ИЛ-10). Концентрации цитокина у мышей измерялись посредством наборов для иммуноферментного анализа с флуоресцентным усилением, предоставленного компанией CytImmune Sciences Inc. (Роквтль, Мэриленд).
Изучение NК-клеток
Подготовка селезеночных клеток. Мыши без опухоли получали ежедневную инъекцию препарата BioBran (100 µг\мл) в бедро. После периода лечения в течение 14 дней мыши были выведены из эксперимента путем смещения шейных позвонков. Была удалена селезенка, помещена в полную среду и заражённые эритроциты были лизированы в дистиллированной воде в течение 20 секунд при комнатной температуре (27°С). Суспензии отдельных клеток были промыты один раз в сбалансированном солевом растворе Хенкса, затем клетки были перерастворены в концентрации 1 х 10 7 клеток\мл в полной среде. Подсчет клеток проводился при помощи гемоцитометра и оптического микроскопа.
Измерение активности NK-клеток посредством микроцитотоксического теста с радиоактивным хромом. Стандартное определение активности NK-клеток посредством микроцитотоксического теста с радиоактивным хромом применялось следующим образом: опухолевые клетки-мишени YAC-1 (5 х 10 6 ) были помечены раствором хромата натрия (100 µCi) на 1 час в 0.1 мл полной среды. Далее опухолевые клетки были промыты 4 раза в 5 мл сбалансированного солевого раствора Хенкса и 1 х 10 4 клетки были пипеткой перенесены в 96-луночный планшет с круглым дном Linbro (Linbro Chemical Co., Хамден, Коннектикут). Клетки-эффекторы были помещены в лунки в четырех экземплярах, чтобы получить соотношение эффектор:мишень (Э:М) 100:1, 50:1, и 12.5:1. После 4 часовой инкубации при температуру 37°С, из каждой лунки было собрано 0.1 мл надосадочной жидкости и ее поместили в гамма-счетчик. Процент освобожденного изотопа вычислялся по следующей формуле:

Оценка мишень-эффекторного конъюгата. Способность селезеночных NK-клеток эффекторов образовывать конъюгаты с YAC-1 клетками-мишенями измерялась в обеих группах (BioBran и контрольной группе). Клетки селезенки (1х10 5 ) были инкубированы с клетками-мишенями 5х10 5 в 1мл полной среды. Смесь клеток была осаждена центрифугированием при 130г в течение 10 минут и инкубирована на 1 час при температуре 4°С. Клеточные осадки были ресуспензированы, центрифугированные мазки подготовлены и окрашены по Гимзе. Процент конъюгатов определялся после подсчета 200 лимфоцитов (связанных и свободных) в образцах по три экземпляра.
Побочные эффекты BioBran (Токсичность)
Каждый день мышей проверяли на предмет побочных эффектов BioBran. В течение всего периода лечения изучались отклонения от нормальных циклов питания\питья и жизненной активности. Изменения массы тела также фиксировались каждую неделю.
Статистический анализ
Значения цитокина рассматривались, как среднее ± стандартная ошибка среднего. Данные анализировались при помощи однофакторного дисперсионного анализа, за которым следовал анализ post hoc множественности сравнений. Статистическая значимость других данных определялась по критерию Стьюдента. Различия рассматривались, как значимые при уровне P 3 ± 144.76) и в группе PBS (буферный раствор фосфата) (2537.11мм 3 ± 143.52) достиг – 63.27% (P 3 на 8 день и до 35 дня. Цифры представляют изменения в объеме опухоли мм 3 в ходе лечения. Затем результаты сравнивались с группой мышей с опухолью, получавшие лечение PBS(▲). Каждое значение представляет среднее ± стандартная ошибка среднего. * Р 3 , результаты сравнивались с группой мышей с опухолью, получавшие лечение PBS (▲). Каждое значение представляет среднее ± стандартная ошибка среднего. *Р b
- Каждое значение представляет среднее ± стандартную ошибку среднего соответствующего числа животных\групп. Чистый конечный вес тела = (Конечный вес тела на 35 день – вес опухоли на 35 день). Прибавка веса тела (Чистый конечный вес тела – начальный вес тела).
- Статистически значимо при Р а
Группа
Параметры
Контрольная группа
(мыши без опухоли)
Мыши с опухолью
PBS BioBran
Карцинома – это самая распространённая форма злокачественного новообразования. Изменённый эпителиальный слой клеток начинает хаотично делиться и поражать соседние органы. Столкнувшись с таким диагнозом, больные желают знать, что это за вид ракового поражения, а также какова продолжительность жизни предвидится при должном внимании к диагнозу.
Карцинома поражает ткань кожного покрова, затрагивая внутренний слизистый слой органов. Отличается от доброкачественной опухоли в её масштабном развитии и быстром распространении метастазов по лимфатическим узлам с поражением отдалённых органов.
Медицинская статистика такова, что 10 млн. человек в год по всему миру диагностируют указанную болезнь. Первое место по источнику поражения занимают лёгкие, на втором – опухоль молочной железы. Далее идут поражения кишечника, печени, желудка, при которых возникает боль в спине. Если раньше болезнь наблюдалась у людей пожилого возраста, сейчас временной отрезок сдвинулся, и рак поражает любого человека вне зависимости от возраста, пола, социального статуса.
Карцинома делится на формы образований, степень дифференцировки, а также по направленности роста. Начальные стадии карциномы не имеют ярко выраженных симптомов.
Причины возникновения карциномы
Причины возникновения поражений размыты и представляют собой список пунктов, которые легко найти в любом крупном городе. Существенное влияние оказывает образ жизни больного до проявления онкологии:
- вредные привычки и малоподвижный образ жизни;
- несбалансированное питание, избыточная масса тела;
- радиация или переизбыток полученных ультрафиолетовых лучей;
- проживание в загрязнённом районе или работа с вредными веществами.
Особую роль занимает наследственное расположение. Если у родственников наблюдались злокачественные опухоли, особенно молочных желёз, то стоит очень внимательно относиться к своему здоровью и реагировать на любые проявления какого-либо заболевания.

Виды карциномы
Мутирующие клетки поражают любой орган в системе человека, при распаде образований организм отравляется токсичными веществами. Причин для этого достаточно, они перечислены выше. Распространяясь, болезнь охватывает больше площади, нарушая работу систем организма, внутренних органов и эндометрия.
- Базальноклеточная. Кожный покров поврежден, метастазы не образовываются. Однако глубокое прорастание повреждает органы. Место локализации – открытые участки тела, часто подвергаемые воздействию ультрафиолетовых лучей: лицо, руки, шея. Косвенные причины возникновения болезни: слабая иммунная система и длительный приём лекарственных форм.
- Плоскоклеточная. Состоит из клеток эпителия, распространяя метастазы по всему организму. Большинство больных с этим типом опухоли – светлокожие люди. Если эпителий способен образовывать роговое вещество – это дифференцированная разновидность плоскоклеточного рака. При невозможности образования рак называется неороговевающим. Часто встречается микроинвазивный рак шейки матки, образованный именно из плоскоклеточных тканей.
- Нейроэндокринная. Новообразование из эпителиальных железистых клеток, которые есть в системе пищеварения. Редко можно обнаружить на лёгких, яичниках или тимусе. Самым малоизученным видом нейроэндокринной карциномы считается рак, образующийся из клеток Меркеля, входящих в состав кожи человека. Нарушение состава этих клеток ведёт к ухудшению осязания и возникновению базалиомы. Редкая форма рака имеет агрессивное течение и быстрое распространение в лимфоузлы. Образуется на лице, шее, голове в виде шишки.
- Светлоклеточная. 85% процентов опухоли этого вида нарушает работу такого органа, как почки. Скорость развития раковых клеток высокая, метастазы образуются в любом по удалённости органе. Изменённый эпителий почки вызывает почечную недостаточность, появляются боли в области поясницы.
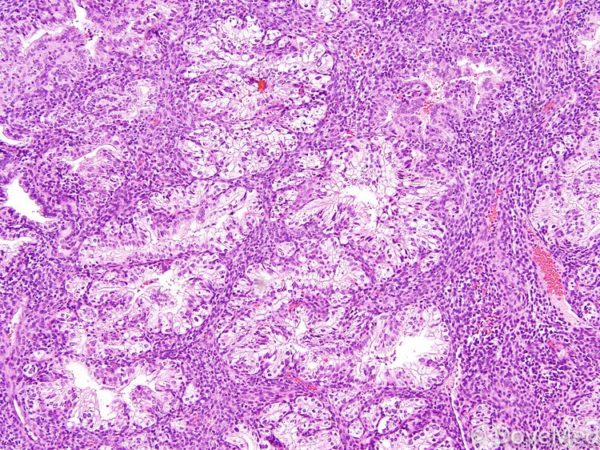
- Первичная перитонеальная. Агрессивная форма рака, поражающая выстилку брюшины. Симптоматика сходна с раком яичников, из-за чего может последовать неправильно установленный диагноз. 75% таких опухолей обнаруживают, когда болезнь достигла 3 стадии, остальные 25% – при четвёртой. Новообразование подразделяется на светлоклеточный, серозный либо муцинозный вид аденокарциномы. Особенно заболеванию подвергаются женщины в постклимактерическом периоде.
- Мукоэпидермоидная. Нарушает работу слюнной железы без проявления. Поэтому эта клеточная форма обнаруживается врачами на последних стадиях. Внешне напоминает узел размером от 5 мм до 12 см. Несмотря на размеры опухоли, заболевание вылечивается. Проверить наличие поражённых желёз можно с помощью цитологического анализа.
- Цервикальная, или рак шейки матки. Если поражение пришлось на шейку, диагностируют чешуйчатый рак. При нарушении цервикального канала – носит название аденокарцинома. Болезнь развивается внутри органа, т.е. внутриэпительная, либо инвазивная – с выходом за пределы поражённого органа.
- Бронхиальная. Поражает лёгкие. В 20% случаев данного вида образуется мелкоклеточный вид карциномы с неблагоприятным прогнозом. Такой вид болезни часто проявляется у курильщиков или работников вредных производств. Однако и у тех, кто живет в экологически загрязнённом месте, возможна данная форма болезни.
- Сосочковая. Образование в щитовидной железе, поражающее людей всех возрастов. Причина проявления – нарушение гормонального фона. Поддаётся гормонотерапии.
Помимо этих видов злокачественный рак делится на подвиды, по месту локализации, проявляющиеся симптомы и прогноз выживаемости. Многое зависит от степени зрелости раковых клеток. Поэтому выделяется дополнительная классификация, где железистая карцинома бывает:
- высокодифференцированная;
- умеренно дифференцированная;
- низкодифференцированная.
Если строение опухоли близко к здоровым клеткам, это высокая степень дифференцирования. Если разница между здоровой клеткой и больной высокая, речь идёт о низкодифференцированной степени. Сложность низкодифференцированной степени состоит в максимальном разнообразии либо в одинаковом наборе поражённых клеток. Несмотря на сложности, есть слизистая, солидная, мелкоклеточная, фиброзная и другие формы низкодифференцированной степени рака.
Доброкачественные новообразования
Чаще всего опухоль локализуется в зоне простаты, однако также образуется в других органах. Аденома предстательной железы – метастатическая фаза отсутствует, но для неё характерен переход в аденокарциному.
Аденома желудка и кишечника – приобретенное заболевание у людей, кто ранее страдал гастритом, неправильно питался либо имеет генетическую предрасположенность. Аденома пищеварительного тракта носит название полип. Единичное новообразование удаляется хирургически, при множественных полипах применяется электрокоагуляция.
Фиброзная аденома груди – подвижное образование. Женщины часто самостоятельно обнаруживают изменения в области грудных желёз. В стадии быстрого развития опухоль удаляют. До этого момента за ней просто наблюдают.
Эндометриальная аденома в матке – разрастание эндометрия до образования кисты либо полипа. Сопровождается кровянистыми выделениями между менструациями, схваткообразными болями. Такой вид аденомы видно на УЗИ, удаляется путём выскабливания матки. Эндометриоидная аденокарцинома матки – бич женщин, у которых отсутствует половая жизнь, не было родов и беременностей, а также наблюдается гормональный сбой. По мере разрастания опухоли женщина внешне напоминает беременную, у нее растет живот, появляются боли в пояснице. Зловонные выделения из влагалища говорят о том, что опухоль распадается.
Рассматривая аденому нижний конечностей, заметно, что её перерождение напоминает ревматизм. По указанной причине больной часто игнорирует первые признаки, пропуская благоприятное лечение болезни. С разрастающимися болями ноги становятся малоподвижными, возникают отёки. С последней стадией болезни чаще встречаются переломы, переходящие в хроническую форму. Поражение настигает стопы, голени, пятки, бедренные суставы, реже встречается рак верхних конечностей.
Аденома позвоночника встречается редко. Чаще всего больной сталкивается с раковой опухолью, проявляющую себя болями в области спины. Проведённая биопсия определит природу возникновения новообразования и поможет составить правильное лечение пациента.
Раковые стадии
Пациенты, узнав диагноз, интересуются стадией и прогнозом развития болезни. При этом стадия не указывает на продолжительность жизни. Врач ставит предположительные сроки, которые зависят от множества факторов. Таким образом, первая стадия не гарантирует полное излечение, как последняя 4 стадия – не значит неминуемую смерть от рака.
Разделение на раковые стадии происходит от распространённости изменённых клеток. Поэтому для чёткости обозначения локализации опухоли и её осложнений в виде метастазов принято использовать классификатор.
Международная классификация болезней (МКБ-10) новообразованиям предоставила собственные коды. Система стадирования обозначается аббревиатурой TNM. Каждая буква имеет определённый смысл: T – опухоль, N – метастазы в лимфоузлах, M – поражение отдалённых органов. К каждой букве приставляется цифровое и буквенное обозначение, точно определяющее все параметры болезни. Рассмотрим цифры:
- Т0-4 – делится на размеры опухоли, начиная от самой маленькой и заканчивая большой площадью поражения.
- N0-3, где 0 – поражения лимфоузлов не произошло, 1-3 – лимфоузлы затронуты. Градация указывает на размер поврежденных участков.
- M0-1, где 0 – метастазы не обнаружены, 1 – произошло отдалённое метастазирование.
Учитывая эти параметры, расшифровать стадию рака возможно по схеме:

Известно, что липопротеины могут связывать и транспортировать, в том числе и через цитоплазматическую мембрану, ксенобиотики, жирорастворимые витамины, стероидные соединения, тиреоидные гормоны, лекарственные препараты [5, 7]. В литературе показано, что наиболее перспективными переносчиками являются липопротеины высокой плотности (ЛПВП) и их белковый компонент аполипопротеин А-I (апоА-I), образующий стабильные комплексы с биологически активными веществами [6, 11, 14]. Показано, что многие клетки обладают рецепторами к апоА-I, поэтому апоА-I нашел применение в искусственных липосомах в качестве маркера для распознавания такими клетками [12, 15]. Однако транспортной ролью функции апоА-I не ограничиваются. Показано, что апоА-I сам по себе и в комплексе с тетрагидрокартизолом (ТГК) связывается с эукариотической ДНК [1]. На коротких олигонуклеотидах было продемонстрировано, что наибольшее сродство комплекс апоА-I-ТГК имеет к олигонуклеотидам, в состав которых входит (GCC)n повторы (n = 3,5). При этом в местах взаимодействия образуются однонитевые разрывы ДНК, в результате чего происходит увеличение копирования ДНК на 22–27 % [2, 13]. Основываясь на этих данных, на специфическом (или слабоспецифическом) взаимодействии апоА-I с ДНК, мы предположили его использование для трансфекции клеток млекопитающих плазмидными ДНК (пДНК). Поскольку некоторые клетки животных, в том числе и опухолевые, имеют рецепторы к апоА-I [9, 10], конгломерат апоА-I(n)-пДНК может быть поглощен этими клетками. Целью настоящего исследования явилось изучение возможности трансфекции клеток асцитной карциномы Эрлиха плазмидными ДНК с помощью апоА-I.
Материалы и методы исследования
Плазмиды для трансфекции содержали ген gfp под контролем промотора цитомегаловируса – pTagGFP2-С,
Результаты исследования и их обсуждение
На рис. 1, А можно видеть, что далеко не все клетки обладали светящимся ядром. Вероятно, это следствие гетерогенной популяции клеток АКЭ, т.е. клеток, находящихся в различных стадиях пролиферации. Клетка обладает максимальным количеством активных рецепторов к апоА-I лишь в определенный промежуток своего жизненного цикла. Отсюда мы и наблюдали небольшую долю клеток со светящимися ядрами.
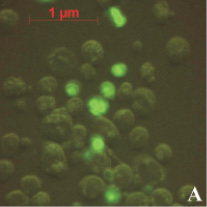
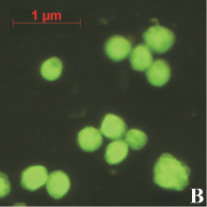
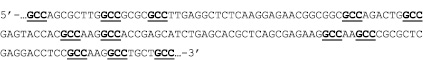
Рис. 2. Фрагмент кДНК гена апоА-I человека, повторы GCC подчеркнуты
В качестве контрольной реакции на возможность переноса пДНК в ядра клеток АКЭ параллельно проводилась трансфекция клеток с помощью зарекомендовавшего себя трансфецирующего реагента Lipofectamin 2000 (далее Lip). В постановке контрольной реакции исследовалось оптимальное для трансфекции соотношение пДНК:Lip – от 1 мкг:1 мкл до 1 мкг:5 мкл. Комплекс пДНК:Lip получали инкубацией в бессывороточной среде при комнатной температуре в течение 20 мин. согласно инструкции к Lip., затем смесь добавляли к клеткам. Суммарное количество пДНК на лунку было аналогичным, как и в случае комплекса апоА-I(n)-пДНК. На следующие сутки, примерно после 24 часов инкубации, начинали наблюдение за клетками в флуоресцентный микроскоп. Через каждые сутки инкубационная среда менялась на свежую, не содержащую трансфецирующих реагентов. Общее время инкубации клеток не превышало трех суток.

Рис. 3. Пример клеток АКЭ, инкубированных с комплексом пДНК:Lip, снимок в флуоресцентном режиме после 24 часов с начала проведения трансфекции. Клетки, экспрессирующие ген gfp, имели характерное ярко-зеленое свечение
В литературе отсутствуют данные о трансфекции клеток АКЭ с помощью Lip, однако в целом можно отметить низкий уровень трансфекции клеток по сравнению с известными клеточными линиями. Например, для нейронных клеток и клеток лини HEK 293 уровень трансфекции в первом пассаже с помощью Lip по данным производителя составляет 25 % и 99 % соответственно [4]. Вероятно, в нашем случае низкий уровень трансфекции обусловлен особенностью клеток АКЭ и, возможно, недостаточной очисткой используемых пДНК.
Заключение
В результате исследований впервые было показано проникновение апоА-I, меченного ФИТЦ, в ядра клеток асцитной карциномы Эрлиха. Впервые была показана возможность трансфекции клеток АКЭ в условиях in vitro с помощью трансфецирующего реагента Lipofectamin 2000, уровень трансфекции составил до 8,6 ± 2,1 % клеток. Эти данные позволяют говорить о пригодности клеток АКЭ в качестве модели для трансфекции. Показана неспособность апоА-I к переносу плазмидных ДНК размером 5–6 т.п.н. в клетки и/или ядра клеток АКЭ в исследуемых молярных соотношениях.
Рецензенты:
Работа поступила в редакцию 01.04.2014.
- Что такое карцинома?
- Причины возникновения карциномы
- Симптомы карциномы
- Органы, поражаемые карциномой
- Виды карциномы
- Степени карциномы
- Методы диагностики карциномы
- Методы лечения
- Возможные осложнения
- Профилактика
- Прогноз
Что такое карцинома?
Карцинома — злокачественное новообразование, развивающееся в эпителиальной ткани, поэтому поражаются кожа и органы, где есть слизистые оболочки: легкие, ЖКТ, мочеполовые, суставы, протоки и даже сосуды. В головном мозге и лимфоузлах, крови и жировой ткани, мышцах и костях развиваются другие злокачественные новообразования, но не рак.
Карцинома не саркома, не меланома, не лейкоз и не лимфома. В коже развиваются плоскоклеточная и базальноклеточная карциномы, и совсем не похожая на рак меланома. Локализация одна, а морфология и закономерности течение, подходы к лечению, особенно лекарственному, очень разные. В ткани лимфатического узла первично развивается только лимфоидная опухоль, но в лимфоузлы могут заноситься раковые клетки, формируя метастазы.
Причины возникновения карциномы
Большинство карцином возникает спонтанно, неблагоприятной наследственностью обусловлены меньше 10%. Злокачественный процесс следствие мутаций ДНК клетки при неадекватной иммунной защите от перерождения на фоне регулярного воздействия канцерогенов:
- Доказано канцерогенное действие курения, особенно для бронхиального плоскоклеточного рака легкого, молочной и поджелудочной желез, мочевого пузыря. Продукты горения табака — химические канцерогены, как асбест, свинец и другие металлы.
- Мощнейший инициатор перерождения клеток — алкоголь.
- Фактор риска рака — излучение: ультрафиолетовое и ионизирующее. В большинстве случаев излучение приводит к возникновению злокачественного новообразования в месте воздействия: солнце вредит коже, радиоактивный йод —щитовидной железе.
- Биологические факторы — внутриклеточные вирусы папилломы и гепатита способствуют мутациям в слизистых половых органов, ротовой полости и печени.
- Неадекватная продукция гормонов тоже может переключить клетку на злокачественное перерождение.
Для большинства карцином не определен окончательный список факторов риска, много пробелов в описании процесса злокачественной трансформации, ясно одно — в патогенезе участвует много факторов, большую часть из которых современная наука пока не знает.
Симптомы карциномы
Клиническая картина определяется локализацией, так в молочной железе безболезненный опухолевый узел достигает внушительных размеров до обнаружения. Также происходит и в желудке — и достаточно места для роста, и растягивается не вовлеченная в опухолевый процесс стенка органа, нивелируя уменьшение желудочного объема.
При раке поджелудочной железы крошечное новообразование способно заблокировать общий желчный проток и вызвать тяжелейшую желтуху с печеночной недостаточностью. При минимальном опухолевом поражении шейки мочевого пузыря симптомы появятся рано и ярко — с нарушением мочеиспускания.
Эпителиальное опухолевое образование не болит, оттого и не заметно пока не случится сдавление крупного сосудисто-нервного пучка, не перекроется просвет органа, мешая движению пищевых масс или биологических жидкостей, то есть пока не нарушится функционирование органа.
Органы, поражаемые карциномой
Самая часто встречающаяся злокачественная патология кожная — 12,6%, чуть реже заболевает толстая кишка и почти столько же молочная железа, каждый десятый случай обусловлен раком легкого, на долю предстательной железы приходится меньше 7% новообразований, на желудок — 5,9%, остальные органы имеют долю меньше 5%.
У россиянок лидирует патология молочной железы — каждый пятый случай, второе место у кожного рака с 14,6%, замыкает тройку карцинома матки с 8% долей. Почти 40% злокачественных процессов у женщин диагностируется в органах репродуктивной системы, на новообразования всей половой системы приходится чуть больше 18%.
У российских мужчин превалирует злокачественный процесс в легком — 17%, в простате — 15%, каждый десятый случай обусловлен новообразованием кожи. Ровно четверть всех мужских карцином развивается в органах мочеполовой системы.
Виды карциномы
В зависимости от вида клеток, ставших источником злокачественной трансформации, карциномы классифицируют на несколько десятков морфологических видов, часто встречаются железистые (аденокарцинома), плоскоклеточные, перстневидно-клеточные, светлоклеточные, базальноклеточные.
Каждый орган состоит из определенных клеточных пластов, так в щитовидной железе есть фолликулярные, папиллярные, медуллярные и плоскоклеточные структуры, но перстневидно-клеточный рак в щитовидке невозможен, потому что там нет перстневидных клеток.
Степени карциномы
Вне зависимости от морфологического вида опухоли злокачественные процессы классифицируют по степени агрессивности, благоприятно текущий вид — высокодифференцированное новообразование. Наиболее агрессивные формы — малодифференцированные и крайняя степень злокачественности — недифференцированные. Средняя степень злокачественности обозначается как умеренно дифференцированная.
На фоне химиотерапии степень дифференцировки может измениться, поскольку погибают особенно чувствительные к лекарствам популяции, выжившие клетки размножаются и постепенно становятся основным клеточным пулом. К примеру, при метастатической стадии рака молочной железы химиотерапия уничтожает низкодифференцированные клетки, а популяции высокой дифференцировки выживают, если в них достаточно рецепторов эстрогенов, то будет эффективна гормонотерапия.
Методы диагностики карциномы
Диагностика злокачественного процесса обусловлена локализацией новообразования. Принципиально разное выявление процесса в желудочно-кишечном тракте и молочной железе, при первом ведущий метод диагностики — эндоскопический, при втором — рентгеновская визуализация. При любом процессе обязательна биопсия с последующей морфологической диагностикой, только гистология позволяет установить окончательный диагноз и начать лечение.
Методы лечения
Без хирургической операции вылечить карциному невозможно, даже при очень высокой чувствительности к лекарствам и при полной регрессии в результате облучения. Без удаления первоисточника злокачественного роста нельзя гарантировать отсутствие рецидива — на некотором расстоянии от опухоли в сосудах и около нервов остаются активно делящиеся раковые клетки. В некоторых клинических ситуациях, например, при распространенном раке пищевода сопоставимы результаты выживаемости при операции и химиолучевом лечении, тем не менее, после операции выживаемость на несколько процентов выше, а статистический процент — это жизни многих людей.
Иногда неоперабельный вариант заболевания с помощью предоперационной химиотерапии удается перевести в технически удаляемый. К сожалению, новообразования не всех локализаций позитивно реагируют на химиотерапию, опухоли матки, легких, печени, почек мало чувствительны к цитостатикам. Не все новообразования чувствительны к облучению, так при раке прямой кишки лучевая терапия входит в программу комплексного лечения, но ЛТ совершенно бесперспективна при такой же по структуре опухоли поперечно-ободочной кишки.
Для повышения эффективности лекарственной терапии малочувствительных новообразований прибегают к доставке химиопрепарата непосредственно к опухолевому узлу с долговременной задержкой лекарства в сосудистой сети органа за счёт перекрытия оттока крови из органа, достигаемой временной эмболизацией сосудов. Особенно результативна химиоэмболизация при процессах в печени, панкреатической и почечно-клеточной карциномах.
Возможные осложнения
Повреждение тканей агрессивно растущей злокачественной опухолью может привести к кровотечению из-за распада. Кровотечение частое осложнение новообразований желудка и кишки, особенно прямой, легочной карциномы, поверхностных мягкотканых узлов.
В полом органе деструкция стенки может осложниться её перфорацией, тогда в брюшную полость попадает микрофлора, пищевые или каловые массы, желчь или моча, и развивается фатальный перитонит.
Перекрытие просвета трубчатого органа или протока прекращает движение пищевых масс или биологических жидкостей, вызывая смертельное осложнение:
- в кишке — кишечную непроходимость с невыносимым болевым синдромом и тяжелейшей интоксикацией;
- в желудке — стеноз выходного отверстия с частыми рвотами и медленной гибелью от голода;
- закупорка бронха приводит к активации воспаления с распадом инфицированного участка легкого и прорывом гнойника в плевральную полость с её эмпиемой;
- непроходимость мочеточника блокирует функционирование почки, дальше наступает почечной недостаточность с уремией;
- в общем желчном протоке, сдавленном лимфоузлами с метастазами или опухолью поджелудочной железы, прекращается ток желчи, она всасывается в кровь и развивается механическая желтуха;
- в мочевом пузыре или уретре блокада оттока мочи приводит к её острой задержке с последующей функциональной недостаточностью почек.
При кишечном новообразовании могут формироваться свищевые ходы, вызывающие септическое состояние и местное гнойное расплавление.
Любое осложнение требует принятия срочных мер, как правило, хирургических, вынуждая отказаться от продолжения лекарственной и лучевой терапии.
Профилактика
При генетически обусловленных злокачественных новообразованиях налажена система активного медицинского наблюдения за носителями мутантных генов и наследственных синдромов. При очень высокой вероятности малигнизации проводятся профилактические операции. Все родственники больных, страдающих генетическими раковыми синдромами, должны пройти генетическое обследование.
Среди всех онкологических пациентов носителей наследственных злокачественных синдромов немного — от 3% до 10%. В большинстве случаев заболевание — результат неожиданных генетических сбоев из-за неправильного образа жизни: вредных привычек, неадекватного питания, нарушения режима сна, отказа от физической активности.
Онкологическая наука зачастую не знает конкретной причины развития спонтанного злокачественного новообразования, но определилась в отношении бытовых канцерогенов, предлагая отказаться от курения и злоупотребления алкоголем, длительного пребывания на открытом солнце.
Прогноз
Последние крупнейшие клинические исследования поставили под сомнение ведущую роль в прогнозе распространенности новообразования на момент выявления, первостепенное значение приобретают биологические характеристики, определяющие скорость роста клеточной популяции, активность деления и способность к выработке механизмов защиты от противоопухолевых лекарств — клеточная структура, степень дифференцировки и молекулярные типы.
Чтобы навсегда вылечить новообразование 3 стадии и не погибнуть от метастазов при 1 стадии важно подобрать адекватную и строго индивидуальную терапию, учитывающую не только стандартные подходы, но и биологические особенности клеточной популяции. В нашей Клинике программы терапии опираются на современную науку и технологии, все подходы индивидуальны и обоснованы.
Читайте также:

