Карбонат меди с хлором
С хлоридом меди отлично знаком каждый химик. Равно, как с процессами его получения и особенными свойствами этого вещества. Впрочем, вещество это настолько же опасно, насколько и интересно. Так что, с опытами нам хлоридом меди, следует быть крайне осторожными!

Хлорид меди: особые приметы
Второе название вещества – монохлорид меди. По сути своей – это соль хлороводородной кислоты. Вещество представляет собой порошок белого или зеленоватого оттенка со структурой в виде кристаллической решетки, которую хорошо можно рассмотреть под микроскопом.
Хлорид меди хорошо растворим в воде, этаноле, метаноле и ацетоне. Вещество это – гигроскопично. Температура плавления хлорида меди – 596 градусов по Цельсию. Следует особо отметить, что это химическое соединение – ТОКСИЧНО! А потому в обращении с ним, следует быть предельно внимательным и аккуратным.
Основные сферы применения:
- Крекинг
- Омеднение металлов
- Текстильная промышленность (используется, как составляющая красителя тканей)
- Реакция декарбоксилирования (особая реакция по отщеплению от молекул карбоновых кислот диоксида углерода)
Хлорид меди: способы получения
- Медь +хлор. Для проведения опыта понадобятся: металлическая проволока, пробирка с хлором и небольшим количеством воды на дне, горелка. Нужно раскалить медную проволоку на пламени горелки и поместить ее в сосуд с хлором и водой. Произойдет бурная реакция с образованием соли, которая растворится в воде.
- Оксид меди + соляная кислота. Для опыта понадобятся: пробирка, спиртовая горелка, соляная кислота и порошок оксида меди. Пробирку на одну треть заполняем соляной кислотой, добавляем немного порошка оксида меди и прогреваем смесь на спиртовой горелке. В результате реакции получится раствор хлорида меди голубого или зеленого цвета (в зависимости от количества добавленного оксида меди).
- Соляная кислота + гидроксид меди. К синтезированному гидроксиду меди добавляется немного соляной кислоты. Гидроксид меди растворится в кислоте, образуя раствор хлорида меди голубого или зеленого цвета.
- Карбонат меди + соляная кислота. В пробирку с соляной кислотой добавляется порошок карбоната меди. Смесь начнет закипать, и в результате реакции образуется углекислый газ и раствор хлорида меди зеленоватого или голубого цвета.
Хлорид меди и изготовление свечей
Некоторые вещества обладают способностью окрашивать пламя обычной восковой свечи в необычные цвета. Такими свойствами обладают, в частности, сульфат магния или хлорид лития. А можно ли сделать красивую зелено-голубую свечу из химических компонентов? И так ли это просто, как кажется? – Вовсе нет! И экспериментировать с изготовлением подобной свечи разрешается лишь опытным химикам! Для изготовления необычной свечи нам понадобятся:
- Пробирка
- Крышка от банки
- медная электрическая проволока толщиной не менее 1,3 мм
- цилиндрический шуруп
- катушка х/б ниток
- ножницы для резки жести
- маленькие щипцы
- скальпель
- гвоздь толщиной 4 мм
- Этиловый спиртовый раствор (85%)
- Хлорную медь и хлорид меди (по 0,1 г)
Инструкция по изготовлению свечи

При контакте с химическими веществами – используйте защитные очки и перчатки! Нельзя жечь свечу в тесном и плохо проветриваемом помещении! Вредные вещества, выделяемые при горении – опасны для здоровья человека!
Если Вы не сторонник опасных экспериментов, не менее эффектную свечу можно изготовить дома без риска для жизни и здоровья. Воспользуйтесь рецептами на нашем сайте, и гелевая свеча "Ароматный глинтвейн", цветочный свечной шедевр "Лети-лети, лепесток" или элегантная свеча "Фан-Фан Тюльпан" станут истинными украшениями Вашего дома.
Понравилась статья? Посоветуй друзьям:
Карбонат меди — неорганическое соединение, 
соль угольной кислоты и меди. Синонимом является название медь углекислая. Формула — CuCO3. Соединение неустойчивое, поэтому в промышленности использования не нашло, зато широко используются гидроксокарбонаты меди (осно́вные карбонаты меди): CuCO3·Cu(OH)2 и 2CuCO3·Cu(OH)2.
Задача получить истинный карбонат меди стоит редко. Простыми способами, с помощью химических реакций обмена между растворимыми солями меди и карбонатами других металлов, получение невозможно, т.к. карбонат меди под воздействием гидролиза тут же переходит в осно́вный карбонат. Истинный карбонат получают из осно́вного карбоната — его обрабатывают двуокисью углерода при повышенной температуре и давлении в несколько атмосфер.
Осно́вные карбонаты получают разными способами. Один из них: воздействие соды (гидрокарбоната натрия) на растворимые в воде соли двухвалентной меди. Частично осно́вную углекислую медь получают из природного малахита.
Осно́вные карбонаты встречаются в природе в виде ценных поделочных камней: малахита (зеленого цвета) и азурита (синего цвета со стеклянным блеском).
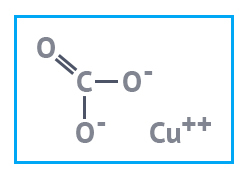 | 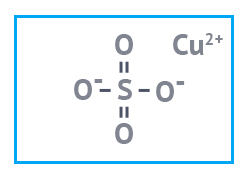 | 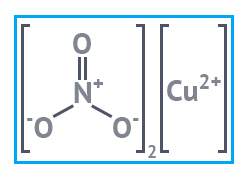 |
| Медь углекислая основная | Медь сернокислая | Медь азотнокислая |
Светло-зеленый мелкокристаллический порошок, без запаха. Его можно наблюдать на старых медных изделиях, например, на монетах. Верхний слой патины как раз и является карбонатом меди, до которого окисляется медь под действием влажного воздуха. В воде практически не растворим. При нагревании разлагается. В воде гидролизируется и превращается в осно́вный карбонат.
Карбонат вступает в реакции с кислотами, выделяя двуокись углерода. Реагирует с раствором аммиака в воде и цианидами металлов.
Осно́вные карбонаты токсичны. Проглатывание приводит к серьезному отравлению. Контакт порошка и пыли с кожей, слизистыми оболочками, дыхательными путями вызывает раздражение, особенно опасно попадание в глаза. При отравлении обязательно следует вызвать скорую помощь.
Все работники, имеющие дело с реактивом, должны использовать средства защиты: резиновые перчатки, защитные очки, респираторы с противопылевым фильтром и спецодежду с длинными рукавами. Помещение должно быть оборудовано принудительной вентиляцией. В лабораториях эксперименты с веществом проводят в вытяжном шкафу.
Транспортировать карбонат меди можно любыми видами транспорта. Хранить в герметичной упаковке (бумажные мешки с полиэтиленовыми вкладышами), на сухих и прохладных складах, защищенных от солнечных лучей, от соседства с кислотами, вдали от нагревательных приборов.
Собираю здесь варианты, задания и решения заданий с ЕГЭ по химии 31 мая 2019 года. Присылайте в комментариях свои задания, варианты и решения.
Задача 34. Растворимость карбоната натрия при определенной температуре равна 31,8 г на 100 г воды. Приготовили 200 г насыщенного раствора. Полученный раствор разделили на две части. К первой части добавили избыток соляной кислоты. При этом выделилось 4,48 л газа. Ко второй части прибавили 222 г 25 %-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Задача 34. К насыщенному раствору сульфата меди (II) массой 320 г добавляли воду до тех пор, пока массовая доля сульфата меди (II) не составила 16%. К полученному раствору добавили 2850 г 3 %-ного раствора гидроксида бария. К образовавшейся смеси добавили 730 г 13,2 %-ного раствора хлороводородное ксилоты. Определите массовую долю хлороводорода в полученном растворе. Растворимость сульфата меди (II) в указанных условиях составляет 25 г на 100 г воды.
В ответе запишите уравнения реакций, которые указаны в условиях задачи, и приведите все небходимые вычисления (указывайте единицы измерения искомых физических величин).
Задача 34. Растворимость безводного карбоната натрия равна 31,8 г на 100 г воды. 395 г насыщенного раствора карбоната натрия разделили на 2 порции, к одной порции прилили избыток раствора нитрата кальция, при этом выпало 50 г осадка. Ко второй порции прилили 252 г 30%-ого раствора азотной кислоты. Найдите массовую долю
азотной кислоты в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условиях задачи, и приведите все небходимые вычисления (указывайте единицы измерения искомых физических величин).
Задача 34. Растворимость безводного сульфида натрия при определённой температуре 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в 2 колбы. К первой колбе прилили избыток раствора хлорида алюминия. Ко второй колбе добавили 100 г соляной кислоты, причём объём газа, выделившегося в первой колбе в 1,5 раза больше объёма газа, выделившегося в первой колбе. Вычислите массовую долю хлорида натрия в растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условиях задачи, и приведите все небходимые вычисления (указывайте единицы измерения искомых физических величин).
Задача 34. Растворимость безводного хлорида кальция равна 55,5 г на 100 г воды. Приготовили насыщенный раствор, соль добавили к 300 г воды. Раствор разделили на 2 порции, к первой порции прилили избыток нитрата серебра, при этом выпал осадок массой 143,5 г. Ко второй порции прилили раствор карбоната натрия массой 1272 г и
массовой долей 10%. Вычислите массовую долю карбоната натрия в полученном растворе во 2-ой пробирке.
В ответе запишите уравнения реакций, которые указаны в условиях задачи, и приведите все небходимые вычисления (указывайте единицы измерения искомых физических величин).
Задача 34. Гидрокарбонат натрия растворяется в воде 12,6 г на 100 г воды. Раствор гидрокарбоната натрия массой 450,4 г разделили на две колбы. В первую добавили избыток гидроксида бария. Осадок составил 39,(2) г. Во вторую колбу добавили раствор серной кислоты массой 245 г 20%. Найдите массовую долю кислоты в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условиях задачи, и приведите все небходимые вычисления (указывайте единицы измерения искомых физических величин).
Задача 34. Растворимость безводного сульфата алюминия равна 34,2 г на 100 г воды. К 300 г воды добавили сульфат алюминия, получился насыщенный раствор, его разделили на 2 части. К первой части добавили раствор аммиака и образовался осадок массой 15,4 г, а ко второй части добавили 320 г 25% гидроксида натрия. Какова массовая доля сульфата натрия в получившемся растворе?
В ответе запишите уравнения реакций, которые указаны в условиях задачи, и приведите все небходимые вычисления (указывайте единицы измерения искомых физических величин).
Задача 32. Сульфат меди прореагировал с алюминием. Выделявшуюся соль отделили, растворили в воде и добавили растовр карбоната натрия. Выделившийся осадок прореагировал с гидроксидом натрия. Полученная соль прореагировала с избытком серной кислоты. Напишите уравнения четырёх описанных реакций.
Задача 32. Карбонат натрия сплавили с оксидом железа (III). Вещество обработали избытком раствора, полученного при пропускании через воду оксида азота (IV) и кислорода. Полученное соединение железа выделили и смешали с
водным раствором карбоната калия. Напишите уравнения четырёх описанных реакций.
Задача 32. Газ, полученный в ходе реакции иодида калия с концентрированной серной кислотой, прореагировал с избытком кислорода. Твердое вещество прореагировало с концентрированной азотной кислотой, в ходе реакции
выделился газ. Этот газ прореагировал с гидроксидом калия. Напишите уравнения четырёх описанных реакций.
Задача 32. Нитрат свинца прореагировал с алюминием. Полученную соль добавили к растовору карбоната натрия, выпавший осадок прореагировал с гидроксидом натрия. К полученной соли добавили избыток серной кислоты. Напишите уравнения четырёх описанных реакций.
Задача 32. Бромид железа III реагирует с гидроксидом калия. К полученной соли добавили концентрированную серную кислоту. Простое вещество разделили на 2 части. Первая часть простого вещества прореагировала с горячим
раствором гидрокисда калия. Вторая часть простого вещества прореагировала с сульфидом калия. Напишите уравнения четырёх описанных реакций.
Задание 32. Твердый хлорид аммония смешали с гидроксидом натрия. Полученный газ пропустили над раскаленным оксидом меди (II) Твердый продукт реакции поместили в разбавленный раствор азотной кислоты. При этом выделился бесцветный газ. Оставшийся раствор подвергли электролизу.
NH4Cl + NaOH = NaCl + NH3 + H2O
2NH3 + 3CuO = 3Cu + N2 + 3H2O
Азотная кислота, сульфат меди (II), ацетат магния, фосфин, хлороводород.
PH3 за счет P –3 – восстановитель
HNO3 за счет N +5 – окислитель
1. Окислили фосфор до простого вещества.:
Такой вариант не засчитают. Фосфор под действием сильных окислителей окисляется до степени окисления +5.
2CH 3 COO – + Mg 2+ + 2H + + 2NO 3 – → 2CH 3 COOH + Mg 2+ + 2NO 3 –
CH 3 COO – + H + → CH 3 COOH
Типичные ошибки в этом задании:
1. Не сократили коэффициенты в сокращенном ионном уравнении:
2CH3COO – + 2H + → 2CH3COOH
Такой вариант ответа приводит к потере 1 первичного балла.
сульфид калия, перманганат калия, гидроксид алюминия, ацетат магния и фосфат калия.
K2S восстановитель за счет S -2
KMnO4 окислитель за счет Mn +7

1. Окислили серу до соединений серы +4:
6CH 3 COO – + 3 Mg 2+ + 6K + + 2PO4 3 – → 6CH 3COO – + 6K + + Mg3(PO4)2

Типичные ошибки в этом задании:
1. Записали заряд ионов, как степени окисления:
хлор, гидроксид натрия, гидрофосфат натрия, гидроксид железа (II), карбонат меди (II)
Взаимодействие гидроксида железа (II) с хлором в щелочной среде:

Еще один вариант ответа:
Диспропорционирование хлора в гидроксиде натрия

Типичные ошибки:
1. Неверно указаны продукты реакций:

Здесь в продуктах приведен хлорид железа (II), хотя железо является восстановителем и переходит в степень окисления +3. Такой вариант не засчитают. Корректно было бы указать в продуктах реакции хлорид железа (III), но лучше проводить реакцию в щелочной среде, как на примере выше.

1. Разложить гидрофосфат-ион на ионы — это ошибка. Гидрофосфат-ион — слабый электролит, а слабые электролиты в РИО на ионы не распадаются:
серная кислота, перманганат калия, пероксид водорода, ацетат меди, нитрат аммония.

Хлорид меди (II) (медь хлорная) — бинарное неорганическое вещество, соединение меди с хлором, относящееся к классу галогенидов и солей (может рассматриваться как соль соляной кислоты и меди). Образует кристаллогидраты вида CuCl2·nH2O.
Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение

Описание
Хлорид меди (II) при стандартных условиях представляет собой жёлто-бурые (по некоторым данным — тёмно-коричневые) кристаллы моноклинной сингонии, пространственная группа I 2/m, параметры ячейки a = 0,670 нм , b = 0,330 нм , c = 0,667 нм , β = 118,38° , Z = 2 .
При кристаллизации из водных растворов образует кристаллогидраты, состав которых зависит от температуры кристаллизации. При температуре ниже 117 °C образуется CuCl2·H2O, при Т a = 0,738 нм , b = 0,804 нм , c = 0,372 нм , Z = 2 .
Хорошо растворим в воде (77 г/100 мл), этаноле (53 г/100 мл), метаноле (68 г/100 мл), ацетоне. Легко восстанавливается до Cu 1+ и Сu 0 . Токсичен.
Получение
В природе дигидрат хлорида меди (II) CuCl2·2H2O встречается в виде редкого минерала эрнохальцита (кристаллы синего цвета).
В промышленности дихлорид меди получают:
- Хлорированием сульфида меди:
- или используют хлорирующий обжиг:
В лабораторной практике используют следующие методы:
- Взаимодействие металлической меди с хлором:
- Взаимодействие оксида меди (II) с соляной кислотой:
- Взаимодействие гидроксида меди (II) с соляной кислотой (реакция нейтрализации):
- Взаимодействие карбоната меди с соляной кислотой:
- Растворение меди в царской водке:
Химические свойства
- Взаимодействие с щелочами с образованием нерастворимого основания и растворимой соли:
- Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений металлов левее меди, например с цинком:
- Реакции ионного обмена с другими солями (если образуется нерастворимое вещество или газ):
Применение
Применяют для омеднения металлов, как катализатор крекинга, декарбоксилирования, протраву при крашении тканей.
--> -->Форма входа -->
--> -->Категории раздела -->
-->| Логика в химии [438] |
| Киберхимия [56] |
| Бинарные химические соединения [841] |
--> -->Поиск -->
--> -->Мини-чат -->
--> -->Друзья сайта -->
--> -->Статистика -->
Медь активно реагирует с галогенами. Она соединяется с хлором, бромом и йодом уже при обычной температуре. Известны галиды Cu Г2 (кроме CuI 2, который не получен). Взаимодействие элементов погруппы меди с галоидами сильно ускоряется в присутствии влаги, при нагревании и под действием света.
Монохлорид меди CuCl - бесцветные кристаллы, т. пл. 430 0 С, ∆Нобр 0 = - 137,26 кДж/моль. Устойчив в сухом воздухе, но окисляется и гидролизуется во влажном воздухе с образованием основных хлоридов двухвалентной меди.
Получают CuCl восстановлением солянокислого раствора CuCl 2 избытком металлической меди в качестве восстановителя, могут быть использованы также гидразин, глицерин, SO 2, Zn , Al .
Монохлорид-промежуточный продукт в производстве меди, поглотитель газов при очистке ацетилена, а также окиси углерода в газовом анализе, катализатор в органическом синтезе, антиоксидант для растворов целлюлозы и т.д.
Дихлорид меди CuCl 2 – темно-коричневые кристаллы, т. пл. 596 0 С, ∆Нобр 0 = - 215 кДж/моль. При 993 0 С разлагается до CuCl и хлора.
CuCl 2 + Cu = 2 CuCl
CuCl2 + H2S = CuS + 2HCl
Получают CuCl 2 взаимодействием CuO или CuCO 3 с HCl , реакцией CuSO 4 с BaCl 2.
Применяют CuCl 2 для омеднения металлов, как катализатор крекинга, декарбоксилирования, окислительно-восстановительных органических реакций, протраву для крашения тканей, для получения основного хлорида меди.
Хлори́д ме́ди(II) (медь хлорная) — бинарное неорганическое вещество, соединение меди схлором, относящееся к классу галогенидов и солей (может рассматриваться как соль соляной кислоты и меди). Образует кристаллогидраты вида CuCl 2·nH 2O.
Хлорид меди(II) при стандартных условиях представляет собой жёлто-бурые (по некоторым данным — тёмно-коричневые) кристаллы с моноклинной решеткой, пространственная группа I 2/m,a = 0,670 нм, b = 0,330 нм, c = 0,667 нм, β = 118°23’, Z = 2 [2] .
Получение В природе дигидрат хлорида меди(II) CuCl 2·2H 2O встречается в виде редкого минерала эрнохальцита (кристаллы синего цвета). В промышленности дихлорид меди получают:
- Хлорированием сульфида меди:

- или используют хлорирующий обжиг:

В лабораторной практике используют следующие методы:
- Взаимодействие металлической меди с хлором:

- Взаимодействие оксида меди(II) с соляной кислотой:

- Взаимодействие гидроксида меди(II) с соляной кислотой(реакция нейтрализации):

- Взаимодействие карбоната меди с соляной кислотой:

- Растворение меди в царской водке:

Химические свойства
- Взаимодействие с щелочами с образованием нерастворимогооснования и растворимойсоли:

- Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений металлов левее меди:

- Реакции ионного обмена с другими солями (если образуется нерастворимое вещество или газ):

Применение
Применяют для омеднения металлов, как катализатор крекинга, декарбоксилирования, протраву при крашении тканей.
Представляет собой белый или зеленоватый порошок, практически нерастворимый в воде (0,0062 г/100 мл при 20 °C). Зеленоватую окраску придают примеси хлорида меди(II).
Впервые хлорид меди(I) был получен Робертом Бойлем в 1666 году, из хлорида ртути(II) и металлической меди:

В 1799 году, Джозеф Луи Пруст успешно отделил дихлорид меди от монохлорида и описал эти соединения. Это было достигнуто путем нагревания CuCl 2 в бескислородной среде, в результате чего хлорид меди(II) потерял половину связанного хлора. После этого он удалил остатки дихлорида меди от хлорида меди(I) и промыл водой.

Физические свойства
Монохлорид меди образует кристаллы белого цвета, кубической сингонии, пространственная группа F 4 3m, a = 0,5418 нм, Z = 4, структура типа ZnS. При нагревании кристаллы синеют. При температуре 408 °C CuCl переходит в гексагональную модификацию, пространственная группа P 6 3mc, a = 0,391 нм, c = 0,642 нм, Z = 4.
Монохлорид меди плавится и кипит без разложения. В пара́х молекулы полностью ассоциированы (димеры с незначительной примесью тримеров), поэтому формулу вещества иногда записывают как Cu 2Cl 2.
Плохо растворим в воде (0,062% при 20 °C), но хорошо в растворах хлоридов щелочных металлов и соляной кислоте. Так в насыщенном растворе NaCl растворимость CuCl составляет 8% при 40 °C и 15% при 90 °C. Водный раствор аммиака растворяет CuCl с образованием бесцветного комплексного соединения [Cu(NH 3) 2]Cl.
Получение
В природе монохлорид меди встречается в виде редкого минерала нантокит (по названию села Нантоко, Чили), который благодаря подмеси атакамита часто окрашен в зелёный цвет.
В промышленности монохлорид меди получают несколькими способами:
- Хлорирование избытка меди, взвешенной в расплавленном CuCl:

- Восстановление CuCl 2 медью в подкисленном растворе:

В лабораторной практике последний метод также широко распространён.
- Очень чистый препарат получается при взаимодействии меди с газообразным хлористым водородом:

- Похожая реакция идёт в растворе в присутствии окислителей (O 2, HNO 3, KClO 3):

- Удобен способ восстановления меди(II) двуокисью серы:

- Восстановление сульфитом при избытке хлоридов:

- Возможна реакция обратного диспропорционирования:

- Возможно получение монохлорида меди термическим разложением дихлорида:

Химические свойства
- При кипячении суспензии монохлорида меди происходит реакция диспропорционирования:

- Монохлорид меди обратимо растворяется в соляной кислоте с образованием комплексного соединения:

- Монохлорид меди устойчив в сухом воздухе, но во влажном начинает окисляться до основного хлорида (который и придаёт кристаллам зелёный цвет):

- В кислой среде окисление приводит к образованию нормальных солей:

- Окисление можно проводить и горячей концентрированной азотной кислотой:

- Аммиачные растворы монохлорида меди поглощают ацетилен с образованием красного осадка:

- Кислые растворы монохлорида меди обратимо поглощают окись углерода:

Применение
- Монохлорид меди — промежуточный продукт при производстве меди.
- Поглотитель газов при очистке ацетилена, а также CO в газовом анализе.
- Катализатор в органическом синтезе, например при окислительном хлорировании метана или этилена, в производстве акрилонитрила.
- Антиоксидант для растворов целлюлозы.
Ag 2 SO 4 + CuCl 2 = 2AgCl + CuSO 4
Читайте также:

