Какие злокачественные опухоли аорты характеризуются поражением интимы
Реферат. Лечение забрюшинных опухолей является трудной, многокомпонентной задачей для онкологов. Удаление опухоли с соблюдением онкологических принципов футлярности и зональности части приводит к образованию обширных дефектов на магистральных сосудах. Широкое внедрение новейших методов пластической сосудистой хирургии позволило значительно повысить процент сохранных операций и улучшить качество жизни многих пациентов. Проведен анализ результатов комбинированного лечения у 58 пациентов с местно-распространенными саркомами мягких тканей с инвазией в магистральные сосуды. Использованы реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей, а также первый опыт в протезирования брюшной части аорты. Представленный анализ результатов, показывает что соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить число органосохранных операций при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
Ключевые слова: забрюшинные опухоли, магистральные сосуды, реконструктивная хирургия.
Вовлечение в опухолевый инфильтрат магистральных сосудов, в том числе брюшного отдела аорты, традиционно считается одним из противопоказаний к радикальному хирургическому лечению при злокачественных опухолях брюшной полости и забрюшинного пространства. Такие поражения считаются неоперабельными из-за технических сложностей вмешательства и сомнений в его радикализме. Тем не менее в довольно редких публикациях, посвященных этой проблеме, продолжительность и качество жизни пациентов после комбинированных операций с протезированием аорты при некоторых заболеваниях оказываются вполне удовлетворительными [1].
Удаление забрюшинной опухоли больших размеров, нередко на фоне затрудненного кровотока по нижней полой вене и наличия множественных венозных коллатералей, сопровождается массивной кровопотерей и требует высокой квалификации хирургической, анестезиологической и реанимационной бригады, достаточной технической оснащенности. При выполнении комбинированных вмешательств возможно вскрытие просвета тонкой или толстой кишки и инфицирование брюшной полости в зоне протеза и т.д.
Первые попытки моноблочного удаления опухоли и участка сосудистой магистрали с последующим восстановлением целостности сосуда были предприняты Г.Л. Ратнером (1961) и E.S. Crawford et al. (1956). Однако с тех пор за полувековой период опубликованы лишь немногочисленные работы, касающиеся реконструкции МСЖ при хирургическом лечении опухолей органов живота. Между тем широкое применение сосудистой хирургии в абдоминальной онкологии предполагает увеличение группы резек-табельных наблюдений, повышение радикальности операции, выполнение операций, определяющих качество жизни пациентов. Таким образом, назрела необходимость в реализации давно предложенной ангиоонкологической стратегии, разработке комбинированных ангиоонкологических операций на основе известных приемов и методов сосудистой техники и определение четких показаний к этим операциям.
До сих пор довольно большое число онкологических больных (70—80%) поступает в стационар с распространенным опухолевым процессом. При этом имеет место высокая частота сосудистой инвазии. Несмотря на вышеизложенное, на сей день нет единой точки зрения в хирургическом лечении местно-распространенного опухолевого процесса. Бытует мнение, что разумным решением при данном поражении является отказ от попытки удаления опухоли либо выполнение циторедуктивных и паллиативных вмешательств. В то же время именно местно-распространенный опухолевый процесс с вовлечением магистральных сосудов наглядно отражает острую необходимость в объединении усилий онкологов и ангиохирургов.
Литературные данные последних лет свидетельствуют не только о росте онкологических заболеваний, но и о заметном увеличении числа неоперабельных больных с данной патологией (Илюхин Ю.А., 1998; Тарасов В.А. и др., 2000; Heda К. et al., 2001). Ключевым признаком неоперабельности опухоли считается вовлечение в опухолевой инфильтрат магистрального кровеносного сосуда. Несмотря на достижения современной сосудистой хирургии и позитивного опыта протезирования кровеносных сосудов у онкологических больных, отношение большинства хирургических клиник к возможностям радикального оперативного лечения больных этой категории в настоящее время представляется более чем сдержанным. Все еще высок процент отказа от радикальных операций в связи с опасностью повреждения сосудов или необходимостью вмешательств на них (Васютков В.Я., 1988; Дудицкая Т.К., 1994; Гробель О.В., 1999). При современном развитии ангиохирургии следует признать необоснованным частичное удаление новообразований с неизбежным сохранением опухолевых клеток в непосредственной близости от магистральных сосудов, поскольку это с высокой вероятностью сопровождается рецидивированием процесса и метастазами.
Впервые отдельные сообщения о произведенных реконструктивных вмешательствах на аорте и магистральных артериях при удалении новообразований различной локализации стали появляться с начала 50-х годов (Moore, 1952; Conley, 1953; Lord, Sehetlin, 1954; Lawrence, 1957). В отечественной литературе впервые такая операция была предпринята Г.Л. Ратне-ром в 1961 г., успешно выполнившим реконструкцию сосуда при удалении злокачественной опухоли мягких тканей бедра.
В последние годы сообщения о сосудистых реконструкциях в онкологической практике стали встречаться все чаще (Васютков В.Я., 1995; Зотов С.П., 1996, 1999; Соболевский В.А., 1999; Bianchi С. et al., 1999; Matsushita М. et al., 2001). Вместе с тем следует отметить, что в большинстве публикаций представлены лишь единичные наблюдения об успешно выполненных операциях, что свидетельствует только о принципиальной возможности сосудистой пластики у онкологических больных.
Такие важнейшие аспекты проблемы, как доопера-ционное определение степени вовлеченности сосуда в опухолевый процесс, выбор объема операции на сосудах и пластического материала в зависимости от локализации и морфологии опухоли, а также оценка результатов комбинированного лечения данного контингента пациентов и качества их жизни в разные периоды после операции представляют актуальную задачу не только для онкологии и сосудистой хирургии, но и для широкого круга специалистов разного профиля.
Указанные обстоятельства требуют широкопланового исследования на стыке двух специальностей: онкологии и сосудистой хирургии, и имеют не только медицинское, но и социальное значение.
Удобство использования готового пластического материала с необходимыми качествами и заложенной геометрией различных сосудов привело к широкому использованию синтетических имплантатов. Синтетические протезы изготавливаются из инертных полимеров. Они хорошо зарекомендовали себя при работе в крупных магистральных артериях.
Таким образом, когда возникает необходимость пластики дефектов аорты, это в подавляющем большинстве случаев выполняется с помощью синтетических протезов, поскольку они производятся серийно нескольких типов и размеров, функционировать могут десятилетия, однако общим основным недостатком для них является нестойкость к инфекции.
Таким образом, одной из нерешенных проблем сосудистой хирургии остается недостаточная эффективность современных методов профилактики осложнений протезирования сосудов в условиях инфицированной раны. Существование данной проблемы обусловлено тем, что использовать комбинированные протезы не всегда возможно из-за их отсутствия в экстренных ситуациях, аутовена может быть ранее удалена при флебэктомии или потребоваться в дальнейшем для АКШ или БПШ, или просто ее может быть недостаточно по площади для пластики большого дефекта. Все это побуждает к поиску новых материалов и способов их пластики, которые отвечали бы следующим требованиям: а) стойкость к инфекции; б) достаточные размеры для пластики больших дефектов; в) вызывающие минимальные иммунные реакции в организме (что наиболее легко достигается, если пластический материал является аутотканью).
При соблюдении этих требований трансплантат также должен быть мобильным, обладать достаточной эластичностью и прочностью, не подвергаться склерозированию, деформации и дилатации под действием давления крови в аорте.
Цель работы — улучшение показателей радикальных операций при удалении опухолей различной локализации путем усовершенствования хирургической тактики на магистральных сосудах.
Приводим наш опыт лечения больных с опухолями различных локализаций с инвазией магистральных сосудов. С 1995 по 2012 г. реконструктивные хирургические вмешательства на магистральных сосудах при радикальном удалении опухолей выполнено у 58 больных. Возраст больных — от 22 до 63 лет, мужчин 43, женщин 15. В дооперационном периоде больные обследованы на УЗИ, КТ, МРТ, УЗ-допплерографии, при необходимости проводилась ангиография. По данным этих исследований, у 41 больного до операции была инвазия сосудов. Изолированная пластика дефекта сегмента артерии выполнена у 38 больных, пластика дефекта вен — у 12, сочетанная пластика артерии и вены — у 8 больных. Показанием к выполнению реконструктивных вмешательств явилось прорастание опухоли или метастазов в стенку магистрального сосуда: в бедренную артерию (10), бедренную вену (3), наружную подвздошную артерию (8), наружную подвздошную вену (8), общую сонную артерию (8), бифуркацию сонной артерии (7), внутреннюю сонную артерию (3), плечевую артерию (10), подключичную вену (4), яремную вену (3). В 14 случаях было прорастание сонных артерий метастазами опухолей головы и шеи.

Клинический случай. В 2012 г. в абдоминальное отделение РКОД МЗ РТ поступила пациентка Ш., 56 лет, с диагнозом: опухоль забрюшинного пространства. При обследовании, по данным КТ, МРТ органов брюшной полости, выявлена опухоль забрюшинного пространства ниже почечных сосудов на уровне L3—L4 размерами 82x78 мм, охватывающая брюшную часть аорты.
При планировании хирургического вмешательства у пациентки с забрюшинной опухолью, расположенной вблизи аорты и, возможно, прорастающей в стенку, перед ведущими специалистами РКОД МЗ РТ стоял ряд вопросов: показано ли хирургическое лечение, существует ли техническая возможность удаления опухоли, насколько высок риск вмешательства, насколько соответствует степень риска ожидаемым ближайшим и отдаленным результатам, какова готовность хирургической, анестезиологической и реанимационной бригады к выполнению комбинированного, чреватого массивной кровопотерей вмешательства?
Учитывая современную оснащенность РКОД МЗ РТ и богатый опыт специалистов в лечении забрюшин-ных опухолей, решено было выполнить радикальное оперативное лечение.
Первым этапом во время операции выполнена ревизия органов брюшной полости, где была выявлена забрюшинная опухоль 8x7 см, располагающаяся на передней поверхности аорты и нижней полой вены (рис. 1). Верхний полюс располагался дистальнее впадения почечных вен, нижний полюс — проксимальнее устья нижней брыжеечной артерии.

Опухоль охватывала данные сосуды по передней и боковым поверхностям полуциркулярно, неподвижно. Для верификации диагноза интро-операционно была выполнена срочная гистология, результат — лейомиосаркома. Нижняя брыжеечная артерия перевязана и пересечена у устья. Аорта отделена от позвоночной фасции (рис. 2). Выполнено удаление опухоли с резекцией брюшной части аорты (рис. 3).



Соблюдение онкологических принципов хирургического вмешательства с резекцией магистральных сосудов, пораженных опухолью, использование сосудистой реконструкции позволяет увеличить
число органосохранных операций на магистральных сосудах при саркомах и других опухолях опорно-двигательного аппарата и шеи, улучшает качество жизни больных.
1. Babaian, R.J. Complications of transabdominal retroperito-neal lymphadenectomy / R.J. Babaian, R.B. Bracken, D.E. Johnson // Urology. — 1981. — Vol. 17. — P. 126—131.
2. Beck, S.D.W. Aortic replacement during post-chemotherapy retroperitoneal lymph node dissection / S.D.W. Beck, R.S. Foster, R. Bihle [et al.] // J. Urol. — 2001. — Vol. 165. — P. 1517—1520.
3. Bohner, H. Primary malignant tumors of the aorta: Clinical presentation, treatment, and course of different entities / H. Bohner, B. Luther, S. Braunstein [et al.] // J. Vasc. Surg. — 2003. — Vol. 38. — P. 1430—1433.
Первичные опухоли аорты (Ао) встречаются очень редко, хотя в течение последних 20 лет в результате усовершенствования неинвазивных визуализирующих методов существенно увеличилось количество сообщений об опухолях. Наиболее часто опухоли Ао диагностируют у пациентов в возрасте 70-80 лет. Грудной и брюшной отделы Ао поражаются с одинаковой частотой.
В некоторых случаях опухоли аорты (Ао) появляются в связи с предшествующей установкой дакроновых аортальных трансплантатов. Большинство первичных опухолей аорты (Ао) гистологически являются саркомами, особенно часто злокачественной гистиоцитомой.
В основном первичные опухоли аорты (Ао) возникают в интиме и растут вдоль ее поверхности и внутрь просвета аорты (Ао), формируя полиповидные образования (часто с дополнительным тромбозом), но в основном не прорастают через стенку Ао. Опухоли интимы могут характеризоваться симптомами сосудистой обструкции вследствие сужения просвета Ао или признаками периферической эмболизации, аналогичными тем, которые бывают при атеротромботической эмболии.
Эмболы обычно представляют собой смесь опухолевых клеток и тромботических масс. Точный диагноз может оставаться неясным до завершения гистологического исследования удаленных эмболов. Менее часто опухоли аорты (Ао) возникают в медии или адвентиции аортальной стенки. Такие опухоли, как правило, не затрагивают аортальный просвет, но вместе с тем ведут себя как агрессивные новообразования, вызывая общие симптомы и боль в спине.
Поскольку первичные опухоли аорты (Ао) редки и их признаки неспецифичны, диагноз редко удается поставить до хирургического исследования или аутопсии. Однако некоторые визуализирующие методы могут помочь в диагностике. Аортография выявляет сужение просвета или интралюминальный дефект наполнения при наличии опухоли интимы, но может быть отрицательной, если опухоль располагается в адвентиции. КТ способна определить опухоли интимы, но не может дифференцировать эти образования от выступающих в просвет аорты (Ао) атеросклеротическими бляшками (АБ).
МРТ лучше определяет как анатомию опухоли, так и степень инвазии. Способность ЧПЭхоКГ отображать интиму аорты (Ао) делает этот метод визуализации особенно полезным в определении опухолей интимы грудного отдела аорты (Ао).
Лечение первичных опухолей аорты (Ао) имеет небольшую успешность, т.к. большинство пациентов уже с метастазами. Хирургические подходы часто носят паллиативный характер с целью предотвратить дальнейшую эмболизацию. Многие пациенты умирают от последствий множественных эмболий жизненно важных органов. Из тех, кого подвергали хирургическому лечению, большинство умирает в течение нескольких суток или месяцев после операции.
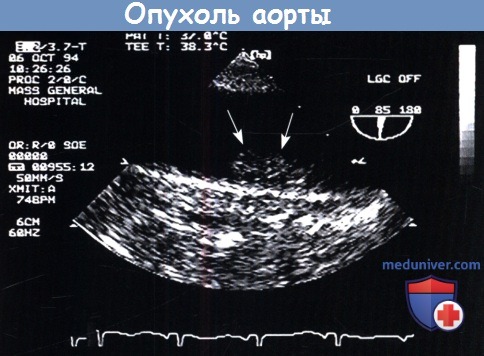
Чреспищеводная эхокардиограмма по длинной оси нисходящей аорты, демонстрирующая первичную опухоль аорты (стрелки), выступающую в просвет аорты.
Эта опухоль имеет размер 3,5 см в длину и поражает слой интимы, но, по-видимому, не затрагивает другие слои стенки аорты.
а) Терминология:
• Первичные злокачественные опухоли аорты (ПЗОА)
• Редко встречающаяся группа сарком, характеризующаяся крайне агрессивным ростом в стенке аорты и неблагоприятным прогнозом
б) Лучевые признаки саркомы аорты:
• Рентгенография:
о Дольчатый контур тени средостения
о Дилатация аорты
• КТ:
о Полиповидное мягкотканное объемное образование в просвете аорты, располагающееся вдоль или вокруг стенки аорты
о Аневризма аорты, которая образуется вследствие снижения прочности стенки аорты из-за наличия в ней инфильтративного объемного образования
о Стенозирование просвета аорты
о Окклюзия ветвей аорты опухолевыми эмболами
• МРТ:
о Наличие контрастирования позволяет дифференцировать опухоль с бляшками на стенке аорты
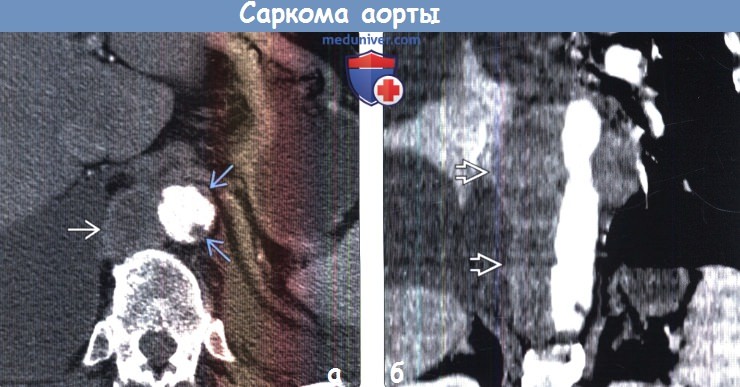
(а) При КТА периаортально определяется контрастирующееся объемное образование с дольчатым контуром, которое соответствует саркоме аорты. Следует отметить наличие опухолевых компонентов в просвете аорты. Мягкотканное объемное образование периаортальной локализации является характерным признаком саркомы аорты.
(б) У этого же пациента при КТА на реконструкции в коронарной плоскости периаортально визуализируется продолговатое мягкотканное объемное образование, имитирующее атеросклеротическую аневризму. Саркому аорты в таких случаях позволяет заподозрить отсутствие кальцификатов. 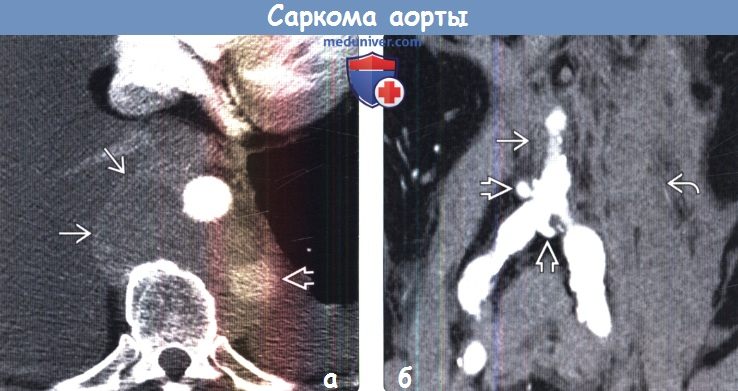
(а) Пациент с жалобами на внезапно возникшие боли в груди. При КТА определяются разрыв аорты, проявляющийся экстравазацией контрастного вещества, и двухсторонний плевральный выпот. Локализующееся периаортально мягкотканное объемное образование с неровным контуром соответствует злокачественной фиброзной гистиоцитоме.
(б) При КТА на реконструкции в коронарной плоскости визуализируются сужение просвета брюшного отдела аорты, псевдоаневризмы или изъязвления и скопление крови в левой половине забрюшинного пространства. При экстренно выполненной резекции аорты в интиме была выявлена саркома. Саркома аорты может имитировать атеросклеротическое поражение сосудов.
в) Дифференциальная диагностика:
• Аневризма аорты
• Выраженный атеросклероз с изъязвлением бляшек
г) Патоморфология:
• Интима: ангиосаркома, интимальная саркома
• Более глубокие слои стенки аорты: лейомиосаркома, фибросаркома
д) Клинические аспекты:
• Нарастающие боли; эмболия
• Может имитировать аневризму аорты ±ее разрыв
• Лечение: резекция единым блоком, химиолучевая терапия, имплантация стент-графта
е) Диагностические пункты саркомы аорты:
• При наличии мягкотканного объемного образования в аорте или вокруг нее и отсутствии признаков атеросклероза следует заподозрить первичную злокачественную опухоль аорты (ПЗОА)
• При первичной злокачественной опухоли аорты (ПЗОА) следует исключить наличие метастазов в костях, легких, печени, кожных покровах и почках
Редактор: Искандер Милевски. Дата публикации: 13.2.2019
Расслоение аорты представляет собой серьезную патологию, когда происходит повреждение внутренней оболочки сосуда (интимы), а кровь устремляется под нее, расслаивая стенку и нарушая ее целостность. Это опасное состояние с высоким риском смертельного исхода, встречающееся преимущественно у людей после 50 лет, в несколько раз чаще – у мужчин.
Аорта – самый крупный сосуд человеческого организма, по которому артериальная кровь из сердца под большим давлением направляется в другие сосуды, кровоснабжающие органы и ткани. Нагрузка на аорту при каждом сердечном толке огромна, кровь ударяет о ее стенки с большой силой, что особенно выражено при артериальной гипертензии. Стенка сосуда, измененная под влиянием атеросклероза, воспалительных процессов, становится хрупкой и не выдерживает нагрузки, тогда и происходит надрыв внутренней оболочки и расслаивание.

пример развития расслоения аорты
Повреждение аорты возникает в тех местах, где толчки крови максимальны – в восходящем отделе и дуге, в нисходящей части ниже места отхождения левой подключичной артерии. В месте надрыва интимы и отделения ее от среднего слоя кровь устремляется в появившийся дефект, усугубляя его и приводя к отслоению еще большей площади внутренней выстилки.

различные варианты расслоения аорты, 2 — с развитием мешотчатой аневризмы, 3 — расслоение дуги аорты
Расслоение аорты может сопровождаться некоторым расширением ее диаметра, тогда говорят о расслаивающей аневризме. Это острое и угрожающее жизни состояние, когда счет идет на часы и минуты, а пациента спасти при разрыве аневризмы практически невозможно, и до 90% больных умирают еще до момента поступления в стационар.
Причины расслоения аорты
Среди причин выделяют:
Мужской пол; Наследственность; Врожденные пороки клапанов сердца; Артериальную гипертензию; Пожилой возраст; Атеросклероз; Инфекционно-воспалительные изменения артериальной стенки.
По данным статистики, мужчины страдают расслоением аорты в 2-3 раза чаще женщин. Это может быть связано с более ранним началом развития у них атеросклероза, склонностью к вредным привычкам и недостаточному контролю своего здоровья. Пожилые лица, чаще страдающие гипертонией, атеросклерозом, диабетом, в большинстве своем имеют те или иные структурные изменения в аорте, поэтому они более подвержены и расслоению ее стенки.
Среди наследственных факторов, приводящих к расслоению аорты, наибольшее значение имеет синдром Марфана, при котором происходит нарушение развития сосудистых стенок и соединительной ткани вследствие генетической аномалии. Сосуды становятся ломкими, не способными противостоять большой нагрузке давлением и в какой-то момент возникает разрыв внутренней оболочки. При синдроме Марфана расслоение появляется уже в молодом возрасте (20-40 лет).
Немаловажное значение имеют врожденные аномалии развития сердечных клапанов (коарктация аорты, пороки), а также уже перенесенные операции на сердце (имплантация искусственного клапана, резекция аорты).
Наиболее значимым поводом для расслоения стенки аорты считают артериальную гипертензию. При этом заболевании кровь под повышенным давлением действует на сосудистую стенку, вызывая ее повреждения, особенно, в местах формирования турбулентных токов крови (дуга, восходящая часть, места ветвления крупных сосудов). Хроническая травматизация аортальной стенки на фоне гипертонии обнаруживается у абсолютного большинства пациентов с расслоением. Систолический удар способствует разрыву интимы и нарушению целостности сосуда.
Атеросклероз нередко становится субстратом для расслаивающих аневризм. Нарушение обменных процессов, отложение жира между внутренним и средним слоем сосудистой стенки приводит к надрывам интимы, местным тромбозам, выраженному артериосклерозу. Стенка аорты в местах атеросклеротических отложений становится чрезвычайно хрупкой и податливой к любому виду механического воздействия.

аневризмы аорты при атеросклерозе, справа — с заметным расслоением
Инфекционно-воспалительные процессы (сифилис, аортоартериит и др.) способствуют некротическим изменениям среднего слоя аорты (медии) с его расслоением. Они могут происходить без формирования аневризм.
Непосредственной причиной расслаивания становится местное структурное изменение, будь то некроз, атеросклероз или микротравма, приводящее к разрыву интимы, проникновению под нее крови с образованием ложного канала, по которому кровь начинает двигаться вдоль сосуда, расслаивая стенку еще больше. В редких случаях можно не обнаружить надрыва, когда оболочки отслаиваются внутренним кровоизлиянием в стенку аорты, но появление сквозного дефекта внутреннего слоя – лишь дело времени.
Расслоение аневризмы аорты происходит по тем же причинам, что и подобное изменение сосудистой стенки вне расширения просвета, однако при аневризме степень риска разрыва аорты при наличии гипертонии или атеросклероза несоизмеримо выше. Аневризма представляет собой локальное расширение просвета сосуда, а стенка его в этом месте всегда изменена воспалительным процессом, атеросклерозом, некрозом. При аневризме очень высока вероятность разрыва не только внутренней оболочки сосуда, но и остальных слоев. В случае расслаивающей аневризмы аорты полный разрыв чреват скоропостижной смертью от массивного кровоизлияния и тотального нарушения кровотока во всех органах.
Симптоматика расслоения аорты
Коварство расслоения аорты состоит в том, что патология может протекать бессимптомно, а когда появятся первые признаки неблагополучия, то времени на диагностику и лечение остается чрезвычайно мало.

Говоря об остром расслоении, имеют в виду длительность его не более двух недель, это наиболее опасный вариант развития событий.
Хроническое расслоение растягивается на недели и месяцы.
Симптомы расслоения аорты зависят от места повреждения сосудистой стенки и степени выраженности изменений. Признаками расслоения можно считать:
Болевой синдром; Обмороки, резкое падение артериального давления, шок; Дефицит пульса, выраженную брадикардию; Нарушение кровообращения во внутренних органов.
Обмороки и резкое падение артериального давления являются прямым следствием нарушения целостности аорты, когда кровь устремляется в ложные каналы ее стенки или даже за пределы. Внутренние органы недополучают питания, страдает сердце, головной мозг, почки. Некоторые больные падают в обморок от нестерпимой боли.
При массивной кровопотере, кровоизлиянии в полость сердечной сумки (тампонада сердца), острой ишемии органов стремительно развивается шок, состояние пациента быстро и прогрессивно ухудшается, он теряет сознание, возможна остановка сердца и смерть.
Недостаточность центрального кровообращения, заброс крови в обратном направлении через аортальный клапан (регургитация) способствуют острой сердечной недостаточности. У многих пациентов отмечается брадикардия и дефицит пульса, артериальное давление на конечностях может существенно разниться, отражая крайне неблагоприятный прогноз.
Нарушение кровотока в органах приводит к появлению симптомов инфаркта миокарда, инсульта, острой почечной недостаточности. Больной бледнеет, наступает цианоз, появляется одышка, снижается количество выделяемой мочи.
Расслоение брюшной аорты часто является следствием атеросклероза. На фоне нарушения кровообращения в нижнем отделе сосуда происходит ишемическое повреждение кишечника, почек, нижних конечностей. Характерна вторичная почечная артериальная гипертензия.

разрыв стенки расслоившейся аорты
Расслоение грудной аорты и восходящей ее части приводит к стремительному нарастанию боли, сердечной недостаточности, развитию инфаркта миокарда и острой ишемии головного мозга. Повреждение этих отделов проявляет тенденцию к быстрому распространению в нижний фрагмент сосуда. Опаснейшими осложнениями расслоения в восходящем отделе считаются гемотампонада перикарда и тотальный разрыв стенки аорты.
Подозрение в отношении расслаивания стенки аорты требует от врача быстрых действий, позволяющих подтвердить диагноз и срочно начать лечение. Самыми информативными методиками диагностики считаются рентгенография грудной клетки, эхокардиография, аортография, КТ и МРТ.
Лечение
Подходы в терапии расслоения аорты зависят от локализации процесса и его выраженности, симптоматики и степени нарушения кровообращения в органах. Лечение может быть консервативным и хирургическим.
При стабильном течении расслоения аорты, когда нет угрозы разрыва стенки сосуда, и показатели гемодинамики не нарушены, показано медикаментозное лечение, направленное, в первую очередь, на нормализацию артериального давления. Гипертония – главнейшая из причин, способствующая появлению и прогрессированию расслоения сосудистой стенки, поэтому всем без исключения пациентам при доказанном расслоении аорты назначается гипотензивная терапия:
Бета-адреноблокаторы (метопролол, лабеталол); Нитропруссид натрия (сосудорасширяющее средство) одновременно с бета-адреноблокаторами или блокаторами кальциевых каналов; Ингибиторы АПФ (эналаприл, каптоприл и т. д.); Блокаторы кальциевых каналов (верапамил, дилтиазем).

При хроническом стабильном течении расслоения врач подбирает индивидуально оптимальную схему и комбинацию лекарств, а в случаях прогрессирования и острого расслоения обычно используют нитропруссид натрия и бета-адреноблокаторы. Нитропруссид натрия считается оптимальным средством первой помощи для быстрого снижения давления у пациентов с расслоением аорты, вводится внутривенно капельно и позволяет поддерживать уровень давления не выше 100-120 мм рт. ст.
При прогрессировании патологии, развитии осложнений, угрожающих жизни, больному необходима срочная медицинская помощь и госпитализация. Для обезболивания используют ненаркотические и наркотические анальгетики (морфин). Если давление резко подает, показаны допамин, мезатон, а при его высоких цифрах – нитропруссид натрия. Как правило, эти препараты вводятся еще на догоспитальном этапе врачами скорой помощи.
При осложненных формах расслоения, остром развитии патологии, риске разрыва аневризмы показана срочная госпитализация в отделение сосудистой хирургии, где после стабилизации гемодинамики будет проводиться операция.
Хирургическое лечение показано больным с острым расслоением восходящего отдела аорты, при прогрессировании заболевания, отсутствии эффекта от проводимого консервативного лечения в случае хронических форм.
Особую опасность составляет поражение восходящего отдела аорты, при котором нередки гемоперикард, тяжелая гипотония, острая сердечная недостаточность, требующие незамедлительного вмешательства. Обычно в таких случаях проводят удаление пораженной части сосуда с последующим протезированием.

примеры протезирования (слева) и стентирования пораженного участка аорты
Хирургическая операция при расслоении аорты может быть в виде:
Иссечения поврежденного фрагмента сосуда с протезированием искусственными материалами; Удаления зоны надрыва со сближением концов сосуда.
При расслоении восходящей аорты нередко можно наблюдать различные изменения аортального клапана и сильную регургитацию (обратный ток крои). Для ликвидации гемодинамических нарушений после удаления расслоения может быть проведено протезирование аортального клапана, пластика его створок.
Вариантом неинвазивного лечения расслоения аорты считается стентирование, когда в сосуд вводится полая трубка (стент), по которой налаживается кровоток, либо баллонная ангиопластика, при которой раздувающийся баллон сдавливает стенку аорты в месте расслоения, препятствуя дальнейшему прогрессированию патологии.
При наличии доказанного расслоения аорты больному показано ограничение физической активности, строгий контроль цифр артериального давления, диета, направленная на нормализацию жирового и углеводного обмена. Диабетикам следует тщательно следить за уровнем сахара крови.
Прогноз при расслоении аорты зависит от степени изменения сосудистой стенки и локализации патологии. При усугублении расслоения, появлении осложнений и в отсутствие лечения смертность в течение первого года с момента диагностики заболевания достигает 90%. При острых состояниях на фоне расслаивающей аневризмы каждый пятый пациент умирает еще до приезда бригады скорой помощи.
Расслаивающаяся аневризма аорты, видео
Вывести все публикации с меткой: Аорта
Шаг 1: оплатите консультацию с помощью формы → Шаг 2: после оплаты задайте свой вопрос в форму ниже ↓ Шаг 3: Вы можете дополнительно отблагодарить специалиста еще одним платежом на произвольную сумму ↑
Читайте также:

