Какая валентность у водорода с хлором
I. Понятие “валентность”

Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н2О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н2О, NaH, NH3, CH4, HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:

Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
II. Правила определения валентности элементов в соединениях
Посмотрите видео по данной теме:

Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН4.
Пример 2. Определим валентность фосфорав соединении Р2О5.
Для этого необходимо выполнить следующие действия:
1. Над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. Умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. Разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
IV. Cоставление бинарных формулпо валентностям химических элементов

Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
V. Задания для закрепления
Задание №1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl
Задание №2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) цинка и хлора,
4) магния и серы.
Задание №3.
Используя материалы лекции составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
Задание №4
Определите валентность химических элементов по формулам их соединений:

Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:

Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
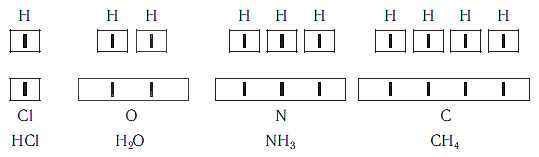
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:

Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
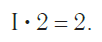
Так же определяют число единиц валентности атома кислорода:
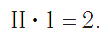
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
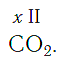
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
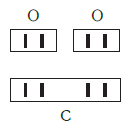
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
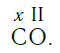
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.

Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
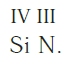
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
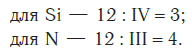
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Валентность определяет способность хлора присоединять к себе атомы других химических элементов.
Хлор, валентность которого имеет различные значения, располагается в седьмой группе, в главной подгруппе таблицы элементов. Выясним особенности строения атома этого галогена.
Хлор в нормальном состоянии
Валентность атомов хлора определяется особенностями строения его внешнего уровня. Данный элемент находится в 7(А) группе, имеет семнадцатый порядковый номер. Учитывая, что элемент является представителем четвертого периода, он имеет не только s-, p-, но и d-орбитали.
Электронная конфигурация атома
Какую электронную формулу имеет хлор? Валентность связана с особенностями внешнего энергетического уровня, поэтому запишем конфигурацию данного элемента.
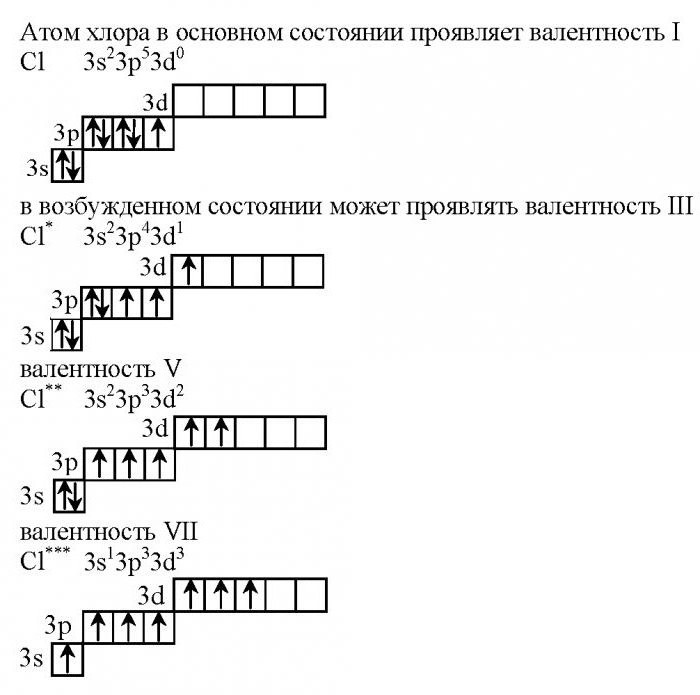
В невозбужденном состоянии на первом уровне у хлора располагаются всего два электрона, второй занимают восемь, на третьем уровне их 10 штук. Отметим, что на последнем уровне есть незаполненная d-орбиталь, которая и характеризует валентные возможности данного галогена.
- 1s22s22p63s23p53d0.
В данном случае валентность хлора равна I. Это характерно при взаимодействии с металлами (образуются хлориды). Высшую валентность VII хлор имеет в соединениях с неметаллами, например, в оксиде хлора (7), а также в хлорной кислоте.
Приведем в качестве примеров формулы соединений хлора, в которых он проявляет такую валентность: HClO4, Cl2O7.
Последний электронный уровень называют в неорганической химии валентным, так как именно он объясняет способность элемента вступать в химические взаимодействия с другими атомами.

Возбужденное состояние
Как ведет себя при нагревании хлор? Валентность его будет меняться в том случае, если атом будет находиться в возбужденном состоянии.
Учитывая тот факт, что у каждого энергетического уровня есть определенный запас энергии, электроны двух первых уровней не изменяют своего первоначального положения. Наблюдается переход одного p-электрона с 3p энергетического уровня на 3d-подуровень. Как будет при этом менять свое участие в химических реакциях хлор? Валентность его изменится, она будет равна трем.
Рассмотрим электронную конфигурацию, которую приобретет в этом случае хлор.
- 1s22s22p63s23p43d1.
Такая конфигурация не является устойчивой, поэтому соединения хлора, в которых он проявляет степень окисления +3, быстро разлагаются.
Так как на 3d-орбитали есть еще четыре свободные квантовые ячейки, возможен последующий переход электрона с 3p-подуровня, который приводит к образованию еще одной конфигурации атома хлора.
- 1s22s22p63s23p33d2.
В этом случае существует пять неспаренных электронов, поэтому хлор способен проявлять валентность V, степень окисления +5.
При максимальном разогревании атома хлора происходит переход электрона с 3s-подуровня на 3d-орбиталь. В этом случае хлор имеет максимальную валентность, равную семи.
- 1s22s22p63s13p33d3.
На внешнем энергетическом уровне у него располагается семь неспаренных электронов, поэтому валентность хлора в соединениях равна 7.
Распределение электронов по уровням, подуровням, их переход осуществляются в соответствии с правилом Хунда и принципом Паули.
Как в этом случае обозначается хлор? Валентность элемента принято указывать римскими цифрами, а возбужденное состояние атома отмечают звездочкой.
Заключение
Все затраты внутренней энергии, которые идут на процесс возбуждения атома хлора, полностью компенсируются той энергией, которая выделяется при образовании ковалентных связей. Это объясняет повышенную химическую активность хлора, находящегося в возбужденном состоянии. В своей максимальной степени окисления (+7) он проявляет свойства сильного окислителя.
Валентные возможности атома химического элемента не ограничиваются только количеством неспаренных электронов в стационарном и возбужденном виде. Например, при образовании связей в молекулах посредством донорно-акцепторного механизма, предполагают использование и свободных орбиталей.
Какие факторы влияют на валентные возможности атома хлора? Подводя итог, скажем, что в первую очередь необходимо отметить количество неспаренных электронов (незаполненные орбитали). Кроме того, в атоме должна быть свободная орбиталь, на которую будут при нагревании переходить электроны.

Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
Как находить валентность?
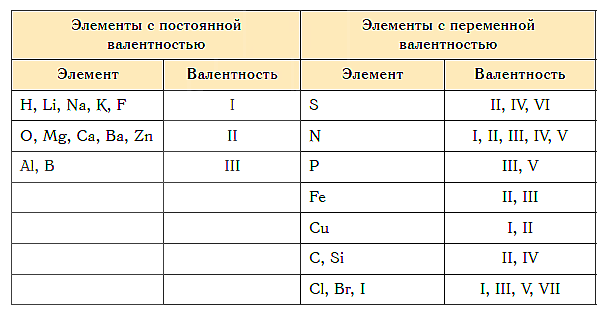
Первый вопрос, который волнует учеников 8 класса, начавших изучать химию – как определить валентность химических элементов? Валентность химического элемента можно посмотреть в специальной таблице валентности химических элементов

Рис. 1. Таблица валентности химических элементов
Валентность водорода принята за единицу, так как атом водорода может образовывать с другими атомами одну связь. Валентность других элементов выражаем числом, которое показывает, сколько атомов водорода может присоединить к себе атом данного элемента. Например, валентность хлора в молекуле хлористого водорода равна единице. Следовательно формула хлористого водорода будет выглядеть так: HCl. Так как и у хлора и у водорода валентность равна единице, никакой индекс не используется. И хлор и водород являются одновалентными, так как одному атому водорода соответствует один атом хлора.
Рассмотрим другой пример: валентность углерода в метане равна четырем, валентность водорода – всегда единица. Следовательно, рядом с водородом следует поставить индекс 4. Таким образом формула метана выглядит так: CH4 .
Очень многие элементы образуют соединения с кислородом. Кислород всегда является двухвалентным. Поэтому в формуле воды H2O, где встречаются всегда одновалентный водород и двухвалентный кислород, рядом с водородом ставится индекс 2. Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
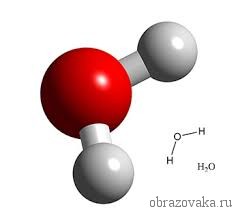
Рис. 2. Графическая формула воды
Не все химические элементы имеют постоянную валентность, у некоторых она может изменяться в зависимости от соединений, где используется данный элемент. К элементам с постоянной валентностью относятся водород и кислород, к элементам с переменной валентностью относятся, например, железо, сера, углерод.
Как определить валентность по формуле?
Если у вас перед глазами нет таблицы валентности, но есть формула химического соединения, то возможно определение валентности по формуле. Возьмем для примера формулу оксид марганца – Mn2O7

Рис. 3. Оксид марганца
Как известно, кислород является двухвалентным. Чтобы выяснить, какой валентностью обладает марганец, необходимо валентность кислорода умножить на число атомов газа в этом соединении:
Получившееся число делим на количество атомов марганца в соединении. Получается:
7 (VII) – валентность марганца в данном соединении
Что мы узнали?
В данной теме раскрывается информация о том, что такое валентность. Валентность – способность образовывать химические соединения посредством присоединения к атомам одного элемента атомов другого элемента. Валентность бывает постоянная и переменная. Зная валентность того или иного элемента, можно легко научиться записывать формулы соединений.
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.

Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | BeH2 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, CH4 |
| 7 | Азот / Nitrogen | N | III, IV | NH3 |
| 8 | Кислород / Oxygen | O | II | H2O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | PH3, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | H2S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | CaH2 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, TiH4 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, H3AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | H2SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, SbH3 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | TeH2, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | LaH3 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, PbH4 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Читайте также:

