Как взаимодействует карбонат калия с хлором
Реакции, взаимодействие калия. Уравнения реакции калия с веществами.










Калий реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, гидроксидами, солями, органическими соединениями и пр. веществами.
Реакции, взаимодействие калия с неметаллами. Уравнения реакции:
1. Реакция взаимодействия калия и кислорода:
Реакция взаимодействия калия и кислорода происходит в первом случае с образованием надпероксида калия, во втором – пероксида калия. Первая реакция представляет собой сжигание калия на воздухе . В ходе первой реакции также образуется примесь – пероксид калия K2O2. Вторая реакция протекает в жидком аммиаке.
2. Реакция взаимодействия калия и селена:
2K + Se → K2Se (t = 100-200 °C).
Реакция взаимодействия калия и селена происходит с образованием селенида калия.
3. Реакция взаимодействия калия и серы:
2K + S → K2S (t = 100-200 °C).
Реакция взаимодействия калия и серы происходит с образованием сульфида калия.
4. Реакция взаимодействия калия и кремния:
Реакция взаимодействия кремния и калия происходит с образованием силицида калия. Реакция протекает при сплавлении реакционной смеси.
5. Реакция взаимодействия калия и красного фосфора:
3K + P → K3P (t = 200 °C).
Реакция взаимодействия калия и красного фосфора происходит с образованием фосфида калия. Реакция протекает в атмосфере аргона.
6. Реакция взаимодействия калия и хлора:
Реакция взаимодействия калия и хлора происходит с образованием хлорида калия. Реакция протекает при комнатной температуре.
7. Реакция взаимодействия калия и водорода:
2K + H2 → 2KH (t = 200-350 °C).
Реакция взаимодействия калия и водорода происходит с образованием гидрида калия.
8. Реакция взаимодействия калия и брома:
Реакция взаимодействия калия и брома происходит с образованием бромида калия.
9. Реакция взаимодействия калия и иода:
Реакция взаимодействия йода и калия происходит с образованием иодида калия.
10. Реакция взаимодействия калия и фтора:
Реакция взаимодействия фтора и калия происходит с образованием фторида калия. Реакция протекает при комнатной температуре.
11. Реакция взаимодействия калия, кислорода и воды:
Реакция взаимодействия калия, кислорода и воды происходит с образованием гидроксида калия.
Реакции, взаимодействие калия с металлами и полуметаллами. Уравнения реакции:
1. Реакция взаимодействия калия и сурьмы:
Реакция взаимодействия калия и сурьмы происходит с образованием стибида калия. Реакция протекает при сплавлении реакционной смеси.
2. Реакция взаимодействия калия и теллура:
2K + Te → K2Te (t = 100-200 °C).
Реакция взаимодействия калия и теллура происходит с образованием теллурида калия.
3. Взаимодействие натрия и калия:
При сплавлении натрия и калия образуется жидкий натрий-калиевый сплав – NaK.
Реакции, взаимодействие калия с оксидами. Уравнения реакции:
1. Реакция взаимодействия калия и воды:
Реакция взаимодействия калия и воды происходит с образованием гидроксида калия и водорода. Реакция протекает бурно.
2. Реакция взаимодействия калия и оксида кремния:
Реакция взаимодействия калия и оксида кремния происходит с образованием кремния и силиката калия.
3. Реакция взаимодействия калия и оксида углерода:
Реакция взаимодействия калия и оксида углерода происходит с образованием углерода и карбоната калия.
4. Реакция взаимодействия калия и оксида бора:
Реакция взаимодействия калия и оксида бора происходит с образованием бора и метабората калия.
5. Реакция взаимодействия калия и оксида ванадия (III):
Реакция взаимодействия калия и оксида ванадия (III) происходит с образованием оксида ванадия (II) и пероксида калия.
Реакции, взаимодействие калия с гидроксидами. Уравнения реакции:
1. Реакция взаимодействия калия и гидроксида натрия :
NaOH + K → KOH + Na (t = 380-450 °C).
Реакция взаимодействия гидроксида натрия и калия происходит с образованием гидроксида калия и натрия.
2. Реакция взаимодействия калия и гидроксида калия :
2K + 2KOH → 2K2O + H2 (t = 450 °C).
Реакция взаимодействия калия и гидроксида калия происходит с образованием оксида калия и водорода.
Реакции, взаимодействие калия с солями. Уравнения реакции:
1. Реакция взаимодействия калия и хлорида ниобия:
NbCl5 + 5K → Nb + 5KCl.
Реакция взаимодействия хлорида ниобия и калия происходит с образованием калия и хлорида ниобия.
2. Реакция взаимодействия калия и фторида кремния:
SiF4 + 4K → Si + 4KF (t = 500 °C).
Реакция взаимодействия фторида кремния и калия происходит с образованием кремния и фторида калия.
3. Реакция взаимодействия калия и хлорида кремния:
SiCl4 + 4K → Si + 4KCl (t = 600-700 °C).
Реакция взаимодействия хлорида кремния и калия происходит с образованием кремния и хлорида калия.
4. Реакция взаимодействия калия и бромида кремния:
SiBr4 + 4K → Si + 4KBr (t = 100-150 °C).
Реакция взаимодействия бромида кремния и калия происходит с образованием кремния и бромида калия.
5. Реакция взаимодействия калия и хлорида иттрия:
YCl3 + 3K → Y + 3KCl.
Реакция взаимодействия хлорида иттрия и калия происходит с образованием иттрия и хлорида калия .
Реакции, взаимодействие калия с кислотами. Уравнения реакции:
1. Реакция взаимодействия калия и ортофосфорной кислоты:
6K + 2H₃PO₄ → 2K₃PO₄ + 3H₂.
Реакция взаимодействия калия и ортофосфорной кислоты происходит с образованием ортофосфата калия и водорода .
Аналогичные реакции протекают и с другими минеральными кислотами.
Реакции, взаимодействие калия с водородосодержащими соединениями. Уравнения реакции:
1. Реакция взаимодействия калия и сероводорода :
Реакция взаимодействия калия и сероводорода происходит с образованием гидросульфида калия и водорода . Реакция протекает в бензоле.
Аналогичные реакции протекают и с другими водородосодержащими соединениями.
Реакции, взаимодействие калия с органическими соединениями. Уравнения реакции:
1. Реакция взаимодействия калия и этанола:
Реакция взаимодействия калия и этанола происходит с образованием этанолята калия и водорода. Реакция протекает при комнатной температуре.
2. Реакция взаимодействия калия с другими органическими соединениями:
Калий реагирует также со спиртами, фенолами, карбоновыми кислотами с образованием солей.










- ← Масса Нептуна
- Рассчитать объем шара по радиусу или диаметру →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 879)
- Экономика Второй индустриализации России (101 437)
- Программа искусственного интеллекта ЭЛИС (22 597)
- Метан, получение, свойства, химические реакции (15 871)
- Мотор-колесо Дуюнова (15 082)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 437)
- Природный газ, свойства, химический состав, добыча и применение (13 907)
- Крахмал, свойства, получение и применение (13 489)
- Прямоугольный треугольник, свойства, признаки и формулы (13 040)
- Целлюлоза, свойства, получение и применение (11 891)
- Пропилен (пропен), получение, свойства, химические реакции (11 632)
- Этилен (этен), получение, свойства, химические реакции (11 145)
- Бутан, получение, свойства, химические реакции (9 829)
- Оксид алюминия, свойства, получение, химические реакции (9 353)
- Оксид железа (III), свойства, получение, химические реакции (9 129)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Серебристо-белый мягкий металл 
39,0983 а. е. м. (г/моль)
418,5 (4,34) кДж/моль (эВ)
| K | 19 |
| 39,0983 | |
| 4s 1 | |
| Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K
2Cl − − 2e − → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH − − 4e − → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
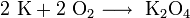
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
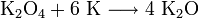
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
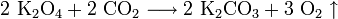
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
942ACC
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение:
1) Дегидрогалогенирование хлорбутана при действии спиртового раствора щелочи:
2) Окисление двойной связи бутена-1 подкисленным раствором перманганата калия (разрыв двойной связи):
3) Реакция этерификации – образование сложного эфира из спирта и карбоновой кислоты:
4) Щелочной гидролиз изопропилпропионата с образованием пропионата натрия и изопропилового спирта:
5) Сплавление соли пропионовой кислоты с щелочью с образованием этана и карбоната натрия:
372960
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Пояснение:
1) Из ацетата натрия метан получают по реакции декарбоксилирования, которая протекает при его сплавлении со щелочью, например, гидроксидом натрия:
2) При взаимодействии метана с хлором в мольном соотношении один к одному образуются преимущественно монохлорметан (Х1) и хлороводород:
3) При обработке монохлорметана водным раствором щелочи протекает нуклеофильное замещение атома хлора на гидроксильную группу с образованием метилового спирта (Х2):
4) Получить метаналь (формальдегид) из метилового спирта можно, действуя слабым окислителем – оксидом меди (II) при нагревании:
5) Перманганат калия, подкисленный серной кислотой, окисляет метаналь до углекислого газа и воды. При этом, так как среда раствора кислая, перманганат-ион восстанавливается до двухвалентного марганца:
D33737
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Пояснение:
1) При действии на пропанол-1 бромоводорода происходит реакция замещения гидроксильной группы в спирте на атом брома с образованием 1-бромпропана (Х1)
3) В кислой среде пропен может вступить в реакцию с водой в соответствии с правилом Марковникова – водород идет к наиболее гидрогенизированному атому, а гидроксильная группа к наименее гидрогенизированному. При этом образуется изопропиловый спирт:
Проблема в том, что по всей видимости, в этом задании банка ФИПИ, которое кстати попалось некоторым на досрочном экзамене ЕГЭ в апреле 2016-го, опечатка, и имелось ввиду 0 о С, а не нагрев.
995FCC
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) При действии на бромэтан водного раствора щелочи протекает нуклеофильное замещение атома брома на гидроксид-ион, при этом образуется этиловый спирт (Х1):
2) Этиловый спирт (Х1) можно превратить в уксусную кислоту, окислив его водным раствором перманганата калия в кислой среде при нагревании:
3) Уксусная кислота вступает в реакцию нейтрализации с щелочами, например, с гидроксидом натрия, при этом образуется ацетат натрия (Х2):
4) После выпаривания водного раствора ацетата натрия (Х2) и сплавления полученного твердого ацетата натрия с твердым гидроксидом натрия происходит реакция декарбоксилирования с образованием метана (X3) и карбоната натрия:
5) Пиролиз метана при 1500 о C приводит к образованию ацетилена (X4) и водорода:
1C6CBE
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) Пропилацетат, являясь сложным эфиром, подвергается щелочному гидролизу с образованием ацетата калия (X1) и пропанола:
2) Из ацетата калия по реакции декарбоксилирования, которая протекает при его сплавлении с щелочью, получают метан:
3) При температуре 1200 o C и быстром охлаждении (для предотвращения разложения ацетилена до простых веществ) метан разлагается на ацетилен (X2) и водород:
4) Димеризация ацетилена происходит в присутствии катализаторов – солянокислого раствора хлоридов меди (I) и аммония – с образованием винилацетилена:
5) При пропускании винилацетилена через бромную воду наблюдается обесцвечивание бромной воды за счет присоединения брома к кратным связям с образованием насыщенного бромпроизводного бутана – 1,1,2,2,3,4-гексабромбутана (X3):
26D1FD
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) В промышленности формальдегид получают окислением метана на катализаторе фосфате алюминия при температуре 450 o C и давлении 1-2 МПа:
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа формальдегида восстанавливается до гидроксильной, т.е. альдегид превращается в спирт – метанол (X1):
3) Металлический натрий взаимодействует с метанолом с образованием метилата натрия (X2) и выделением водорода:
4) Реагируя с соляной кислотой, метилат натрия обратно превращается в метанол (X1):
5) Перманганат калия в кислой среде при нагревании окисляет метиловый спирт до углекислого газа (X3) (Mn +7 → Mn +2 ; C -2 → C +4 ):
6C53D6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) В присутствии оксида алюминия при температуре 400 o C происходит дегидратация спирта с образованием этилена (X1) и воды:
2) Перманганат калия в нейтральной среде окисляет этилен до этиленгликоля (X2) (Mn +7 → Mn +4 ; 2C -2 → 2C -1 ):
3) При действии избытка бромоводорода на этиленгликоль происходит замещение гидроксильных групп на анионы брома, в результате чего образуется 1,2-дибромэтан (X3):
4) Этин (или ацетилен) можно получить действием на 1,2-дибромэтан спиртовым раствором щелочи:
5) По реакции М.Г. Кучерова в присутствии солей ртути в кислой среде (в водном или спиртовом растворе) ацетилен превращается в этаналь:
5B7666
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Получить ацетон (пропанон) можно по реакции М.Г. Кучерова, действуя на пропин (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе):
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа кетона восстанавливается до гидроксильной, т.е. кетон превращается во вторичный спирт – изопропанол (X2):
3) При действии бромоводорода на изопропанол происходит нуклеофильное замещение гидроксильной группы на анион брома, в результате чего образуется 2-бромпропан:
4) При действии спиртового раствора щелочи 2-бромпропан превращается в ненасыщенный углеводород – пропилен (X3):
5) Дегидрированием пропилена на катализаторе (Pt, Pd, Ni) можно получить пропин (X1):
EE403A
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Получить бромметан можно действием брома на метан (X1) на свету. Реакция замещения протекает по свободнорадикальному механизму:
2) При взаимодействии бромметана с аммиаком вначале образуется соль амина, которая при избытке аммиака превращается в свободный амин. В случае метиламина образуются метиламин (X2) и бромид аммония:
3) Азотистая кислота неустойчива, поэтому ее получают в ходе реакции, действуя на подкисленный раствор амина нитритом натрия. В случае первичного амина – метиламина - наблюдается выделение азота, а в растворе образуется метанол (X3):
4) Действием на метиловый спирт оксидом меди (II) при нагревании получим формальдегид, при этом Cu +2 восстановится до Cu 0 :
5) При окислении формальдегида перманганатом калия в кислой среде выделяется углекислый газ (X4) (Mn +7 → Mn +2 ; C 0 → C +4 ):
11E9DF
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Алканы с основной цепью 6 и более атомов углерода способны вступать в реакцию дегидроциклизации, при этом образующийся шестичленный цикл далее дегидрируется и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода. В данном случае образующийся циклогексан дегидрируется в бензол (X1):
2) Алкилирование ароматических углеводородов алкилгалогенидам и в присутствии безводного AlCl3является классическим примером реакции Фриделя-Крафтса. Реакция представляет собой электрофильное замещение в бензольном кольце. Алкилирование бензола метилхлоридом приводит к образованию толуола (X2):
3) При действии на толуол избытком хлора на свету все атомы водорода в метильном радикале толуола замещаются на хлор. Реакция замещения протекает по свободнорадикальному механизму:
4) При щелочном гидролизе тригалогенидов с атомами хлора при одном атоме углерода с высокими выходами образуются соли карбоновых кислот (в данном случае бензоат калия (X3)):
AC20AD
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) 1,2-дихлорэтан является геминальным дихлорпроизводным этана. В условиях водного раствора щелочи 1,2-дихлорэтан превращается в карбонильное соединение – ацетальдегид:
2) При восстановлении карбонильных соединений водородом образуются спирты. Так, пропуская смесь паров ацетальдегида и водорода над никелевым катализатором, можно получить этанол (X1):
3) Замещение гидроксильной группы спирта на аминогруппу происходит в жестких условиях. Пропуская пары этанола и аммиак над нагретым оксидом алюминия, получают этиламин:
4) При пропускании через водный раствор этиламина углекислого газа происходит образованием гидрокарбоната этиламмония (X2):
5) При нагревании гидрокарбонат этиламмония разлагается на углекислый газ, этиламин (X3) и воду:
Примечание: правильным может считаться вариант, в котором веществом Х2 является не гидрокарбонат, а карбонат этиламмония.
7EAE60
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Ацетилен (этин) вступает в реакцию гидратации в присутствии солей ртути в водном растворе с образованием ацетальдегида (реакция Кучерова) (Х1):
2) Ацетальдегид при действии на него подкисленного водного раствора перманганата калия превращается в уксусную кислоту:
3) Уксусная кислота вступает в реакцию нейтрализации с гидроксидом натрия, при этом образуется ацетат натрия (Х2) и вода:
4) Ацетат натрия взаимодействует с галогеналканами с образованием сложных эфиров, в данном случае образуется метиловый эфир уксусной кислоты (метилацетат)(Х3):
5) Сложные эфиры в присутствии кислот могут вступать в реакцию гидролиза. При гидролизе метилацетата в кислой среде образуется уксусная кислота и метанол:
7E4C51
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии спиртового раствора щелочи на любой из изомеров дибромэтана образуется ацетилен (X1):
2) Действуя на ацетилен (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетальдегид (X2) (реакция М.Г.Кучерова):
3) При окислении ацетальдегида перманганатом калия в кислой среде образуется уксусная кислота (Mn +7 → Mn +2 ; C +1 → C +3 ):
4) Получить хлоруксусную кислоту можно действием хлора на уксусную кислоту на свету. Реакция замещения протекает по свободнорадикальному механизму, в результате чего атом водорода при алкильном радикале замещается на хлор (X3):
5) При обработке хлоруксусной кислоты аммиаком образуется аминокислота – глицин:
39882С
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При температуре выше 140 0 C в присутствии концентрированной серной кислоты спирты подвергаются внутримолекулярной дегидратации с образованием алкена и воды. В данном случае при 180 0 C и действии конц. H2SO4 пропанол-1 превращается в пропилен (X1):
3) При действии спиртового раствора щелочи на 1,2-дибромпропан образуется пропин:
4) Действуя на пропин водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетон (X3) (реакция М.Г.Кучерова):
5) Пропуская смесь паров ацетона и водорода над палладиевым катализатором, получают пропанол-2 (или изопропанол) (X4):
A8F8C2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Циклопропан присоединяет бромоводород с раскрытием цикла, в результате чего образуется 1-бромпропан:
2) В лабораторных условиях алканы получают по реакции Вюрца из галогеналканов. Частичный положительный заряд на атоме углерода при галогене в галогенопроизводных делает возможной реакцию этих соединений с активными металлами. Моногалогеналканы уже при комнатной температуре взаимодействуют с натрием, превращаясь в алканы с удвоенным углеродным скелетом. Таким образом, из двух молекул 1-бромпропана получается н-гексан (X1):
3) Алканы, имеющие в молекуле шесть и более атомов углерода, могут вступать в более сложные реакции дегидрирования, в ходе которых отщепление водорода сопровождается замыканием цепи в цикл: реакции дегидрирования – циклизации. В данном случае гексан превращается в бензол (X2):
4) Толуол получают алкилированием бензола метилгалогенидом в присутствии катализатора AlCl3 (электрофильное замещение, механизм SE):
5) Метильная группа толуола окисляется перманганатом калия в кислой среде до карбоксильной группы, следовательно, толуол превращается в бензойную кислоту (X3) (Mn +7 → Mn +2 ; C -3 → C +3 ):
92C355
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) В лабораторных условиях пропан можно получить по реакции Вюрца из галогеналканов – хлорэтана и хлорметана, однако данная реакция сопряжена с образованием двух побочных продуктов – бутана и этана. Моногалогеналканы при комнатной температуре способны взаимодействовать с натрием:
2) Дегидрированием пропана на катализаторе (Pt, Pd, Ni) можно получить пропилен (X1):
3) При окислении алкена перманганатом в нейтральной среде на холоду образуется двухатомный спирт, щелочь и оксид марганца (IV). В данном случае из пропилена образуется пропандиол-1,2 (X2) (Mn +7 → Mn +4 ; C -2 → C -1 , C -1 → C 0 ):
4) Многоатомные спирты способны вступать в реакции нуклеофильного замещения с галогеноводородами. Действуя избытком бромоводорода на пропандиол-1,2 получается 1,2-дибромпропан (X3):
5) При действии спиртового раствора щелочи на дигалогеналкан – 1,2-дибромпропан – образуется пропин (X4):
Читайте также:

