Как убить бессмертную раковую клетку
Рак остается одним из самых сложных для лечения заболеваний, от которого не существует одного эффективного лекарства. При этом в многочисленных исследованиях, посвященных поиску эффективных средств от недуга, не раз упоминаются определенные продукты питания, которые разными исследователями считаются эффективными для уничтожения раковых стволовых клеток.

Это очень важно, потому что именно тот факт, что химиотерапия не уничтожает раковые стволовые клетки, считается причиной того, что у онкологических пациентов случаются рецидивы и появляются метастазы. Эти клетки, иногда называемые "материнскими клетками", составляют лишь небольшую часть всех клеток опухоли, но они имеют способность самовосстанавливаться и сопротивляются химиотерапии. Они также могут отделяться и создавать новые колонии опухолей, поэтому их уничтожение является ключом к эффективному лечению рака в долгосрочной перспективе.
Лекарств, нацеленных конкретно на эти клетки, нет, но исследователи обнаружили множество природных веществ, способных бороться с этими клетками. Naturalnews. com перечислил продукты, которые являются лучшими "убийцами" раковых клеток.
Зеленый чай
Зеленый чай уже давно используется в китайской медицине для лечения множества недугов, но только недавно исследователи раскрыли его невероятный потенциал для лечения рака. Исследователи из медицинского центра Бэйлорского университета обнаружили, что активный ингредиент зеленого чая, EGCG (epigallocatechin-3-gallate), убивает раковые стволовые клетки и, следовательно, может помочь в случаях, когда образование не поддается химиотерапии. Хотя EGCG присутствует также в черном чае, в зеленом чае его концентрация выше.
Имбирь
Доклиническое исследование показывает, что один из компонентов имбиря дает в 10 000 раз большую эффективность в борьбе со стволовыми клетками при раке молочной железы, чем популярный препарат Таксол. Компонент, который известен как 6-Shogaol, выделяется, когда корень имбиря сварен или высушен, и его концентрация, необходимая для умерщвления раковых клеток, для клеток здоровых не опасна, в отличие от традиционных препаратов, применяемых в таких случаях.
Куркума
Куркумин, компонент древней индийской специи куркума, может выборочно влиять на стволовые раковые клетки без риска воздействия на здоровые стволовые клетки, необходимые для регенерации ткани. Это вещество эффективно при раке молочной железы, раке поджелудочной железы, колоректальном раке и раке головного мозга.
Ягоды винограда
Вещество resveratrol, которое находится в коже и семенах ягод винограда, наносит "смертельный" удар по стволовым клеткам рака толстой кишки. Таковы выводы ученых из Пенсильванского университета. Они верят, что в будущем это открытие поможет научиться предотвращать рак толстой кишки, который является одним из самых распространенных ныне типов рака. Когда во время эксперимента resveratrol и выдержка из семени винограда принимались одновременно, их воздействие было чрезвычайно мощно, и при этом они не повредили здоровым клеткам.
Другие продукты, которые убивают раковые стволовые клетки
Хотя вышеозначенные продукты — одни из самых мощных противораковых природных лекарств, есть и много других со сходным эффектом. Среди них — черника, морковь, кофе, грейпфрут, мята, вишня, лук, черный перец и тимьян.
Обилие продуктов, которые могут иметь большое влияние на рак, напоминает нам, насколько эффективно и безопасно природа может помочь справиться с серьезными недугами нашего времени. Многие врачи не очень хорошо разбираются в теме, у иных же есть финансовые мотивы, чтобы продолжать настаивать на дорогих и часто опасных лекарствах. По этой причине есть большой смысл расширять свой кругозор и узнавать, что, помимо лекарственной помощи, доступно нам в борьбе с серьезными заболеваниями.
Эта статья — о причинах возникновения, закономерностях развития и путях лечения онкологических болезней, а также о тех трудностях, с которыми сталкиваются ученые-онкологи при разработке новых средств и методов лечения рака. Но вначале стоит вспомнить некоторые основные понятия.
Несколько слов про опухолевые клетки
Человеческий организм состоит примерно из 100 триллионов клеток. Изменение этого количества всегда физиологически оправданно. Например, при воспалении увеличивается число белых клеток крови (лейкоцитов), которые противостоят возбудителям инфекции. При интенсивных физических нагрузках возрастают количество мышечных клеток и мышечная масса. Процесс поддержания оптимальной численности клеток — клеточный гомеостаз — осуществляет сложная система контроля клеточных делений (пролиферации) и клеточной гибели.
В здоровом и нормально функционирующем организме ежесекундно погибает огромное количество клеток, столько же образуется вновь. Но иногда процесс клеточного гомеостаза выходит из-под контроля и возникает опухоль.
Опухолью называют патологическое разрастание ткани, состоящее из качественно измененных (атипичных) по морфологии, степени дифференцировки и характеру роста клеток. Не всякое увеличение объема ткани представляет собой опухоль. Отек, например, связан не с разрастанием клеток, а с накоплением межклеточной жидкости, гипертрофированные мышцы культуриста — адаптация организма к длительным физическим нагрузкам. Эти изменения преходящи: после снижения мышечных нагрузок дополнительная ткань подвергается инволюции (то есть рассасывается). Появление опухоли с адаптацией не связано, и инволюции она не подвержена. Опухоль, в отличие от нормальной ткани, не имеет выраженной структуры, ее строение в той или иной степени беспорядочно. Она образована клетками, которые не завершают дифференцировку и несут признаки юных, а часто и эмбриональных форм.
Если рост опухоли не ограничен собственной тканью и органом, а оторвавшиеся от основного узла атипичные клетки мигрируют в соседние и отдаленные органы, вызывая появление там вторичных опухолевых узлов (метастазов), то такая опухоль злокачественна.
Помимо способности образовывать метастазы, то есть существовать вне привычного клеточного окружения, для раковых клеток характерно неуправляемое деление, причем делиться они могут неограниченное количество раз, не обнаруживая при этом признаков старения, и в значительной мере утрачивают способность к программированной клеточной гибели. Именно совокупность всех этих признаков и отличает раковую клетку от нормальной.
Опухолевая трансформация клетки происходит, когда она накапливает некоторое количество мутаций, причем не любых, а критических для канцерогенеза. Пока ученые точно не знают, сколько мутаций и в каких именно генах должно произойти, чтобы клетка стала опухолевой. Очевидно, никак не меньше пяти, а по самым оптимистическим прогнозам 8–10. Важно, что речь идет не о каком-то определенном наборе мутаций: их комбинации, определяющие опухолевую трансформацию, могут быть самыми разными. С молекулярно-генетической точки зрения не существует двух совершенно одинаковых опухолей, как и совершенно одинаковых причин их возникновения. Уникальность каждой опухоли намного превышает уникальность дактилоскопических узоров.
Ежедневно в человеческом организме возникают сотни тысяч мутантных клеток. Их постоянно отслеживают и уничтожают две системы контроля: система клеточного генетического самоконтроля, о которой шла речь выше, и система неспецифического противоопухолевого иммунитета.
Исполнительный механизм системы противоопухолевого иммунитета сопряжен с механизмом обеспечения генетического самоконтроля. Это означает, что клетка, которая в результате мутации станет невосприимчива к действию одной системы контроля, будет неуязвима и для другой. Потомки такой клетки унаследуют приобретенный признак и положат начало формированию мутантного клона — способность ускользать от системы генетического самоконтроля позволит и в дальнейшем избегать гибели при тиражировании вновь появившихся мутаций. Эти клетки еще нельзя назвать опухоле-трансформированными, поскольку они пока не приобрели всех необходимых для этого генетических дефектов, но начало положено: мутаторный фенотип открыл простор для дальнейшего накопления мутаций.

Возникнув, опухолевая ткань не только безудержно растет вследствие бесконтрольного деления составляющих ее клеток, но и постоянно эволюционирует, порождая новые клеточные клоны, наиболее злокачественные из которых, то есть лучше приспособленные к автономному существованию, в процессе конкурентной борьбы вытесняют менее злокачественные. Остановить такую экспансию можно, лишь удалив опухоль из организма или, по крайней мере, ограничив ее рост.
Лечение онкологических заболеваний
Сегодня существует три основных метода лечения раковых больных: хирургическое удаление опухолевых узлов, химиотерапия и радиолучевая терапия, причем в подавляющем большинстве случаев их приходится комбинировать.
Хирургическое вмешательство эффективно лишь тогда, когда процесс локализован и иссечение опухоли в пределах здоровых тканей не разрушает функционирование жизненно важных органов. В иных случаях, а также если первичный опухолевый очаг вовсе отсутствует, например, при лейкозах, применяют химиотерапию, которая теоретически должна поражать опухолевые клетки вне зависимости от их локализации.
Открытие каждого нового класса химических соединений, обладающих противоопухолевой активностью, вызывало всплеск оптимизма, но всякий раз результаты оказывались значительно скромнее ожиданий. Первые лекарства от рака либо химически повреждали молекулы ДНК и белков (алкилирующие соединения: эмбихин, мелфалан, метилнитрозомочевина, циклофосфамид и др.), либо препятствовали процессу удвоения нити ДНК (антиметаболиты, первые из которых, метотрексат и 5-фторурацил, созданные в 1949 и 1956 годах соответственно, до сих пор применяют в онкологии). Позднее появились препараты, поражающие другие внутриклеточные мишени: противоопухолевые антибиотики (доксорубицин, блеомицин), вещества растительного происхождения (винбластин, паклитаксел, этопозид), комплексные соединения платины (цисплатин, карбоплатин). Несмотря на то что эти химические соединения действуют в клетках на самые разные молекулярные мишени, их объединяет способность избирательно подавлять рост и вызывать гибель опухолевых клеток при относительно малом повреждении клеток нормальных тканей. Параллельно с поиском новых противоопухолевых препаратов шло изучение молекулярных механизмов действия на клетку уже найденных и применявшихся на практике лекарств. По мере развития представлений о механизмах противоопухолевой активности разных препаратов стало очевидным, что вопрос о низкой эффективности химиотерапии опухолей неразрывно связан с другим, не менее актуальным. По словам академика Н. Н. Трапезникова, многие годы возглавлявшего Онкологический научный центр после Н. Н. Блохина, если раньше онкологи ставили вопрос, почему не действуют лекарственные препараты, то сейчас вопрос ставится иначе: а почему они действуют? Ответ на последний вопрос был найден совсем недавно.
Однако избирательность химиопрепаратов не абсолютна: в процессе лечения они наряду с опухолевыми часто поражают нормальные клетки, в первую очередь быстро обновляющихся тканей: костного мозга, эпителия желудочно-кишечного тракта и волосяных фолликулов кожи. Но если поражение фолликулов вызывает только облысение — досадный, однако временный косметический дефект, то массовая гибель клеток эпителия и костного мозга представляет реальную угрозу жизни пациентов.
Однако если действие противоопухолевых лекарств направлено именно на активацию программы клеточной гибели, то следует предположить, что раковая клетка, в которой генетическая программа ее собственной смерти повреждена или вовсе утрачена, должна оказаться устойчивой к действию всех известных препаратов. Доказательство такого предположения неожиданно было получено в нашей лаборатории в Онкологическом центре.
Клетки А4
В самом начале текущего века мы изучали активацию программы клеточной гибели моноклональными антителами к одному из рецепторов смерти, Fas. Этот рецептор появляется на поверхности зрелых лимфоцитов, а также присутствует на некоторых видах злокачественных лимфобластных клеток. Мы использовали моноклональные антитела к этому рецептору, которые имитируют действие природного лиганда FasL, возбуждают рецептор и активируют сигнал клеточного самоубийства. Для экспериментов мы выбрали хорошо известную линию Т-лимфобластных клеток человека Jurkat, выделенных много лет назад из крови больного лейкозом мальчика, на поверхности которых присутствует рецептор Fas. Добавление в питательную среду aнти-Fas-моноклональных антител вызывает быстрое развитие апоптоза этих клеток. Нам нужно было получить культуру, в которой клетки были бы лишены этого рецептора или чтобы рецептор оказался неработающим, то есть клетки, полностью устойчивые к действию анти-Fas-антител. Для этого мы использовали известный прием клеточной селекции, выращивая культуру в присутствии микроскопических концентраций антител. По мере роста культуры концентрацию антител постепенно увеличивали, пока не получили клетки, прекрасно растущие в среде с антителами. Поскольку полученная в результате этого эксперимента культура первоначально росла в чашке с номером А4, мы ее так и назвали — А4, еще не предполагая, что это чисто рабочее название присвоено совершенно уникальной клеточной линии.
По своему внешнему виду и набору поверхностных антигенов клетки А4 сходны с родительскими клетками Jurkat, но не имеют рецептора Fas, поэтому анти-Fas-антитела не стимулируют их гибель. Этот результат не был неожиданностью. Озадачивало другое: полученный клон в полной мере сохранил присущую родительской линии экспрессию рецепторов смерти других типов: АРО-2 для лиганда TRAIL и TNFR-1 для цитокина TNFa, однако применение этих лигандов не вызвало у клеток А4 никаких признаков апоптоза, хотя каждый из них активировал программу гибели родительских клеток Jurkat. Объяснение этому феномену могло быть только одно: устойчивость клеток А4 к апоптозу обусловлена не отсутствием соответствующего рецептора смерти, а нарушениями в каскаде последующих реакций передачи апоптозного сигнала.
Из наших результатов следует, что стимулы самой различной природы, активирующие программу клеточной гибели опухолевых клеток Jurkat, практически не вызывают апоптоз клеток клона А4. Означает ли этот факт, что клетки А4 нельзя убить? Разумеется, нет. Клетки А4 можно умертвить, но такой дозой лекарства, которая несовместима с жизнью пациента. На родительскую линию Jurkat цитостатики действуют в концентрациях на один-два порядка ниже. Другими словами, не способные к апоптозу клетки А4 проявляют фенотип множественной лекарственной устойчивости.

Чтобы выяснить, как клеточная культура реагирует на то или иное лекарство, ее обычно обрабатывают препаратами в концентрации, вызывающей гибель ровно половины клеток (LD50), и наблюдают за судьбой второй половины, пережившей токсическую атаку. В дальнейших исследованиях мы выращивали клетки обеих линий в среде с цитостатиками цисплатином, доксорубицином или этопозидом (каждое из этих лекарств вызывает апоптоз клеток Jurkat). Для клеток А4 концентрации лекарств LD50 были в 30–100 раз выше. Подсчет и морфологический анализ клеток, переживших цитотоксическую атаку, показал, что клетки Jurkat погибают в основном по механизму апоптоза, а клетки А4 — путем некроза, безвременной и неестественной кончины клетки, попавшей в невозможные для жизни условия; их ядро и цитоплазма набухают, а затем разрываются ядерная и клеточная мембраны. Различной оказалась и судьба потомков выживших в этих условиях клеток обеих линий: после пересева в полную питательную среду клетки Jurkat восстановили исходный облик и скорость роста через три недели, хотя в культуре было еще довольно много умирающих клеток. Потомки клеток А4 даже спустя три недели культивирования продолжали гибнуть в огромном количестве. В их популяции появились как многоядерные клетки, так и клетки с микроядрами — результат неравномерного распределения генетического материала в процессе деления.
Клетки Jurkat, служившие исходным материалом в нашем исследовании, не экспрессируют белок р53, поэтому их геном достаточно изменчив и склонен к накоплению дополнительных мутаций. Вероятно, клетки А4, отобранные из общей популяции в результате Fas-опосредованной селекции, представляют собой клон, появившийся в результате одной или нескольких таких мутаций, природа которых пока не установлена. Собственно, она и не важна и, скорее всего, представляет лишь один из множества возможных вариантов. Важен результат: утратив программу клеточной гибели, клетки А4 получили возможность выжить в присутствии таких высоких концентраций противоопухолевых лекарств, которые больной перенести не может, следовательно — формировать опухолевую ткань, абсолютно устойчивую к лекарственному лечению.
Поскольку клон А4 сформировался спонтанно, можно предположить, что и у онкологических больных клетки, утратившие программу клеточной гибели, могут возникать на разных этапах прогрессии опухоли, независимо от того, какими лекарствами их лечат. И весь имеющийся арсенал специфических противоопухолевых средств оказывается бессильным перед таким клоном.
Эта ситуация — печальное следствие применяемой до настоящего времени методологии отбора новых противоопухолевых лекарств, при которой используют клеточные линии, в большей или меньшей степени сохраняющие способность к программированной гибели. В результате такого скрининга отбирают наиболее эффективные индукторы апоптоза, которые не представляют реальной опасности для опухолевых клеток, утративших к нему способность.
Мы полагаем, что полученная нами линия клеток А4, а также подобные ей, могут оказаться полезными моделями для поиска принципиально новых противоопухолевых средств, действие которых не ограничится активацией апоптоза. Конечно, существует опасность побочного влияния таких веществ и на клетки нормальных тканей, ведь мутации будут возникать и в их геномах. Но, в отличие от опухолевых, в них продолжает функционировать механизм генетического самоконтроля, не позволяющий тиражировать генетические дефекты в следующих поколениях. Насколько перспективным окажется использование в лечебных целях супермутагенов, покажет будущее.
Для того чтобы вылечиться от рака и предотвратить рецидив, необходимо убить стволовые раковые клетки. Известно, что ни химиотерапия, ни лучевая терапия не могут убить стволовые раковые клетки, в том числе поэтому после их прохождения так часто встречаются случаи рецидивов. Стволовые раковые клетки провоцируют развитие рака и, если от них не избавиться, болезнь будет возвращаться снова и снова.
Не существует лекарств, которые могли бы убить стволовые раковые клетки. Это возможно достичь только натуральными способами и при помощи альтернативных методов борьбы с раком.
Ниже перечислен список веществ и продуктов, содержащих эти вещества:
- Эпигаллокатехин-3-галлат (EGCG) — зеленый чай
- 6-гингерол — Имбирь
- β-каротин — Морковь, листовая зелень
- Байкалейн — Китайский шлемник
- Куркумин — Куркума
- Циклопамин — Кукуруза Лилли [употреблять в пищу это растение нельзя; это просто пример существования природных компонентов, которые убивают раковые стволовые клетки]
- Дельфинидин — Черника, малина
- Флавоноиды (генистеин) – Соя (почти 98% сои в мире – ГМО, будьте осторожны и не принимайте сою, если на ней не написано, что она органическая), красный клевер
- Госсипол — Хлопковое семя [употреблять в пищу это растение нельзя; это просто пример существования природных компонентов, которые убивают раковые стволовые клетки]
- Гуггулстероне — Коммифора мирровая
- Изотиоцианаты — Крестоцветные овощи
- Линалоол — Мята
- Ликопин — Грейпфрут, помидор
- Партенолид — Пиретрум
- Периловый спирт — Мята, вишня, лаванда
- Пиперин — Черный перец
- Плацикодон сапонин — Playycodon grandifloruim
- Псоралидин — Psoralea corylilyfolia
- Кверцетин — Каперсы, лук, гречка
- Ресвератрол — Виноград, сливы, ягоды
- Салиномицин — Streptomyces albus
- Силибинин — Расторопша
- Урсоловая кислота — Тимьян, базилик, орегано
- Витамин D3 — Рыба, масло печени трески (лучше принимать в виде витамина)
- Витхаферин А — Withania Somnifera (Ашваганда)
Убедитесь, что вы регулярно употребляете эти продукты. Это может значительно улучшить ваше здоровье вне зависимости от того, болеете вы раком или нет.
Стволовые раковые клетки устойчивы к химиотерапии и лучевой терапии, они на них не реагируют. Более того, химиотерапия и, особенно, лучевая терапия способны увеличивать количество и вирулентность стволовых раковых клеток в опухоли, обладая при этом хорошо известным побочным эффектом дальнейшего повреждения иммунной системы пациента. А для того чтобы побороть рак организму нужна очень сильная иммунная система.
Несмотря на то, что онкологическая индустрия ничего не делает для того чтобы побороть стволовые раковые клетки (что является крайне неэтичным), в Америке и Европе растет число практикующих врачей и клиник, которые не отворачиваются от правды и заинтересованы в альтернативных способах профилактики и лечения рака с использованием пищевых и / или растительных подходов.
Вы можете посмотреть список клиник, которые помогают пациентам победить рак альтернативными методами, в разделе сайта КЛИНИКИ.
Истории пациентов, победивших рак альтернативными методами, можно почитать в разделе ИСТОРИИ ИСЦЕЛЕНИЯ.
- 26187
- 21,0
- 19
- 4
Известная клеточная линия HeLa получена из клеток, взятых у раковой пациентки по имени Генриетта Лакс, умершей в 1951 году. Линия клеток HeLa используется для исследования раковых и других заболеваний.
![]()
Анна Старокадомская
![]()
Антон Чугунов![]()
Андрей Панов
- Личность
- Медицина
- ОколоНауки
Генриетта Лакс

Рисунок 1. Генриетта Лакс с мужем Дэвидом.
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Вирджинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта Лакс обратилась в госпиталь Джонса Хопкинса — её беспокоили странные выделения, которые она периодически обнаруживала на своём нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиационное облучение, она умерла. Ей был 31 год.
Пока Генриетта находилась в госпитале Хопкинса, лечащий врач отправил её опухоль (цервикальная биопсия) на анализ Джорджу Гею (George Gey) — начальнику лаборатории исследования клеток тканей в госпитале Хопкинса. Напомним, что в то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была предопределённая гибель клеток — после определенного количества делений вся клеточная линия погибала.
Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с её клетками, и заявил, что началась новая эпоха в медицинских исследованиях — эпоха новых перспектив в поиске лекарств и исследовании жизни.
Почему её клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать всё новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили учёных культивировать сотни других линий раковых клеток. И, хотя до сих пор не найдено условий для культивирования нетрансформированных клеток, раковые клетки в большинстве своём являются адекватной моделью для поиска ответов на вопросы, задаваемые учёными и медиками.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком (Jonas Salk). Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надёжности своего лекарства сначала вколол вакцину себе, своей жене и троим детям.
С момента смерти Генриетты Лакс клетки её опухоли непрерывно использовалась для исследования таких заболеваний как рак, СПИД, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В биомедицинском мире клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Кстати, даже сегодня поражает размах экспериментов, проводимых тогда советскими генетиками в космосе (см. врезку).
Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости. С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке ядер перед клонированием знаменитой овцы Долли проводились на HeLa), и для составления генетических карт, и для отработки искусственного оплодотворения, и тысяч других исследований (см. рисунок 2).

Рисунок 2. Исследования, проведённые с помощью клеток линии HeLa.
Космическая генетика в СССР
На третьем космическом корабле-спутнике (01.12.1960 г.) в полёт отправились ещё больше живых объектов: две собаки — Пчёлка и Мушка, две морские свинки, две белые лабораторные крысы, 14 чёрных мышей линии С57, семь мышей-гибридов от мышей СБА и С57 и пять белых беспородных мышей. Там же поместили шесть колб с высокомутабельной и семь колб с низкомутабельной линиями дрозофил, а также шесть колб с гибридами. Кроме того, две колбы с мухами были покрыты дополнительной защитой — слоем свинца толщиной 5 г/см 2 . Помимо этого на корабле находились семена гороха, пшеницы, кукурузы, гречихи, конские бобы. В специальном лотке летали проростки семян лука и нигеллы. На борту корабля имелись несколько пробирок с актиномицетами, ампулы с культурой ткани человека в термостате и вне термостата, шесть пробирок с хлореллой в жидкой среде. В эбонитовых патронах находились запаянные ампулы с бактериальной культурой кишечной палочки и двумя разновидностями фага — Т3 и Т4. В специальных устройствах содержались культура клеток HeLa, лёгочная амниотическая ткань человека, фибробласты, клетки костного мозга кролика, а также контейнер с икрой и спермой лягушки. Были размещены также вирусы табачной мозаики различных штаммов, вирус гриппа.
Помимо науки.
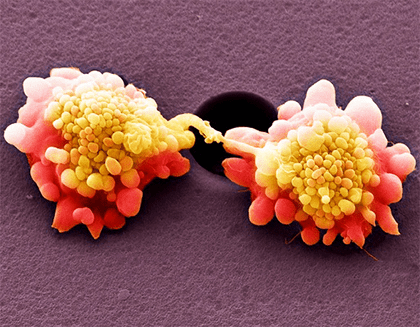
Рисунок 3. Клетки HeLa под сканирующим микроскопом в псевдоцветах.
Steve Gschmeissner / Science Photo Library
Личность самой Генриетты Лакс долгое время не афишировалась. Доктор Гей, конечно, знал о происхождении клеток HeLa, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что это именно её клетки прославились на весь мир. После смерти доктора Гея в 1970 году тайна раскрылась. Это случилось следующим образом. Напомним, что стандарты стерильности и техники работы с клеточными линиями только зарождались, и некоторые ошибки всплывали только спустя годы. Так и в случае с клетками HeLa — спустя 25 лет учёные выяснили, что множество клеточных культур, происходящих из других типов тканей, включая клетки молочных желез и предстательной железы, оказались заражёнными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках, и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирования генома, напомним, тогда ещё не изобрели), одна группа учёных разыскала родственников Генриетты и попросила дать им образцы ДНК семьи для того, чтобы составить карту генов. Таким образом тайное и стало явным.
Кстати, сейчас американцы переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. Плюс, и по сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры не хотят поддерживать разговор.
Реальное бессмертие?
Сколько в человеческом организме клеток, не знает никто. Публикуемые в научных работах шести-, семи-, а то и восьмизначные цифры обозначают лишь приблизительную вероятность, но не реальное количество. Гораздо точнее наука установила разницу между ними - клетки сердца, легких, печени, почек, любых тканей отличаются друг от друга белками, из которых состоят, ферментами, участвующими в их функционировании, генами в их ДНК. И в "чужом" органе они работать не будут. Исключение составляют так называемые стволовые клетки, но не о них сейчас речь.
Но есть одно свойство, присущее всем клеткам, - свойство, за которое ученый с мировым именем академик РАН Владимир Скулачев образно назвал их камикадзе, - готовность в любой момент прибегнуть к "самоубийству" - запрограммированной клеточной смерти, называемой апоптозом. Название придумал древнеримский врач Гален, наблюдая осенний сброс листвы деревьями, - тоже своего рода суицид. К апоптозу клетка прибегает тогда, когда что-то в ней непоправимо сломалось и ее дальнейшее существование может навредить организму. Подчеркиваю: только может навредить, до настоящего вреда дело не доходит, поскольку тут же поступает приказ на уничтожение и запускается система умерщвления. Вот так клетки бросаются на амбразуру - все, кроме раковых.
Раковые будто пришли с другой планеты. В отличие от остальных они безудержно размножаются, пожирая ткани вокруг себя и образуя опухоль, растущую как лавина. И обладают поразительной способностью к выживанию, вот почему так трудно остановить их рост, а еще труднее вообще уничтожить. В отличие от остальных клеток, срок жизни которых исчисляется днями или неделями, раковые умирают вместе с "хозяином", в теле которого поселились и которого сами же убили. В некоторых лабораториях мира они живут в колбах уже более ста лет и чувствуют себя превосходно. И до недавнего времени считалось, что к добровольному уходу из жизни они неспособны. Российские и американские исследователи доказали, что это мнение ошибочно.
- Апоптоз, самоубийство клеток происходит по сложной, четко отработанной технологии, - рассказывает руководитель российской группы исследователей, лауреат Ленинской премии Михаил Ханин, профессор Центра теоретических проблем физико-химической фармакологии РАН. - В каждой клетке затаились и ждут своего часа особые ферменты, их называют каспазами. Это - палачи, непосредственные исполнители смертной казни. А сигнал к исполнению дают специальные рецепторы на клеточной мембране, зорко следящие за состоянием своей клетки, за ее взаимодействием с окружающими тканями и точно отмечающие момент, когда она может стать опасной для организма. Специалисты называют их жутковато - "рецепторы смерти". Отданный ими сигнал запускает длинную цепь биохимических реакций, в результате которых мирно "спящие" каспазы превращаются вдруг в бешеных убийц, уничтожающих цитоплазму, ядро и наконец сам геном клетки. Она сморщивается, уменьшает объем, после чего ее съедают окружающие здоровые клетки, используя ее ткани в своем развитии. Так сказать, своего рода безотходная технология.
Уже 30 лет биологи интенсивно изучают механизм апоптоза. И довольно далеко продвинулись в этой работе. Главное, выяснили, как запускается в действие огромная, многоэтапная цепочка биохимических реакций, несущая роковой приказ клетке на самоуничтожение, где одни белки и ферменты передают эстафету другим, на определенных этапах к ним примыкают третьи, четвертые, пятые и еще другие, которые вроде бы и не имеют прямого отношения к поставленной задаче, но без их присутствия приказ до цели не дойдет. Более того, исследователи научились сами запускать цепную реакцию апоптоза, провоцируя "рецепторы смерти" давать сигнал на уничтожение, и вполне работоспособные клетки послушно кончают самоубийством. Теперь остался последний шаг: от обычных клеток перейти к раковым.
Заставить раковую клетку покончить с собой. На первый взгляд - задача из области фантастики. Ведь цель этих клеток не оберегать организм, в котором они живут, а, наоборот, уничтожать окружающие ткани, пожирая их и перерабатывая в собственные белки, чтобы питать ими постоянно растущую опухоль. Так что, логически рассуждая с позиций здравого смысла, у раковых клеток вовсе не должно быть механизма апоптоза, а если он почему-то есть, то должен быть просто неработоспособным. Вот таким предположением поделился я со своим собеседником, чем вызвал у него откровенную усмешку.
- Неблагодарное это занятие - пытаться разгадать загадки природы, опираясь на обывательскую логику здравого смысла, - сказал Михаил Ханин. - Природа мыслит другими категориями, учитывая в своих решениях множество факторов, которые, на наш взгляд, никакого отношения к данной проблеме не имеют. Вот так и с раковыми клетками. Казалось бы, зачем им апоптоз, если их предназначение разрушать организм, а не оберегать его? Тем не менее в каждой раковой клетке, как и в любой другой, есть механизм самоуничтожения. И он безотказно срабатывает, если суметь его запустить.
В последней фразе - суть проблемы. Раковые клетки - отнюдь не сестры-близнецы, у каждого вида рака они свои. И по-разному противостоят попыткам запустить механизм апоптоза. Большинство клеток бешено сопротивляются, другие поддаются команде на уничтожение так же, как и обычные клетки, а третьи даже легче. Вот почему медицина достигла определенных успехов в лечении онкологических заболеваний. Некоторые болезни подчас излечиваются полностью, развитие других сильно замедляется. Сегодня медики считают, что все виды рака можно излечить апоптозом, тем более что механизмы его запуска давно освоены. Это, в частности, всем известные - радиационное облучение и химические токсичные вещества, которые не просто сами разрушают раковые клетки, как считалось раньше, а заставляют "рецепторы смерти" дать роковой сигнал. И чем раньше обнаружены скопления раковых клеток, начавших превращаться в опухоль, тем меньше их живучесть, тем слабее сопротивление сигналу на смерть. Есть и другие способы запуска апоптоза, только вот беда: ни один из них не дает стопроцентного эффекта. Один и тот же рак на одной и той же стадии у одного больного иногда излечивается полностью, у второго просто прекращается рост опухоли, а у третьего он лишь слегка замедляется. К тому же при одном запуске апоптоза результаты одни, при другом у того же вида рака бывают совсем другие. Поэтому не всегда можно предсказать заранее, что лучше поможет данному больному: облучение или химиотерапия? Почему же так происходит? А дело в том, что для науки до сих пор остается "черной дырой" средний этап апоптоза - процессы, происходящие между подачей сигнала на смерть и до разрушения клетки.
- Задача медицины - подавить сопротивление раковых клеток сигналу саморазрушения,- говорит Михаил Александрович,- добиться его неукоснительного выполнения. На это и направлена наша работа совместно с американскими коллегами из клиники Мейо в городе Рочестер (штат Миннесота), которой руководит выдающийся исследователь апоптоза, доктор философии и медицины, профессор Скотт Гарольд Кауфманн. И решаем мы эту проблему с двух разных сторон, соединив, казалось бы, далекие друг от друга вещи - биохимию и математику.
Надо думать, природе пришлось немало потрудиться, чтобы решить головоломную задачу - как изменить главное свойство обычной клетки при перерождении ее в раковую, не изменяя ее строения. Ведь механизм апоптоза никуда не выбросишь, он остается в клетке, задачи которой теперь кардинально меняются: не оберегать организм, а разрушать его. И апоптоз должен не мешать этому процессу, но тем не менее быть готовым и к разрушению самой клетки на случай, так сказать, непредвиденных ситуаций. Природа решила эту задачу, сделав раковый апоптоз сложнейшей нелинейной системой, в которой участвует огромное количество белков, где одни способствуют самоубийству клеток, другие не мешают, а третьи препятствуют. И во всей этой запутанной паутине различных биохимических процессов скрывается некий единственный процесс, который и приводит к окончательному результату - смерти клетки. Природе он известен, и она им иногда пользуется: иначе чем объяснить редкие случаи самоизлечения рака, ставящие медиков в тупик? Науке же пока известно, что этот процесс существует и у каждого вида рака он свой. Его и необходимо вычленить, выявить участвующие в нем белки, определить влияние каждого из них на общую динамику системы. Более того, необходимо определить скорость каждой из десятков и сотен биохимических реакций, входящих в систему апоптоза данного вида рака, без чего невозможно научиться управлять этим процессом. По сравнению со всей этой работой поиски пресловутой иголки в стоге сена - задачка для первоклассников. И исследования американских биохимиков грозили затянуться на десятки лет, если бы к ним не пришли на помощь российские математики.
- В последние годы математические и компьютерные модели занимают все большее место в биологических лабораториях, показав себя весьма эффективным методом исследования динамики сложных биохимических систем, - отмечает профессор Ханин. - А если говорить просто, то все, что биохимики создают в своих колбах и на что у них уходят недели и месяцы, а бывает, и годы, мы воспроизводим на экране компьютера, за считаные минуты проигрывая вариант за вариантом.
Конечно, это сказано слишком просто. На деле же идет сложнейшая работа - скрупулезный перебор на компьютерных моделях всех биохимических реакций, входящих в систему апоптоза, и их сочетаний. Определение их скоростей и других параметров, сверка полученных данных с теми, что успели получить коллеги за океаном - если сошлось, значит, правильно. Вот так белок за белком определяется одна из возможных цепочек от "рецепторов смерти" до раковых клеток. Но как определить, та ли это цепочка, по которой приказ на смерть дойдет до адресата, не потеряв силы, и разбудит "спящих" каспаз, заставив их приступить к своей палаческой работе? Или в нее попали белки лишние, не поддерживающие приказа, а то и препятствующие ему? Поэтому полученные варианты тестируются великим принципом оптимальности, которым руководствуется природа, создавая все свои творения. Он гласит, что все, что делается, должно происходить с минимальными затратами времени и энергии. Поэтому исследователи четко знают, что им надо искать, - цепочку биохимических реакций, содержащую минимальное количество белков, по которой сигнал на смерть доходит до палачей-каспаз за минимальное время и с минимальными потерями энергии. А вот получение этих данных позволит медикам создать систему управления механизмом апоптоза, действующую при лечении больных с максимальной эффективностью.
Читайте также:




