Как с железом так и с хлором реагирует сера

Сера является не только важным компонентом множества химических соединений, но и непосредственно экзамена ОГЭ.
Она часто встречается в заданиях разного типа и уровня, и все возможные задания, в которых рассматриваются особенности серы, мы и пройдем в рамках этого урока.
Задание 1:
Выберите два высказывания, в которых говорится о сере как о простом веществе:
1) При горении серы на воздухе образуется сернистый газ;
2) Сера в природных водах встречается в основном в виде сульфат - иона;
3) Сера входит в состав некоторых аминокислот;
4) В состав ядра атома серы входит 16 протонов;
5) Серный цвет - это мелкий порошок серы, применяющийся в качестве средства защиты растений.
Решение:
Для начала, нужно понять само определение "простое вещество".
Простое вещество - это вещество, которое состоит из атомов одного химического элемента. В противовес простому веществу обычно указывают понятие "химический элемент".
Химический элемент - это определенный вид атомов.
Соответственно, для решения этого задания необходимо выбрать те варианты ответа, где указаны физические и химические свойства серы.
1) При горении серы на воздухе образуется SO2 (сернистый газ) - подходит, так как здесь сера обладает химическими свойствами и показана как простое вещество. Кстати, вот эта реакция:
2) Сера в природных водах встречается в виде сульфат - ионов - не подходит, так как ионы не обладают свойствами простых веществ;
3) Сера входит в состав некоторых аминокислот - не подходит, почему? Дело в том, что в данном варианте ответа сера не обладает самостоятельными свойствами, а только входит в состав аминокислот в виде иона;
4) В состав ядра серы входит 16 протонов - не подходит, здесь речь идет о химическом элементе серы;
5) Серный цвет - это мелкий порошок серы, применяющийся в качестве средства защиты растений - подходит, в этом варианте ответа сера представлена как простое вещество.
Задание 2:
Степень окисления серы в высшем оксиде равна степени окисления серы в веществе:
Решение:
Сера расположена в 6А группе, поэтому имеет высшую степень окисления равной номеру своей группы, ее высший оксид - SO3 , в котором она проявляет степень окисления +6.
Поэтому, для решения этого задания необходимо выбрать вещество со степенью окисления +6.
1) H2SO3 (сернистая кислота) - здесь у серы +4, не подходит;
2) (NH4)2SO4 (сульфат аммония) - когда ты видишь в формуле сложного вещества остаток SO4 (это кислотный остаток - сульфат), то запомни, что в сульфат - ионе степень окисления серы равна +6, подходит;
3) K2S - это вещество называется сульфид калия, нужно помнить, что у калия в классической химии нет отрицательной степени окисления, а так как в молекуле сложного вещества должно быть равное количество катионов и анионов, значит, отрицательную степень будет проявлять сера, в данном случае, -2, ответ не подходит;
4) SCl2 (дихлорид серы) - сера и хлор это два неметалла, причем оба достаточно активные, однако, хлор сильнее проявляет электроотрицательность,поэтому в бескислородных солях у хлора степень окисления равна -1, значит, у серы будет +2; не подходит.
Задание 3:
Железо при обычных условиях реагирует с
2) оксидом углерода (4);
3) сульфатом меди (2);
Решение:
Как понять, при каких условиях элемент реагирует с различными веществами? На самом деле, не так и сложно.
Например, в данном задании у нас железо, мы знаем, как выглядит этот элемент в природе, он не так активен, как калий или литий, из -за пленки с кислородом при окислении на воздухе.
Однако, и железо при обычных условиях может взаимодействовать с теми веществами, с которыми возможна реакция замещения.
А этот тип реакций возможен
Иными словами, смотрим на ряд активности:
K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Cu Hg Ag Pt Au
Итак, анализируем каждый вариант ответа:
1) с водой - если кинуть железную арматуру в воду, ничего не произойдет, только постепенно железо начнет покрываться ржавчиной.
P.S. Ржавчина не имеет четкой химической формулы, это смесь оксидов и гидроксидов железа.
Поэтому, данный вариант ответа нам не подходит.
2) с углекислым газом (CO2) - этот газ всегда присутствует в воздухе, так как является его непосредственным компонентом.
Углекислый газ выделяют большинство органических существ в реакциях энергетического обмена.
- Но, с железом реакции нет, ответ не подходит.
3) с сульфатом меди (2) - это как раз тот случай, когда нам нужно воспользоваться рядом активности металлов (РАМ) (смотри выше).
- Медь находится в РАМ после железа, поэтому Fe с легкостью вытеснит его из сульфата, причем, без нагревания; ответ подходит.
4) с серой - железо взаимодействует с S, но определенно не при обычных условиях; ответ не подходит.
Итак, верный ответ в этом вопросе - 3.
Задание 4:
Какие два утверждения верны для характеристики как углерода, так и серы?
1) на внешнем слое находится шесть электронов;
2) соответствующее простое вещество существует в твердом агрегатном состоянии;
- 3) химический элемент образует простое вещество - металл;
4) значение электроотрицательности меньше, чем у фосфора;
5) химический элемент образует оксид с общей формулой ЭО2.
Решение:
В этом вопросе нужно найти общие черты углерода и серы; хотя эти два элемента совершено разные по своим химическим свойствам и другим критериям, все же, они имеют схожие данные.
- Смотрим на первый вариант ответа: на внешнем слое находится шесть электронов - количество электронов на внешнем подуровне численно равно номеру группы, в которой находится элемент (это правило касается элементов главных подгрупп !)
В ПСЭ сера находится в 6А группе, у нее шесть электронов на внешнем подуровне, а углерод - в 4А, и у него четыре электрона, значит, этот вариант ответа не подходит.
- Второй вариант: соответствующее простое вещество существует в твердом агрегатном состоянии - да, это именно так.
И сера, и углерод в природе являются твердыми веществами (несмотря на то, что оба образуют газообразные оксиды при взаимодействии с кислородом) - ответ подходит.
- В третьем варианте ответа - химический элемент образует простое вещество - металл, ты наверняка понимаешь, что это неверное утверждение.
Сера и углерод - это типичные Неметаллы, ответ не подходит.
Значение электроотрицательности меньше, чем у фосфора - четвертый ответ требует наличия ряда электроотрицательности неметаллов (РЭН):
H As I Si P Se C S Br Cl N O F
Здесь хорошо видно, что и углерод, и сера стоят после фосфора (P), значит, их показатели электроотрицательности выше, чем у элемента, входящего в состав АТФ. Ответ не подходит.
- Пятый пункт: химический элемент образует оксид с общей формулой ЭО2 - для этого необходимо вспомнить степени окисления углерода и серы, а также оксиды, которые они образуют.
Углерод в имеет много степеней окисления (особенно в органической химии), но оксиды образует только в двух вариациях - CO и CO2.
Сера также как углерод имеет не одну степень окисления, и ее оксиды - SO2 и SO3.
Этот вариант нам подходит, так как и сера, и углерод образуют оксиды с общей формулой ЭО2 .
Химические свойства меди
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
С азотом металлический хром взаимодействует при температурах более 1000 o С:
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
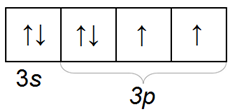
Валентных электронов у атома серы 6. Поэтому, ceра может образовывать до 6 валентных связей. Атом серы имеет больший радиус и потому проявляет меньшую электроотрицательность по сравнению с кислородом. Степени окисления, которые может проявлять сера в окислительно-восстановительных реакциях: S 0 , S -2 , S +4 , S +6 .
Сера это
Сера цвет
Соединения двухвалентной серы
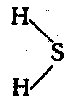
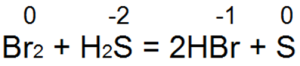
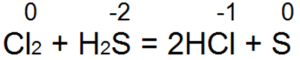
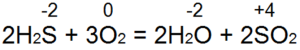
Соединения четырехвалентной серы
Соединения шестивалентной серы
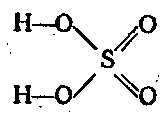
Что такое серная кислота
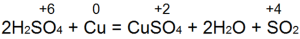

Концентрированная серная кислота реагирует с металлами, более активными, чем водород, иначе, чем разбавленная. Цинк например, из концентрированной серной кислоты не вытесняет водород, а восстанавливает серную кислоту до двуокиси серы, свободной серы или сероводорода:
H2SО4 + Zn → ZnSО4 + SO2
H2SО4 + Zn → ZnSО4 + S
H2SО4 + Zn → ZnSО4 + H2S
■ 91. Все три приведенных уравнения реакций серной кислоты с цинком являются окислительно-восстановительными. Расставьте в них коэффициенты на основе электронного баланса. (См. Ответ)
Безводная серная кислота называется моногидратом. Моногидрат не содержит ионов и поэтому не проводит электрического тока. Моногидрат хорошо поглощает влагу. Поскольку многие реакции серной кислоты с металлами являются ионными, моногидрат не вступает в реакцию с некоторыми металлами, более активными, чем водород, например с железом, поэтому его можно перевозить в железных цистернах. Золото, платина устойчивы к серной кислоте в любых концентрациях. Концентрированная серная кислота окисляет и некоторые неметаллы, например углерод.
■ 93. В чем сходство И различие серной кислоты с другими кислотами? (См. Ответ)
94. Могут ли осуществляться реакции, в которых серная кислота проявляла бы восстановительные свойства?
95. Как осуществить следующие превращения:
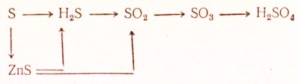
Напишите уравнения соответствующих реакций. Для окислительно-восстановительных составьте электронный баланс, уравнения ионных реакций напишите в ионной форме.
96. В одной склянке находится раствор серной кислоты, в другой — азотной, в третьей — соляной. Как их различить?
97. Для получения двуокиси углерода на мрамор СаСО3 действуют соляной кислотой. Почему для этой цели нельзя применить серную кислоту? (См. Ответ)
98. Как осуществить следующие превращения:
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII – XIV вв., после появления пороха и огнестрельного оружия. Главным поставщиком серы была Италия.

Кристаллы природной серы
В наши дни сера используется как сырьё для производства серной кислоты, пороха, при вулканизации каучука, в органическом синтезе, а также для борьбы с вредителями сельского хозяйства. Порошок серы применяют в медицине в качестве наружного дезинфицирующего средства.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая сера представляет собой жёлтый порошок, нерастворимый в воде. При кристаллизации из хлороформа CHCl3 или из сероуглерода CS2 она выделяется в виде прозрачных кристаллов октаэдрической формы. ромбическая сера состоит из циклических молекул S8, имеющих форму короны. При 113 о С она плавится, превращаясь в жёлтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются цепочки. А если нагреть серу до 445 о С, она закипает. Выливая кипящую серу струйкой в холодную воду, можно получить пластическую серу – резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются игольчатые кристаллы моноклинной серы (tпл = 119 о С). Подобно ромбической сере, эта модификация состоит из молекул S8. При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
В природе сера находится как в свободном состоянии, так и в виде соединений. Важнейшие из них следующие: FeS2 – пирит; или железный (серный) колчедан, CuS – медный блеск, Ag2S – серебряный блеск, PbS – свинцовый блеск. Сера часто встречается в виде сульфатов: гипса – CaSO4 ∙2H2O; мирабилита, или глауберовой соли Na2SO4∙10H2O; горькой (английской) соли MgSO4 ∙ 7H2O и др. Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах (в составе белков).
Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют из них в специальных аппаратах – автоклавах.
В лабораторных условиях свободную серу можно получить, например, при сливании растворов сероводородной и сернистой кислот, при неполном сгорании сероводорода:
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами имеющими меньшую ЭО). Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам и кислотам – окислителям).
Взаимодействие серы с простыми веществами

Взаимодействие серы с цинком
Сера реагирует как окислитель:

Валентных электронов у атома серы 6. Поэтому, ceра может образовывать до 6 валентных связей. Атом серы имеет больший радиус и потому проявляет меньшую электроотрицательность по сравнению с кислородом. Степени окисления, которые может проявлять сера в окислительно-восстановительных реакциях: S 0 , S -2 , S +4 , S +6 .

Сера это

Сера цвет
Соединения двухвалентной серы
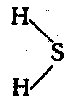
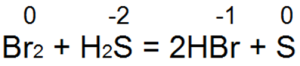
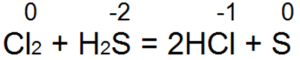
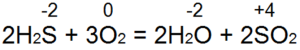
Соединения четырехвалентной серы
Соединения шестивалентной серы

Что такое серная кислота
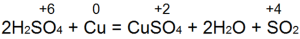

Концентрированная серная кислота реагирует с металлами, более активными, чем водород, иначе, чем разбавленная. Цинк например, из концентрированной серной кислоты не вытесняет водород, а восстанавливает серную кислоту до двуокиси серы, свободной серы или сероводорода:
H2SО4 + Zn → ZnSО4 + SO2
H2SО4 + Zn → ZnSО4 + S
H2SО4 + Zn → ZnSО4 + H2S
■ 91. Все три приведенных уравнения реакций серной кислоты с цинком являются окислительно-восстановительными. Расставьте в них коэффициенты на основе электронного баланса. (См. Ответ)
Безводная серная кислота называется моногидратом. Моногидрат не содержит ионов и поэтому не проводит электрического тока. Моногидрат хорошо поглощает влагу. Поскольку многие реакции серной кислоты с металлами являются ионными, моногидрат не вступает в реакцию с некоторыми металлами, более активными, чем водород, например с железом, поэтому его можно перевозить в железных цистернах. Золото, платина устойчивы к серной кислоте в любых концентрациях. Концентрированная серная кислота окисляет и некоторые неметаллы, например углерод.
■ 93. В чем сходство И различие серной кислоты с другими кислотами? (См. Ответ)
94. Могут ли осуществляться реакции, в которых серная кислота проявляла бы восстановительные свойства?
95. Как осуществить следующие превращения:
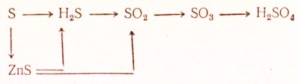
Напишите уравнения соответствующих реакций. Для окислительно-восстановительных составьте электронный баланс, уравнения ионных реакций напишите в ионной форме.
96. В одной склянке находится раствор серной кислоты, в другой — азотной, в третьей — соляной. Как их различить?
97. Для получения двуокиси углерода на мрамор СаСО3 действуют соляной кислотой. Почему для этой цели нельзя применить серную кислоту? (См. Ответ)
98. Как осуществить следующие превращения:
Читайте также:

