Как повредить мембрану раковой клетки
Причины повреждения мембран
При определенных ситуациях и нагрузках в ткани может образовываться большое число высокотоксичных свободных радикалов: оксидов, гидроксидов и перекисей. Эти соединения химически очень агрессивны. Они способны повреждать клеточные мембраны и вызывать самые разные нарушения жизнедеятельности организма. Но сами по себе они не являются первичным механизмом новообразования, а служат лишь фоном, на котором могут произойти последующие роковые изменения. Это всего лишь один из факторов образования в организме большого количества ущербных клеток, часть которых в дальнейшем под влиянием других факторов может переродиться в злокачественные.
Например, в мышцах при перегрузках в условиях недостатка кислорода бескислородное окисление глюкозы может увеличиться в 1000 раз, сопровождаясь огромным выбросом радикалов. Тем не менее от этого онкоклетки не появляются.
Любая нагрузка на ткань и ее клетки постепенно может приводить к нарушению мембран — это и травмы, и вирусы, и гормональное бремя. В итоге в тканях может образоваться застойное провоспалительное поле.
Поэтому в теории канцерогенеза следует пересмотреть значение канцерогенных веществ и радиоактивного облучения, в первую очередь повреждающих мембранномитохондриальный комплекс. Канцерогены не являются мутагенами, а действуют через мембраны.
Имеются определенные доказательства того, что онкологические клетки имеют морфологически измененные митохондрии и мембраны. Электронно-микроскопические наблюдения свидетельствуют о потере четкости и изящества в строении их оболочек, о набухании гранул — скоплений энергоемких соединений и т. д. Они напоминают изношенные механизмы. Это тоже говорит о существенном нарушении их качественных функций.
Мембраны онкоклеток имеют аномально высокую проницаемость.
Причины неполноценности мембран:
• недостаток антиоксидантной системы;
• чрезмерное образование радикалов, канцерогенов;
• вирусы и инвазии;
• недостаточность омега-3 кислоты.
Важнейшей причиной неполноценности мембран может стать и недостаточность омега-3 кислоты, связанная с недостатком потребления хлорофилл содержащих продуктов. Мембраны клеток состоят из двух жировых и одного белкового слоя. Жировые слои как раз и образованы из омега-3 и омега-6 полиненасыщенных жирных кислот (ПНЖК) в соотношении 3:1. Главным является способность омега-3 конкурентно замещать омега-6 в мембранах клеток и обмене веществ.
Омега-3 затрудняет превращение арахидоновой кислоты в простагландины, которые стимулируют рост опухолей; ингибируют (тормозят) активность ферментов, способствующих опухолевому перерождению; ингибируют активацию онкогенов и факторов роста опухолей; предотвращают образование новых сосудов в опухолях, нужных для интенсивного питания раковых клеток (онкоангиогенез); тормозят рост и вызывают смерть опухолевых клеток. В антиканцерогенном действии кислоты омега-3 имеет значение ее способность стимулировать иммунитет и нормализовать липидный обмен.
Известно, что оболочка митохондрий аналогична мембране клеток. Оболочка несет целый ряд функций, в том числе является основой для расположения на ней крист, в которых находятся ферменты, обеспечивает проницаемость, изоляцию своей ДНК от радикалов. При неполноценных мембранах клетки выходят из оптимального режима работы, ослабевает эффективность их функционирования, митохондрии вынуждены увеличивать свои обороты, работать неэкономно, вплоть до перегрева и порчи ДНК.
Но в природе омега-3 кислота встречается крайне редко. Считается, что в организме она сама не вырабатывается, но можно ожидать, что лечение с помощью регулярного приема достаточного количества хлорофилл-комплексов естественным путем повысит ее уровень. При этом сразу отмечу, что хлорофилла в пище постоянно должно быть много, чтобы перевести липидный обмен веществ в сторону самопроизводства омега-3.
Последние научные исследования показали, что эта кислота все же может вырабатываться в организме на фоне регулярного применения большого количества зеленых листьев, содержащих хлорофилл, или сока из зелени. Но беда в том, что современный человек резко ограничил потребление зеленой листвы в своем пищевом рационе.
Именно в связи с изменением качества питания, из которого полностью исключены хлорофиллсодержащие продукты, происходит резкое повышение уровня заболеваемости онкологией у современных людей.
Кроме того, значительно снижен антиоксидантный комплекс в пище, отчего многократно ослабевает и защита мембран и их сенсорных структур. Все это служит прологом для дальнейшей малигнизации клеток.
Определенные пролиферативные нагрузки, превышающие функциональные возможности ткани, стимулируют избыточную пролиферацию[4] — как неспецифическую защитную реакцию ткани. Но это еще не является причиной образования опухоли. Для начала онкопроцесса нужно сочетание целого ряда факторов, в том числе и неустойчивость мембран.
Кроме того, омега-3 также является липидной кислотой, имеющей отношение не только к строению мембран, но и энергетике клеток и работе их митохондрий.
Без жирных кислот ферменты, обеспечивающие усваивание кислорода в дыхательной системе, не функционируют. Организм начинает задыхаться, даже если человек дышит чистым воздухом. Дефицит жирных кислот подрывает жизненные функции организма. Таким образом, рак возникает, когда нам не хватает омега-3.
Очевидно, в первую очередь недостаток омега-3 сказывается на работе митохондрий, на их естественной защите от радикалов, постоянно образующихся в процессе дыхания. В данном случае кислота играет роль мощного антиоксиданта.
Кроме того, многие ферменты не могут нормально работать в условиях неполноценности строения мембран. Энергетика клетки выходит из оптимального экономичного энергетического режима и переходит на работу вразнос, что приводит к повреждению ДНК митохондрий и их перерождению. Это хорошо вписывается в энергетические теории онкологии. Последнее становится краеугольным камнем в моей мембранно-митоходриальной теории рака.
Провоспалительный статус онкоклеток
Из-за недостатка в организме омега-3 кислоты арахидоновая кислота беспрепятственно превращается в простагландины, которые на клеточном уровне включают механизмы воспаления. Они и служат стартовой площадкой для последующих процессов перерождения здоровых клеток в опухолевые.
В последние годы ученые выдвигают возможные провоспалительные механизмы как первопричину опухолей на клеточном уровне.
Такой тип энергетики не позволяет подключать высшие дифференциальные программы развития и, следовательно, клетки могут функционировать только по вегетативным принципам существования. Эти первичные программы намного сильнее последующих наслоений. Клетки постепенно теряют свою дифференциацию, скатываются на примитивные уровни. Такие вторичные генетические перенастройки и нарушения в клетках нельзя обозначать как мутации. Это всего лишь универсальный механизм клеточных перестроек, связанный с энергетическими нарушениями, обусловленными изменениями на уровне митохондрий и мембран.
Сейчас очень много работ посвящено поиску генов (онкогенов), определяющих онкологию. Правильнее утверждать, что все те гены, которые сегодня описаны, как определяющие онкопроцесс, не являются таковыми. Они всего лишь проявление вторичной перестройкой работы генома ядра. Они всего лишь отражение измененных внутрицитоплазматических гомеостатических констант и работы митохондрий.
Известен белок р53, который является супрессором[6] развития раковых опухолей, кодируемый у людей геном ТР53. Этот белок чрезвычайно важен для многоклеточных организмов. Он регулирует клеточный цикл и может служить антионкогеном, т. е. предотвращать развитие рака.
Механизмов антираковых функций р53 несколько. Он распознает повреждения хромосомной ДНК и может инициировать временную остановку деления клеток в так называемых точках регулирования клеточного цикла. Белок р53 также способен активировать гены белков, исправляющих повреждения ДНК (например, при перерождении клетки в раковую). За время паузы белки, восстанавливающие ДНК, получают необходимое для работы время. Если ДНК восстанавливает нормальную функцию, клетки снова начинают делиться, и их ракового перерождения не происходит. Если повреждение ДНК не поддается исправлению, белок р53 способен запустить процесс апоптоза — запрограммированной гибели клетки. Похожим образом белок р53 может реагировать и на другие клеточные стрессы.
Проводились исследования активности опухолевого супрессора р53 при действии различных стрессов. Один из видов клеточного стресса — нарушение работы дыхательной цепи митохондрий.
Что такое дыхательная цепь митохондрий?
Оказалось, что когда цепь переноса электронов перекрывали на уровне комплексов 1, 2 или 4, активность опухолевого супрессора р53 оставалась на исходном низком уровне. Однако при нарушении переноса электронов через комплекс 3 дыхательной цепи митохондрий происходила значительная активация белка р53.
Это означает, что сами по себе неполадки в работе дыхательной цепи не так важны для клетки, как остановка потока электронов через комплекс 3.
В последнем случае сигнал о несчастье достаточно быстро передается в клеточное ядро, уровень и активность р53 резко возрастают, в результате чего включается работа генов, ответственных за остановку клеточного цикла. Клетки перестают делиться, и через некоторое время в них включается механизм программируемой клеточной смерти — апоптоз.
Так как неполадки в работе дыхательной цепи происходят в митохондриях, а активированный р53 работает в другой части клетки, в ядре, должен существовать путь передачи сигнала от митохондрии в клеточное ядро. Провели поиск этого сигнального пути. Нельзя сказать, что нашли все его звенья, однако ключевое звено было выявлено. Оказалось, что за передачу сигнала ответственен фермент DHODH, который участвует в биосинтезе пиримидиновых нуклеотидов (мономерных блоков для синтеза новых молекул ДНК и РНК). Этот фермент расположен в итохондриальной мембране вблизи комплекса 3 дыхательной цепи. Остановка потока электронов через комплекс 3 ведет к нарушению работы этого фермента и, как следствие, остановке синтеза пиримидиновых нуклеотидов.
Синтез РНК и ДНК происходит в клеточном ядре, и нарушение каждого из этих процессов может приводить к активации р53. Показано, что недостаток мономерных блоков для образования новых молекул РНК и ДНК в делящейся клетке и является причиной активации р53. Так, добавление пиримидиновых нуклеотидов в среду для роста клеток выключало активацию р53 при ингибировании комплекса 3, и клетки выживали.
Впервые показано, что биосинтез пиримидиновых нуклеотидов является связующим звеном между дыхательной цепью митохондрий и опухолевым супрессором р53.
Преимущества предлагаемой нами аберрантной теории онкологии заключаются в том, что с ее помощью можно построить логичную последовательную модель онкопроцеса, в которую можно вписать и не укладывающиеся в предшествующие модели энергетические и анаболитно-катаболические нарушения на клеточном уровне. В частности, становится намного понятнее, почему гликолизный метаболизм опухоли в восемь раз сильнее, чем гликолиз здоровой работающей мышцы, и в сто раз сильнее, чем в покоящейся ткани.
Весь онкогенный процесс начинается с изменения энергетических процессов.
Методика данного лечения основана на предложенной мною мембранномитохондриальной теории рака. Дело в том, что подавление онкоклеток с помощью фокусированного катаболизма — это решение только части проблемы. С помощью же предлагаемого метода мы можем не только уменьшить объем опухоли, но и полностью избавиться от нее и метастазов.
Но и этого будет недостаточно. Так как первичные механизмы злокачественного перерождения клеток до конца не устранены, остается риск рецидива болезни. Только устраняя базу, на которой может возобновиться процесс, можно полностью избавиться от патологии. Для этого обязательным звеном лечения должно быть восстановление мембранно-митохондриального комплекса.
Как известно, митохондрии являются структурами, которые осуществляют синтез аденозинтрифосфорной кислоты (АТФ) — основной энергетической единицы всего царства живого. Обычно митохондрии представляют собой мелкие (длиной 1/2-3 мкм) внутриклеточные образования, располагающиеся в местах, где необходимо использование энергии для любых жизненных процессов. Длинные и разветвленные митохондрии могут энергетически обеспечивать отдаленные друг от друга участки клетки. Мембраны митохондрий способны проводить энергию.
Повышение общей эффективности и устойчивости ремиссионного процесса можно достичь с помощью применения льняного масла, содержащего омега-3 кислоту.
Данный текст является ознакомительным фрагментом.
Клеточная мембрана, располагающаяся между живой цитоплазмой и жидкой межклеточной средой, играет важную роль в жизни клетки. Ее можно обнаружить при применении любого хорошего фиксатора и окрасить любыми красителями. При приготовлении мазков костного мозга некоторые клетки разрываются, тогда как другие уплощаются; это показывает, что в одних клетках мембрана скрепляет живое вещество прочнее, чем в других. Некоторые физические свойства этой мембраны не целиком определяются ее составом, так как они зависят от характера цитоплазмы, отграничиваемой такой мембраной.
При помощи микроманипулятора можно показать, что для растяжения клеточной мембраны нужно приложить определенную силу. Плотность и эластичность оболочек различных типов клеток неодинаковы.
Однако то, что мы видим под микроскопом,— это не основная структура мембраны, а лишь наружная оболочка, толщина и состав которой могут варьировать от слизистой пленки или желточной оболочки яйца и от миелиновой оболочки отростка нервной клетки до построенной из целлюлозы оболочки растительной клетки.
Опыты с применением микроманипулятора показывают, что такую видимую наружную оболочку можно частично удалить, не вызывая гибели клетки, не нарушая ее проницаемости или других жизненно важных процессов.
Та часть клеточной стенки, которая необходима для жизнедеятельности любой клетки, от самой простой до самой сложной, называется плазматической мембраной. Эта мембрана, толщина которой равна диаметру всего лишь нескольких молекул, т. е. примерно 0,001 m, находится за пределами разрешающей способности обычных микроскопов. Как известно, теоретическим пределом видимости для такого микроскопа являются частицы диаметром
0,25 m. Однако положение подобной мембраны может быть определено довольно точно: это — поверхность, отделяющая цитоплазму от внешней среды; при этом следует учитывать существование наружной оболочки, толщина которой изменчива.
Лишь немногие исследователи обладают компетенцией, необходимой для того, чтобы решиться обсуждать сложный вопрос о физических и химических свойствах плазматических мембран. Изложение этого вопроса читатель может найти в работе Даниелли (1951). Известно, что такие мембраны состоят из непрерывного слоя липоидных молекул (фосфатидов, стеринов, жиров) толщиной не более 2—4 молекул, покрытого с поверхности слоем белка. Предполагают, что длинные оси молекул липоидов располагаются перпендикулярно поверхности, чем определяются некоторые свойства, связанные с проницаемостью; молекулы белков располагаются тангенциально и придают оболочке механическую прочность. Вероятно, различные участки мембран отличаются друг от друга по своим свойствам, особенно в поляризованных клетках; различия существуют и между клетками разных типов.
Большинство имеющихся данных относительно плазматических мембран основано на результатах изучения эритроцитов и растительных клеток. В будущем должно быть проведено тщательное изучение плазматических мембран злокачественных клеток, так как в настоящее время этому вопросу посвящены лишь отдельные, не связанные между собой наблюдения.
Непосредственно под плазматической мембраной располагается слой цитоплазмы, называемый октоплазмой, который обычно не содержит микроскопически видимых гранул и имеет консистенцию геля, почему и называется еще слоем плазмагеля. Этот слой имеет очень большое функциональное значение (см. Льюис, 1942).
До сих пор при помощи обычного или электронного микроскопа не удалось выявить каких-либо различий между мембранами злокачественных клеток и их нормальных прототипов. Однако по крайней мере некоторые особенности поведения злокачественных клеток, вероятно, являются результатом особого строения их плазматических мембран и эктоплазмы, которая располагается под этими мембранами. Прекрасные исследования Хилье и Гоффмана (1953), посвященные плазматическим мембранам эритроцитов, могут служить отправной точкой для дальнейшей работы в этом направлении.
Каким должно быть питание при онкологических заболеваниях? Какие продукты абсолютно противопоказаны при той или иной форме рака?
Фитотерапия способна оказать существенную помощь не только в лечении онкологических заболеваний, но также и в их профилактике.
Многих людей, имеющих у себя или у родственников онкологическое заболевание, интересует вопрос: передается ли рак по наследству?
Лечение рака во время беременности является довольно сложным, ведь большинство лекарственных средств обладает токсичностью.
Какие перспективы у беременности после перенесенного онкологического заболевания? Следует ли выдерживать срок после лечения рака?
Профилактика является важной частью общей борьбы с онкологическими заболеваниями. Как же уменьшить вероятность возникновения рака?
Что представляет из себя паллиативное лечение рака? Как оно может повлиять на качество жизни онкологического больного и изменить ее к лучшему?
Учеными разработано достаточно много перспективных методов лечения рака, пока еще не признанных официальной медициной. Но все может измениться!
Как найти силы для борьбы с раком? Как не впасть в отчаяние от возможной инвалидности? Что может послужить надеждой и смыслом жизни?
Бытует такое мнение, что постоянные стрессовые ситуации способны привести к развитию онкологических заболеваний. Так ли это?
Многие онкологические больные часто страдают от резкой потери веса. Чем это вызвано и можно ли как-то справиться с этой проблемой?
Правила ухода за больными, вынужденными постоянно находиться в кровати, имеют свои особенности и их нужно обязательно знать.
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
18 сентября 2013
- 4193
- 3,5
- 6
- 2
![]()
Антон Чугунов![]()
Андрей Панов

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Рак — это злокачественная опухоль, которая дает выросты в окружающие ее ткани, похожие на конечности ракообразного (отсюда и название). Ежегодно это заболевание уносит более 300 тысяч жизней. Основными причинами рака являются три группы факторов: физические (ионизирующее излучение, в т.ч. ультрафиолет), химические (канцерогенные вещества) и биологические (некоторые вирусы и бактерии). Под влиянием этих факторов клетки могут стать атипичными, поменять облик и свойства, что отражается во множестве молекулярно-генетических признаков, отличающих их от здоровых клеток:
- Увеличение лабильности и текучести клеточной мембраны, снижение адгезивности и контактного торможения. В норме клетки, вступая в контакт друг с другом, прекращают деление. В опухолевых клетках отсутствие контактного торможения приводит к безудержной пролиферации.
- Нарушение регуляции роста и дифференцировки опухолевых клеток. В нормальных клетках процессы роста и дифференцировки уравновешивает модулятор — кальций-зависимая протеинкиназа. В опухолевых клетках активность этого белка повышена, что приводит к резкой индукции пролиферации.
- Атипичный энергетический обмен, который проявляется в преобладании гликолиза. Нормальные дифференцированные клетки в присутствии кислорода в качестве основного источника энергии используют трёхэтапный процесс утилизация глюкозы (см. врезку):
- гидролиз высокомолекулярных органических соединений;
- гликолиз;
- окислительное фосфорилирование и цикл Кребса.
![]()
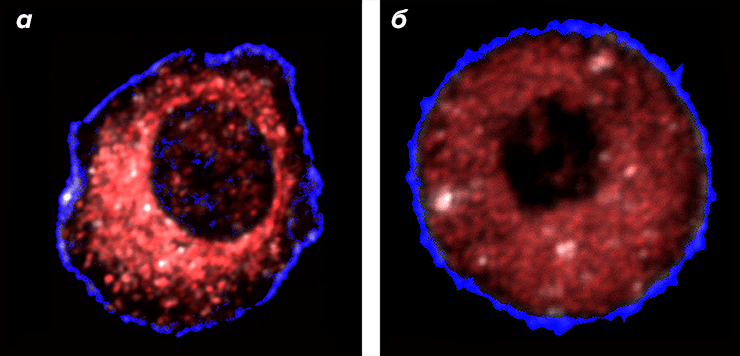
Рисунок 1. Здоровая (а) и раковая (б) клетки печени. Митохондрии помечены флуоресцентным красным красителем. У здоровой клетки митохондрии расположены кластерами вокруг ядра и отсутствуют вблизи внешней биомембраны. В раковой клетке митохондрии располагаются повсеместно и кластеров не образуют, поэтому интенсивность свечения снижается.
Особенности энергетического обмена
Живой организм — это открытая система, характеризующаяся постоянным обменом веществом и энергией с окружающей средой. На клеточном уровне существуют пластический (анаболизм) и энергетический (катаболизм) виды обмена. В ходе пластического обмена из простых веществ синтезируются более сложные (с затратой энергии). Энергетический обмен обеспечивает клетку энергией в виде АТФ. Все вещества в ходе энергетического обмена распадаются, а АТФ синтезируется. У животных энергетический обмен протекает в 3 этапа:
- Расщепление сложных органических веществ до более простых. Например, расщепление гликогена до глюкозы, фруктозы и галактозы. У многоклеточных организмов происходит в пищеварительном тракте, у одноклеточных — в лизосомах.
- Бескислородное окисление или гликолиз (расщепление глюкозы). Происходит в цитоплазме клетки без участия кислорода. На этом этапе из одной молекулы глюкозы образуется две молекулы пировиноградной кислоты и две молекулы АТФ. Также происходит восстановление молекулы НАД + до НАД•2Н. У животных и некоторых бактерий при недостатке кислорода происходит молочнокислое брожение с образованием молочной кислоты (лактата).
- Окислительное фосфорилирование и цикл Кребса происходят в митохондриях только в присутствии кислорода. На этом этапе расходуется пировиноградная кислота, ацетил-КоА, 12 молекул НАД•2Н и образуется 36 молекул АТФ.
Суммарно в ходе трёхэтапного цикла энергетического обмена из одной молекулы глюкозы образуется 38 молекул АТФ.
И голодно, и холодно, или раковый обмен
![]()
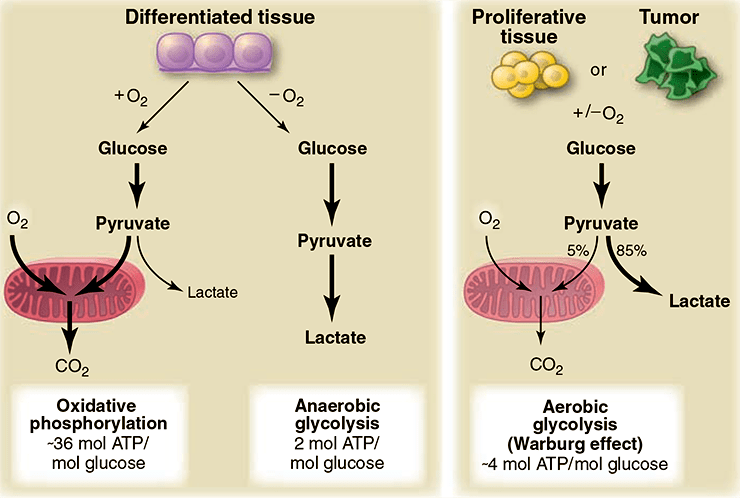
Рисунок 2. Различия между реакциями окислительного фосфорилирования, анаэробного гликолиза и аэробного гликолиза (эффект Варбурга). В присутствии кислорода в нормальных дифференцированных тканях в процессе гликолиза происходит расщепление глюкозы до пирувата, который затем в митохондриях в процессе окислительного фосфорилирования полностью окисляется до СО2. Кислород является необходимым компонентом полного окисления глюкозы; когда кислорода оказывается недостаточно, в клетках в процессе гликолиза синтезируется лактат. Лактат не является субстратом для реакции окислительного фосфорилирования, и полного окисления глюкозы в этом случае не происходит. Такой путь расщепления глюкозы до лактата способен поддерживать стабильный синтез минимального количества АТФ. Варбургом было отмечено, что раковые клетки имеют тенденцию к производству лактата, а не пирувата, независимо от присутствия кислорода в клетках. Это свойство также характерно и для нормальных пролиферирующих клеток. Часть митохондрий в раковых клетках остаются функционально активными, и как в раковых, так и в нормальных пролиферирующих клетках доля окислительного фосфорилирования может составлять примерно 10%.
Общебиологические законы ракового обмена
Одноклеточные организмы состоят всего из одной клетки, но эта клетка — целостный организм, ведущий самостоятельное существование. Одноклеточные организмы хорошо приспособлены к окружающей среде, в которой они растут и размножаются (рис. 3). Основным фактором эволюционного давления для одноклеточных, ограничивающим их размножение, является доступность питательных веществ. Поэтому метаболизм одноклеточных эволюционно развивался так, чтобы запасы питательных веществ и свободной энергии были направлены, в первую очередь, на построение структур, необходимых для возникновения новой клетки. Большинство одноклеточных размножается с использованием энергии гликолиза, даже когда кислорода достаточно. Следовательно, несмотря на низкую эффективность (две молекулы АТФ против 36), гликолиз может обеспечить достаточно энергии для клеточной пролиферации.
![]()
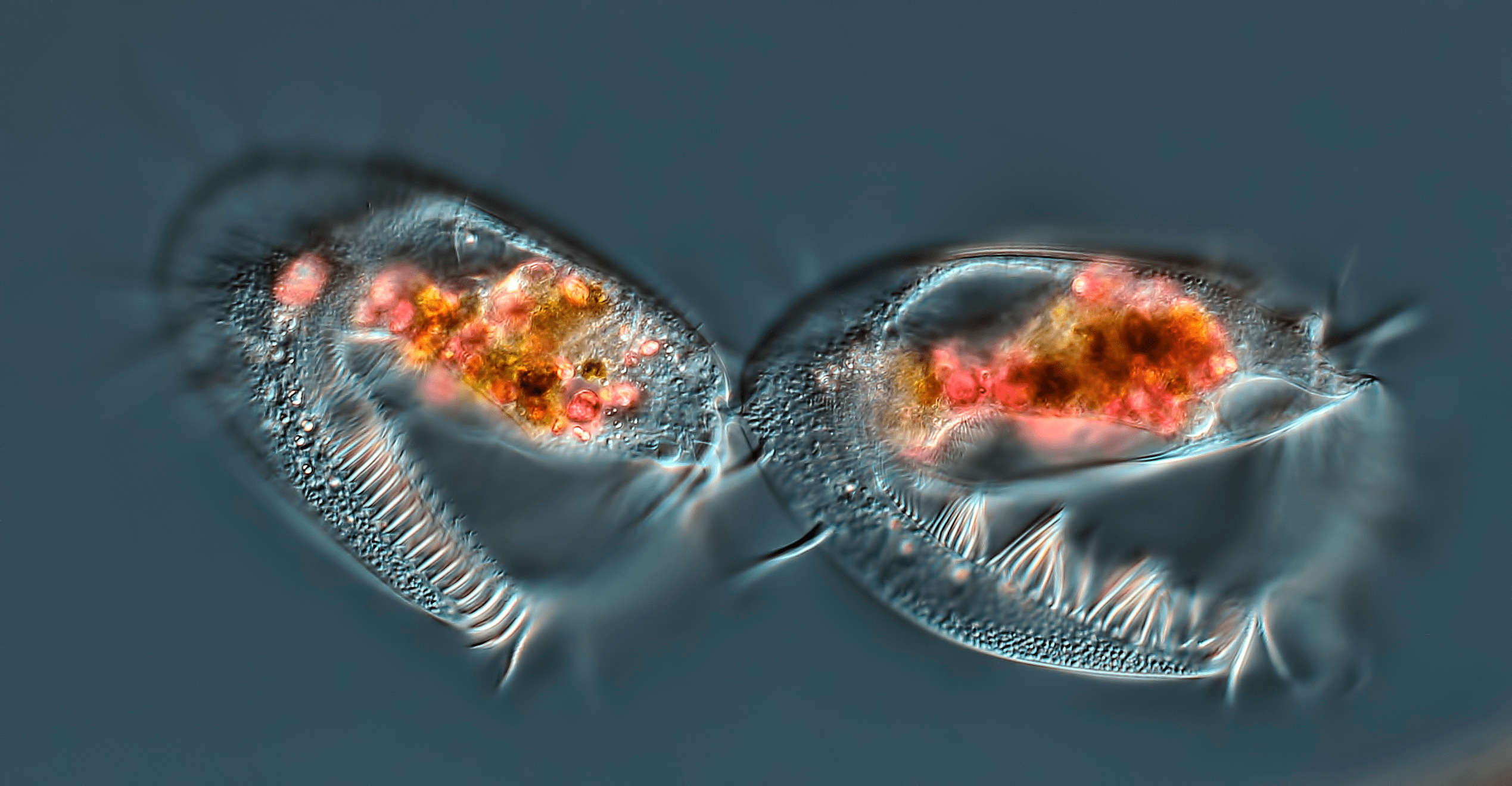
Рисунок 3. Завершающая стадия клеточного деления инфузории. Фотография сделана с использованием дифференциального интерференционного контраста ×40.
![]()
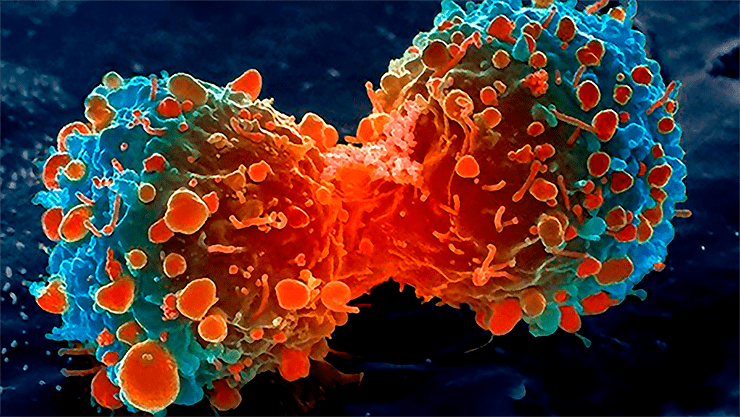
Рисунок 4. Пролиферация раковых клеток легкого, сканирующий электронный микроскоп (STEM)
Но почему же менее эффективный обмен веществ (с точки зрения производства АТФ) предпочтителен для размножения одноклеточных организмов или безудержной пролиферации раковых клеток?
Одно из возможных объяснений состоит в идее самой пролиферации. Для осуществления процесса деления необходимо наличие большого количества строительного материала — нуклеотидов, аминокислот и липидов [15]. Глюкоза обеспечивает клетку энергией (расщепление дает до 38 молекул АТФ в трёхэтапном процессе), но также используется как стройматериал в процессе биосинтеза (поскольку содержит шесть атомов углерода). Например, в ходе биосинтеза одного из основных компонентов клеточных мембран — пальмитата (эфира пальмитиновой кислоты) — необходимо 16 атомов углерода и семь молекул АТФ [16]. Для синтеза аминокислот и нуклеотидов также требуется больше углерода, чем энергии. Так, одна молекула глюкозы может обеспечить 36 молекул АТФ, либо предоставить свои шесть атомов углерода. Очевидно, что в пролиферирующей клетке бóльшая часть глюкозы не может участвовать в производстве АТФ посредством окислительного фосфорилирования, поскольку одну молекулу глюкозы выгоднее использовать для синтеза 16-ти углеродной цепи пальмитиновой кислоты, в процессе окисления которой образуется 35 молекул АТФ.
Альтернативное объяснение заключается в том, что здоровые клетки многоклеточного организма не испытывают недостатка в поставке глюкозы из циркулирующей крови, и АТФ синтезируется постоянно [17], [18]. При этом даже незначительные колебания содержания АТФ/АДФ в таких клетках могут нарушить их рост. Нормальные клетки с дефицитом АТФ подвергаются апоптозу [19], [20]. Поддержание оптимального уровня АТФ/АДФ обеспечивается активностью специальных регуляторных киназ, которые снижают производство АТФ путем преобразования двух молекул АДФ в одну молекулу АТФ и одну АМФ; пролиферация при этом условии блокируется.
Опухолевые клетки используют в качестве основного источника энергии гликолиз и характеризуются генерацией избыточного лактата (содержащего три атома углерода), который выводится из клетки, хотя мог быть использован для синтеза АТФ или биосинтеза. Но, возможно, вывод избыточного углерода (в виде лактата) имеет смысл, поскольку он позволяет ускорить включение углерода в биомассу и облегчить деление клеток. Для большинства делящихся клеток важным является не выход АТФ, а скорость метаболизма. Например, иммунные реакции и заживление ран зависят от скорости пролиферативного умножения эффекторных клеток. Чтобы выжить, организм должен максимизировать скорость роста клеток. Клетки, которые наиболее эффективно превращают глюкозу в биомассу, растут быстрее. Кроме того, если для организма питательных веществ оказывается недостаточно, включается механизм активной утилизации избытка лактата. В печени в цикле Кори происходит переработка лактата, запасающегося в результате метаболизма активно пролиферирующей ткани [16]. Такой способ переработки органических отходов, образующихся в результате пролиферации клеток при иммунном ответе в результате заживления ран, частично пополняет энергетические запасы организма.
Заключение
Читайте также: