Как попасть на исследование рака
Чтобы ответить на такие вопросы, нужно немного раскрыть суть того, что из себя представляет клиническое исследование (далее – КИ), зачем это все нужно, какова кухня, и как, собственно, в КИ попадать. Разумеется, что освещая тут эти вопросы, я рассматриваю только клинические исследования в онкологии. В каждой специальности есть своя специфика проведения исследований и обсуждать сейчас особенности, например, как испытания новых вакцин на здоровых добровольцах, я не буду.
Клиническое исследование – это испытание нового лекарственного препарата или нового метода лечения на добровольцах. Поскольку речь у нас идет об онкологии, то на добровольцах, больных онкологическим заболеванием.
Зачем. Дело в том, что многие онкологические заболевания в поздних стадиях развития плохо поддаются лечению Или вообще ему не поддаются. Например, 5-летняя выживаемость пациентов с метастатической меланомой при использовании всех современных методов лечения и лекарственных препаратов составляет 5 %. То есть, 95% пациентов умирает в течение пяти лет, несмотря на все проводимое лечение. А большая часть из них умирает в течение 6-8 месяцев после развития метастатического процесса. Существующий арсенал стандартных методов лечения – это пять-семь лекарственных препаратов и несколько возможных их комбинаций, в целом малоэффективных.
Разумеется, что такое положение вещей обуславливает постоянные поиски новых лекарственных препаратов и новых методов лечения.
Кто занимается этими поисками? В наше время – не врачи. Большая часть исследований в поисках новых лекарственных препаратов проводится фармкомпаниями. Иногда – лабораториями, принадлежащими каким-то организациям, например, НИИ в России, но за последние десятилетия ничего действительно стоящего отдельные лаборатории научно-исследовательских институтов, насколько я могу сходу вспомнить, не изобрели. Связано это с финансированием – крупные фармкомпания единовременно финансируют большое количество лабораторий, исследований и получают на выходе этого финансирования большое количество молекул, которые могут быть активны в отношении опухолей.
После того, как молекулу получили в лаборатории, она проходит преклинические исследования – в пробирках, на животных. В ходе этих исследований предварительно изучаются ее противоопухолевые свойства и токсичность. После того как завершились эти преклинические исследования, и в том случае, если показано, что противоопухолевые свойства имеются, а токсичность на животных контролируема, начинаются исследования на людях. Сразу оговорюсь, что этическая и юридическая сторона таких исследований очень хорошо проработана, но в объеме одного сообщения я не смогу эту часть раскрыть – слишком объемный вопрос.
Поначалу в исследования I-й фазы включается очень небольшое количество пациентов, поскольку токсичность у людей еще не изучена. Десяток, несколько десятков человек. и у этой группы изучается переносимость препарата. Иногда оказывается, что препарат, который легко переносили мышки, кошки и обезьянки, у человека вызывает такие побочные эффекты, что его применять нельзя, несмотря на все прочие прекрасные свойства. И приходится такой препарат сдавать на свалку истории.
Дальше, если показано, что препарат хорошо переносится человеком, начинают изучать различные дозовые режимы, его фармакокинетику (как препарат распределяется в организме, как быстро выводится, сколько времени длится его максимальная концентрация, и т.д.). Это вторая фаза исследований. В этой фазе подбирается оптимальная доза препарата и предварительно оцениваются его клинические эффекты. В этой фазе препарат исследуется на уже большей группе людей. Но окончательные выводы об эффективности препарата после окончания исследования II фазы сделать еще нельзя – выборка недостаточна.
После того, как особенности взаимодействия препарата и организма более-менее изучены, приступают к изучению эффективности препарата.
Для этого проводятся крупные клинические исследования. Согласно современным критериям, доказательным считается хорошо спланированное исследование, которое проводится во многих центрах одновременно, и в котором больные разделены на группы сравнения – в одной группе исследуется новый препарат, а в другой группе больные получают стандартное лечение или плацебо (в онкологии последнее редко). При этом больные распределяются случайно, без учета мнения исследователя – это называется рандомизацией. Суть рандомизации заключается в том, чтобы исследователь умышленно или нет не набирал в исследуемую группу, например, более легких пациентов, оставляя в группу контроля более тяжелых. Иногда, чтобы исключить психологический эффект приема нового препарата, пациент не знает, какой препарат – исследуемый или контрольный он принимает (слепой метод), а иногда об этом не знает не только пациент, но и врач (двойной слепой). Всё это сделано, чтобы уменьшить влияние врача и пациента на ход исследования.
В ходе этих крупных исследований III – IV фаз оценивается эффективность препарата при лечении какого-то заболевания. Дополнительно оцениваются побочные эффекты на большой группе больных. По окончании этих исследований, если препарат показал, что он эффективен в лечении болезни, он проходит регистрацию в неком государственном органе, в ведении которого лежит контроль за существующими лекарственными препаратами. В США это FDA (Food and Drug Administration), в Евросоюзе – EMA (European Medicines Agency), в России регистрацией препаратов занимается Минздрав.
После регистрации производитель может начинать продавать препарат.
Собственно, для производителя эта цель и является основной – окупить расходы на все лаборатории, которые изучали много молекул, лишь одна из которых вышла на рынок; на все преклинические исследования (и персонал, и кошки-мышки-обезьянки стоят денег, и немалых); ну и на клинические исследования – это самая расходная статья в изучении препарата. Окупить предшествующие исследования и заработать.
Что кому дает клиническое исследование
Что дает производителю препарата – я уже написал. Окупаемость, прибыль, развитие.
Что дает науке и медицине в целом? Появление новых лекарственных препаратов, развитие экспериментальной и клинической науки, победы над болезнями.
Что дает непосредственно врачу-исследователю, участвующему в процессе? Во-первых деньги – эта контрактная оплачиваемая работа. Во-вторых, возможность поработать с современным препаратом и узнать много нового. Работа по исследованиям – это интересная работа, в ходе нее растешь как специалист.
Что дает пациенту? В идеале пациенту дает возможность вылечиться от неизлечимого заболевания. Да, такое бывает, и я таких пациентов знаю и наблюдаю. В других случаях, если препарат эффективен, дает возможность длительное время контролировать заболевание, не давать ему развиваться, и дать, таким образом, дополнительные месяцы, годы, а иногда десятилетия жизни. А иногда, когда препарат оказывается неэффективным, участие в исследовании ничего не дает пациенту. И пациент, когда ему предлагается участие в КИ, информируется о том, что польза от исследования может быть, а может не быть. В последнем случае есть польза только науке, в которой отрицательный результат тоже важен.
В любом случае, пациент, участвующий в исследовании, получает лечение и контроль за лечением по общемировым стандартам. В ходе исследования нет проблем сделать пациенту необходимые обследования в нужное время, назначить что-то дополнительно. При этом, все процедуры, обследования и лекарственные препараты по исследованию пациент получает бесплатно.
Это обуславливает то, что многие пациенты хотят принимать участие в КИ, поскольку КИ все-таки предоставляет шанс и обеспечивает высокое качество лечебного процесса.
И вот тут мы возвращаемся к вопросу, как туда попасть. И для этого опять придется вернутся к тому, кто исследования организует.
Организуют спонсоры чаще всего спонсор - фармкомпании. Не имея возможности проводить клинические исследования самостоятельно, они заключают контракты с врачами-исследователями, которые проводят уже исследования на базе клиник. Но на деньги фармкомпаний. Какие врачи и клиники интересны фармкомпаниям для таких контрактов? Те, что, во-первых, смогут набрать достаточное (заказанное фармкомпанией) количество испытуемых, во-вторых, качественно провести исследование (в соответствии с планом фармкомпании и правилами GCP) и обеспечить достоверность результатов.
Соответственно, в первую очередь спонсор исследования заинтересован в контрактах с крупными клиниками, имеющими большой поток пациентов с заболеванием, лечение которого исследуется. Бессмысленно заключать, например, контракт на исследование препарата в лечении рака почки с больницей какого-нибудь небольшого российского городка: там за год может быть таких пациентов один-два, а может и не быть вообще. А вот профильное отделение онкоурологии или химиотерапии в каком-то крупном онкологическом центре – самое то. То есть, чтобы найти исследование, нужно ехать в доступный крупный центр – там шансов больше.
Мало смысла искать исследование препарата, который уже исследован, прошел регистрацию и продается. Конечно, такое желание понятно: препарат уже заведомо эффективный, а цена высокая (тот же Сутент, эффективный при раке почки, стоит порядка 200 тысяч рублей в месяц), получить его бесплатно в рамках КИ – очень заманчиво.
Но тот же Сутент уже прошел все фазы исследований. Сейчас фармкомпания заинтересована его не исследовать, а продавать, окупать свои расходы и зарабатывать, в том числе и на новые исследования. То есть, она может и поисследовать сутент, но уже на меньшей выборке, и исходя из каких-то своих целей – изучить новые показания к применению лекарства, например. То есть, искать исследование Сутента сейчас бессмысленно, искать нужно препарат, который еще не прошел регистрацию, а находится во II - III фазе клинических исследований. Препаратов, которые перечислены в письме в начале поста это тоже касается – они уже прошли регистрацию FDA, и наборов в исследование по ним сейчас гораздо меньше, чем год-два назад.
Итак, ищем еще не зарегистрированный препарат, на первом этапе обращаясь в какую-то крупную онкологическую клинику. Не факт, что получится. При том, что в крупных клиниках практически всегда проводятся клинические исследования, совершенно не обязательно, что они проводятся именно по этому заболеванию, и именно сейчас. Например, сейчас я участвую в трех исследованиях по раку почки, но обращаться к нам с этим заболеванием бессмысленно – набора в эти исследования мы уже не проводим. И это зависит совершенно не от нас, а от условий, которые выдвинул нам спонсор. Набор проводится ограниченное время, несколько месяцев, а потом мы годы изучаем препарат на уже набранных пациентах. Откроем еще один-два набора по раку почки в разные исследования осенью-зимой, но с таким заболеванием ждать этих наборов не имеет смысла, можно не дожить, и надо искать как-то еще.
Следует еще учесть, что если препарат уже раскручен, если уже были опубликованы какие-то статьи, касающиеся его эффективности, если среди профессионалов и пациентов уже ходят слухи о том, что это что-то стоящее, попасть в КИ с этим препаратом всегда сложнее. Желающих много, количество мест ограничено. И тут бессмысленно жаловаться на то, что мы набираем мало пациентов – у нас план набора с четко оговоренным количеством больных, которое мы можем включить. Мы лишь выполняем заказ спонсора. И сами порой от этого страдаем, если видим, что препарат хороший, а включить всех больных не можем.
Как искать, если нет подходящих КИ в доступных центрах
Можно искать по тематическим сайтам. Например, я, при начале у нас какого-то исследования обычно оставляю информационное сообщение о нем на онкофоруме. Сейчас на нем не висит моих объявлений, но, например, в разделе онкоурологии висят объявления исследователя Ильи Тимофеева о наборе в исследования по раку почки. А некоторое время назад висели наши – о наборе, в том числе и в исследования по вемурафенибу при меланоме. Есть и другие тематические сайты – ракпочки.нет, где можно периодически найти объявления о наборах по тому же раку почки, исследования по другой тематике можно иногда найти на сайтах клиник и онкологических диспансеров, других онкологических ресурсах.
В результатах поиска, которые представляют из себя данные о КИ, часто перечислены страны, в которых они проводятся, контакты, куда можно обратиться.
Найти так набор в клиническое исследование можно почти всегда по почти любому заболеванию. Просто отнюдь не всегда это будет в вашем городе и иногда даже в вашей стране. Существующее законодательство позволяет бесплатно участвовать в клиническом исследовании в других странах, и, собственно то, что исследование проводится, например, в США, не препятствие к участию в нем. Проблемы тут возникают в оплате дороги, жилья, визах, каких-то дополнительных медицинских услугах, не входящих в стоимость исследования. Таким образом, поиск клинического исследования – это процесс, который требует определенного труда и затрат, связанных с перемещением в другие города, и иногда страны.
Найдя где-то подходящее клиническое исследование на clinicartrials.gov, нужно позвонить, либо списаться с теми людьми, координационными центрами, которые представлены в контактной информации. Там можно узнать, продолжается ли набор в КИ, где есть ближайший центр и с кем нужно связаться, чтобы стать кандидатом на участие в КИ. Из американского офиса крупной фармкомпании вас, вероятнее, всего, направят в российское ее представительство, если вы в России, и если в России проводится набор. Либо дадут контакты ближайшего центра в другой стране. Конечно, в реальности все происходит иногда сложнее - до кого-то не удается дозвониться, кто-то в отпуске, нужного человека может не быть на месте и попросят перезвонить, но в целом, последовательность телефонных переговоров и писем может помочь добиться цели – выйти на врача, который непосредственно занимается набором больных в исследование.
Следующая сложность, которая может возникнуть, это несоответствие пациента критериям включения в исследование. Дело в том, что в каждое исследование есть свои критерии включения и исключения, суть которых сводится к тому, чтобы создать однородную выборку больных с заданными характеристиками. Например, в исследование могут не включаться пациенты с метастазами определенных локализаций, или требуемым условием может быть определенный гистологический тип опухоли или наличие в ней определенных мутаций. Основные критерии включения и исключения всегда приводятся в аннотации к исследованию, но они всегда неполные.
Например, частым условием является хороший статус по ECOG, что означает, что пациент должен быть в хорошем самочувствии, полностью сам себя обслуживать, сохранять в той или иной мере работоспособность. Если пациент не соответствует критериям включения или у него есть критерии исключения, то как бы не хотел сам пациент, и как бы не хотел врач его включить, в это исследование врач пациента включить не может.
В этом случае приходится начинать все сначала. В связи с этим, лучше вести поиск сразу в нескольких направлениях – списываться с разными центрами, пытаться стать кандидатом в разные КИ.
На этом я закончу написание этой простыни, которая является ответом на вопрос, заданный в начале. На самом деле, я тут не осветил и малой части вопросов, касающихся клинических исследований, которые мне бы хотелось осветить. Быть может, займусь этим еще как-нибудь. Ну а тем, кто ищет - удачи в поиске!
На консультативно-диагностическую и стационарную медицинскую помощь в Онкоцентре в рамках Программы государственных гарантий бесплатного оказания гражданам медицинской помощи имеют право граждане, застрахованные в РФ по системе обязательного медицинского страхования (далее — ОМС).
КАК ПОЛУЧИТЬ КОНСУЛЬТАЦИЮ?
Предварительная запись на консультацию осуществляется:
-
при личном обращении в регистратуру;
по телефону (499) 324-24-24;
позаявкечерез сайт Центра.
Перечень необходимых документов для первичной консультации больного в Онкоцентре:
1. Направление для оказания медицинской помощи за счет средств ОМС (форма 057/у-04) из медицинской организации, в которой пациент проходит диагностику и лечение в рамках оказания первичной медико-санитарной помощи и (или) специализированной медицинской помощи.
Направление должно быть заверено личной подписью лечащего врача, личной подписью руководителя медицинской организации (уполномоченного лица), печатью лечащего врача, печатью направляющей медицинской организации, и содержать следующие сведения:
Фамилия, имя, отчество пациента, дата его рождения, адрес регистрации по месту жительства (пребывания);
Номер действующего полиса обязательного медицинского страхования и название страховой медицинской организации;
Страховое свидетельство обязательного пенсионного страхования (СНИЛС);
Код диагноза основного заболевания по Международной классификации болезней–10 (МКБ-10);
Наименование медицинской организации, в которую направляется пациент для оказания медицинской помощи за счет средств ОМС;
Фамилия, имя, отчество и должность лечащего врача, контактный телефон, электронный адрес.
3. Оригиналы и копии следующих документов пациента:
Документ, удостоверяющий личность пациента (паспорт - для взрослых, свидетельство о рождении - для детей);
Действующий полис обязательного медицинского страхования пациента;
Страховое пенсионное свидетельство (СНИЛС).
Листок нетрудоспособности (при наличии)
Обратите внимание!
Если вам отказывают в направлении (форма 057/у-04) в наш Онкоцентр, вы можете обратиться к администрации своего регионального лечебного учреждения с заявлением.
Главному врачу ЛПУ_______________ (ФИО)
От ___________ (ФИО, паспортные данные, номер медицинского полиса)
При очной консультации:
Обратиться по адресу: г. Москва ул. Каширское шоссе дом 23 (метро Каширская) консультативно-диагностическое подразделение НИИ клинической онкологии им. Н.Н. Трапезникова, регистратура №1.
После первичной консультации больной осматривается ведущими сотрудниками профильного отделения, материалы рассматриваются консилиумом онкологов в составе хирурга, химиотерапевта и радиотерапевта. Результаты консилиума оформляются документально в виде консультативного заключения о принятом решении госпитализировать больного для лечения или рекомендации лечения в медицинской организации по месту жительства.
Для ускорения сроков ожидания госпитализации необходимо иметь обязательный минимальный объем обследования для плановой госпитализации с действующим сроком обследования:
Общий анализ крови — 10 -14 дней
Общий анализ мочи — 10 -14 дней
Биохимический анализ крови (глюкоза, общий билирубин и его фракции, АСТ, АЛТ, мочевина, креатинин, щелочная фосфатаза, белок) —10--14 дней
Коагулограмма — 10 - 14 дней
Анализы крови на ВИЧ, маркеры гепатита В и С — 3 месяца
Анализ крови на сифилис — 3 месяца
Группа крови и резус фактор (учитывать наличие результата на бланке ЛПУ)
Рентгенография органов грудной клетки или флюорография — 1 год
Консультация терапевта — 1 месяц
Для женщин - консультация гинеколога, маммолога, (в возрасте до 40 лет - УЗИ молочных желёз, с 40 до 50-ти лет - маммография 1 раз в 2 года и с 50-ти лет 1 раз в год)
Просим вас обратить внимание
1. Консультация и госпитализация по ОМС возможна, если отсутствуют противопоказания и пациент обследован в необходимом объеме, что должно быть подтверждено медицинским документами.
2. Медицинский страховой полис должен быть действующим. Обратитесь в медицинскую страховую компанию, где вы застрахованы и убедитесь, что ваш медицинский страховой полис не погашен. Причины погашения полиса могут быть такими:
1) паспорт поменяли, а медицинский страховой полис нет - страховой полис недействителен.
2) не имеете российское гражданство, имеете или вид на жительство, или временную регистрацию в России - необходимо менять медицинский страховой полис ежегодно.
3) временный медицинский страховой полис действителен только 30 рабочих дней.
Информацию по вопросам оказания медицинской помощи по ОМС можно получить также в страховых компаниях:
ООО ВТБ Медицинское страхование
Для обращения граждан по вопросам медицинского страхования, экспертизы медицинской помощи, порядка получения полиса и его замене работает телефон горячей линии ОМС: 8-800-100-81-22
Московский городской фонд обязательного медицинского страхования
Почтовый адрес: 117152 Москва, Загородное шоссе, д. 8а
Отдел организации защиты прав застрахованных: +7 (495) 952-93-21
Министерство здравоохранения Российской Федерации
Почтовый адрес: 127994 ГСП-4 Москва, Рахмановский переулок, д. 3
КАК ПОЛУЧИТЬ ТАЛОН НА ВМП?
ВОЗМОЖНА ЛИ ГОСПИТАЛИЗАЦИЯ БЕЗ НАПРАВЛЕНИЯ?
Пациент может напрямую обратиться за медпомощью в федеральное учреждение. Если речь идет о плановой госпитализации, то с положительным решением комиссии онкоцентра необходимо будет обратиться за талоном на ВМП в региональный департамент здравоохранения.
КАКОВ ПОРЯДОК ГОСПИТАЛИЗАЦИИ В НИИ ДЕТСКОЙ ОНКОЛОГИИ И ГЕМАТОЛОГИИ?
После обследования, консультации специалистов в научно-консультативном отделении НИИ ДОиГ и положительного решения Комиссии по госпитализации, ребенок госпитализируется в стационарные отделения НИИ ДОиГ Онкоцентра.
ПРИ ПЛАНОВОЙ ГОСПИТАЛИЗАЦИИ НЕОБХОДИМО ПРЕДОСТАВИТЬ:
- Копию паспорта одного из родителей;
- Копию свидетельства о рождении/паспорта ребенка;
- Копию медицинского страхового полиса ребенка;
- Справку об инвалидности, если ребенок – инвалид детства;
- Копию пенсионного страхового свидетельства;
Кроме того, потребуются медицинские исследования ребенка и сопровождающего лица. Госпитализация проводится только при наличии готовых результатов обследования.
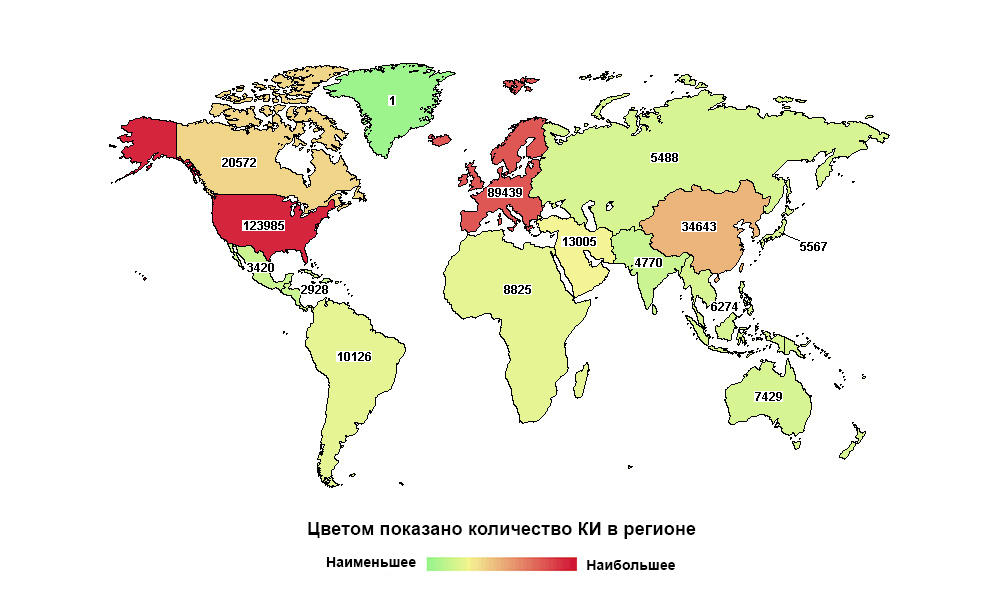
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
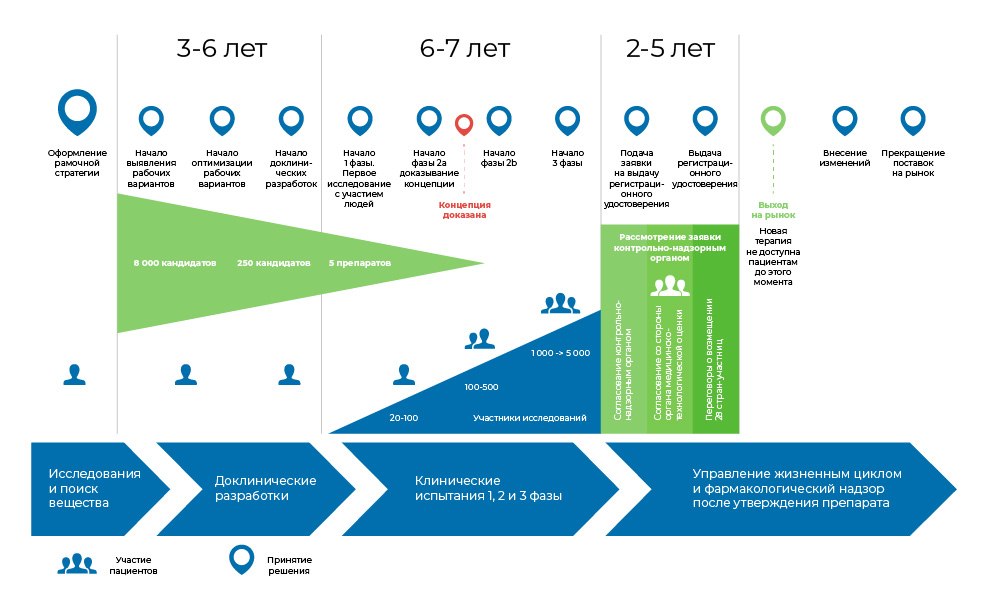
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
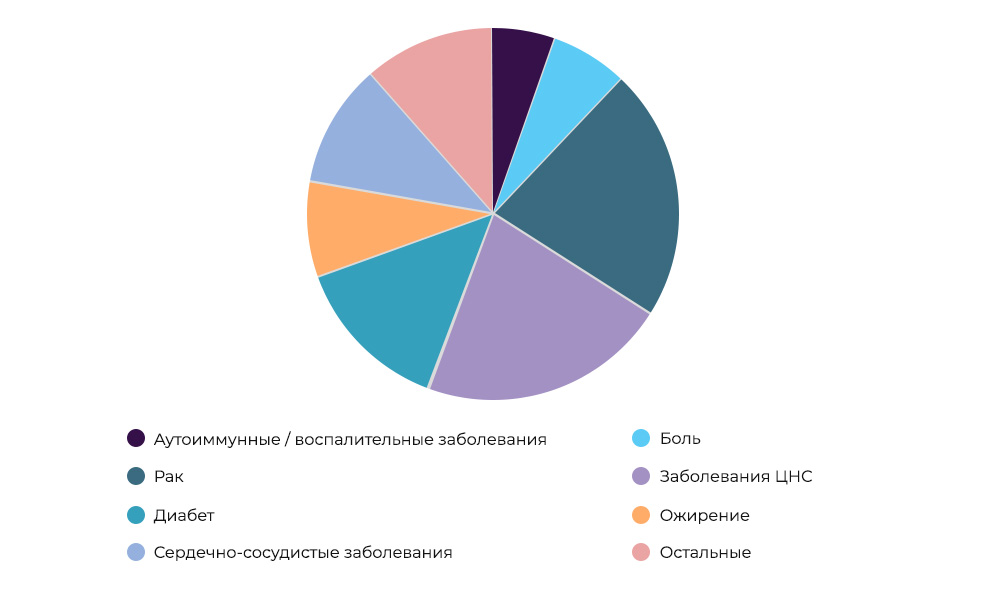
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
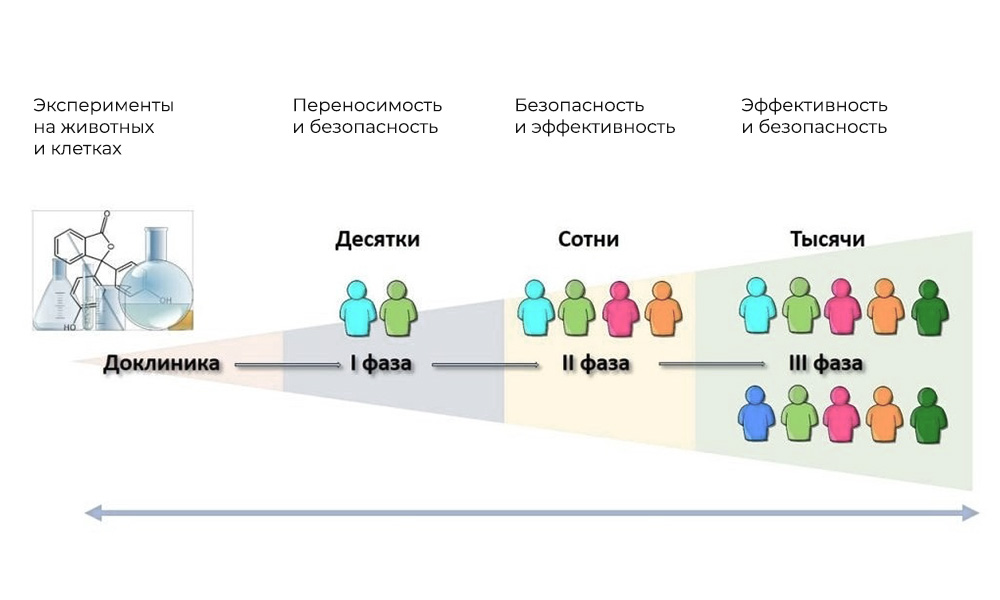
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
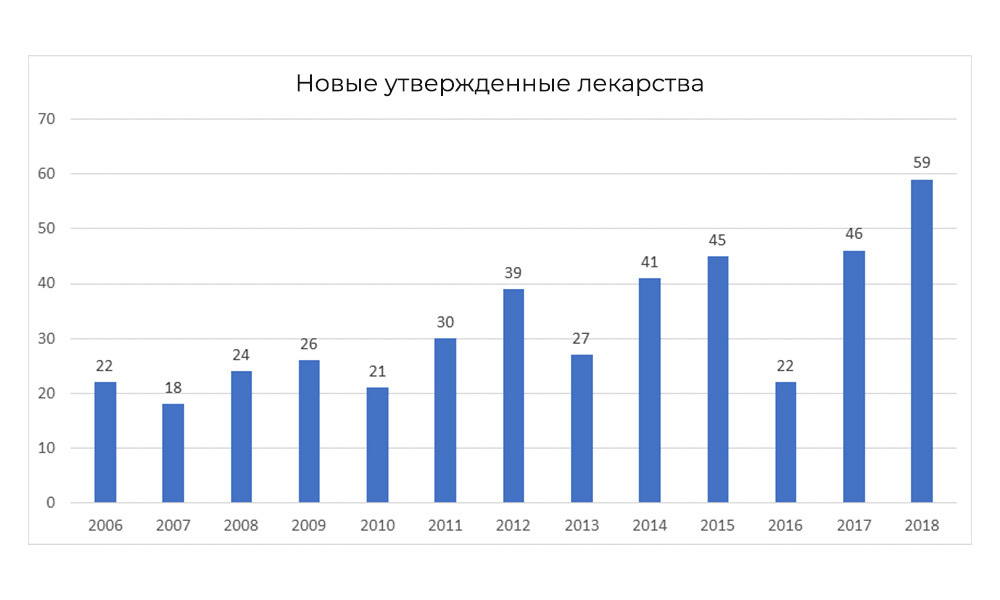
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Читайте также:

