Как находят раковый ген
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.












25 апреля отмечается Всемирный день ДНК. Этот праздник установлен в честь признания важности генетики и научных открытий, сделанных в этой области. Наша ДНК, хранит в себе генетические данные, передающиеся нам от родителей, всю информацию о человеке и, в том числе, о болезнях.
Онкология и генетика
Например, человеку достались генные изменения, которые затрудняют вывод токсинов из организма. В этом случае, если он курит или работает на токсичном производстве, вероятность заболеть раком у него выше, чем у тех, кто не имеет такой генетической программы, так как организм не в силах справиться с выводом канцерогенов.
Некоторые из распространенных видов рака могут быть вызваны наследственными генетическими мутациями. В разных поколениях одной семьи могут появляться онкологические заболевания в определенной локализации. Самые распространенные из них — рак молочной железы (РМЖ) и яичников, рак предстательной железы.
Обычно РМЖ или рак яичников возникает у женщин в возрасте старше 50 лет. Если женщина заболевает в более раннем возрасте, это может означать, что она является носителем одной из мутации генов BRCA1 или BRCA2. В нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от злокачественного перерождения. Нарушение работы BRCA1/BRCA2 приводит к нарастанию ошибок в процессе репарации ДНК, что влечет за собой увеличение риска развития рака в этих локализациях.
Неблагоприятную наследственность не надо воспринимать как фатальную, поскольку существует большая вероятность избежать возникновения рака. Для этого нужно изучить свою медицинскую родословную. Если в вашей семье встречалось более одного случая рака в определенной локализации, заболевание в каждом из парных органов (почки, грудные железы) или несколько типов рака у родственников, то вам стоит обратиться к специалисту и сдать генетический тест. Он поможет выявить индивидуальную раковую предрасположенность, снизить риск развития патологии и своевременно принять профилактические меры, или диагностировать заболевание на ранней стадии и составить эффективный план лечения.
Не следует расслабляться и при отсутствии генетических мутаций, поскольку такой факт не дает 100% гарантии отсутствия риска.Даже если у вас нет тревожных симптомов, онкологи рекомендуют ежегодно проходить плановые осмотры у основных специалистов и проводить базовые исследования, такие как анализы мочи и крови, флюорография и другие. Комплексную проверку своего здоровья можно провести, например, в рамках диспансеризации. Существуют графики таких обследований в зависимости от возраста.
Внимание к собственному здоровью позволит обнаружить на ранней стадии или даже избежать развития не только рака, но и других заболеваний. Регулярные обследования позволяют выявить злокачественные новообразования на самом раннем этапе в 95% случаев. А это значительно повышает шансы на полное выздоровление.
Наша ДНК может изменяться вследствие многих факторов, поэтому важно заботиться о своем организме. Придерживайтесь здорового образа жизни, правильно и разнообразно питайтесь, контролируйте массу тела. Поддержание этих факторов в норме существенно снижает риск развития онкологических заболеваний. Отказ от вредных привычек и профилактика инфекционных заболеваний позволяют предотвратить поломки в генах и повышают вероятность сохранить свое здоровье как можно дольше.
Зачем вакцинам клетки погибших эмбрионов
Для ряда возбудителей — особенно тех, что человек недавно получил от других видов — проблемы нет. На тканях курицы и ее яиц можно выращивать большие объемы вируса гриппа (а для массового изготовления вакцин нужны именно большие объемы), кори и много чего еще.
Казалось бы, что проще, чем взять клетку кожи обычного здорового человека из лаборантов и размножать вирусы на ней. Увы, это утопия. В наши обычные, здоровые клетки встроен механизм самоликвидации: через определенное количество делений они стареют и гибнут. А это нежелательно: по мере деления и гибели старых клеток генетический состав клеточной линии меняется.
Если мы хотим, чтобы параметры вакцины были стабильными — а любое отклонение от них может дать вакцине больше активности возбудителя, что опасно для вакцинируемого, — мы должны выращивать возбудителя в стабильных, неизменных и контролируемых условиях. То есть в таких, которые обычные, здоровые клетки человека из-за встроенного в них механизма самоликвидации просто не могут обеспечить.
Источников и тех, и других хоть отбавляй, случаев рака и абортов десятки миллионов ежегодно. Но нам нужны клетки с максимально стабильными параметрами, поэтому лучше взять клетки эмбрионов однажды и использовать их долго.
В чем итальянские исследователи обвиняют вакцину Priorix Tetra
Звучит страшновато — особенно если не знать тему. Хочется разобраться: правда это или нет? Если мы хотим понять серьезность претензий ученого, надо узнать, кто он, какова его научная репутация, можно ли ему доверять. Как он проводил свое исследование, какая у него методика. Что за ученые работают на Corvelva и как они пришли к своим выводам?
Да-да. Анонимы из Corvelva не указали в работе название лаборатории, лишь отметив, что отправили образец на анализ в одну из лабораторий в США. Заметим: они итальянцы. То есть люди делают выводы по генетическому анализу, который делали не они сами. Не очень похоже на нормальную для научного исследования последовательность действий.
Хорошо, а теперь забудем все это. Допустим, такие претензии исходили бы не от анонимов из интернета (исследователей Corvelva трудно назвать иначе: имена-то свои они назвать стыдятся), а от серьезных ученых. Методика была бы указана, название лаборатории было бы ясным — и это была бы лаборатория с хорошей репутацией. Допустим — без особых оснований, но допустим, — что все данные по анализу вакцины в работе верные.
Что тогда? Верен ли в этом случае вывод, что вакцины, чьи вирусы выращены на MRC-5, могут вести к возникновению рака у человека, привитого такой вакциной?
Если у клеточной линии есть вероятность рака, она способна проявиться на генах этой клеточной линии: какие-то из них станут раковыми. Но такие проблемы не могут проявиться у того, кто эту клеточную линию получит с инъекцией.
Что будет, если мы возьмем обычные клетки одного человека и перенесем их в ткани другого каким угодно образом? Могут ли они начать размножаться внутри него? Нет.
Напомним: в ходе половых актов люди оставляют на партнерах огромное количество клеток эпителия, в том числе на слизистых. Но никто не видел, чтобы эти клетки приживались на половом партнере. Напротив, они там гибнут. Даже если вы просто пересадите ткань (или орган) одного человека другому, иммунная реакция эту ткань убьет. Чтобы этого не происходило, стараются выращивать утраченную ткань из клеток самого пациента.
Генетический материал из клетки MRC-5 тоже не может попасть в клеточное ядро человека, получающего инъекцию вакцины. Причины аналогичные: клеточное ядро человека крепко защищено, и туда просто так не попасть. Если было бы иначе, мы бы постоянно получали генетические модификации от множества клеток микробов, живущих в симбиозе с человеком.
Зачем коту Базилио темные очки
Но разве это первый раз? Разве перед нами уже не проходили толпы мошенников всех мастей, предлагающих, допустим, пить мочу для излечения от всех болезней и снятия венца безбрачия? Или быстрейшую диктатуру пролетариата (вариант — приватизацию) как ключ к быстрому экономическому росту?
Безусловно, их обещания никогда не сбываются. Никто из людей не стал здоровее от того, что пил мочу, нигде диктатура пролетариата не ускорила экономический рост, нигде приватизация не привела к росту конкурентоспособности и рыночной доли приватизированных отраслей. Точно так же нигде отказ от вакцинации не приведет к сокращению смертности от рака: эти вещи просто никак не связаны между собой.
Об этом мы поговорили с онкогинекологом, хирургом Владимиром Носовым, руководителем Клиники гинекологии и онкогинекологии Eвропейского медицинского центра – первой клиники в России, где персонализированная терапия онкогинекологических заболеваний стала стандартной практикой.
В своём нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от опухолевого перерождения. Если возникает мутация в этих генах, здоровые клетки оказываются не защищенными и сами могут становиться злокачественными. Вероятность заболеть раком груди при носительстве мутации гена BRCA 1/2 колоссальная — до 80%(в общей популяции у женщин без мутации — около 10-12%), риск заболеть раком яичников — до 40-45 %( в популяции —около 1,5%) .
В большинстве случаев назначение этих препаратов после первой линии химиотерапии обеспечивает ремиссию около 3 лет – это огромное достижение, еще никогда в онкогинекологии ремиссия при 3-4 стадии заболевания не продлевалась каким-либо лекарством на столь длительный срок.
Дальнейшие исследования позволили выяснить, что мутации могут быть не только герминогенными, то есть присутствующими во всех клетках организма. Дополнительные 15-20% мутаций генов BRCA происходят только в клетках опухоли, но в крови и других клетках организма их нет. Эти мутации называют соматическими. Они не передаются по наследству, не увеличивают риск развития других онкологических заболеваний, но пациенты, у которых обнаружены мутации в клетках опухоли, также являются кандидатами для лечения ингибиторами PARP.
В Институте онкологии EMC мы предлагаем всем пациентам с раком яичников провести полное секвенирование генов BRCA опухоли и крови. Это позволяет подобрать наиболее эффективную персонализированную терапию. Если речь идет о наследственной мутации – мы рекомендуем в обязательном порядке генетическое обследование детям, сестрам, братьям, родителям, а самим пациенткам-носителям мутации – также пройти дополнительный скрининг на рак молочных желез, риски которого колоссально повышены.
Плохое наследство
Наследственная мутация передается детям с вероятностью 50%, причем как по женской, так и по мужской линии. Носителям мы рекомендуем специальную программу наблюдения и профилактические мероприятия для снижения риска онкологических заболеваний, а также обсуждаем с ними вопросы сохранения репродуктивной функции.
Например, на днях я оперировал пациентку 57 лет с раком яичника. На плановой гистологии был подтвержден злокачественный характер опухоли. Мы провели генетическое исследование опухоли, выявили мутацию BRCA1. Затем было выполнено полное генетическое исследование по крови, чтобы понять, является ли мутация соматической (присутствующей только в опухоли) или герминогенной (наследственной). Выяснилось, что мутация наследственная. Мы рекомендовали пройти обследование двум дочерям пациентки, которые, к сожалению, унаследовали эту мутацию. Женщины-близнецы, им сейчас 31 год, обе еще не планировали беременность и роды. Я рекомендовал им обратиться к репродуктологу, провести стимуляцию и заморозить яйцеклетки, а в 35 лет, именно с этого возраста риски рака яичников начинают расти, удалить профилактически яичники и маточные трубы. В этом случае мы сохраняем матку, и в будущем они смогут выносить своих биологических детей.
Более того, во время ЭКО можно провести предимплантационную диагностику и подсадить эмбрионы, не унаследовавшие мутацию. Таким образом, будущее поколение уже будет защищено.
Рак эндометрия (рак тела матки) – самое распространенное онкогинекологическое заболевание у женщин. Сегодня подходы к его лечению также меняются благодаря персонализированной терапии.
До недавних пор считалось, что существует два типа рака эндометрия. Наиболее частый, первого типа, обычно возникает у полных пациентов, часто с сопутствующими диабетом и гипертонией. Второй – серозный, более агрессивный, не связанный с избытком эстрогенов. На основании клинической картины врачи принимали решение о необходимости дополнительного лечения после операции. Сегодня, благодаря лучшему пониманию биологии опухоли, мы знаем, что этих типов не два, а четыре. И для каждого из них предусмотрено определенное лечение. Чтобы определить, с каким типом рака эндометрия мы имеем дело, достаточно для начала провести иммуногистохимическое исследование.
Каждую опухоль эндометрия вне зависимости от стадии, мы тестируем на наличие определенных молекул, указывающих на благоприятный или менее благоприятный прогноз заболевания. Например, наличие мутации гена P53 говорит о менее благоприятном прогнозе. В этом случае мы рекомендуем не только наблюдение, но и дополнительное лечение с помощью химио-или лучевой терапии.
Некоторые раки матки, так же, как и некоторые раки яичников и молочной железы, имеют в своей основе генетический синдром – синдром Линча. Если мы находим проявления синдрома Линча в опухоли, мы направляем пациентов на полноценное генетическое тестирование. Это важно, потому что рак матки – не единственное заболевание, к которому предрасположены носители мутаций, вызывающих синдром Линча. В частности, у них повышен риск рака толстой кишки в молодом возрасте.
Часто первым возникает рак матки, через какое-то время развивается рак толстой кишки.
Поэтому носителям синдрома Линча рекомендуют начинать скрининг на рак кишки не в 45-50, а гораздо раньше — с 30 лет и делать колоноскопию раз в 6 или 12 месяцев, чтобы не пропустить развитие заболевания.
Выявление синдром Линча у пациентки с раком матки может повлиять и на лечение.
При поздних стадиях пациентам с синдромом Линча мы назначаем специфическую иммунотерапию препаратом пемпролизумаб, что позволяет улучшить прогнозы пациентов.
Генетическое профилирование опухоли – это колоссальный прорыв, который позволил нам подойти к полностью персонализированной терапии в онкологии, основанной не только на диагнозе, но и на понимании биологии опухоли. Для пациентов — это возможность получить точное узкоспециализированное лечение, дающее лучшие результаты, а в случае наследственных раков — возможность защитить будущие поколения от опасных заболеваний.

Мир семимильными шагами двигается к персонифицированной медицине, где важнейшую роль будет играть изучение генетических факторов человека. Это знание поможет не только вылечивать, но и предотвращать страшные болезни, например рак.
Анджелина Джоли – не просто голливудская звезда, но и настоящий боец! Мать и тётя актрисы в относительно молодом возрасте погибли от так называемого наследственного опухолевого синдрома. И Анджелина со свойственной ей решительностью превентивно (то есть заранее) удалила себе молочные железы и яичники (органы – мишени для наследственного рака, высокий риск которого обнаружил её генетический анализ). Первой из публичных личностей она открыто призналась, что сделала операцию, чтобы спастись от ещё несуществующей, но без экстренных мер практически неотвратимой угрозы. Личный риск Джоли, по подсчётам врачей, составлял 87%. Так она создала важный прецедент, который наверняка поможет сохранить жизнь многим женщинам во всём мире!

Это не случайность
Спорадический (то есть случайный) рак может возникнуть у любого. Главная причина болезни – генетические мутации в клетках. С годами в организме их накапливается критическое количество, поэтому развитие опухолей в пожилом возрасте – явление закономерное и почти неотвратимое. Как любят говорить онкологи, каждый человек доживёт до своего рака, если только раньше не погибнет от инфаркта или инсульта.
Но есть и наследственные формы болезни, поколениями поражающие людей из одной семьи. Путь к раку для носителей определённых мутаций в генах короче, чем у других людей. Если обычной клетке для превращения в раковую необходимо накопить 5–6 значимых мутаций, то при наследственном генном дефекте достаточно 4–5.
На долю наследственных опухолевых синдромов приходится лишь 5% среди всех онкологических заболеваний. Но риск стать жертвой страшной болезни для людей, которые носят в себе дефектный ген, не просто выше, чем у других, – он практически фатален. Например, риск заболеть раком молочной железы для обычной женщины составляет около 8–12%, а для носительниц мутаций в гене BRCA1 – больше 60%.

Тревожные признаки
Причина наследственного рака – в полученной от родителей мутации какого-то одного гена, из-за которого опухоль развивается в конкретном органе. Причём наличие семейной истории в этом случае не так важно. Например, если брать самый частый из наследственных синдромов рака молочной железы (РМЖ) и яичников (РЯ), то он может проявиться даже у женщины, в семье которой никто не страдал этим заболеванием. Ведь патогенную мутацию можно унаследовать и от отца.
У наследственного опухолевого синдрома есть чёткие клинические признаки:
Вид наследственного рака
Вклад
в заболеваемость
Гены, мутация в которых повышает риск
Рак молочной железы
BRCA1, BRCA2, CHEK2 и другие
Рак толстой кишки
MLH1, MSH2, MSH6, PMS2
CDH1, BRCA1, BRCA2
Рак поджелудочной железы
Рак предстательной железы
Медуллярный рак щитовидной железы
Приговор отменяется!
Например, при угрозе наследственного рака молочной железы и яичников мероприятия по ранней диагностике (УЗИ, маммография, сдача онкомаркеров) не слишком эффективны. Доказано, что они не гарантируют своевременное выявление опухоли. А рак яичников и вовсе часто выявляется только на запущенных стадиях. Более того, целый ряд новообразований склонен давать метастазы и на первой стадии, поэтому даже раннее выявление заболевания не всегда спасает от смерти. Особенно это характерно для некоторых наследственных опухолевых синдромов. Так, при выявлении РМЖ на первой стадии шансы прожить 5 и более лет есть как минимум у 98% женщин, а для носительниц мутаций в гене BRCA1 этот показатель всего 82%.

Наследственный медуллярный рак щитовидной железы относится к редким заболеваниям и вызывается патогенными мутациями в онкогене RET. Выявление у ещё здорового человека такой мутации – веское основание, чтобы заранее удалить щитовидку. Установлено, что просто частые наблюдения не защитят человека от гибели, а своевременная операция практически полностью снижает риск заболевания. Утрата органа эффективно компенсируется заместительной гормонотерапией.
При угрозе наследственного рака толстой кишки регулярные наблюдения, наоборот, очень эффективны. Исследования доказали, что, если делать колоноскопию каждые 1–2 года, можно достоверно уменьшить риск смерти от этой болезни. Профилактические операции на здоровой толстой кишке обычно не проводятся. Как не удаляют и те органы, утрата которых ведёт к существенному снижению качества жизни. Поэтому органы желудочно-кишечного тракта, части скелета, головной мозг хирурги, конечно, удалять не станут.

Важно
Одно из самых значимых достижений биомедицины последних лет – полногеномное секвенирование (NGS). Оно позволяет всего за несколько дней проанализировать ДНК любого человека. Благодаря ему наши знания о генетических патологиях многократно увеличатся уже в ближайшем будущем. Возможно, полногеномный анализ, который пока ещё слишком дорогое удовольствие (стоит тысячи долларов), в скором времени станет инструментом скрининга.
1. Делайте прививки!
Прививка от гепатита В (вызывает рак печени) и ВПЧ (причина рака шейки матки) может предотвратить 1,1 млн случаев рака в год.
2. Прогресс в онкогематологии
В конце ХХ века 60% детей, больных острым лейкозом, умирали, а сейчас в 90% случаев это заболевание излечивается полностью.
3. Не опускайте руки!
Сейчас в мире насчитывается около 28 млн человек, излечившихся от рака. Большинство из них – женщины, победившие рак груди.

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Когда родственник заболевает раком, нам страшно. В какой-то мере страшно и за свое здоровье – передается ли рак по наследству? Прежде чем делать поспешные выводы и впадать в панику, давайте разберемся с этим вопросом.
По своей сути, рак – генетическое заболевание, которое возникает вследствие поломки генома клетки. Раз за разом в клетке происходит последовательное накопление мутаций, и она постепенно приобретает свойства злокачественной – малигнизируется.

Генов, которые участвуют в поломке, несколько, и перестают работать они не одновременно.
- Гены, кодирующие системы роста и деления, называются прото-онкогенами. При их поломке клетка начинает бесконечно делиться и расти.
- Есть гены-супрессоры опухолей, отвечающие за систему восприятия сигналов от других клеток и тормозящие рост и деление. Они могут сдерживать рост клетки, а при их поломке этот механизм выключается.
- И, наконец, есть гены репарации ДНК, кодирующие белки, которые чинят ДНК. Их поломка способствуют очень быстрому накоплению мутаций в геноме клетки.
Генетическая предрасположенность к онкологии
Существует два сценария возникновения мутаций, вызывающих онкологические заболевания: ненаследственный и наследственный. Ненаследственные мутации появляются в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения. В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет.
Однако, в 5-10% случаев предопределяющую роль играет наследственность. Происходит это в том случае, когда одна из онкогенных мутаций появилась в половой клетке, которой посчастливилось стать человеком. При этом каждая из примерно 40*1012 клеток организма этого человека также будет содержать начальную мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой.
Повышенный риск развития рака передается из поколения в поколение и называется наследственным опухолевым синдромом. Встречается данный синдром довольно часто – примерно у 2-4% населения.
Несмотря на то, что основную массу онкологических заболеваний вызывают случайные мутации, наследственному фактору также необходимо уделять серьезное внимание. Зная об имеющихся унаследованных мутациях, можно предотвратить развитие конкретного заболевания.
Предрасположенность к раку наследуется как Менделевский доминантный признак, иными словами, как обычный ген с различной частотой возникновения. При этом вероятность возникновения в раннем возрасте у наследственных форм выше, чем у спорадических.
Распространенные генетические исследования
Коротко расскажем вам об основных видах генетических исследований, которые показаны людям из группы риска. Все эти исследования можно провести в нашей клинике.
Определение мутации в гене BRCA
В 2013 году благодаря Анджелине Джоли весь мир активно обсуждал наследственный рак молочной железы и яичников, о мутациях в генах BRCA1 и BRCA2 теперь знают даже неспециалисты. Из-за мутаций теряются функции белков, кодируемых этими генами. В результате основной механизм репарации (восстановления) двунитевых разрывов молекулы ДНК нарушается, и возникает состояние геномной нестабильности – высокой частоты мутаций в геноме клеточной линии. Нестабильность генома является центральным фактором канцерогенеза.
Учеными описано более тысячи различных мутаций в этих генах, многие из которых (но не все) связаны с повышенным риском возникновения онкологического заболевания.
У женщин с нарушениями в BRCA1/2 риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания – всего 5,6%. Растет вероятность развития злокачественных опухолей и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин – и в предстательной железе.
Генетическая предрасположенность к наследственному неполипозному колоректальному раку (синдром Линча)
Колоректальный рак – одно из самых распространенных онкологических заболеваний в мире. Около 10% населения имеет генетическую предрасположенность к нему.
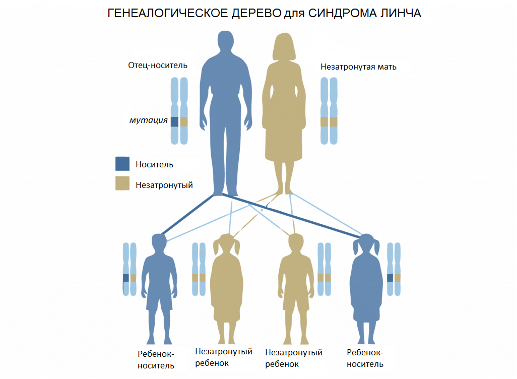
Генетический тест на синдром Линча, также известного как наследственный неполипозный колоректальный рак (НПКР), определяет заболевание с точностью 97%. Синдром Линча – наследственное заболевание, в результате которого злокачественная опухоль поражает стенки толстого кишечника. Считается, что около 5% всех случаев колоректального рака связаны с этим синдромом.
Определение мутации в гене BRaf
При наличии меланомы, опухолей щитовидной или предстательной железы, опухоли яичников или кишечника рекомендуется (а в некоторых случаях обязательно) проведение анализа на BRaf мутацию. Это исследование поможет выбрать необходимую стратегию лечения опухоли.
BRAF – это онкоген, который отвечает за кодировку белка, располагающегося в сигнальном пути Ras-Raf-MEK-MARK. Этот путь, в норме, регулирует деление клеток под контролем фактора роста и различных гормонов. Мутация в онкогене BRaf приводит к избыточному неконтролируемому разрастанию и устойчивости к апоптозу (запрограммированной смерти). Результатом является в несколько раз ускоренное размножение клеток и рост новообразования. По показаниям данного исследования специалист делает заключение о возможности использования ингибиторов BRaf, которые продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией.

Методика проведения анализа
Любой генетический анализ – сложная многоэтапная процедура.
Генетический материал для анализа берут из клеток, как правило, из клеток крови. Но в последнее время лаборатории переходят на неинвазивные методы и иногда выделяют ДНК из слюны. Выделенный материал подвергается секвенции – определению последовательности мономеров при помощи химических анализаторов и реакций. Эта последовательность и является генетическим кодом. Полученный код сравнивают с эталонным и определяют, какие участки относятся к тем или иным генам. На основании их наличия, отсутствия или мутации делают заключение о результатах теста.
Сегодня в лабораториях множество методов генетического анализа, каждый из них хорош в тех или иных ситуациях:
За счет большого количества химических реактивов процедуры генетических исследований достаточно финансово затратные.. Мы стараемся устанавливать оптимальную стоимость всех процедур, поэтому цена на такие исследования у нас начинается от 4 800 рублей.
Группы риска
В группы риска по наследственному раку попадают люди, у которых наблюдается хотя бы один из перечисленных факторов:
- Несколько случаев одного вида рака в семье
(например, рак желудка у деда, отца и сына); - Заболевания в раннем для данного показания возрасте
(например, колоректальный рак у пациента моложе 50 лет); - Единичный случай определенного вида рака
(например, рак яичников, или трижды негативный рак молочной железы); - Рак в каждом из парных органов
(например, рак левой и правой почки); - Больше одного типа рака у родственника
(например, сочетание рака молочной железы и рака яичников); - Рак, нехарактерный для пола пациента
(например, рак молочной железы у мужчины).
Если для человека и его семьи характерен хотя бы один фактор из списка, то следует получить консультацию у врача-генетика. Он определит, есть ли медицинские показания для того, чтобы сдавать генетический тест.
Чтобы обнаружить рак на ранней стадии, носителям наследственного опухолевого синдрома следует проходить тщательный скрининг на онкологические заболевания. В некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
При проведении теста опухоль анализируется, составляется индивидуальный молекулярный паспорт. В комплексе с анализом крови, в зависимости от требуемого теста, проводится комбинацирование различных анализов на геном и белок. В результате данного теста появляется возможность назначения таргетной терапии, эффективной для каждого типа имеющейся опухоли.
Профилактика
Бытует мнение, что для определения предрасположенности к раку можно сделать простой анализ на наличие онкомаркеров – специфических веществ, которые могут быть продуктами жизнедеятельности опухоли.
Повышение показателя может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. В то же время, есть примеры людей с онкологическими заболеваниями, у которых значения онкомаркера оставались в пределах нормы. Специалисты используют онкомаркеры как метод для отслеживания протекания уже обнаруженного заболевания, результаты которого нужно перепроверять.
Для выявления вероятности генетической наследственности в первую очередь, если вы входите в группу риска, нужно обратиться за консультацией к врачу-онкологу. Специалист, исходя из вашего анамнеза, сделает вывод о необходимости проведения тех или иных исследований.
Важно понимать, что решение о проведении какого-либо теста должен принять именно врач. Самолечение в онкологии неприемлемо. Неправильно интерпретированные результаты не только могут вызвать преждевременную панику – вы попросту можете упустить наличие развивающегося онкологического заболевания. Выявление рака на ранней стадии при наличии вовремя поставленного правильного лечения дает шанс на выздоровление.
Стоит ли паниковать?
Рак – неизбежный спутник долгоживущего организма: вероятность накопления соматической клеткой критического числа мутаций прямо пропорциональна времени жизни. То, что рак – генетическое заболевание, не значит, что оно наследственное. Он передается в 2-4% случаев. Если у вашего родственника обнаружили онкологическое заболевание – не впадайте в панику, этим вы навредите и себе, и ему. Обратитесь к врачу-онкологу. Пройдите исследования, которые он вам назначит. Лучше, если это будет специалист, который следит за прогрессом в области диагностики и лечения рака и в курсе всего, что вы сами только что узнали. Следуйте его рекомендациям и не болейте.
Читайте также:





