Как медь при соединении с хлором
Тем не менее, в силу того, что использование медных труб в системах водоснабжения и отопления для России относительно новое, зачастую и у заказчиков, и у строителей возникают различные вопросы по проектированию, монтажу и эксплуатации. Один из таких вопросов о совместимости медных труб с хлорированной водой.
Итак, какое же вредное влияние имеет хлор, содержащийся в питьевой воде на медные трубы? Ответ – никакого. Вредного – никакого. По всей вероятности, почвой для предположения о вредоносном воздействии хлора на медь послужило такое его вредное воздействие на некоторые виды ЛАТУНИ, используемый при производстве различной сантехнической арматуры. Дело в том, что у латуней с высоким содержанием цинка при взаимодействии хлором, особенно на горячей воде, происходит т.н. обесцинкивание, в результате чего латунь утрачивает свою прочность. Явление это известно давно и поэтому добросовестные изготовители для применения в хлорированной воде производят арматуру из латуни с пониженным содержанием цинка. Но, поскольку, латунь является одним из сплавов меди и даже имеет схожий цвет, многие строители, от незнания, распространили свойство латуни на медные трубы.
На самом деле, систематическое воздействие раствора хлора может оказать вредной влияние на медные трубы при уровне его содержания свыше . 50 мг/л. С той оговоркой, что такой уровень содержания хлора в питьевой и даже технической воде не может быть достигнут даже теоретически. А при реально достижимых в системах водоснабжения величинах содержания свободного хлора он оказывает на медные трубы. положительное влияние, способствую образованию и/или поддержанию на внутренней стенке труб тонкого слоя твердого трудно растворимого слоя окисла меди, например, малахита, которые продлевает срок службы медных труб свыше заявленных. Так, например, в США зачастую используют именно насыщенные растворы хлора (до 200 мг/л) не только для целей эффективной дезинфекции медных систем, но и для ускорения образования на внутренней поверхности упомянутого защитного слоя. Точности ради следует заметить, что большинство труб европейского производства в результате применяемой технологии подготовки товарной продукции УЖЕ имеют на внутренней поверхности защитную пленку из окиси меди, поэтому гиперхлорирование для таких труб не требуется и, хоть и не критично, но противопоказано: высокие уровни хлора могут смыть тонкую заводскую защитную пленку, хотя на ее месте начнет образовываться новая, другая защитная пленка. А США товарная трубная продукция защитной пленки не имеет, поэтому гиперхлорирование при промывке обосновано.
В крайне редком случае сочетании с некоторыми другими веществами, теоретически содержащимися в питьевой воде, вредной действие хлора на медь может начаться (но не обязательно) уже с уровня 5-6 мг/л, что моделировалось в лабораторных условиях, но, повторимся, такой уровень содержания хлора в воде не только невероятен для сетей централизованного водоснабжения, но и не допустим по причинам, имеющим значение для здоровья населения.
В качестве примера можно привести опыт Гонконга, где медные трубы являются не просто основным, а почти единственным материалом для трубопроводов систем питьевого водоснабжения, исключая стояки из ВЧШГ в небоскребах. Так вот, верхний предел по содержанию свободного хлора в питьевой воде в Гонконге установлен не уровне не 0,5 мг/л (как в России), а на уровне 5 мг/л, т.е. в 10 раза выше! Причины понятны: в климатических условиях Юго-Восточной Азии выше риски лавинообразного распространения нежелательных бактерий и микробов. Но дело не в этом. При том, что среднегодовые значения по содержания остаточного свободного хлора в питьевой воде в Гонконге на кране у потребителя составляют всего 0,6 мг/л (т.е. практически равны и даже чуть выше ВЕРХНЕГО предела, установленного в России), сезонные колебания включают повышения до упомянутых 2 мг/л (т.е. в 4 раза больше, чем верхний допустимы предел в России). И так много десятков лет. Есть ли в Гонконге из-за этого какие либо проблемы с медными трубами или гигиеническими показателями воды? Ответ известен – нет! Теория и практика, в данном случае Гонконга, находятся в полном согласии. А практика, заметим, все-таки один из критериев истины!

При этом, как известно, реальную опасность хлорированная вода таит для полимерных труб. Так, у нас есть свидетельства того, что некоторые добросовестные производители полимерных труб ограничивают их применение в случае, если содержание свободного хлора в воде превышает 0,1 мг/л. Как видно из приведенных норм, реальное содержание хлора в воде силу требований СанПиН-а в России выше. Другой вопрос состоит в том, что некоторые производители или продавцы полимерных труб не предупреждают потребителя об ограничениях, связанных с хлором, но это пусть остается на совести самих таких производителей и продавцов.
Реакция взаимодействия меди и хлора.










Уравнение реакции взаимодействия меди и хлора:
Медь взаимодействует с хлором . Реакция взаимодействия меди и хлора представляет собой сгорание меди в атмосфере хлора .
Реакция меди и хлора протекает при условии: при предварительном нагревании меди до температуры 200-300 °C.
В результате реакции происходит образование хлорида меди .
В ходе реакции меди и хлора при стандартных условиях выделяется тепловая энергия (теплота).
Таким образом, реакция меди и хлора носит экзотермический характер.










- ← Реакция цинка и хлора
- Реакция кальция и азотной кислоты →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 881)
- Экономика Второй индустриализации России (101 438)
- Программа искусственного интеллекта ЭЛИС (22 600)
- Метан, получение, свойства, химические реакции (15 872)
- Мотор-колесо Дуюнова (15 086)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 439)
- Природный газ, свойства, химический состав, добыча и применение (13 912)
- Крахмал, свойства, получение и применение (13 490)
- Прямоугольный треугольник, свойства, признаки и формулы (13 042)
- Целлюлоза, свойства, получение и применение (11 893)
- Пропилен (пропен), получение, свойства, химические реакции (11 632)
- Этилен (этен), получение, свойства, химические реакции (11 146)
- Бутан, получение, свойства, химические реакции (9 831)
- Оксид алюминия, свойства, получение, химические реакции (9 354)
- Оксид железа (III), свойства, получение, химические реакции (9 129)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Химические свойства меди
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
С азотом металлический хром взаимодействует при температурах более 1000 o С:
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
Особенности атомных структур элементов побочных подгрупп
В данной главе мы будем рассматривать элементы побочных подгрупп I—VIII группы. Все они являются элементами больших периодов.
Элементы этих подгрупп имеют свои особенности в строении атомов. У элементов главных подгрупп происходит постепенное завершение внешнего электронного слоя, который содержит только s— и р-оболочки. У элементов же побочных подгрупп предвнешний слой находится в процессе завершения, а внешний слой при этом, как правило, сохраняет неизменно 2 электрона. На предвнешнем слое возникает и заполняется d-оболочка, состоящая из 5 d-орбиталей. На каждой орбитали 2 электрона, поэтому заполнение d-орбиталей происходит последовательно у 10 элементов, расположенных по возрастанию порядковых номеров. Элементы побочных подгрупп всех групп, за исключением I и II, принадлежат к числу d-элементов.
Валентными у элементов побочных подгрупп являются электроны, расположенные как во внешнем слое на s-орбиталях, так и на d-орбиталях более глубокого предвнешнего слоя. Таким образом, для этих элементов характерно образование различного числа валентных связей. Легче всего, разумеется, участвуют в образовании химической связи электроны внешнего слоя; их в атоме один или два. Такое строение атома типично для металла, поэтому элементы побочных подгрупп обладают обычно металлическими свойствами.
■ 1 . Начертите схемы строения атомов скандия, титана, ниобия. (См. Ответ)
Укажите электронные конфигурации внешнего и предвнешнего электронных слоев их атомов. Изобразите размещение электронов внешнего и предвнешнего слоев по орбиталям.
2. В чем отличие структуры внешнего электронного слоя атомов элементов главных подгрупп от атомов элементов побочных подгрупп.
3. Какими свойствами должны обладать элементы побочных подгрупп в связи с строением их атомов.
4. Сколько электронов вмещает d-оболочка электронного слоя? (См. Ответ)
Начнем рассмотрение элементов побочных подгрупп с подгруппы меди. К элементам подгруппы меди относятся медь Сu, серебро Ag и золото Аu, расположенные в побочной подгруппе I группы. Распределение электронов по энергетическим уровням у этих элементов приведено в табл. 22.
Радиусы атомов элементов побочной подгруппы значительно меньше радиусов атомов элементов главной подгруппы, поэтому электрон внешнего электронного слоя с большим трудом отрывается от атома. Как видно из табл. 22, эти элементы имеют сходное строение не только внешнего, но и предвнешнего слоя, и мы вправе ожидать от них большого сходства химических свойств.
В табл. 23 приведены физические свойства металлов подгруппы меди.
■ 5. Сравните радиусы атомов щелочных металлов и металлов подгруппы меди тех же периодов. Какой вывод можно сделать?
6. Почему у элементов подгруппы меди электрон внешнего слоя удерживается прочнее, чем в атомах щелочных металлов?
7. К какой группе металлов по плотности следует отнести металлы подгруппы меди? (См. Ответ)
Медь Сu
Химический знак Сu, атомный вес 63,54. Медь — типичный металл, поэтому ее атомы связаны между собой металлической связью. Электронная конфигурация предвнешнего и внешнего электронных слоев меди выглядит следующим образом: 3s 2 3p 6 3d 10 4s 1 .
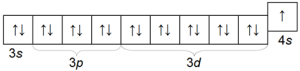
По внешнему виду медь — вещество красного цвета с характерным металлическим блеском. Медь — довольно мягкий металл, однако намного тверже, чем щелочные.
Следует отметить высокую пластичность меди, которую она проявляет не только в нагретом, но и в холодном состоянии. Благодаря своей мягкости и пластичности медь может быть подвергнута холодной обработке. Отсюда широкое использование этого металла для изготовления художественных изделий при помощи чеканки. Не только сама медь, но и все металлы этой подгруппы обладают высокой пластичностью.
Медь что это такое
Один из лучших проводников тепла и электричества, однако для использования ее в этих целях медь обычно хорошо очищают от примесей других металлов, так как даже от незначительных загрязнений ее электропроводность сильно уменьшается.
Химические свойства меди и ее аналогов очень отличаются от свойств щелочных металлов, расположенных в главной подгруппе I группы. Так, они располагаются в ряду напряжений после водорода. Степень окисления меди в окислительно-восстановительных реакциях +1 или +2. Других степеней окисления медь обычно не проявляет.
Медь довольно легко сплавляется с другими металлами, образуя ряд сплавов, наиболее распространенными из которых являются бронза (сплав, состоящий из меди и олова) и латунь (сплав меди и цинка).
При обычной температуре медь постепенно вступает во взаимодействие с кислородом, двуокисью углерода и влагой воздуха, превращаясь в основной карбонат меди. Этот процесс протекает очень медленно и объясняет причину, по которой изделия из меди с течением времени покрываются зеленым налетом.
При прокаливании на газовой горелке медь покрывается черным налетом окиси меди СuО. Нагретая медь довольно легко вступает во взаимодействие с хлором, образуя хлорид меди (II), и с некоторыми другими неметаллами.
С разбавленными кислотами медь обычно в реакции не вступает, так как не может вытеснить водород, но с разбавленной азотной кислотой реагирует без вытеснения водорода, однако с выделением окиси азота. С концентрированными серной и азотной кислотой медь также вступает в окислительно-восстановительную реакцию, которая также протекает без вытеснения водорода. Во всех названных реакциях медь в основном проявляет свою высшую валентность II. Соединения одновалентной меди получить значительно сложнее.
■ 8. Какова электронная конфигурация внешнего и предвнешнего слоя атома меди? (См. Ответ)
9. Перечислите физические свойства меди и укажите, где они находят себе применение.
10. Напишите следующие уравнения реакций, характеризующих химические свойства меди: а) взаимодействие с кислородом; б) взаимодействие с хлором; в) взаимодействие с водой, кислородом и двуокисью углерода воздуха; г) с концентрированными серной и азотной кислотами; д) с разбавленной азотной кислотой.
Все уравнения рассмотрите с точки зрения окислительно-восстановительных процессов. Если реакция ионная, запишите уравнение в полной и сокращенной ионной форме.
11. Для получения медного купороса CuSO4-5H2O медный лом прокаливают на воздухе и получившийся продукт обрабатывают 70% серной кислотой. Сколько меди и раствора серной кислоты израсходуется на получение 125 т медного купороса? Напишите уравнения протекающих при этом реакций.
12 Приведите все известные вам способы получения хлорида меди (II), сульфата меди (II), нитрата меди (II), исходя из чистой меди. Уравнения реакций записывайте в ионной форме, а в окислительно-восстановительных указывайте окислитель и восстановитель. Для реакций можно использовать дополнительно любые вещества. Процессы можно вести с любым количеством промежуточных веществ.
13. Почему металлическую медь можно получить электролизом раствора хлорида, а металлический натрий — нельзя. (См. Ответ)
Медь образует два ряда соединений—соединения двухвалентной и одновалентной меди.
Соединения двухвалентной меди — это СuО (окись меди), гидроокись меди и наиболее распространенные соли.
Окись меди представляет собой твердое вещество черного цвета, поступает в лаборатории в виде порошка или гранул (гранулированная окись меди). Ее получают обычно из металлической меди путем прокаливания на воздухе, а также разложением солей, например:
Cu2(OH)2CO3 = 2CuO + Н2O + CO2
Окись меди — основной окисел, при обычных условиях весьма устойчивый. При небольшом нагревании окись меди довольно легко восстанавливается водородом или углеродом до металлической меди:
СuО + С = Сu + СО СuО + Н2 = Сu + Н2O
С водой окись меди никогда не реагирует, поэтому соответствующее ей основание — гидроокись меди Си(ОН)4— никогда не образуется путем взаимодействия окисла с водой. Гидроокись меди — слабое нерастворимое основание, легко вступает во взаимодействие с кислотами с образованием солей:
Сu(ОН)2 + H2SO4 = CuSO4 + 2Н2O
Cu(OH)2 + 2Н + + SO 2- = Cu 2+ + SO 2 4 — + 2H2O
Cu(OH)2 + 2H + = Cu 2+ + 2H2O
Взаимодействие со щелочами при некоторых условиях возможно, но совершенно нетипично, хотя и свидетельствует об очень слабо выраженных амфотерных свойствах. Гидроокись меди легко растворяется в аммиаке, образуя раствор ярко-синего цвета. Этот раствор нередко применяется в органической химии для разного рода качественных реакций, а также иногда для обработки целлюлозы.
Гидроокись меди легко разлагается даже при простом хранении на воздухе:
Cu(OH)2 = СuО + Н20
При этом она чернеет, превращаясь постепенно в черную окись меди.
Из солей меди наиболее распространены медный купорос CuSO4 · 5H2O, хлорид меди СuСl2 · 2Н2O, нитрат меди Cu(NO3)2 · 3H2O, сульфид меди CuS. Кристаллогидраты медных солей при нагревании довольно легко отдают кристаллизационную воду, теряя свою окраску. Обычно кристаллические медные соли и их растворы имеют красивую голубую окраску. Медные соли используют для борьбы с сельскохозяйственными вредителями, в текстильной промышленности для изготовления красителей.
В природе медь встречается в виде минерала — самородной меди, однако чаще ее добывают в виде сульфидов (важнейшие—халькозин Cu2S, халькопирит CuFeS2 ит.д). Полученную из них медь очищают электролизом (рафинируют), а затем используют для изготовления проводов медных сплавов и других изделий.
■ 14. Как осуществить ряд превращений: (См. Ответ)
Сu → Cu(NO3)2 → CuO → Cu(OH)2 → CuSO4 → CuCl2.?
15. Окись меди прокалили в токе водорода, затем обработали концентрированной азотной кислотой до прекращения выделения бурого газа, далее, добавив щелочи, получили студенистый голубой осадок. Какие химические процессы происходили? Напишите их уравнения в молекулярной и ионных формах.
16. Даны окись меди, вода, серная кислота, нитрат серебра. Как, не имея других веществ, получить медь, нитрат меди, сульфат меди.
17. Смесь карбоната и нитрата меди подвергли прокаливанию. Что останется в реакционном сосуде после прокаливания? Каков состав выходящей смеси газов?
18. Смесь меди с окисью меди обработали 30% азотной кислотой. При этом выделилось 2,8 л окиси азота. Известно, что в составе смеси медь составляет 40% Какой объем раствора азотной кислоты был израсходован на реакцию? (См. Ответ)
Серебро и золото
Серебро Ag и золото Аu — аналоги меди, но относятся к числу так называемых благородных металлов. Такое название возникло из-за того, что эти металлы обладают значительной химической стойкостью к окислению.
Электронные конфигурации внешних и предвиешних слоев атомов серебра и золота:
Ag 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Au 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1 .
Серебро и золото — наиболее ковкие металлы, причем на первом месте по мягкости и ковкости стоит золото, а серебро — на втором. Однако по электро- и теплопроводности на первом месте находится серебро. Цвет у этих металлов различный. Серебро белого цвета, а золото — желтого.
Как уже было сказано, серебро и золото устойчивы к окислению и длительное время могут сохраняться, не изменяя внешнего вида. В связи с этим, а также благодаря мягкости они легко шлифуются, полируются и потому используются для разного рода поделок и украшений. Золото применяют в стоматологии для изготовления зубных коронок. Серебро также используют в медицине для изготовления некоторых инструментов. Гораздо чаще, чем чистые металлы, применяют их сплавы с медью, обладающие антикоррозийной стойкостью, но благодаря меди — большей твердостью и лучшими механическими свойствами.
Несмотря на сравнительную химическую устойчивость, серебро и золото могут подвергаться воздействию некоторых реактивов. Серебро, например, может реагировать с азотной кислотой, как с разбавленной, так и с концентрированной:
Ag + HNО3 → (Ag +1 ; N +4 ) (конц.)
Ag + HNО3 → (Ag +1 ; N +2 ) (разб.)
а также с концентрированной серной кислотой:
Ag + H2SО4 → (Ag +1 S +4 )
Статья на тему Подгруппа меди
Читайте также:

