Изолированная перфузия конечности при меланоме
Опасные патологические образования в конечностях (например, неоперабельные опухоли) – одна из классических причин ампутации. Изолированная перфузия избавляет от такой перспективы. В данной методике объединены эндоваскулярная хирургия, регионарная химиотерапия, гипертермия и другие инновационные виды лечения. Хорошие результаты дает изолированная перфузия конечностей при лечении неоперабельной саркомы или меланомы, расположенной в руке или ноге.
В международной клинической практике нередко встречается английское название этой процедуры: isolated limb perfusion, или ILP. В клиниках Германии применяется название: isolierte Extremitätenperfusion, либо более полный вариант: isolierte hypertherme Extremitätenperfusion.
Extremitäten – это конечности, Perfusion значит, в широком смысле, протекание жидкости, а в данном случае – кровообращение.
Смысл процедуры состоит в том, что в конечности, пораженной опухолью, на время устанавливается собственный круг кровообращения, изолированный от организма. Для чего это нужно? В кровь, циркулирующую в конечности, добавляют высокодозированные химиопрепараты (цитостатики), разрушающие опухоль. Концентрация этих препаратов была бы губительной для организма. Но в данном случае она губительна только для опухоли.
К тому же кровь, пропускаемую по изолированному кругу, значительно нагревают против нормальных физиологических значений, что также убивает опухоль. Эндоваскулярная хирургия выступает в данном случае как один из элементов онкологического лечения.
После проведения изолированной перфузии возможна полная ремиссия опухоли. Впрочем, основная задача, которую ставят врачи (и она практически во всех случаях достижима!), – ремиссия опухоли до операбельного масштаба. Добившись значительного уменьшения опухоли, ее удаляют обычным хирургическим методом.
Следует, впрочем, отметить, что процедуры изолированной перфузии, требующие сложного оборудование и особой квалификации врачей, проводятся лишь в немногих клиниках в мире. В том числе в Германии. Мировой центр такого лечения – клиника Medias в Бургхаузене, которую возглавляет один из создателей метода изолированной перфузии, известнейший немецкий хирург, гематолог и онколог профессор Карл Райнхард Айгнер.
Как проходит процедура
Она длится около 90 минут, под полным наркозом. Перед ее началом выявляют основную артерию, питающую зону опухоли. Сюда будут введены высокодозированные цитостатики для жесткого подавления опухоли. Нередко цитостатики комбинируют с препаратами из группы факторов некроза опухоли (TNF-альфа). В результате опухоль вместе с кровью получает сильные подавляющие вещества.
Для того, чтобы изолировать кровообращение, в главную артерию пораженной конечности и в главную вену вводят баллонные катетеры. Баллоны раздуваются и блокируют кровоток. Кровообращение в изолированной конечности поддерживают через внешнюю систему (аппарат искусственного кровообращения). Это ядовитая кровь, к тому же нагретая до губительной для опухоли температуры. Полтора часа она протекает через опухоль – но не поступает в организм. В нем циркулирует чистая кровь нормальной температуры, свободная от цитостатиков. Эта кровь не поступает в изолированную конечность.
По завершении процедуры производят очистку крови из изолированной конечности. Для этого ее прогоняют аппаратом искусственного кровообращения через фильтры. Затем, спустив блокирующие баллоны, выводят их из сосудов, восстанавливая общее кровообращение.
Стоимость процедуры, разумеется, отнюдь не низкая. Но и, что называется, не поражающая воображение. Она не превышает затрат на полный курс системного лечения или на проведение операции по удалению опухоли. К тому же не будем забывать: альтернативной операцией в данном случае была бы ампутация пораженной конечности. Изолированная перфузия проводится при высокостадийной опухоли, когда спасти конечность (да и жизнь пациента!) иными способами невозможно.
Разумные затраты – этим вообще отличается эндоваскулярная хирургия. За проведение одного цикла изолированной перфузии в клиниках Германии взимают плату около трех тысяч евро. Следует, впрочем, знать, что для достижения результата циклы должны повторяться (не менее трех раз через три-четыре недели). Кроме того взимается плата и за сопутствующие процедуры, а также за пребывание в стационаре (примерно неделя при каждом цикле).
В статье рассматриваются различные аспекты использования изолированной регионарной перфузии (ИРП) у больных метастатической меланомой кожи конечности. Перечислены стандартные подходы к выполнению ИРП с описанием разных режимов перфузии, проанализированы результаты применения ИРП в мировой клинической практике. Приведены результаты собственного исследования безопасности и эффективности ИРП с мелфаланом у пациентов с меланомой кожи конечности. Безопасность процедуры оценивали по результатам рН-метрии перфузата, определения фармакокинетики мелфалана и анализа послеоперационных осложнений. Представлены результаты общей и безрецидивной выживаемости пациентов после лечения, а также проведено сравнение отдаленных результатов терапии больных, не получавших ИРП в составе комбинированного лечения, и больных, которым выполнялась ИРП. Показана эффективность ИРП в качестве адъювантной терапии у пациентов с метастатической меланомой кожи конечности.
В статье рассматриваются различные аспекты использования изолированной регионарной перфузии (ИРП) у больных метастатической меланомой кожи конечности. Перечислены стандартные подходы к выполнению ИРП с описанием разных режимов перфузии, проанализированы результаты применения ИРП в мировой клинической практике. Приведены результаты собственного исследования безопасности и эффективности ИРП с мелфаланом у пациентов с меланомой кожи конечности. Безопасность процедуры оценивали по результатам рН-метрии перфузата, определения фармакокинетики мелфалана и анализа послеоперационных осложнений. Представлены результаты общей и безрецидивной выживаемости пациентов после лечения, а также проведено сравнение отдаленных результатов терапии больных, не получавших ИРП в составе комбинированного лечения, и больных, которым выполнялась ИРП. Показана эффективность ИРП в качестве адъювантной терапии у пациентов с метастатической меланомой кожи конечности.
Меланома кожи не относится к числу наиболее распространенных злокачественных новообразований. Так, в 2014 г. в России зарегистрировано 9493 новых случая меланомы кожи и 3558 смертей от нее [1]. Однако прирост стандартизованного показателя заболеваемости меланомой с 2004 по 2014 г. составил 17,27%. У 5–8% больных меланомой по мере прогрессирования опухолевого процесса развиваются транзитные метастазы [2]. Они являются результатом попадания опухолевых эмболов в кожные и подкожные лимфатические узлы и развиваются в области между очагом первичной опухоли и дренирующим бассейном регионарных лимфатических узлов. Время от момента диагностирования первичной опухоли до появления транзитных метастазов составляет в среднем от 13 до 16 месяцев.
К факторам риска развития транзитных метастазов меланомы кожи относят большую толщину первичной меланомы (более 1 мм), изъязвление опухоли, лимфососудистую инвазию, вовлечение регионарных лимфатических узлов, локализацию опухоли на нижней конечности [3–5]. Наличие транзитных метастазов коррелирует с III стадией меланомы, которая в зависимости от наличия изъязвления первичной опухоли и одновременного вовлечения регионарных лимфатических узлов подразделяется на IIIB и IIIC стадии. Прогноз при данных стадиях неблагоприятный – общая пятилетняя выживаемость пациентов достигает 20–60% [4, 6, 7].
Золотым стандартом лечения транзитных метастазов меланомы считается хирургическая резекция. Подобная операция технически выполнима, если метастазы представлены одним или единичными поражениями, что делает возможным резекцию с последующим закрытием раны. Однако когда транзитные метастазы представляют собой множественные обширные поражения конечности, хирургическая резекция может быть ассоциирована с серьезными осложнениями или значительной деформацией пораженной конечности, что нередко приводит к отказу от данного метода лечения [8].
Возможности системной химио- (дакарбазин, темозоломид и др.) и иммунотерапии (интерфероны, интерлейкин 2), как правило, ограниченны при транзитных метастазах меланомы кожи. Лечение отличается выраженной токсичностью [8]. Данное обстоятельство подтолкнуло ученых к поиску новых лечебных методик, позволяющих доставлять высокие концентрации противоопухолевых препаратов в пораженную конечность при минимальном риске системной токсичности. Изоляция пораженной конечности (транзитные метастазы по определению находятся в пределах конечности) от системного кровообращения должна способствовать реализации данной концепции. В 1958 г. O. Creech и E.T. Krementz разработали и применили на практике технологию, получившую название изолированной регионарной перфузии (ИРП) [9].
Техника и режимы изолированной регионарной перфузии
Пораженную конечность можно изолировать путем хирургического доступа к подвздошным, бедренным, подколенным, подмышечным или плечевым артериям и венам. Магистральные для пораженного региона сосуды клипируются и канюлируются проксимальнее уровня локализации опухоли, после чего канюли подключаются к замкнутому перфузионному контуру. Для достижения максимальной изоляции конечности проксимальнее уровня канюляции накладывается пневматический жгут [2, 10]. Длительность перфузии обычно составляет для верхней конечности 30 минут, для нижней – 60 минут.
Стандартным препаратом для ИРП является мелфалан с оптимальным профилем эффективности и токсичности для данной методики [11]. При ИРП удается достичь 20-кратной концентрации лекарственного препарата в пораженной конечности по сравнению с концентрацией, создаваемой системной химиотерапией [12]. Стандартными дозами мелфалана при ИРП для нижней и верхней конечностей считаются 10 и 13 мг/л объема конечности соответственно [2].
В 1990-х гг. D. Lienard и соавт. показали, что фактор некроза опухоли (ФНО) альфа, системное введение которого во многом не оправдало ожиданий из-за серьезных побочных эффектов, может безопасно использоваться в условиях ИРП и повышать уровень ответа на лечение как при меланоме кожи, так и при саркоме мягких тканей конечности [13]. С тех пор комбинацию мелфалана и ФНО-альфа стали широко применять при ИРП у пациентов с транзитными метастазами меланомы кожи. ФНО-альфа используют в дозе 2 мг для нижней конечности, в дозе 1 мг – для верхней конечности.
Гипертермия является важным компонентом методики ИРП, поскольку обладает самостоятельным цитотоксическим действием, а также усиливает захват лекарственных препаратов опухолевыми клетками [14, 15]. Температура перфузата в диапазоне 41,5–43 о С считается наиболее эффективной с точки зрения увеличения ответа на лечение [16], в то же время часто приводит к развитию тяжелых послеоперационных осложнений (вплоть до ампутации конечности) и характеризуется выраженной токсичностью [17]. Именно поэтому в клинической практике температуру перфузата при ИРП обычно поддерживают на уровне 40–41 о С [10, 18].
Чтобы обеспечить минимальное системное воздействие химиопрепарата, циркулирующего в изолированном перфузионном контуре, необходимо следить за скоростью циркуляции перфузата и отсутствием утечек.
Кроме того, ИРП рекомендуется проводить в условиях оксигенации, чтобы поддерживать нормальную оксигенацию и рН изолируемой области [8].
По окончании перфузии проводят промывку перфузионного контура физиологическим раствором, чтобы предотвратить попадание оставшейся дозы противоопухолевого препарата в системный кровоток после деканюляции и удаления пневматического жгута с конечности.
Безопасность и эффективность изолированной регионарной перфузии
Осложнения ИРП подразделяют на системную токсичность, обусловленную утечкой препарата в системный кровоток, и местную.
Сегодня, когда ИРП выполняется опытными хирургами в специализированных онкологических центрах, случаи возникновения клинически значимой утечки противоопухолевых препаратов (более 10% введенной дозы) крайне редки, поэтому серьезные проявления системной токсичности также регистрируются редко [2].
Местная токсичность ИРП оценивается в соответствии со схемой, предложенной J. Wieberdink и соавт. [19]. Риск ампутации конечности после ИРП (5-я степень токсичности) низкий – 0–2%. Токсичность 3-й и 4-й степени регистрируется у 4–26% пациентов. В большинстве случаев после ИРП отмечается 1-я (нет реакции) или 2-я (умеренная эдема/эритема) степень токсичности [20].
Поскольку вопрос об эффективности ИРП в качестве адъювантной терапии остается спорным [21–24], данная методика используется преимущественно для улучшения локального контроля над заболеванием, а также с паллиативной целью для купирования местных симптомов. ИРП позволяет добиться у пациентов с транзитными метастазами меланомы кожи конечности ответа на лечение, которого не удается достичь при использовании других методик: частота полных ответов составляет 26–91%, частичных – 9–50%. Общая частота ответов на лечение – 69–100% (табл. 1) [20, 25–33].
Следует отметить, что ИРП показывает лучшие результаты по сравнению с другой методикой регионарного лечения меланомы кожи – изолированной регионарной инфузией. Преимуществом последней перед ИРП считается малоинвазивность [20].
Систематический обзор 22 исследований подтвердил эффективность добавления ФНО-альфа к мелфалану: средняя частота полных ответов у 556 пациентов, получавших при ИРП комбинацию ФНО-альфа и мелфалана, составила 68,9% против 46,5% у 562 больных, у которых ИРП выполнялась только с мелфаланом [34].
Частота рецидивов после ИРП достигает 50%, а длительность ответа на лечение, как правило, превышает один год [35]. В случае рецидива предлагается использовать такую же тактику, как и для транзитных метастазов меланомы в целом: местное иссечение опухоли, если это технически выполнимо, а при распространенном процессе – повторную ИРП. В нескольких исследованиях показано, что у определенной категории пациентов терапевтический эффект повторной ИРП не уступает эффекту первой процедуры [36, 37].
Отсутствие клинических исследований, посвященных сравнительной оценке отдаленных результатов ИРП с результатами других методов лечения, не позволяет сделать вывод об эффективности методики с точки зрения увеличения выживаемости больных. Медиана общей выживаемости пациентов после ИРП составляет около двух лет, причем данная величина коррелирует с ответом на лечение [35]. По данным одноцентрового клинического исследования с участием 103 пациентов с транзитными метастазами меланомы кожи, пятилетняя общая выживаемость больных после ИРП составила 26%, безрецидивная – 12% [38].
Материал и методы исследования
В исследование изолированной регионарной перфузии конечности, проведенное в НИИ онкологии им. Н.Н. Петрова, были включены 24 пациента с меланомой кожи конечности (табл. 2), которым в период с 2004 по 2014 г. в отделении общей онкологии им. Н.Н. Петрова была выполнена ИРП.
16 больным с множественной диссеминацией транзитных метастазов меланомы кожи ИРП конечности была проведена в индукционном режиме, восьми больным меланомой кожи конечности – в адъювантном режиме (после широкого иссечения местного рецидива или одиночного транзитного метастаза).
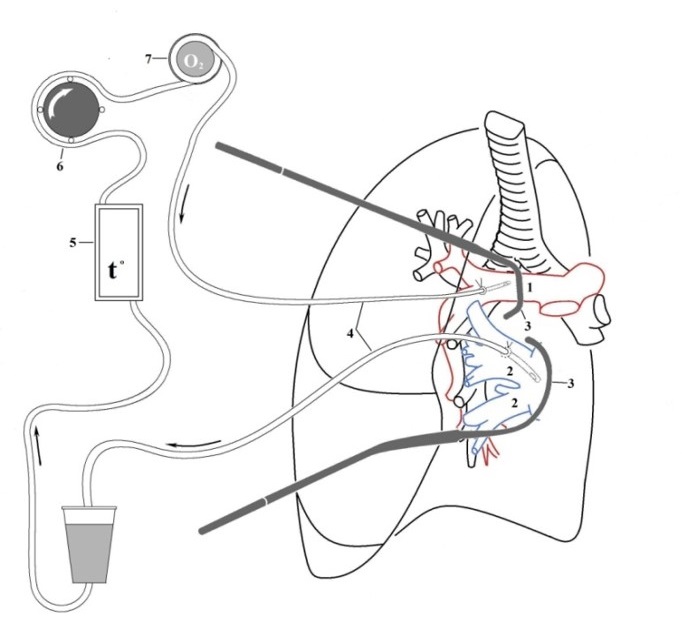
ИРП выполнялась по следующей методике [10, 39]. На первом этапе выделялись, канюлировались и клипировались магистральные для пораженного региона сосуды проксимальнее уровня локализации опухоли. Одновременно с данными манипуляциями системно вводили гепарин из расчета 100 ЕД/кг. Далее резервуар заполняли перфузатом – 500 мл 0,9%-ного раствора NaCl, содержащего 5000–10 000 ЕД гепарина. Для предупреждения сброса цитостатика в системный кровоток через коллатеральное кровообращение накладывали жгут проксимальнее уровня канюляции. Затем изолированную сосудистую сеть подсоединяли к перфузионному контуру (рис. 1).
Температура перфузата во время ИРП составляла 40–41 о С. В качестве противоопухолевого препарата использован мелфалан, доза которого рассчитывалась как 10 мг/л объема нижней конечности и 13 мг/л объема верхней конечности. Во время перфузии проводили непрерывный мониторинг не только температуры, но и рН-перфузата с помощью рН-метра в составе технической перфузионной установки.
В послеоперационном периоде регулярно контролировали общее состояние больных и показатели лабораторных исследований. Степень местной токсичности оценивали по системе J. Weiberdink и соавт. [19]. Системное токсическое действие на организм определяли по шкале токсичности (критерии СТС NCIC) [40]. Пациенты, которым ИРП была выполнена в неоадъювантном режиме, через две-три недели были подвергнуты контрольному объективному и инструментальному обследованию, по результатам которого оценивали эффект лечения.
Статистическая обработка полученных результатов была проведена с помощью пакетов программ IBM SPSS Statistics 20.0 и GraphPad.
Результаты и их обсуждение
Интраоперационных осложнений при проведении ИРП не зафиксировано. На рис. 2 представлены результаты рН-метрии перфузата при ИРП нижней конечности.
Резкий скачок в значении рН произошел в первые пять минут перфузии, когда кровь из изолированной области смешивалась с физиологическим раствором, которым предварительно был заполнен перфузионный контур. Далее на протяжении ИРП показатель рН перфузата менялся незначительно и в среднем составлял 7,19 ± 0,40. В норме pH крови человека поддерживается в пределах 7,35–7,47. Таким образом, уровень рН в изолированном контуре не отличается от физиологических значений, что является одним из подтверждений безопасности процедуры ИРП и косвенным доказательством достаточности оксигенации перфузируемого региона.
При анализе образцов перфузионного раствора установлено, что в процессе ИРП конечности концентрация мелфалана уменьшалась и к моменту завершения процедуры составляла в среднем 3,3% исходной дозы (рис. 3). Несмотря на клипирование магистральных сосудов перфузируемой конечности и циркулярное наложение жгута выше места канюлирования сосудов, при проведении ИРП конечности у всех больных отмечался сброс цитостатика в системный кровоток (рис. 4).
В процессе ИРП конечности в системный кровоток четырех больных (из десяти, у которых брали пробы) попало менее 1,0 мг мелфалана. У оставшихся шести пациентов в крови было обнаружено от 1 до 1,6 мг мелфалана. Относительно используемых доз системный сброс мелфалана в проведенном исследовании не превысил 1,6%, что подтверждает незначительный уровень системной утечки во время ИРП. Полученные данные позволяют говорить о том, что концентрация мелфалана в перфузионном растворе в процессе ИРП конечности снижалась в основном за счет его накопления в мягких тканях конечности и опухолевых тканях.
Несмотря на использование более высоких доз мелфалана для ИРП, системная токсичность не отличалась от таковой при стандартных схемах химиотерапии. Системная токсичность у больных после проведения ИРП была обусловлена сбросом через многочисленные сосудистые коллатерали цитостатика из замкнутого контура в системный кровоток. Частота возникновения гранулоцитопении 3–4-й степени составила 29%, тромбоцитопении 3–4-й степени – 22%. При этом в 36% случаев показатели тромбоцитов крови оставались в пределах нормальных значений. Анемия 3–4-й степени зафиксирована у 45% больных. Однако основной причиной анемии, наблюдаемой с первых дней послеоперационного периода, была интраоперационная кровопотеря – в среднем 930 мл (диапазон 400–2800 мл). Такая выраженная кровопотеря была связана с методикой выполнения ИРП, в основном из-за кровопотери при канюлировании сосудов и процедуре отмывания, когда происходит потеря раствора, содержащего как цитостатик, так и форменные элементы крови.
Из симптомов местной токсичности чаще регистрировались отек конечности, гиперемия кожи, боли по ходу сосудов, парестезия.
Важный момент: у некоторых пациентов ИРП приводила к полному или частичному местному разрешению опухолевого процесса (рис. 5).
Медиана наблюдения пациентов с меланомой кожи конечностей составила 23 месяца (5–50 месяцев). В ходе динамического наблюдения из 24 больных живы восемь, из них четверо − без признаков опухолевого процесса, четверо – с наличием местно-распространенного опухолевого процесса без признаков отдаленного метастазирования (у одного больного местное прогрессирование опухолевого процесса). 16 больных в период динамического наблюдения умерли в результате прогрессирования и дальнейшей генерализации опухолевого процесса. Медиана безрецидивной выживаемости после выполнения ИРП составила 13 ± 4,2 месяца, годичная безрецидивная выживаемость – 54%, двух- и трехлетняя – 35%, четырехлетняя – 26%. Общая годичная выживаемость пациентов с меланомой кожи конечностей после выполнения ИРП достигла 83%, общая двух-, трех- и четырехлетняя выживаемость – 46,5, 33 и 25% соответственно. Полученные результаты соотносятся с литературными данными об отдаленных результатах ИРП у больных меланомой кожи конечности [35].
Результаты лечения сравнивали у больных меланомой кожи конечностей, у которых совместно с хирургическим вмешательством выполнялась ИРП, и у пациентов без нее (контрольная группа). Контрольную группу составили 54 пациента с меланомой кожи конечностей, которым проведено хирургическое либо комбинированное лечение без применения ИРП. Годичная безрецидивная выживаемость больных, получавших ИРП, достигла 54%, двух- и трехлетняя – 35%, четырехлетняя – 26%, медиана безрецидивной выживаемости – 13,0 ± 4,2 месяца. В то же время у пациентов контрольной группы, которым было проведено специализированное лечение без ИРП, показатель годичной безрецидивной выживаемости составил 29%, двухлетней – 18,5%, трех- и четырехлетней – 11%, медиана периода без прогрессирования – 4,9 ± 0,9 месяца (рис. 6), что было достоверно ниже, чем в группе с ИРП.
Аналогичная ситуация имела место при анализе общей выживаемости больных меланомой кожи конечности. Общая годичная выживаемость пациентов, получавших комбинированное лечение по поводу множественной диссеминации транзитных метастазов меланомы кожи конечностей с ИРП без полного удаления опухолевых узлов, составила 87%, двухлетняя – 42%, трехлетняя – 25%. При этом показатель общей годичной выживаемости пациентов с множественной диссеминацией транзитных метастазов меланомы кожи конечностей, получавших паллиативное лечение без ИРП, составил 35%, двухлетней – 6% (рис. 7).
Таким образом, нам удалось показать, что ИРП действительно эффективна с точки зрения улучшения отдаленных результатов лечения пациентов с метастатической меланомой кожи конечности при использовании в качестве адъювантной терапии.
Лечение транзитных метастазов меланомы кожи остается сложной задачей для онкологов во всем мире. За последние 50 лет изолированная регионарная перфузия зарекомендовала себя как безопасная и эффективная технология и стала важной составляющей мультимодального подхода к лечению больных меланомой кожи конечностей.
Будучи одной из разновидностей регионарной химиотерапии, ИРП позволяет добиваться хорошего терапевтического ответа, превосходящего таковой системной химиотерапии. Кроме того, ИРП эффективна у пациентов, у которых возможности других методов лечения исчерпаны.
Несмотря на то что основными показаниями к применению ИРП остаются местный контроль над злокачественным процессом и облегчение местных симптомов заболевания, данная методика, как показывает наш опыт и опыт некоторых зарубежных авторов, может быть весьма эффективна в адъювантных условиях после иссечения опухолевых очагов. Для подтверждения данных результатов требуется проведение сравнительных клинических исследований, по итогам которых место ИРП среди существующих подходов к лечению метастатической меланомы кожи может быть пересмотрено.
Эффективных методов лечения большинства метастатических опухолей не существует. Однако разработка и внедрение в клиническую практику комплексных подходов к лечению онкологических больных с использованием перфузионных технологий значительно изменили ситуацию с оказанием помощи таким больным.
Химиоперфузия – что это за метод лечения?
В результате этого создается высокая концентрация препаратов в месте локализации опухоли, при минимальном всасывании в системный кровоток. Таким образом, появляется возможность для максимально агрессивного воздействия на опухоль при незначительной системной токсичности, которая часто заставляет пациентов прерывать или прекращать курсы внутривенной химиотерапии.
В этом и состоит основное преимущество химиоперфузии — с ее помощью создается максимальная концентрация химиопрепаратов, действующих локально на опухоль. При обычной системной химиотерапии такие дозы невозможны, организм больного просто не смог бы выдержать воздействие такого количества токсичных препаратов.
При химиоперфузии уменьшается риск побочных эффектов и значительно снижается общая токсичность лечения.
В сочетании с химиоперфузией часто применяется тепловая обработка клеток опухоли (гипертермия), которая оказывает самостоятельное противоопухолевое действие и усиливает действие химиопрепаратов.
Виды химиоперфузии
Существует несколько видов химиоперфузии, в зависимости от того, через какую часть организма или органа осуществляется циркуляция раствора химиопрепарата:
- Внутрибрюшинная химиоперфузия – для пациентов с опухолевым поражением брюшной полости (перитонеальный канцероматоз);
- Химиоперфузия плевральной полости – для пациентов с опухолевым поражением плевры;
- Изолированная химиоперфузия легкого – для пациентов с метастатическим поражением легких;
- Изолированная химиоперфузия конечности – для пациентов с местно-распространенными формами меланомы кожи и саркомы мягких тканей конечности.
По температурному режиму:
- Гипертермическая
- Нормотермическая
По цели процедуры:
- Лечебная
- Паллиативная
Как проходит химиоперфузия
Во время операции нужный орган изолируется при помощи систем катетеров и на него направляется противоопухолевый препарат с помощью внешнего насоса аппарата искусственного кровообращения.
Аппаратно-техническое обеспечение химиоперфузии имеет следующую принципиальную схему (рис. 1):
- Специальный резервуар содержит перфузат (смесь физраствора и цитостатика)
- Перфузионный насос обеспечивает циркуляцию перфузата по замкнутому контуру.
- Термостатирующее устройство поддерживает температуру перфузата на заданном уровне.
- Система управления и контроля
К основным факторам, определяющим эффективность химиоперфузии, относятся:
- Температура перфузата;
- Вид и объем перфузата;
- Длительность перфузии;
- Техника выполнения перфузии;
- Противоопухолевый препарат и его доза.
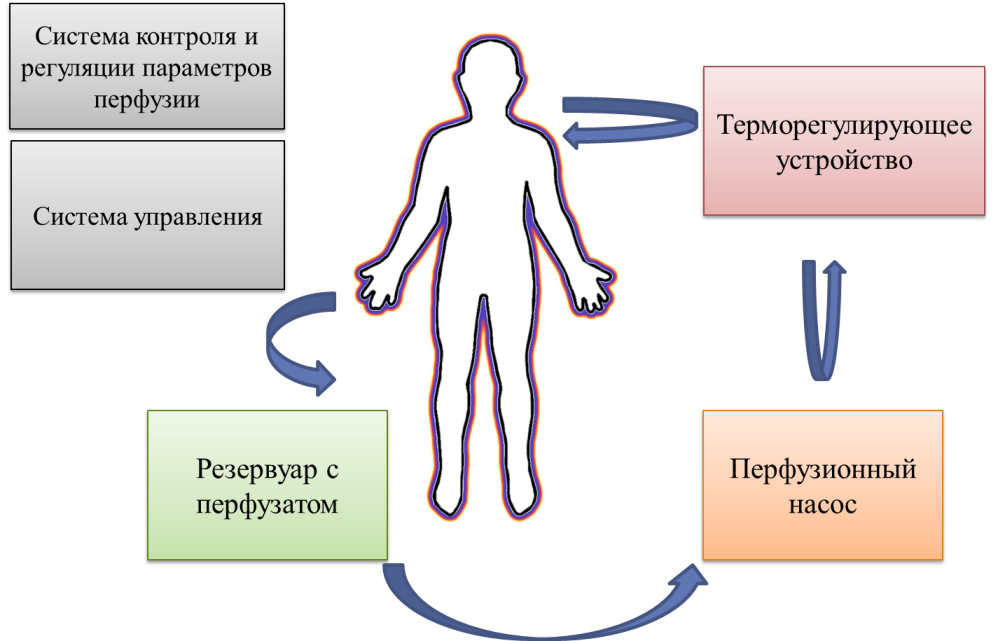
Рис. 1. Схема аппаратно-технического обеспечения химиоперфузии
Аппараты для проведения химиоперфузии начали разрабатываться и использоваться в клинической практике с 1990-х годов.
Изолированная химиоперфузия легкого
Метод изолированной химиоперфузии легкого с использованием одного аппарата искусственного кровообращения, подключаемого через полости сердца, был предложен в начале 70-х годов прошлого столетия. Но даже сегодня на тему проведения изолированной химиоперфузии легкого опубликовано, пожалуй, наименьшее количество работ и доступно наименьшее количество информации в сравнении с другими видами химиоперфузии. Это во многом обусловлено сложностью выполнения процедуры – немногие врачи владеют техникой ИХПЛ – а также особенностями послеоперационного ведения таких пациентов, куда входит комплекс мер по профилактике и лечению осложнений.
Каким пациентам необходима изолированная химиоперфузия легкого (ИХПЛ)?
Основным методом оказания помощи больным раком легких является хирургический. Для пациентов с 3-4 стадией, с метастатическими изменениями в лёгких, результаты лечения не всегда являются удовлетворительными. В зависимости от локализации первичной опухоли пятилетняя выживаемость таких больных составляет не более 40 %.
Важным недостатком хирургического лечения является невозможность удаления микрометастазов легочной ткани, высокая вероятность того, что при множественном метастатическом поражении не все метастазы будут обнаружены и удалены во время хирургического вмешательства. Это впоследствии приводит к появлению новых метастазов в легких более чем у трети оперированных пациентов. В таких случаях приходится выполнять повторные операционные вмешательства, отличающиеся повышенным травматизмом и осложненным послеоперационным течением.
Одним из перспективных путей улучшения результатов лечения пациентов с метастатическим поражением лёгких считается комбинированное лечение. Во время хирургического вмешательства, после хирургического удаления легочных метастазов, проводится изолированная перфузия органа противоопухолевым препаратом в высокой дозе.
Противопоказания к ИХПЛ
Абсолютные противопоказания к ИХПЛ:
- Острая сердечно-сосудистая недостаточность
- Острое нарушение мозгового кровообращения
- Декомпенсированная и терминальная полиорганная недостаточность
- Наличие метастазов в других органах
- Невозможность выполнения полной метастазэктомии
Аппарат для ИХПЛ представлен на рисунке 2 и состоит из следующих элементов:
- центробежный перфузионный насос,
- блок управления насосом,
- мембранный оксигенатор, выполняющий также роль резервуара,
- фильтр.
Кроме этого, в состав перфузионного контура входит термостатирующее устройство, поддерживающее температуру перфузата на требуемом уровне.

Рис. 2. Аппарат для изолированной химиоперфузии легкого
На таком аппарате в НМИЦ онкологии им. Н.Н. Петрова ИХПЛ производится в течение 30 мин при температуре перфузата 37ºС. В качестве перфузата используется стерильный физиологический раствор объемом 1000-1500 мл. В качестве противоопухолевого препарата для ИХПЛ, как правило используется мелфалан (30-50 мг) или цисплатин (110-135 мг/м 2 ).
Послеоперационный период у пациентов после изолированной химиоперфузии легкого
В послеоперационном периоде все пациенты проходят:
- контрольное рентгенологическое обследование органов грудной клетки;
- лабораторные исследования:
- клинический анализ крови;
- биохимический анализ крови;
- коагулограмма;
- определение газового состава крови;
- общий анализ мочи.
- Электрокардиография.
Кроме того, в послеоперационном периоде проводится лечение, включающее кратковременную профилактическую антибактериальную терапию, терапию антикоагулянтами, коррекцию водноэлектролитных нарушений, терапию, направленную на предотвращение развития отека легкого, а также симптоматическая терапия.
Проведение ИХПЛ в процессе хирургического вмешательства по поводу внутрилегочных метастазов позволяет достоверно увеличить показатели общей и безрецидивной выживаемости больных с метастатическим поражением легких.
В НМИЦ онкологии им. Н.Н. Петрова накоплен наибольший в России опыт выполнения как полостных, так и изолированных регионарных химиоперфузий у онкологических больных.
Мировой лидер по выполнению изолированной химиоперфузии легкого — заведующий хирургическим торакальным отделением НМИЦ онкологии им. Н.Н. Петрова, д.м.н., профессор, Евгений Владимирович Левченко. Эффективность процедуры составляет 50% (то есть стойкая ремиссия наступила у каждого второго пациента). За 10 лет, с 2010 по 2017 год им выполнено 168 перфузий.
В 2017 г. за одну из таких операций Е.В. Левченко удостоен премии фонда им. академика В.Н. Перельмана – в 2009 г. хирург провел ИХПЛ 17-летней пациентке с многочисленными метастазами в легких. Во время вмешательства он удалил в общей сложности 70 метастазов и добился стойкой ремиссии несмотря на агрессивность первичной опухоли – остеогенной саркомы. На момент вручения награды прошло почти 9 лет после операции, пациентка благополучно живет без признаков прогрессирования.

Кроме ИХПЛ в Центре занимаются химиоперфузиями конечностей и брюшной полости. С 2004 по 2017 г. сделано более 150 регионарных химиоперфузий конечностей – этой темой занимается заведующий научным отделением онкоурологии и общей онкологии, д.м.н. Георгий Иванович Гафтон.
Перфузия брюшной полости выполняется в НМИЦ онкологии им. Н.Н. Петрова с 2008 года на отделениях общей онкологии и урологии (д.м.н. Георгий Иванович Гафтон), онкогинекологии (к.м.н. Константин Джамильевич Гусейнов), абдоминальной онкологии (д.м.н. Алексей Михайлович Карачун). Использование внутрибрюшинной химиоперфузии специалистами разных отделений объясняется тем, что метод применяется у пациентов с перитонеальным канцероматозом (опухолевое поражение брюшной полости), который развивается у пациентов с колоректальным раком, раком яичников, желудка, опухолями аппендикса. Почти за 10 лет было выполнено около 100 перфузий.


Авторская публикация:
КИРЕЕВА ГАЛИНА СЕРГЕЕВНА
старший научный сотрудник научной лаборатории канцерогенеза и старения, кандидат биологических наук,
Председатель Совета молодых ученых НМИЦ онкологии им. Н.Н. Петрова
Читайте также:

