Ионная связь между фосфором и хлором

Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для того, чтобы разорвать связь и отбросить фрагменты молекулы на бесконечно большое расстояние.
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Известны следующие основные типы химической связи: ковалентная (полярная и неполярная), ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счёт образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то её называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая её электронная пара смещается в сторону более электроотрицательного атома, но остаётся связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щёлочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O. Подробнее о шкале Полинга будет рассказано в следующем уроке.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решётку. В этой решётке их удерживают общие для всего металла электроны (электронный газ).
Тренировочные задания
1. Ковалентной неполярной связью образовано каждое из веществ, формулы которых
2. Ковалентной полярной связью образовано каждое из веществ, формулы которых
3. Только ионной связью образовано каждое из веществ, формулы которых
4. Металлическая связь характерна для элементов списка
1) Ba, Rb, Se
2) Cr, Ba, Si
3) Na, P, Mg
4) Rb, Na, Cs
5. Соединениями только с ионной и только с ковалентной полярной связью являются соответственно
6. Ионная связь образуется между элементами
1) хлором и бромом
2) бромом и серой
3) цезием и бромом
4) фосфором и кислородом
7. Ковалентная полярная связь образуется между элементами
1) кислородом и калием
2) серой и фтором
3) бромом и кальцием
4) рубидием и хлором
8. В летучих водородных соединениях элементов VA группы 3-го периода химическая связь
1) ковалентная полярная
2) ковалентная неполярная
3) ионная
4) металлическая
9. В высших оксидах элементов 3-го периода вид химической связи с увеличением порядкового номера элемента изменяется
1) от ионной связи к ковалентной полярной связи
2) от металлической к ковалентной неполярной
3) от ковалентной полярной связи до ионной связи
4) от ковалентной полярной связи до металлической связи
10. Длина химической связи Э–Н увеличивается в ряду веществ
11. Длина химической связи Э–Н уменьшается в ряду веществ
12. Число электронов, которые участвуют в образовании химических связей в молекуле хлороводорода, —
13. Число электронов, которые участвуют в образовании химических связей в молекуле P2O5, —
14. В хлориде фосфора (V) химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
15. Наиболее полярная химическая связь в молекуле
1) фтороводорода
2) хлороводорода
3) воды
4) сероводорода
16. Наименее полярная химическая связь в молекуле
1) хлороводорода
2) бромоводорода
3) воды
4) сероводорода
17. За счёт общей электронной пары образована связь в веществе
18. Ковалентная связь образуется между элементами, порядковые номера которых
1) 3 и 9
2) 11 и 35
3) 16 и 17
4) 20 и 9
19. Ионная связь образуется между элементами, порядковые номера которых
1) 13 и 9
2) 18 и 8
3) 6 и 8
4) 7 и 17
20. В перечне веществ, формулы которых соединения только с ионной связью, это
Помогите со схеми образования ионной связи между атомами химических элементов:
а) калия и кислорода; б) лития и хлора; в) магния и фтора.
Помощь уже в пути, держи.
а) Рассмотрим схему образования ионной связи между натрием и
кислородом.
1. Натрий — элемент главной подгруппы I группы, металл. Его атому легче отдать I внешний электрон, чем принять недостающие 7: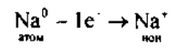
1. Кислород— элемент главной подгруппы VI группы, неметалл.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.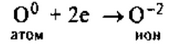
1. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
2. Схематично образование ионной связи между атомами натрия и кислорода можно записать так: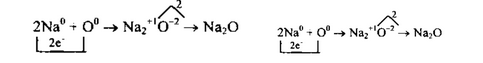
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
I. Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7: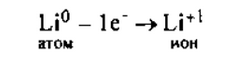
2. Хлор— элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, чем отдать 7 электронов: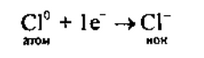
2. Наименьшее общее кратное 1, т.е. чтобы 1 атом лития отдал, а атом хлора принял 1 электрон, надо взять их по одному.
3. Схематично образование ионной связи между атомами лития и хлора можно записать так: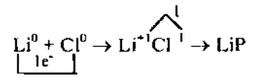
в) Рассмотрим схему образования ионной связи между атомами
магния и фтора.
1. Магний— элемент II группы главной подгруппы, металл. Его
атому легче отдать 2 внешних электрона, чем принять недостающие 6: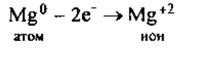
2. Фтор — элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов: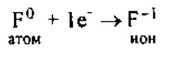
2. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
3. Схематично образование ионной связи между атомами лития и фосфора можно записать так: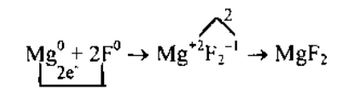
Ковалентная связь, которая образуется по донорно-акцепторному механизму, называется донорно-акцепторной связью. При образовании донорно-акцепторной связи один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором):
Донорно-акцепторная связь иногда обозначается стрелкой, которая направлена от атома-донора к атому-акцептору: А→В
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой атома-донора и свободной орбитали атома-акцептора:
Донорно-акцепторная связь имеет такие же свойства, как и обычная ковалентная связь, а отличается от нее только происхождением общей электронной пары. Образование донорно-акцепторной связи рассмотрим на примере иона аммония NH4 + . Этот сложный ион образуется в результате присоединения иона водорода Н + к молекуле аммиака NH3:
Три неспаренных электрона, которые находятся на 2р-подуровне, участвуют в образовании трех ковалентных связей с атомами водорода в молекуле NH3. Это обычные связи, образованные по обменному механизму. Неподеленная электронная пара, которая находится у атома азота на 2s-подуровне, может участвовать в образовании донорно-акцепторной связи, т. е. атом азота в молекуле аммиака может быть донором электронной пары. Ион водорода вообще не имеет электронов, но имеет свободную 1s-орбиталь, поэтому он может быть акцептором электронов:

Все четыре связи N—H в ионе аммония являются равноценными. Это обусловлено тем, что в момент образования связи в атоме азота происходит гибридизация 2s-орбитали и трех 2р-орбиталей, т. е. sp 3 -гибридизация. В результате возникают четыре одинаковые гибридные орбитали, которые направлены к вершинам тетраэдра. Таким образом, ион аммония, как и молекулы типа АВ4, имеет тетраэдрическую форму.
Обратите внимание, что валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи.
Следовательно, если элемент образует ковалентные связи и по обменному, и по донорно-акцепторному механизму, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. К ним относятся: а) орбитали с неспаренными электронами; б) орбитали с неподеленными электронными парами; в) свободные орбитали.
Для азота валентность IV является максимальной, потому что внешний электронный слой атома азота (второй энергетический уровень) состоит из четырех орбиталей. Такую валентность азот имеет и в таких соединениях, как N2О5, HNО3, NaNО3 и т. п. Например, в молекуле азотной кислоты три ковалентные связи N—O образуются неспаренными электронами атома азота, а одна связь N—О образуется неподеленной парой электронов атома азота:
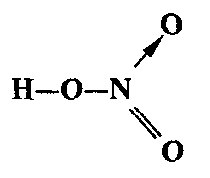
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ДЭО > 1,7), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование частиц, имеющих электрические заряды. Эти Частицы называются ионами:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Ионную связь можно рассматривать как крайний случай ковалентной полярной связи.
Как вы уже знаете, наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны: Поэтому ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов.
При отдаче электронов атомы металлов превращаются в положительно заряженные ионы, которые называются катионами, например:
Na 0 — 1ē→Na + — катион натрия;
Ca 0 — 2ē→Ca 2+ — катион кальция.
При присоединении электронов атомы неметаллов превращаются в отрицательно заряженные ионы, которые называются анионами, например:
Cl 0 + 1ē→ Cl — — хлорид-анион;
O 0 + 2ē→O 2- — оксид анион.
Например, образование ионной связи при взаимодействии атомов натрия и хлора схематично можно показать так:
Как видно из этого примера, ионы имеют завершенные электронные конфигурации, т. е. при образовании ионной связи, как и при образовании ковалентной связи, атомы переходят в более устойчивое состояние.
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, щелочи и многие соли. Так, в молекулах гидроксида натрия NaOH и сульфата натрия Na2SО4 связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и водорода в NaОН и между атомами кислорода и серы в Na2SО4) — ковалентные полярные.
Как известно, атомы металлов более или менее легко отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых веществ-металлов.
Простые вещества, которые образуют элементы-металлы, при обычных условиях представляют собой твердые кристаллические вещества (кроме ртути Hg). В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами — электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке.
Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической связью.
Металлическая связь обусловливает важнейшие физические свойства металлов.
Водородная связь является особым видом химической связи. В образовании этой связи участвует атом водорода, который в данной молекуле уже связан обычной ковалентной связью с атомом какого-либо элемента, имеющего большую электроотрицательность (например, с фтором, кислородом, азотом). Ковалентные связи H—F, Н—О, H—N являются сильно полярными (большая разность ЭО!). Поэтому атом водорода имеет избыточный положительный заряд +5, а на атомах фтора, кислорода и азота находятся избыточные отрицательные заряды:

Это примеры образования межмолекулярных водородных связей. (Водородные связи обозначаются точками). Образование межмолекулярных водородных связей является причиной существования ассоциатов молекул типа (HF)n, (H2O)n и др.
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы —ОН и атомом кислорода группы >С=О:
Внутри- и межмолекулярные водородные связи существуют в молекулах белков, ДНК и др.
Таким образом, при образовании водородной связи атом водорода находится между двумя атомами с высокой ЭО; с одним из них он связан обычной ковалентной связью, а с другим — водородной связью.
Энергия водородной связи приблизительно в десять раз меньше энергии обычной ковалентной связи и варьируется в пределах 15 — 40 кДж/моль. Тем не менее, водородные связи играют важную роль во многих физико-химических и биологических процессах.
Межмолекулярная водородная связь является одним из видов межмолекулярных взаимодействий.
Существуют также универсальные силы взаимодействия между любыми молекулами, которые не приводят к разрыву или образованию новых химических связей. Эти силы называются ван-дер-ваальсовыми силами (в честь голландского физика Ван-дер-Ваальса). Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в жидком и твердом агрегатном состояниях.
Одним из видов ван-дер-ваальсовых сил является ориентационное взаимодействие. Такое взаимодействие возникает между дипольными молекулами; противоположно заряженные концы диполей притягиваются друг к другу.
Если рядом находятся полярная и неполярная молекулы, то под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу. Такой вид взаимодействия называется индукционным:

Рефераты по другим темам можно скачать здесь
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- 1. Ca(ClO2)2
- 2. HClO3
- 3. NH4Cl
- 4. HClO4
- 5. Cl2O7
Запишите в поле ответа номера выбранных соединений.
Ответ: 13
Определить наличие ионного типа связи в соединении в подавляющем большинстве случаев можно по тому, что в состав его структурных единиц одновременно входят атомы типичного металла и атомы неметалла.
По этому признаку мы устанавливаем, что ионная связь имеется в соединении под номером 1 - Ca(ClO2)2, т.к. в его формуле можно увидеть атомы типичного металла кальция и атомы неметаллов - кислорода и хлора.
Однако, больше соединений, содержащих одновременно атомы металла и неметалла, в указанном списке нет.
Помимо указанного выше признака, о наличии ионной связи в соединении можно говорить, если в составе его структурной единицы содержится катион аммония (NH4 + ) или его органические аналоги - катионы алкиламмония RNH3 + , диалкиламония R2NH2 + , триалкиламмония R3NH + или тетраалкиламмония R4N + , где R - некоторый углеводородный радикал. Например, ионный тип связи имеет место в соединении (CH3)4NCl между катионом (CH3)4 + и хлорид-ионом Cl − .
Среди указанных в задании соединений есть хлорид аммония, в нем ионная связь реализуется между катионом аммония NH4 + и хлорид-ионом Cl − .
Из предложенного перечня выберите два соединения, в которых тип химической связи такой же, как в молекуле фтора.
2) оксид азота (II)
Запишите в поле ответа номера выбранных соединений.
Ответ: 15
Молекула фтора (F2) состоит из двух атомов одного химического элемента неметалла, поэтому химическая связь в данной молекуле ковалентная неполярная.
Ковалентная неполярная связь может быть реализована только между атомами одного и того же химического элемента неметалла.
Из предложенных вариантов ковалентный неполярный тип связи имеют только кислород и алмаз. Молекула кислорода является двухатомной, состоит из атомов одного химического элемента неметалла. Алмаз имеет атомное строение и в его структуре каждый атом углерода, являющегося неметаллом, связан с 4-мя другими атомами углерода.
Оксид азота (II) - вещество состоящее из молекул, образованных атомами двух разных неметаллов. Поскольку электроотрицательности разных атомов всегда различны, общая электронная пара в молекуле смещена к более электроотрицательному элементу, в данном случае к кислороду. Таким образом, связь в молекуле NO является ковалентной полярной.
Бромоводород также состоит из двухатомных молекул, состоящих из атомов водорода и брома. Общая электронная пара, образующая связь H-Br, смещена к более электроотрицательному атому брома. Химическая связь в молекуле HBr также является ковалентной полярной.
Иодид натрия - вещество ионного строения, образованное катионом металла и иодид-анионом. Связь в молекуле NaI образована за счет перехода электрона с 3s-орбитали атома натрия (атом натрия превращается в катион) на недозаполненную 5p-орбиталь атома иода (атом иода превращается в анион). Такая химическая связь называется ионной.
Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- 1. C2H6
- 2. C2H5OH
- 3. H2O
- 4. CH3OCH3
- 5. CH3COCH3
Запишите в поле ответа номера выбранных соединений.
Ответ: 23
Пояснение:
Водородные связи имеют место в веществах молекулярного строения, в которых присутствуют ковалетные связи H-O, H-N, H-F. Т.е. ковалентные связи атома водорода с атомами трех химических элементов с наивысшей электроотрицательностью.
Таким образом, очевидно, водородные связи есть между молекулами:
4) карбоновых кислот
6) первичных и вторичных аминов
7) плавиковой кислоты
Из предложенного перечня выберите два соединения с ионной химической связью.
- 1. PCl3
- 2. CO2
- 3. NaCl
- 4. H2S
- 5. MgO
Запишите в поле ответа номера выбранных соединений.
Ответ: 35
Пояснение:
Сделать вывод о наличии ионного типа связи в соединении в подавляющем большинстве случаев можно по тому, что в состав структурных единиц вещества одновременно входят атомы типичного металла и атомы неметалла.
По этому признаку мы устанавливаем, что ионная связь имеется в соединении под номером 3 (NaCl) и 5 (MgO).
Помимо указанного выше признака, о наличии ионной связи в соединении можно говорить, если в составе его структурной единицы содержится катион аммония (NH4 + ) или его органические аналоги - катионы алкиламмония RNH3 + , диалкиламония R2NH2 + , триалкиламмония R3NH + или тетраалкиламмония R4N + , где R - некоторый углеводородный радикал. Например, ионный тип связи имеет место в соединении (CH3)4NCl между катионом (CH3)4 + и хлорид-ионом Cl − .
Из предложенного перечня выберите два вещества с одинаковым типом строения.
4) поваренная соль
Запишите в поле ответа номера выбранных соединений.
Ответ: 23
Из предложенного перечня выберите два соединения, у которых ковалентная связь образована по донорно-акцепторному механизму.
- 1. CH3NH2
- 2. CCl4
- 3. NH4Cl
- 4. CH3NH3Br
- 5. SO2Cl2
Запишите в поле ответа номера выбранных соединений.
Ответ: 34
Из предложенного перечня выберите два соединения, которые имеют молекулярную кристаллическую решетку.
- 1. Cs2O
- 2. I2
- 3. KBr
- 4. NaI
- 5. HCl
Запишите в поле ответа номера выбранных соединений.
Ответ: 25
Из предложенного перечня выберите два вещества немолекулярного строения.
Запишите в поле ответа номера выбранных соединений.
Ответ: 45
Из предложенного перечня выберите два соединения с наиболее прочными химическими связями.
- 1. Cl2
- 2. Br2
- 3. O2
- 4. I2
- 5. N2
Запишите в поле ответа номера выбранных соединений.
Ответ: 35
Из предложенного перечня выберите два соединения, в молекулах которых ковалентная связь образована одной общей электронной парой.
- 1. N2
- 2. Cl2
- 3. NO
- 4. HBr
- 5. O2
Запишите в поле ответа номера выбранных соединений.
Ответ: 24
Из предложенного перечня выберите два вещества, в молекулах которых присутствует двойная связь между атомами углерода и кислорода.
4) уксусная кислота
Запишите в поле ответа номера выбранных соединений.
Ответ: 34
Из предложенного перечня выберите два вещества с наиболее полярными связями.
- 1. HCl
- 2. HF
- 3. H2O
- 4. H2S
- 5. HI
Запишите в поле ответа номера выбранных соединений.
Ответ: 23
Из предложенного перечня выберите два вещества, в которых имеются и ковалентные полярные, и ионные связи.
- 1. NaCl
- 2. NaNO3
- 3. Na2SO4
- 4. Na
- 5. Na2O
Запишите в поле ответа номера выбранных соединений.
Ответ: 23
Из предложенного перечня выберите два вещества с ионной связью.
3) оксид углерода (IV)
4) хлорид натрия
5) оксид кальция
Запишите в поле ответа номера выбранных соединений.
Ответ: 45
Из предложенного перечня выберите два вещества с таким же типом кристаллической решетки, как у алмаза.
2) оксид натрия Na2O
3) угарный газ CO
4) белый фосфор P4
Запишите в поле ответа номера выбранных соединений.
Ответ: 15
Из предложенного перечня выберите два вещества с ионной связью.
- 1. NH4Cl
- 2. HCOONa
- 3. NH3
- 4. HCOOH
- 5. CO
Запишите в поле ответа номера выбранных соединений.
Ответ: 12
Из предложенного перечня выберите два вещества с наибольшей длиной химической связи в молекуле.
- 1. HF
- 2. HCl
- 3. HBr
- 4. HI
- 5. H2O
Запишите в поле ответа номера выбранных соединений.
Ответ: 34
Из предложенного перечня выберите два вещества, в молекулах которых есть одна π-связь.
- 1. SO2
- 2. HBr
- 3. HCOOH
- 4. H2
- 5. O2
Запишите в поле ответа номера выбранных соединений.
Ответ: 35
Из предложенного перечня выберите два вещества с атомной кристаллической решеткой.
- 1. Cl2
- 2. B
- 3. Cu
- 4. Si
- 5. P4
Запишите в поле ответа номера выбранных соединений.
Ответ: 24
Из предложенного перечня выберите два вещества, в молекулах которых есть одна тройная связь.
- 1. HCOOH
- 2. HCOH
- 3. C2H4
- 4. N2
- 5. C2H2
Запишите в поле ответа номера выбранных соединений.
Ответ: 45
Для того, чтобы найти правильный ответ, нарисуем структурные формулы соединений из представленного списка:
Таким образом, мы видим, что тройная связь имеется в молекулах азота и ацетилена. Т.е. правильные ответы 45
Из предложенного перечня выберите два вещества, в молекулах которых есть ковалентная неполярная связь.
1) Гидроксид натрия
5) Пероксид водорода
Запишите в поле ответа номера выбранных соединений.
Ответ: 45
Из предложенного перечня веществ выберите два вещества, которые имеют молекулярную кристаллическую решётку.
- 1. CO2
- 2. SiO2
- 3. NH3
- 4. NaH
- 5. PbO2
Запишите в поле ответа номера выбранных веществ.
Ответ: 13
Из предложенного перечня веществ выберите два вещества, для каждого из которых характерно наличие водородной связи между молекулами.
4) уксусная кислота
Запишите в поле ответа номера выбранных веществ.
Ответ: 24
Из предложенного перечня веществ выберите два вещества, которые имеют атомную кристаллическую решётку.
Запишите в поле ответа номера выбранных веществ.
Ответ: 34
Из предложенного перечня веществ выберите два соединения, в которых одна из ковалентных связей образована по донорно-акцепторному механизму.
- 1. LiOH
- 2. Li3PO4
- 3. (NH4)2HPO4
- 4. NH4F
- 5. H3PO4
Запишите в поле ответа номера выбранных веществ.
Ответ: 34
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
1) оксид кремния
4) силикат лития
Запишите в поле ответа номера выбранных веществ.
Ответ: 14
Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
- 1. H2SO4
- 2. KNO3
- 3. PCl3
- 4. KCl
- 5. H3BO3
Запишите в поле ответа номера выбранных веществ.
Ответ: 24
Из предложенного перечня веществ выберите два соединения, в которых присутствует ионная связь.
2) хлорид натрия
Запишите в поле ответа номера выбранных соединений.
Ответ: 25
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная неполярная связь.
Запишите в поле ответа номера выбранных соединений.
Читайте также:

