Инвазия при раке предстательной железы
Каждый пациент на приёме у врача больше всего боится, что у него заподозрят или, что хуже, найдут новообразование. Однако мало кто знает о механизме развития опухоли и за счет чего конкретно данный диагноз является настолько страшным. В этой статье мы разберёмся, что именно делает онкологические заболевания такими опасными для жизни.
- Строение тканей с точки зрения формирования опухолевого процесса
- Доброкачественные и злокачественные опухоли: в чем разница?
- Что такое инвазия опухоли?
- Факторы, определяющие степень инвазивности опухоли
- Инвазия раковых клеток в сосуды
- Циркуляция раковых клеток в системе кровотока и экстравазация
- Резюме
Строение тканей с точки зрения формирования опухолевого процесса
Чтобы разобраться в механизме образования и развития опухоли, необходимо иметь представление о принципе строения тканей в организме. Большинство тканей, независимо от места их расположения, имеют сходный план строения:
- Базальная мембрана — это неклеточная структура, отграничивающая ткани друг от друга;
- Ростковый слой — группа активно делящихся клеток, расположенных на базальной мембране, которые обеспечивают обновление ткани. Именно изменение генетического материала клеток росткового слоя влечёт за собой развития опухоли;
- Слой созревающих клеток — клетки ростового слоя, которые постепенно продвигаются в верхние слои в процессе дифференцировки (приобретения формы и свойств, характерных для данной ткани);
- Поверхностный слой — группа клеток, которая и обеспечивает выполнение тканью определённой функции.
Между ростковым и поверхностным могут располагаться дополнительные слои в зависимости от конкретного вида ткани. Но принцип строения всегда один и тот же: клетки, способные делиться, находятся на базальной мембране. В процессе созревания они перемещаются в верхние слои, утрачивая способность к делению и приобретая специфические свойства.
Доброкачественные и злокачественные опухоли: в чем разница?
Исходя из того, клетки какого слоя подверглись мутации, выделяют два типа неоплазий — доброкачественные и злокачественные. Их отличия заключаются в том, что первый тип формируется из высоко дифференцированных клеток созревающего слоя. При доброкачественных опухолях клетки не будут сильно отличаться от здоровых клеток данной ткани. Такая неоплазия считается неагрессивной и растет медленно, а также не даёт метастазы. Патогенное действие доброкачественного новообразования заключается главным образом в сдавлении окружающих её тканей. Иногда такие опухоли полностью или частично закрывают просвет какого-либо полого органа.
В процессе развития рака выделяют 4 стадии:

Что такое инвазия опухоли?
Инвазия обуславливает способность опухолей давать метастазы — вторичные очаги онкологического процесса вдали от материнской опухоли, возникшие из-за миграции раковых клеток. Обязательное условие метастазирования — наличие у опухоли собственной капиллярной сети. Она формируется, когда количество неопластических клеток достигает 103 (1-2 мм).
- Разрыв межклеточных связей, соединяющих раковые клетки между собой;
- Прикрепление клеток опухоли к базальной мембране;
- Разрушение базальной мембраны лизирующими (расщепляющими) ферментами;
- Миграция клеток в соседние ткани и органы.
Раковые клетки, находящиеся в процессе инвазии, более устойчивы к облучению и химеотерапии, чем стационарные. Во многом это связано с временной утратой мигрирующими клетками способности к делению. Также движущиеся опухолевые клетки проявляют повышенную активность антиапоптотических генов (гены, препятствующие запрограммированной смерти клетки — апоптозу). И, поскольку химиотерапевтические препараты направлены на стимуляцию апопоза, их устойчивость к лечению возрастает.
Факторы, определяющие степень инвазивности опухоли
Чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие следующих факторов:
- Быстрое деление и давление. Механическое воздействие опухолевой массы на базальную мембрану способствует её разрушению и, как следствие, инвазии раковых клеток;
- Подвижность клеток. Клетки новообразования способны к миграции, причем их движение не является хаотичным. Они движутся в направлении большей концентрации кислорода, питательных веществ, а также в сторону более нейтрального показателя кислотности (рН);
- Межклеточные связи. Чем прочнее эти контакты, тем меньше шансов, что опухоль начнет инвазивный рост. У злокачественных клеток связи слабые, поэтому клетки легко отрываются от новообразования и попадают в кровоток или в лимфатическую систему;
- Действие лизосомальных ферментов. Злокачественная опухоль вырабатывает вещества, способные разрушать здоровые клетки и межклеточное вещество, что будет способствовать инвазии;
- Иммунная система человека. В организме существует собственная противоопухолевая защита, которую обеспечивает наш иммунитет. Её активность у каждого человека индивидуальна. Она зависит от генетической предрасположенности и состояния всего организма в конкретный момент. Так, при заболеваниях, сопровождающихся угнетением иммунной системы (например, при ВИЧ), пациенты могут погибать от онкологических заболеваний, возникших из-за отсутствия противоопухолевой активности.
Инвазия раковых клеток в сосуды
Вслед за прорастанием в базальную мембрану наступает интравазальная (внутрисосудистая) инвазия опухоли. Чаще раковые клетки мигрируют в артерии. Это связано с тем, что стенки артерий более упругие и эластичные, в то время как у вен они тонкие и легко спадаются в опухолях. Однако раковые клетки могут быть занесены в вены из лимфатических сосудов.
Циркуляция раковых клеток в системе кровотока и экстравазация
Экстарвазация представляет собой выход опухолевых клеток из сосудов для формирования метастатического очага. В этом процессе задействованы те же ферменты, что и в инвазии через базальную мембрану.
Резюме
Вот что следует знать об инвазии опухолей:
- Инвазия — это проникновение раковых клеток через базальную мембрану ткани, из которой развилась опухоль;
- Инвазия свойственна только злокачественным новообразованиям;
- В инвазии участвуют лизирующие ферменты, которые способны разрушать как неклеточные структуры, так и связи между здоровыми клетками (например, выстилка сосудов);
- Явление инвазии лежит в основе метастазирования;
- Инвазия бывает индивидуальной и групповой, и последняя чаще обуславливает появление метастазов,
- Самые распространенные виды инвазивных опухолей — рак шейки матки и рак молочной железы.
Медицинский эксперт статьи

Клинически различают локализованный T1-2, N0, M0), местнораспространённый (Т3-4, N0-1, M0) и генерализованный рак (T1-4, N0-1, М1).
Больных с клинически локализованными и местнораспространёнными стадиями распределяют по степени риска (Д’Амико А В. и др., 2003):
- низкая: стадия Т1а-с; уровень ПСА менее 10 иг/мл: градация по Глисону - 2-5; при биопсии - одностороннее поражение менее 50%:
- умеренная: стадия Т2а; уровень ПСА менее 10 нг/мл; градация по Глисону - 3 + 4 = 7; при биопсии - двустороннее поражение менее 50%;
- высокая стадия Т2b , Т3а-b; уровень ПСА - 10-20 нг/мл; градация по Глисону - более 4 + 3 - 7; при биопсии - поражение более 50%, периневральная инвазия;
- очень высокая: стадия Т4; уровень ПСА более 20 нг/мл; градация по Глисону - более 8; при биопсии - лимфоваскулярная инвазия.
После уточнения диагноза и установления распространённости процесса (локализованный, местнораспространенный или генерализованный) врач и пациент стоят перед выбором метода лечения. В современном обществе огромное значение уделяют качеству жизни больных после начала лечения. Качество жизни без лечения соответствует течению основного заболевания и зависит от прогрессирования онкологического процесса. Изменение качества жизни возникает в основном после начала лечения и применения одного из терапевтических или хирургических методов. Чёткое установление стадии процесса позволяет не только выбрать оптимальный метод лечения, но и прогнозировать дальнейшее течение заболевания.
Определение уровня ПСА в сочетании с клинической картиной рака простаты и градацией опухоли по шкале Глисона значительно повышает информативность каждого из перечисленных показателей в установлении патологической стадии рака. А.В. Партин и соавт. (1997) предложили прогностические таблицы, позволяющие прогнозировать дальнейшее распространение опухоли, выбор метода лечения, степень радикальности и прогноз эффективности лечения
Для оценки распространённости опухоли наиболее часто используют ПРИ, ТРУЗИ, определение уровня ПСА и остеосцинтиграфию. При необходимости назначают компьютерную томографию (КТ) или магнитно-резонансную томографию (MPТ) и рентгенографию грудной клетки.
Любой из методов визуализации предназначен для определения стадии и оценки эффективности лечения После верификации диагноза уролог должен уточнить объём первичной опухоли, ее границы, инвазивный или метастатический потенциал опухоли. Все эти показатели имеют большое значение для прогноза заболевания и выбора метода лечения.

[1], [2], [3], [4], [5], [6], [7], [8], [9]
Первичная опухоль (Т)
Прежде всего, следует определить, ограничена опухоль предстательной железой (Т1-2) или выходит за пределы капсулы (Т3-4). Пальцевое исследование часто не позволяет оценить распространённость опухоли. По некоторым данным, результаты ПРИ соответствуют таковым при гистологическом исследовании менее чем у 50% больных. Тем не менее более подробное обследование показано лишь при решении вопроса о радикальном лечении.
Уровень ПСА может отражать распространённость опухоли, однако не позволяет точно определить морфологическую стадию. Сочетание уровня ПСА, индекса Глисона и данных пальпации позволяет лучше предсказать морфологическую стадию, чем каждый из этих параметров в отдельности. Значение свободного ПСА спорно: в одном из исследований определение содержания свободного ПСА помогало уточнить стадию при локализованных опухолях, однако другие работы этого не подтвердили. Разрешить этот вопрос помогут лишь углублённые исследования.
Для изучения состояния предстательной железы чаще всего применяют трансректальное УЗИ. Этот метод позволяет обнаружить лишь 60% опухолей и не всегда показывает прорастание капсулы. Почти у 60% больных со стадией Т3. УЗИ указывает на менее распространённый процесс. Ультразвуковые признаки прорастания капсулы - выпуклость, неровность и разрыв контура железы. Инвазия опухолевых клеток в семенные пузырьки - плохой прогностический признак, но информация о ней крайне важна для выбора метода лечения. При ТРУЗИ следует обращать внимание на эхоструктуру пузырьков (гиперэхогенность), их асимметрию, деформацию и расширение. Также о поражении семенных пузырьков свидетельствует утрата закругленности и уплотнение у основания железы. Эти признаки довольно субъективны, поэтому целиком полагаться на данные УЗИ нецелесообразно. Инвазия семенных пузырьков указывает на высокий риск местного рецидива и метастазов и для уточнения (перед операций) показана их биопсия. Начинать обследование с этой процедуры не следует, но если риск инвазии велик и от результата биопсии зависит выбор лечения, то её выполнение оправданно. Отрицательный результат не исключает микроскопической инвазии. Как правило, биопсию семенных пузырьков проводят при клинической стадии Т2b, и выше и содержании ПСА более 10 нг/мл. Результат считают положительным, если хотя бы один биоптат из основания предстательной железы содержит опухолевые клетки. Повысить точность клинического определения стадии позволяют не только дополнительные исследования, но и тщательный анализ результатов первичной биопсии (играют роль количество и протяжённость опухолевых очагов, инвазия капсулы). Имеет значение и степень дифференцировки: при индексе Глисона менее 6 опухоль в 70% случаев локализована.
Кровоток в предстательной железе при раке выше, чем в нормальной железе или при ее гиперплазии. После кастрации интенсивность кровотока в железе снижена. Перспективна разработка эходопплерографических карт для диагностики и мониторинга РПЖ, однако в настоящее время нет достоверных данных об использовании эходопплерографии в определении стадии местного процесса. Возможно применение этого метода для получения дополнительного материала при прицельной биопсии из очагов патологической васкуляризации.
Результаты визуализации рака простаты прямо зависят от технической оснащённости клиники и опыта специалиста. Именно поэтому все современные методы визуализации носят не определяющую, а уточняющую роль, и выбор метода лечения основан на совокупности данных клинического обследования и инструментальных исследований.
Наилучшими возможностями для визуализации структуры предстательной железы обладает МРТ. Современный стандарт обследования органов малого таза методом MPТ - применение эндоректального датчика, позволяющего получить изображение с максимально возможным пространственным разрешением, составляющим 0,5-1 мм. Нагнетание воздуха в эндоректальный датчик обеспечивает чёткую визуализацию капсулы предстательной железы, ректопростатических углов и ректопростатической фасции Денонвилье. Применение эндоректального датчика при MРТ не ограничивает визуализацию регионарных лимфатических узлов (вплоть до уровня бифуркации брюшной аорты). Раку предстательной железы свойственна низкая интенсивность сигнала на Т-взвешенных изображениях на фоне сигнала высокой интенсивности от неизмененной периферической зоны железы. Неправильная форма, диффузное распространение с масс-эффектом, нечёткие и неровные контуры - морфологические характеристики очагов низкой интенсивности сигнала в периферической зоне предстательной железы, позволяющие предположить неопластический характер поражения. При проведении динамического контрастирования очаги рака быстро накапливают контрастный препарат в артериальную фазу и быстро выводят препарат, что отражает степень ангиогенеза и, соответственно, степень злокачественности опухоли. Низкая интенсивность сигнала также свойственна очагам постбиопсийных кровоизлияний, простатита, стромальной доброкачественной гиперплазии нейтральной зоны железы, фиброзно-рубцовым изменениям, фибромускулярной гиперплазии, последствиям гормональной или лучевой терапии. МРТ без динамического контрастирования не позволяет достоверно дифференцировать большинство перечисленных изменений и заболеваний.
Как отмечено выше, одна из основных задач любого метода визуализации при РПЖ - определение объёма поражения железы и распространения опухоли за пределы капсулы. Определение объема опухоли важно в прогностическом отношении. Объём опухоли менее 4 см 3 свидетельствует об отдалённых метастазах, а 12 см 3 - о крайне высокой вероятности метастазов. По данным исследований, точность МРТ в обнаружении очагов неопластического поражения предстательной железы составляет от 50 до 90%. Чувствительность МРТ при определении локализации РПЖ составляет около 70-80%, при этом микроскопические очаги рака (фокусы) с помощью МРТ обнаружить невозможно.
Важнейшее преимущество эндоректальной MPТ - возможность определения локализации очагов неопластического поражения в зонах, недоступных другим методам диагностики, и уточнения характера и направления роста опухоли. Так, например, МРТ позволяет обнаружить очаги неопластического поражения в передних отделах периферической зоны предстательной железы, недоступных при трансректальной биопсии. В целом МРТ существенно дополняет данные ПРИ и ТРУЗИ о локализации опухоли.
Эндоректальная MPТ позволяет визуализировать капсулу железы, сосудисто-нервные пучки, семенные пузырьки, верхушку железы, перипростатичсское венозное сплетение и определить локальную распространённость опухоли железы. Следует подчеркнуть, что пенетрацию капсулы считают микроскопическим признаком, и даже современные аппараты МРТ (эндоректальная катушка) не способны дать такую информацию. Возможно лишь получение данных о прорастании за пределы капсулы железы.
Критерии диагностики экстракапсулярной экстензии при МРТ:
- наличие собственно экстракапсулярной опухоли;
- неровность контура железы (деформация, ангулярность);
- асимметрия нейроваскулярных пучков;
- облитерация ректопростатических углов;
- широкий контакт опухоли с капсулой.
Самой высокой специфичности (до 95-98%) и точности результата МРТ достигают при обследовании пациентов среднего или высокого риска экстракапсулярной инвазии. Считают, что экстракапсулярная инвазия (по данным МРТ) указывает на нецелесообразность хирургического лечения и неблагоприятный прогноз заболевания. Гормональная или лучевая терапия не влияет на точность обнаружения экстракапсулярного распространения опухоли предстательной железы. Основная трудность в обнаружении очагов рака и экстракапсулярного распространения опухоли - высокая вариабельность интерпретации томограмм разными специалистами. Первостепенная задача специалиста по лучевой диагностике - достижение высокой специфичности диагностики (даже в ущерб чувствительности) для того, чтобы не лишить операбельных пациентов шанса на проведение радикального лечения.
Сходство плотности раковой, гиперплазированной и нормальной ткани предстательной железы при КТ делает этот метод малопригодным для оценки местной распространенности опухоли. Прорастание в семенные пузырьки более важно, чем прорастание в капсулы, но и в этом случае КТ даёт информацию лишь при запущенном процессе. Однако этот метод активно применяют для разметки области воздействия перед лучевой терапией.
Медленное развитие лучевой диагностики в нашей стране привело к поздней диагностике РПЖ и, следовательно, к недостаточной распространённости радикальных методов лечения РПЖ (например, простатэктомии), малой доступности современных томографов и отсутствию соответствующих обучающих программ для специалистов по лучевой диагностике и урологов. Несмотря на то что КТ и МРТ сейчас широко распространены, уровень оснащения кабинетов и образования специалистов по лучевой диагностике недостаточен для того, чтобы полученная информация стала определяющей при выборе метода лечения больных РПЖ.
Регионарные лимфатические узлы (N)
Оценивать регионарные лимфатические узлы следует лишь в тех случаях, когда это напрямую влияет на лечебную тактику (обычно при планировании радикального лечения). Высокий уровень ПСА, опухоли Т2с-Т3а, низкая дифференцировка и периневральная инвазия сопряжены с высоким риском метастазирования в лимфатические узлы. Оценку состояния лимфатических узлов по уровню ПСА считают недостаточной.
Необходимую информацию предоставляет лишь лимфаденэктомия (открытая или лапароскопическая). Недавние исследования расширенной лимфаденэктомии показали, что РПЖ не всегда поражает запирательные лимфатические узлы. При бессимптомных опухолях и уровне ПСА менее 20 кг/мл. КТ подтверждает увеличение лимфатических узлов лишь в 1 % случаев. Применение МРТ или КТ оправдано при высоком риске метастазирования, так как специфичность этих методов достигает 93-96%. Однако даже положительный результат при их применении может быть ложным, и только пункция подозрительного лимфатического узла позволяет отказаться от лимфаденэктомии, По данным ретроспективного анализа, размеры лимфатического узла не всегда свидетельствуют о наличии в нем метастазов, более информативным признаком считают асимметрию пораженных лимфатических узлов. В настоящее время только у 2-3% больных, перенёсших радикальную простатэктомию по поводу локального РПЖ, диагностируют метастазирование в лимфатические узлы на основании послеоперационного гистологического исследования.
В качестве методов обнаружения метастазирования в лимфатические узлы рекомендуют использовать позитронно-эмиссионную томографию (ПЭТ) и сцинтиграфию с мечеными антителами, но их применение пока ограничено в связи с недостаточной чувствительностью.
Для оценки риска поражения регионарных лимфатических узлов можно использовать номограммы Партина (2001). Номограммы - Математические алгоритмы, которые используют для конкретного пациента или для группы больных. Эти таблицы позволяют определить вероятность местного распространения опухоли (на капсулу, семенные пузырьки) и поражения лимфатических узлов на основании клинической стадии, уровня ПСА и индекса Глисона. В частности, они дают возможность выделить группу больных с низкой (менее 10%) вероятностью метастазирования в лимфатические узлы (при уровне ПСА более 20 нг/мд, стадии Т1-2а и индексе Глисона 2-6); в этой группе перед радикальным лечением состояние лимфатических узлов можно не уточнять. Оценить риск метастазировани я в лимфатические узлы позволяет и обнаружение участков опухоли с выраженной анаплазией (4-5 баллов): если такие участки обнаруживают в четырёх биоптатах и более или они преобладают хотя бы в одном биоптате, риск достигает 20-45%. У остальных больных он не превышает 2,5%. Дополнительное обследование в таких случаях не требуется
Отдалённые метастазы (М)
У 85% больных, умирающих от РПЖ, обнаруживают поражения осевого скелета. Костные метастазы возникают вследствие попадания раковых клеток с током крови в костный мозг, что приводит к росту опухоли и лизису костных структур. Распространенность костных метастазов влияет на прогноз, а их раннее обнаружение предупреждает врача о возможных осложнениях. В 70% случаев метастазирование сочетается с повышением активности костного изофермента щелочной фосфатазы (ЩФ). Определение активности ЩФ и уровня ПСА в подавляющем большинстве случаев позволяет обнаружить костное метастазирование. Поданным многофакторного анализа, на эти показатели влияет лишь количество метастазов в кости. Важно, что активность костного изофермента ЩФ отражает степень поражения костей более точно, чем уровень ПСА.
Наиболее чувствительным методом обнаружения метастазов в кости считают сцинтиграфию (превосходит рентгенографию и определение активности щелочной и кислой фосфатазы). В качестве радиофармацевтического препарата лучше использовать дифосфонаты технеция, накопление которых в костях происходит намного активнее, чем в мягких тканях. Показана корреляция между полуколичественной оценкой поражения костей и выживаемостью. Обнаружение отдалённых метастазов возможно в любом органе. Чаще они возникают в нерегионарных лимфатических узлах, легких, печени, головном мозге и коже. При соответствующих жалобах и симптомах для их обнаружения используют рентгенографию грудной клетки, УЗИ, КТ и МРТ. Тактика при подозрении на костное метастазирование представлена на схеме.
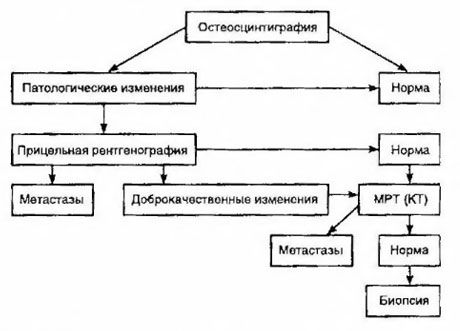
Самым надёжным лабораторным показателем, помогающим в определении степени метастазирования, служит уровень ПСА. Показано, что его увеличение свыше 100 нг/мл - единственный параметр, достоверно указывающий на отдалённые метастазы. Определение уровня ПСА уменьшает число больных, нуждающихся в сцинтиграфии костей. Вероятность обнаружения метастазов в кости при уменьшении уровня ПСА очень низка. При отсутствии жалоб и исходном содержании ПСА менее 20 нг/мл, обнаружении высоко- и умереннодифференцированных опухолей от сцинтиграфии можно отказаться. В то же время при низкодифференцированных опухолях и прорастании капсулы показана сцинтиграфия (независимо от уровня ПСА).
Проблема, с которой может столкнуться каждый мужчина – рак предстательной железы. К сожалению, современная медицина не предлагает методов профилактики и не располагает, какой риск столкнуться с бедой. На ранних стадиях опухоль успешно лечится. Онкология – не приговор и при своевременном и правильном лечении вероятность выздоровления велика.
Успех операции или терапии зависит от определенной конкретной стадии, которая выявляется диагностикой и сдачей анализов (мочи, крови, секрета простаты).
- Прогноз при раке простаты ↓
- 0 стадия ↓
- 1 стадия ↓
- 2 стадия ↓
- 3 стадия ↓
- 4 стадия ↓
- Методы лечения рака простаты ↓
- Лечение ультразвуком ↓
- Удаление предстательной железы ↓
- Радиотерапия ↓
- Метод TOOKAD ↓
- Стоит ли использовать народные средства ↓
Прогноз при раке простаты

По статистики Министерства здравоохранения России в 2018 г. онкология предстательной железы занимает 4-е место среди диагностированных случаев злокачественных образований, уступая раку кожи, молочной железы и раку легких. Каждый третий случай оканчивается летальным исходом.
Предстательная железа или простата – экзокринная железа с трубчато-альвеолярным строением, присутствующая в мужском организме, является андрогензависимым органом. Находится она чуть ниже мочевого пузыря, через нее проходит в своём начале мочеиспускательный канал. Железа вырабатывает секрет, который выбрасывается в момент эякуляции и разжижает эякулят. Здоровая предстательная железа имеет объём 25 мл., в длину от 32 до 45 мм, в ширину от 35 до 50 мм, а толщиной – от 17 до 25 мм.
Причины возникновения злокачественных образований предстательной железы:

В современном мире всё меньше опасных, вредных производственных работ, поэтому основной причиной рака является курение
нарушение баланса гормонов: андростендиона, тестостерона, дигдротестостерона;
Злокачественные образования могут развиваться в любом возрасте, но чаще поражает мужчин, перешагнувших 40-летний возраст. Пропорционально повышению возраста, повышается и риск возникновения заболевания:
- от 35 до 40 лет – 10 случаев на 10000;
- от 50 до 60 лет – 100 случаев на 10000;
- старше 70 лет – 1000 на 10000.
Отличительной чертой рака простаты – это продолжительное и бессимптомное течение болезни.
Любое онкологическое заболевание делится на стадии. Ее определяют по размеру опухоли, поражению тканей, наличия вторичных очагов (метастазов).
Нулевая стадия (предрак) содержит раковые клетки любых локализации. Начальный этап зарождения новообразования и причисляются к доброкачественной опухоли. В онкологии такой процесс называют in situ, что означает опухоль на месте. Клетки находятся в одном месте и не выходят за границы эпителия.

Явных симптомов на этой стадии нет. Опухоль минимального размера, при пальпации не ощущается, ультразвуковое исследование не выявляет заболевание. Диагностировать можно только с помощью теста-онкомаркера ПСА – простатический специфический антиген. Если обнаружена опухоль на этой стадии, это большая удача. На этом этапе болезни лечение проходит с помощью терапии и не занимает длительного времени. Исход для пациента – благоприятный.

Размер опухоли увеличивается, выявляется пальпированием и ультразвуковым исследованием, но она не еще проникла за пределы капсулы железы. Возможны появления затрудненного и частого мочеиспускания, особенно в ночное время суток. Так происходит потому, что разрастающаяся опухоль давит на канал уретры. 70-80% диагностированных больных со 2 стадией, выздоравливают.
Размер опухоли обретает крупные размеры и выявляется всеми способом. Симптомы: сильные боли в области лобка, промежности, пояснице. Мочеотделение с болями, жжением, кровью в моче. Причина этого – опухоль вышла за пределы простаты и начала поражать соседние внутренние органы: уретру и мочевой пузырь. Начинают появляться метастазы регионарной локации. Победить онкологию на этой стадии трудно, потребуется не только операция, но и сочетание ряда комплексов для нейтрализации раковых клеток. Шанс излечиться на 3-й стадии – менее 40%.
Опухоль приобрела агрессивный характер, раковые клетки, разнесенные через кровь и лимфу, остаются в отдаленных уголках организма. Продуцируются метастазы, которые могут быть в печени, костях, легких и других органах. В последней стадии появляются сильнейшие боли, происходит интоксикация организма из-за раковых клеток, резко снижается масса тела, пропадает интерес к жизни и происходит быстрое угасание пациента. Лечению рак 4-й степени не поддается, поэтому прибегают к паллиативной терапии, которая несколько уменьшает мучения больного и немного продлевает остаток жизни.
Методы лечения рака простаты
Методика зависит не только от стадии заболевания, но и от типа опухоли. Чтобы определить тип применяют биопсию: берется биоматериал с образцами тканей и изучается под микроскопом.

Локальное лечение опухоли ультразвуковыми волнами. Метод щадящий, так как отсутствует оперативное вмешательство. В прямую кишку пациента вводится зонд с камерой для определения точного расположение опухоли и железа обрабатывается ультразвуком. Температура достигается до 100 градусов, и гипертермия убивает раковые клетки. Операция занимает пару часов, и больной через 2-3 суток будет выписан. Ультразвук не содержит радиацию и не влияет на потенцию. Положительный результат ультразвука – выше 80%.

Простата – важный мужской орган, но не жизненно необходимый. Если клетки рака не распространились на другие органы или ткани, то врач онколог предложит удалить предстательную железу. Распространенные виды хирургического вмешательства:
- Радикальная простатэктомия – в ходе операции раковые клетки удаляются вместе с простатой.
- Тазовая лимфодиссекция – удаляются лимфатические узлы в тазовой области.
- Трансуретральная резекция – снимает только симптомы, но онкологию не лечит.
Прогноз после операции: если опухоль не вышла за пределы простаты – 99% результат, что больные проживут не менее пяти лет или излечатся полностью, если рак с метастазами – шансов практически нет.
Любая операция – риск для жизни, вмешательство в работу организма и стресс для него. После операции возможны побочные эффекты: проблемы с мочеиспусканием в течение нескольких месяцев и потеря эрекции.
Существует щадящий вид хирургического лечения – лапароскопия, при котором риск послеоперационных осложнений снижается и легче переносится пациентом. При лапароскопическом вмешательстве железу удаляют посредством небольших надрезов в несколько миллиметров.

Если опухоль вышла за пределы или когда больной слаб для хирургического вмешательства, применяют лучевую терапию. Используют рентгеновские лучи, которые убивают раковые клетки и их бесконтрольный рост. После сеансов радиотерапии опухоль уменьшатся и ткани очищаются от раковых клеток.
Лучевая терапия может быть отдельным способом лечения и в совокупности с хирургическим вмешательством. Используют два вида лучевой терапии:
- Дистанционная лучевая радиотерапия – облучение под лучевым аппаратом. Чтобы свести к минимуму воздействие радиации на здоровые органы, врачи направляют пучок радиации точно на опухоль. Разновидности внешней лучевой терапии:
- 3D-конформная;
- протонная;
- IMRT – лучевая терапия модулированной интенсивности;
- SBRT – стереотоксическая лучевая терапия.
- Интерстициальная лучевая радиотерапия (брахитерапия) – введение радиоактивных гранул. Эффект радиации усиливается за счет уменьшения расстояния до злокачественного образования. Гранулы, содержащие радиоактивные химические вещества, таких как палладий, радий, цезий и др., вводятся в тело пациента, и они воздействуют на окружающие ткани. Разновидности внутренней лучевой терапии:
- Постоянная брахитерапия – гранулы находятся в организме долгое время;
- Временная брахитерапия – использование гранул только во время сеансов.

Лучевая терапия – сильнейшее облучение организма радиоактивными веществами. Метод очень эффективен в борьбе со злокачественными образованиями, но имеет очень много побочных действий. Распространенные последствия:
- Головные боли, головокружение, слабость, повышение температуры тела.
- Нарушение работы пищеварительной системы – диарея, запор, тошнота, рвота.
- Изменяется состав крови, снижаются тромбоциты и лейкоциты.
- Появляется аритмия.
- Выпадают волосы, снижается зрение и слух.
- Появляются отеки и сухость кожи, высыпания в местах применения радиации.
После окончания полного курса, нормальное функционирование всех органов восстанавливается. Метод эффективен на 1 и 2 стадии заболевания, 93% пациентов излечиваются.
Инновационный метод лечения онкологии простаты. Лечение с помощью внутривенного лекарственного вещества TOOKAD Soluble. Препарат не оказывает негативного влияния на здоровые ткани и выводится из организма через 3-4 часа. Сразу после введения препарата проводят контролируемое фотодинамическое воздействие на раковую ткань через оптоволоконный зонд. Продолжительность воздействия – 22 минуты.

Воздействие света вызывает цепную реакцию, которая приводит к полному разрушению всей опухоли без повреждения окружающих органов и здоровых тканей, в том числе уретры или нервов, отвечающих за потенцию. Лечебная процедура занимает полтора часа. Метод эффективен и результат исцеления составляет более 80%.
Существуют еще методы лечения рака предстательной железы, такие как криохирургия, радиохирургия, иммунная и химиотерапии, гормональное лечение.
Стоит ли использовать народные средства
Народные средства не только не работают, но и могут нанести непоправимый вред. Может ухудшиться состояние больного, проявиться ослабление и отравление организма, так как зачастую методы основаны на ядовитых веществах. Особенно опасна нетрадиционная медицина тем, что пациенты использует эти средства в надежде, что удастся избежать операции, облучения и полностью излечиться от онкологии, но опаздывают с лечением, когда шансов на выздоровление нет.
Помнить надо о следующем:
- Рак – не приговор!
- Своевременное обращение и обследование в клинике – шаг к успешному лечению.
- Народная медицина НЕ лечит онкологические заболевания.
Читайте также:

