Инвазия предстательной железы что это такое в онкологии
Рак является одним из самых страшных и в то же время распространенных заболеваний. При своевременном обнаружении онкология хорошо поддается терапии.
Однако если патология не была диагностирована на начальной стадии, то раковые клетки начинают распространяться по всему организму, развивается инвазивный рак.
Что такое инвазия в онкологии знают далеко не все люди. А ведь от данного процесса метастазирования зависит течение онкологии, возможные осложнения.

Понятие инвазии опухоли
Инвазия опухоли – что это такое? Это патологический процесс, при котором раковые клетки отсоединяются от первичного новообразования и распространяются по организму, прорастая сквозь ткани других органов. Так формируются вторичные опухолевые очаги.
Некоторые считают, что инвазия и метастазирование – это одинаковые понятия, на самом деле – это различные вещи. В нормальном состоянии клетки обладают способностью к инвазивному росту. Это проявляется в ситуациях:
- в период вынашивания ребенка (плацента врастает в стенку матки);
- период роста, развития эмбриона;
- регенерация крупных ран.
Инвазия в онкологии является начальным процессом развития метастаз в разных частях организма. Инвазивный рак очень сложно поддается лечению. Объясняется это тем, что раковые клетки, будучи за пределами базальной мембраны, усиленно питаются и насыщаются кислородом, вследствие этого иммунитет ослабляется и происходит обширное поражение организма.
Если терапия не была проведена своевременно, то рак перейдет в запущенную фазу и вероятность излечения будет минимальной.
Этапы инвазивного процесса
Инвазия опухоли протекает постепенно. Весь процесс развития инвазивного рака происходит в несколько этапов:
- Первая стадия . Межклеточные контакты ослабляются, мембранные белки, которые связывают между собой раковые клетки, отдаляются друг от друга, их количество уменьшается. В это же время концентрация клеток, обеспечивающих мобильность новообразований, повышается. При инвазионном раке размеры опухоли не превышают 2 см,
- Вторая стадия . Раковые клетки крепятся к тканям матрикса (межтканевый барьер организма, состоящий из соединительнотканных структур и базальных клеточных мембран). Размеры опухоли на данном этапе инвазивного рака достигают 2-5 см.
- Третья стадия . Раковые клетки вырабатывают особые ферменты, способствующие ослаблению матрикса. В результате это провоцирует разрушение тканевых барьеров. На этом этапе новообразование не обладает четкими границами, наблюдается склеивание патологических клеток в лимфоузлах.
- Четвертая стадия . Запущенная форма инвазионного рака, при которой патологические клетки мигрируют в соседние структуры, все больше поражая организм пациента. Наблюдаются метастазы в отдаленных органах.
Стандартный процесс инвазии в онкологии состоит из 4 этапов, их длительность в каждом случае может отличаться. И если у одного человека инвазивный рак развивается в течение нескольких лет, то у других переход с первой стадии в последнюю может занять всего пару месяцев.

Как развивается в разных органах
Инвазия опухоли – патологический процесс, способный поражать абсолютно любой орган человеческого организма. Наименее подвержены инвазивному раку органы с плотной фиброзной тканью, плотными артериальными стенками и хрящевой структурой. Редко патология затрагивает почки и печень. Часто диагностируется инвазия шейки матки или молочных желез.
Инвазия шейки матки является распространенным онкологическим заболеванием, которое чаще всего диагностируется у женщин 45-55 лет. Вероятность развития патологии повышается при наличии предрасполагающих факторов:
- заражение папилломавирусом человека;
- венерические заболевания;
- беспорядочные половые связи;
- прием гормональных средств;
- перенесенная онкология мочеполовой системы;
- множественные роды;
- некоторые женские заболевания;
- ранее начало сексуальной жизни;
- курение.
Заподозрить развитие инвазивного процесса в шейке матки можно по симптомам:
- нерегулярные менструации;
- кровотечения во время полового акта;
- водянистые выделения;
- зловоние;
- нарушение мочеиспускания;
- боли внизу живота.
Помимо этого могут присутствовать неспецифические признаки, как гипергидроз, потеря аппетита, головокружение и слабость.
Инвазия молочной железы (инвазивная карцинома) представляет собой быстропрогрессирующий тип раковой опухоли, который при попадании в лимфотоки разносится по всему организму. Такая разновидность онкологии развивается по ряду причин:
- мастопатия;
- фиброаденома;
- отказ от грудного вскармливания;
- аборт при первой беременности;
- хронические патологии репродуктивной системы;
- нерегулярная половая жизнь;
- генетическая предрасположенность.
Проявляется инвазивный рак молочной железы по-разному. Если раковые клетки не распространяются за пределы груди, то пациентка может изредка ощущать дискомфорт и болезненность при ощупывании молочных желез. При развитии патологии возникают симптомы:
- болезненность сосков;
- кровянистые выделения из сосков;
- изменение формы груди;
- уплотнения в груди, не имеющие точных границ.
При данном заболевании наблюдаться покраснение, побледнение или сморщивание кожи в области грудной клетки.

Факторы инвазивности процесса
Для того чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие таких предрасполагающих факторов:
- Давление. Чем больше атипичных клеток, тем выше сила давления в тканях первичного ракового очага. В результате оказывающегося давления имеющиеся межтканевые барьеры разрушаются, происходит поражение соседних тканей.
- Подвижность клеток. Раковые клетки мигрируют в направлении тканей, которые обладают высоким уровнем pH, а также большей концентрацией кислорода и питательных веществ.
- Контакты между клетками. Раковые клетки имеют слабые связи, из-за чего вероятность их попадания в кровоток и соседние структуры существенно возрастает.
- Лизосомальные ферменты. Раковые новообразования продуцируют литические ферменты, которые способствуют разрушение здоровых клеток, провоцируя развитие инвазии.
- Пролиферативное свойство. Благодаря данному свойству ткани увеличиваются в размерах. При разрастании ткани, окружающей опухоль, раковые клетки могут свободно перемещаться по организму.
- Особенности иммунитета. От состояния иммунной системы во многом зависит течение патологии. Если иммунная система ослаблена, то скорость распространения раковых клеток за пределы первичного очага существенно увеличивается. Сильный иммунитет, напротив, максимально затормаживает процесс инвазии.
Процесс инвазии также зависит и от таких факторов, как травмы и повреждения, воспалительные процессы, отеки и клеточная пролиферация.
Способы диагностики
На начальной стадии развития инвазивного рака специфические симптомы отсутствуют, из-за чего появляются трудности со своевременным обнаружением проблемы. Чтобы выявить инвазию необходимо проходить регулярные скрининговые обследования. И поскольку инвазионные опухоли чаще всего диагностируются в молочных железах и шейке матки, женщины после 20 лет должны каждый год проверяться у гинеколога и маммолога.
При появлении подозрений на инвазию опухоли следует пройти детальное обследование, включающее в себя проведение таких методов диагностики:
- общие анализы крови и мочи;
- ультразвуковое исследование;
- рентгенография;
- КТ, МРТ.
Потребуется прохождение позитронно-эмиссионной томографии, дуктографии, пиелографии, ректороманоскопии. Обязательно проводится гистологическое обследование, иммуногистохимические тесты.

Методы лечения
Лечение инвазивного рака зависит от степени патологического процесса, особенностей протекания онкологии, расположения опухоли и многого другого. В зависимости от стадии онкологического процесса врачи могут назначать терапию следующего типа:
- нулевая, первая стадия – хирургическое вмешательство;
- вторая – лучевая терапия в сочетании с операцией;
- третья – химиотерапия, комбинированная с радиационной терапией;
- четвертая – лучевая, паллиативная терапия.
Могут проводиться и другие методики лечения, в том числе и экспериментальные. Курс терапии подбирается только опытным специалистом, после прохождения летального обследования.
Прогноз при инвазии опухоли зависит от того, на каком этапе была обнаружена проблема. Если лечение было начато на первой стадии, то выживаемость составляет 90%. При поздней диагностике срок жизни пациента не превышает 1 года.
Каждый пациент на приёме у врача больше всего боится, что у него заподозрят или, что хуже, найдут новообразование. Однако мало кто знает о механизме развития опухоли и за счет чего конкретно данный диагноз является настолько страшным. В этой статье мы разберёмся, что именно делает онкологические заболевания такими опасными для жизни.
- Строение тканей с точки зрения формирования опухолевого процесса
- Доброкачественные и злокачественные опухоли: в чем разница?
- Что такое инвазия опухоли?
- Факторы, определяющие степень инвазивности опухоли
- Инвазия раковых клеток в сосуды
- Циркуляция раковых клеток в системе кровотока и экстравазация
- Резюме
Строение тканей с точки зрения формирования опухолевого процесса
Чтобы разобраться в механизме образования и развития опухоли, необходимо иметь представление о принципе строения тканей в организме. Большинство тканей, независимо от места их расположения, имеют сходный план строения:
- Базальная мембрана — это неклеточная структура, отграничивающая ткани друг от друга;
- Ростковый слой — группа активно делящихся клеток, расположенных на базальной мембране, которые обеспечивают обновление ткани. Именно изменение генетического материала клеток росткового слоя влечёт за собой развития опухоли;
- Слой созревающих клеток — клетки ростового слоя, которые постепенно продвигаются в верхние слои в процессе дифференцировки (приобретения формы и свойств, характерных для данной ткани);
- Поверхностный слой — группа клеток, которая и обеспечивает выполнение тканью определённой функции.
Между ростковым и поверхностным могут располагаться дополнительные слои в зависимости от конкретного вида ткани. Но принцип строения всегда один и тот же: клетки, способные делиться, находятся на базальной мембране. В процессе созревания они перемещаются в верхние слои, утрачивая способность к делению и приобретая специфические свойства.
Доброкачественные и злокачественные опухоли: в чем разница?
Исходя из того, клетки какого слоя подверглись мутации, выделяют два типа неоплазий — доброкачественные и злокачественные. Их отличия заключаются в том, что первый тип формируется из высоко дифференцированных клеток созревающего слоя. При доброкачественных опухолях клетки не будут сильно отличаться от здоровых клеток данной ткани. Такая неоплазия считается неагрессивной и растет медленно, а также не даёт метастазы. Патогенное действие доброкачественного новообразования заключается главным образом в сдавлении окружающих её тканей. Иногда такие опухоли полностью или частично закрывают просвет какого-либо полого органа.
В процессе развития рака выделяют 4 стадии:

Что такое инвазия опухоли?
Инвазия обуславливает способность опухолей давать метастазы — вторичные очаги онкологического процесса вдали от материнской опухоли, возникшие из-за миграции раковых клеток. Обязательное условие метастазирования — наличие у опухоли собственной капиллярной сети. Она формируется, когда количество неопластических клеток достигает 103 (1-2 мм).
- Разрыв межклеточных связей, соединяющих раковые клетки между собой;
- Прикрепление клеток опухоли к базальной мембране;
- Разрушение базальной мембраны лизирующими (расщепляющими) ферментами;
- Миграция клеток в соседние ткани и органы.
Раковые клетки, находящиеся в процессе инвазии, более устойчивы к облучению и химеотерапии, чем стационарные. Во многом это связано с временной утратой мигрирующими клетками способности к делению. Также движущиеся опухолевые клетки проявляют повышенную активность антиапоптотических генов (гены, препятствующие запрограммированной смерти клетки — апоптозу). И, поскольку химиотерапевтические препараты направлены на стимуляцию апопоза, их устойчивость к лечению возрастает.
Факторы, определяющие степень инвазивности опухоли
Чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие следующих факторов:
- Быстрое деление и давление. Механическое воздействие опухолевой массы на базальную мембрану способствует её разрушению и, как следствие, инвазии раковых клеток;
- Подвижность клеток. Клетки новообразования способны к миграции, причем их движение не является хаотичным. Они движутся в направлении большей концентрации кислорода, питательных веществ, а также в сторону более нейтрального показателя кислотности (рН);
- Межклеточные связи. Чем прочнее эти контакты, тем меньше шансов, что опухоль начнет инвазивный рост. У злокачественных клеток связи слабые, поэтому клетки легко отрываются от новообразования и попадают в кровоток или в лимфатическую систему;
- Действие лизосомальных ферментов. Злокачественная опухоль вырабатывает вещества, способные разрушать здоровые клетки и межклеточное вещество, что будет способствовать инвазии;
- Иммунная система человека. В организме существует собственная противоопухолевая защита, которую обеспечивает наш иммунитет. Её активность у каждого человека индивидуальна. Она зависит от генетической предрасположенности и состояния всего организма в конкретный момент. Так, при заболеваниях, сопровождающихся угнетением иммунной системы (например, при ВИЧ), пациенты могут погибать от онкологических заболеваний, возникших из-за отсутствия противоопухолевой активности.
Инвазия раковых клеток в сосуды
Вслед за прорастанием в базальную мембрану наступает интравазальная (внутрисосудистая) инвазия опухоли. Чаще раковые клетки мигрируют в артерии. Это связано с тем, что стенки артерий более упругие и эластичные, в то время как у вен они тонкие и легко спадаются в опухолях. Однако раковые клетки могут быть занесены в вены из лимфатических сосудов.
Циркуляция раковых клеток в системе кровотока и экстравазация
Экстарвазация представляет собой выход опухолевых клеток из сосудов для формирования метастатического очага. В этом процессе задействованы те же ферменты, что и в инвазии через базальную мембрану.
Резюме
Вот что следует знать об инвазии опухолей:
- Инвазия — это проникновение раковых клеток через базальную мембрану ткани, из которой развилась опухоль;
- Инвазия свойственна только злокачественным новообразованиям;
- В инвазии участвуют лизирующие ферменты, которые способны разрушать как неклеточные структуры, так и связи между здоровыми клетками (например, выстилка сосудов);
- Явление инвазии лежит в основе метастазирования;
- Инвазия бывает индивидуальной и групповой, и последняя чаще обуславливает появление метастазов,
- Самые распространенные виды инвазивных опухолей — рак шейки матки и рак молочной железы.
Рак предстательной железы (РПЖ), он же рак простаты (код С61 по МКБ) – самое распространенное злокачественное новообразование мужской половой системы. По данным на 2014 год в России заболеваемость составляла 388 случаев на 100 тысяч населения, причем за последние 10 лет она выросла на 18%. Если же говорить о злокачественных новообразованиях у мужчин в общем, то РПЖ по частоте уступает только карциномам бронхолегочной системы.
Смертность от рака простаты растет вслед за заболеваемостью. 22% пациентов впервые обращаются к врачу только на 4 стадии, когда радикальное лечение невозможно, а вероятность благоприятного исхода крайне невелика.

Факторы риска
Классификация
По морфологическим признакам (из каких именно клеток развивается новообразование) злокачественные опухоли простаты делятся на аденокарциному (которая, в свою очередь, подразделяется еще на 8 гистологических подтипов), переходноклеточный и плоскоклеточный рак.
Оценивает степень распространенности РПЖ.
T – непосредственно размеры новообразования
- T1 – опухоль не прощупывается и не определяется методами лучевой диагностики, не имеет клинических проявлений и обнаруживается при биопсии из-за увеличенного уровня простатспецифического антигена (ПСА) в крови.
- T2 – новообразование ограничено железой;
- T3 – опухоль распространяется за пределы капсулы простаты в окружающую клетчатку и семенные пузырьки;
- T4 – прорастание в рядом распололоженные органы и ткани.
N – поражение лимфоузлов.
- N0 – узлы не поражены;
- N1 – вовлечение в процесс регионарного лимфоколлектора.
M – наличие отдаленных метастазов.
- M0 – очагов нет;
- M1 – диагностируются опухолевые отсевы в другие органы.
Классификация, которая отражает степень патологического изменения клеток. Созревание нормальных клеток называется дифференцировкой – во время этого процесса они приобретают характерные для каждого вида тканей особенности. Раковые клетки делятся очень быстро и не успевают дифференцироваться. Соответственно, чем ниже степень дифференцировки , тем агрессивней течение опухоли. 1 балл по Глисону – высокодифференцированная ткань, 5 – низкодифференцированная. Поскольку РПЖ обычно неоднороден по структуре, выбираются два самых характерных участка, им присваивают баллы по шкале Gleason. Далее их суммируют и получают окончательное значение от 2 до 10, отражающее степень агрессивности опухоли, и, как следствие, вероятный прогноз.
Еще один способ классификации злокачественности опухоли по уровню клеточной дифференцировки.
- G1 – высокая степень дифференцировки;
- G2 – умеренная;
- G3 – низкодифференцированное новообразование;
- G4 – недифференцированное.
Стадии рака простаты
Формируются исходя из рубрификации по TNM
- Опухоль случайно обнаружена при операции, по объему не превышает 5% объема органа, лимфоузлы не вовлечены, метастазов нет, G1 по ВОЗ.
- Опухоль ограничена предстательной железой, метастазов в лимфоузлы и отдаленных нет, любая G.
- Новообразование прорастает капсулу простаты, но не распространяется на близлежащие органы (кроме семенных пузырьков), любая G.
- Инвазия в соседние органы (мочевого пузыря, прямой кишки или мышц тазового дна), либо поражение лимфоузлов, либо появление отдаленных метастазов. Любая G.
Клиническая картина
На начальных стадиях развития новообразования жалоб нет. По мере разрастания опухоли появляются признаки, которые можно разделить на несколько групп:
Симптомы, связанные с нарушением оттока мочи (сдавлением уретры):
- слабая прерывистая струя мочи;
- учащенное мочеиспускание;
- резкие внезапные позывы;
- ощущение неполного опорожнения мочевого пузыря;
- недержание мочи в стрессовой ситуации.
Симптоматика, связанная с ростом опухоли:
- появление крови в сперме;
- кровь в моче;
- нарушения эрекции;
- боль в промежности и над лобком;
- недержание мочи.
Признаки отдаленных метастазов:
- боли в костях;
- боли в пояснице (появляются если опухоль прорастает или сдавливает мочеточники);
- отеки ног (при нарушении нормального лимфотока);
- снижение силы или паралич нижних конечностей (при сдавлении спинного мозга);
- беспричинная потеря веса;
- субфебрильная (37 – 38) температура;
- анемия.
Диагностика
Диагноз обычно устанавливается по итогам лабораторного и инструментального обследования.
Уровень простатспецифического антигена (PSA или ПСА). Это особый белок, который в норме находится исключительно в тканях предстательной железы и в кровь попадает в минимальных количествах. Повышенный уровень ПСА в крови признак не только злокачественной опухоли, но и любых патологических изменений органа. Повышение его возможно если железа воспалена (хронический простатит), или при доброкачественной гиперплазии (аденоме простаты). Референтные значения ПСА увеличиваются с возрастом: если для мужчин 40 – 49 лет норма до 2,5 нг/мл, то в 50 – 59 максимальное допустимое значение увеличивается до 3,5 нг/мл, 60 – 69 лет – до 4,5 нг/мл, после 70 лет до 6,5 нг/мл.
Обычно, показатели менее 10 нг/мл характерны для доброкачественной гиперплазии простаты, уровень выше 10 нг/мл обычно говорит о раке. Но примерно в 13% случаев карциномы предстательной железы уровень ПСА остается нормальным.
Ультразвуковая диагностика. Обычно используют трансректальное УЗИ (ТРУЗИ) – так датчик можно поместить максимально близко к железе, увеличив точность диагностики. Под контролем УЗИ выполняют прицельную биопсию, чтобы взять на анализ ткани именно измененных участков.
МРТ. Способна выявить опухоль диаметром менее 5 мм. Результаты исследования оцениваются по системе PI-RADS, что подразумевает стандартизированные технические протоколы получения изображения. Далее предстательная железа делится на несколько сегментов, изменения в которых имеют разную диагностическую значимость. Всем обнаруженным визуально изменениям присваивается некоторое количество баллов, которое зависит от конкретной картины и расположения патологии. Полученное значение может быть от 1 до 5, где 1 – скорее всего доброкачественное новообразование, а 5 – злокачественное.
Кроме того, МРТ используют для обнаружения метастазов.
Гистологическая верификация обязательна для подтверждения онкологического диагноза. Берут несколько образцов тканей и изучают их под микроскопом. Иногда для установления окончательного диагноза приходится повторять исследование. Показания к вторичной биопсии:
- атипичная ацинарная пролиферация (изменение желез, подозрительное на рак);
- высокий уровень ПСА, особенно если значения продолжают увеличиваться;
- наличие биоптатах трех и более участков предраковых изменений – интерстициальной неоплазии высокой степени.
Для обнаружения отдаленных метастазов используют также рентгенографию грудной клетки. определение уровня щелочной фосфатазы (косвенный признак метастазирования в костную ткань), УЗИ, КТ и МРТ брюшной полости.
Лечение
У пожилых больных с тяжелой сопутствующей патологией (ожидаемая продолжительность жизни менее 10 лет) при локализованной высокодифференцированной опухоли клинические рекомендации предлагают начинают с тактики тщательного наблюдения (отсроченного лечения). это не означает бездействия. Пациент находится под строжайшим медицинским патронажем, и при первых же признаках прогрессирования болезни переходят к терапии. Контрольные обследования делают с интервалом 3 – 12 месяцев.
Метод выбора при лечении локализованного рака предстательной железы. При этом удаляют сам орган, простатическую часть уретры, семенные пузырьки. Радикальная операция – единственный способ одномоментно удалить всю опухоль, что при локализованном раке (1 и 2 стадии) означает полное излечение.
Иногда радикальную простатэктомию делают и при диссеминированном, метастатическом раке. Это выполняют для того, чтобы уменьшить массу опухоли, после чего проводят консервативное лечение.
Еще одна методика, которая наряду с радикальной простатэктомией, позволяет добиться полного излечения. Чаще всего используется дистанционное фотонное облучение: при этом источник излучения внешний. В методике, называемой брахитерапия, источник излучения помещается непосредственно в ткани простаты. Так или иначе, ЛТ требует длительного времени (обычно от 1.5 до 2 месяцев). Она эффективна как при локализованном, так и при местнораспространенном раке. Во втором случае лучевую терапию сочетают с гормональной.

К ним относятся криоабляция простаты, лазерная абляция и разрушение тканей с помощью высокоинтенсивного сфокусированного ультразвука (HIFU). Эти методики пока не имеют достаточных доказательств клинической эффективности, и используются как альтернатива операции или химиотерапии при противопоказаниях к радикальному вмешательству.
РПЖ – гормонозависимая опухоль, и снизив концентрацию тестостерона в тканях железы можно замедлять рост злокачественной ткани. Гормональную терапию обычно используют при распространенном раке как паллиативный метод – средство продлить жизнь и улучшить ее качество – но не как радикальный способ полного избавления от новообразования.
Снизить концентрацию тестостерона в тканях простаты можно двумя путями:
- Уменьшить выработку гормона яичками.
- Заблокировать рецепторы к мужским половым гормонам в клетках простаты. При этом общий уровень тестостерона крови остается нормальным.
Удаление обоих яичек, то есть кастрация. Это традиционный метод, с эффективностью которого сравниваются все остальные способы гормонотерапии рака предстательной железы. Двусторонняя орхиэктомия эффективна в 85% впервые выявленного гормонозависимого РПЖ. Побочные эффекты: операция психологически плохо переносится, приливы, остеопороз, эректильную дисфункцию, гинекомастию (увеличение грудных желез).
ЛГ – вещество, которое вырабатывается в гипофизе. Он действует на клетки яичек, которые синтезируют тестостерон. Но процесс производства самого лютеинизирующего гормона тоже регулируется специальным веществом: релизинг-гормоном (англ. release – освобождать). Релизинг-гормон лютеинизирующего гормона вырабатывается в гипоталамусе. Примерно раз в 90 минут порция этого вещества поступает в кровь, влияет на клетки гипофиза, который вырабатывает лютеинизирующий гормон чтобы тот, в свою очередь подействовал на яички, запустив синтез тестостерона.
Конкретные дозировки и интервалы применения назначает врач. Длительность курса обычно измеряется годами.
Точно так же, как и агонисты, связываются с соответствующими рецепторами. Но, в отличие от агонистов не активируют их, а блокируют. Лютеинизирующий гормон не синтезируется, следовательно, тестостерон тоже. Наиболее изученный препарат этой группы – дегареликс.
Все вышеописанные методики гормональной терапии характеризуются идентичными показателями эффективности.
Блокируют рецепторы к андрогенам непосредственно в самой предстательной железе. Препараты: ципротерон, мегестрол, хлормадинон, бикалутамид, флутамид, нилутамид.
Обычно их рекомендуют перед назначением агонистов ЛГРГ, чтобы предупредить скачок уровня тестостерона в начале курса лечения. Как самостоятельную терапию их назначают при гормонрезистентоном (современный термин: кастрационно-резистентный) раке, когда кастрация не уменьшает уровень простатспецифического антигена.
В качестве второй линии терапии может быть назначен кетоконазол. Это противогрибковый препарат, который при длительном применении угнетает синтез андрогенов. Требует постоянного контроля функций печени.
При метастатическом раке предстательной железы доксетацел применяют одновременно с гормонотерапией. Также он эффективен и при кастрационнорезистентном раке.
Прогноз
Для пациентов с высоко – и умереннодифференцированными новообразованиями, по отношению к которым использовали тактику отсроченного лечения 10-летняя выживаемость составляет 87%.
Для пациентов с 1 – 2 стадиями рак простаты пятилетняя выживаемость после радикальной простатэктомии или лучевой терапии составляет 85 – 97% (безрецидивная — 70 – 90%).
Для пациентов с имеющимися метастазами средняя продолжительность жизни с момента выявления заболевания составляет 24 – 36 месяцев.
Профилактика рака предстательной железы не разработана. Также есть сомнения в эффективности системы скрининга. Принятое в России пальцевое ректальное исследование позволяет обнаружить бессимптомный рак не более чем в 4% случаев. С другой стороны, регулярное измерение уровня простатспецифического антигена на 25 – 31% уменьшает вероятность умереть от рака простаты. Использовать ли эту информацию – каждый решает сам.
Медицинский эксперт статьи

Клинически различают локализованный T1-2, N0, M0), местнораспространённый (Т3-4, N0-1, M0) и генерализованный рак (T1-4, N0-1, М1).
Больных с клинически локализованными и местнораспространёнными стадиями распределяют по степени риска (Д’Амико А В. и др., 2003):
- низкая: стадия Т1а-с; уровень ПСА менее 10 иг/мл: градация по Глисону - 2-5; при биопсии - одностороннее поражение менее 50%:
- умеренная: стадия Т2а; уровень ПСА менее 10 нг/мл; градация по Глисону - 3 + 4 = 7; при биопсии - двустороннее поражение менее 50%;
- высокая стадия Т2b , Т3а-b; уровень ПСА - 10-20 нг/мл; градация по Глисону - более 4 + 3 - 7; при биопсии - поражение более 50%, периневральная инвазия;
- очень высокая: стадия Т4; уровень ПСА более 20 нг/мл; градация по Глисону - более 8; при биопсии - лимфоваскулярная инвазия.
После уточнения диагноза и установления распространённости процесса (локализованный, местнораспространенный или генерализованный) врач и пациент стоят перед выбором метода лечения. В современном обществе огромное значение уделяют качеству жизни больных после начала лечения. Качество жизни без лечения соответствует течению основного заболевания и зависит от прогрессирования онкологического процесса. Изменение качества жизни возникает в основном после начала лечения и применения одного из терапевтических или хирургических методов. Чёткое установление стадии процесса позволяет не только выбрать оптимальный метод лечения, но и прогнозировать дальнейшее течение заболевания.
Определение уровня ПСА в сочетании с клинической картиной рака простаты и градацией опухоли по шкале Глисона значительно повышает информативность каждого из перечисленных показателей в установлении патологической стадии рака. А.В. Партин и соавт. (1997) предложили прогностические таблицы, позволяющие прогнозировать дальнейшее распространение опухоли, выбор метода лечения, степень радикальности и прогноз эффективности лечения
Для оценки распространённости опухоли наиболее часто используют ПРИ, ТРУЗИ, определение уровня ПСА и остеосцинтиграфию. При необходимости назначают компьютерную томографию (КТ) или магнитно-резонансную томографию (MPТ) и рентгенографию грудной клетки.
Любой из методов визуализации предназначен для определения стадии и оценки эффективности лечения После верификации диагноза уролог должен уточнить объём первичной опухоли, ее границы, инвазивный или метастатический потенциал опухоли. Все эти показатели имеют большое значение для прогноза заболевания и выбора метода лечения.

[1], [2], [3], [4], [5], [6], [7], [8], [9]
Первичная опухоль (Т)
Прежде всего, следует определить, ограничена опухоль предстательной железой (Т1-2) или выходит за пределы капсулы (Т3-4). Пальцевое исследование часто не позволяет оценить распространённость опухоли. По некоторым данным, результаты ПРИ соответствуют таковым при гистологическом исследовании менее чем у 50% больных. Тем не менее более подробное обследование показано лишь при решении вопроса о радикальном лечении.
Уровень ПСА может отражать распространённость опухоли, однако не позволяет точно определить морфологическую стадию. Сочетание уровня ПСА, индекса Глисона и данных пальпации позволяет лучше предсказать морфологическую стадию, чем каждый из этих параметров в отдельности. Значение свободного ПСА спорно: в одном из исследований определение содержания свободного ПСА помогало уточнить стадию при локализованных опухолях, однако другие работы этого не подтвердили. Разрешить этот вопрос помогут лишь углублённые исследования.
Для изучения состояния предстательной железы чаще всего применяют трансректальное УЗИ. Этот метод позволяет обнаружить лишь 60% опухолей и не всегда показывает прорастание капсулы. Почти у 60% больных со стадией Т3. УЗИ указывает на менее распространённый процесс. Ультразвуковые признаки прорастания капсулы - выпуклость, неровность и разрыв контура железы. Инвазия опухолевых клеток в семенные пузырьки - плохой прогностический признак, но информация о ней крайне важна для выбора метода лечения. При ТРУЗИ следует обращать внимание на эхоструктуру пузырьков (гиперэхогенность), их асимметрию, деформацию и расширение. Также о поражении семенных пузырьков свидетельствует утрата закругленности и уплотнение у основания железы. Эти признаки довольно субъективны, поэтому целиком полагаться на данные УЗИ нецелесообразно. Инвазия семенных пузырьков указывает на высокий риск местного рецидива и метастазов и для уточнения (перед операций) показана их биопсия. Начинать обследование с этой процедуры не следует, но если риск инвазии велик и от результата биопсии зависит выбор лечения, то её выполнение оправданно. Отрицательный результат не исключает микроскопической инвазии. Как правило, биопсию семенных пузырьков проводят при клинической стадии Т2b, и выше и содержании ПСА более 10 нг/мл. Результат считают положительным, если хотя бы один биоптат из основания предстательной железы содержит опухолевые клетки. Повысить точность клинического определения стадии позволяют не только дополнительные исследования, но и тщательный анализ результатов первичной биопсии (играют роль количество и протяжённость опухолевых очагов, инвазия капсулы). Имеет значение и степень дифференцировки: при индексе Глисона менее 6 опухоль в 70% случаев локализована.
Кровоток в предстательной железе при раке выше, чем в нормальной железе или при ее гиперплазии. После кастрации интенсивность кровотока в железе снижена. Перспективна разработка эходопплерографических карт для диагностики и мониторинга РПЖ, однако в настоящее время нет достоверных данных об использовании эходопплерографии в определении стадии местного процесса. Возможно применение этого метода для получения дополнительного материала при прицельной биопсии из очагов патологической васкуляризации.
Результаты визуализации рака простаты прямо зависят от технической оснащённости клиники и опыта специалиста. Именно поэтому все современные методы визуализации носят не определяющую, а уточняющую роль, и выбор метода лечения основан на совокупности данных клинического обследования и инструментальных исследований.
Наилучшими возможностями для визуализации структуры предстательной железы обладает МРТ. Современный стандарт обследования органов малого таза методом MPТ - применение эндоректального датчика, позволяющего получить изображение с максимально возможным пространственным разрешением, составляющим 0,5-1 мм. Нагнетание воздуха в эндоректальный датчик обеспечивает чёткую визуализацию капсулы предстательной железы, ректопростатических углов и ректопростатической фасции Денонвилье. Применение эндоректального датчика при MРТ не ограничивает визуализацию регионарных лимфатических узлов (вплоть до уровня бифуркации брюшной аорты). Раку предстательной железы свойственна низкая интенсивность сигнала на Т-взвешенных изображениях на фоне сигнала высокой интенсивности от неизмененной периферической зоны железы. Неправильная форма, диффузное распространение с масс-эффектом, нечёткие и неровные контуры - морфологические характеристики очагов низкой интенсивности сигнала в периферической зоне предстательной железы, позволяющие предположить неопластический характер поражения. При проведении динамического контрастирования очаги рака быстро накапливают контрастный препарат в артериальную фазу и быстро выводят препарат, что отражает степень ангиогенеза и, соответственно, степень злокачественности опухоли. Низкая интенсивность сигнала также свойственна очагам постбиопсийных кровоизлияний, простатита, стромальной доброкачественной гиперплазии нейтральной зоны железы, фиброзно-рубцовым изменениям, фибромускулярной гиперплазии, последствиям гормональной или лучевой терапии. МРТ без динамического контрастирования не позволяет достоверно дифференцировать большинство перечисленных изменений и заболеваний.
Как отмечено выше, одна из основных задач любого метода визуализации при РПЖ - определение объёма поражения железы и распространения опухоли за пределы капсулы. Определение объема опухоли важно в прогностическом отношении. Объём опухоли менее 4 см 3 свидетельствует об отдалённых метастазах, а 12 см 3 - о крайне высокой вероятности метастазов. По данным исследований, точность МРТ в обнаружении очагов неопластического поражения предстательной железы составляет от 50 до 90%. Чувствительность МРТ при определении локализации РПЖ составляет около 70-80%, при этом микроскопические очаги рака (фокусы) с помощью МРТ обнаружить невозможно.
Важнейшее преимущество эндоректальной MPТ - возможность определения локализации очагов неопластического поражения в зонах, недоступных другим методам диагностики, и уточнения характера и направления роста опухоли. Так, например, МРТ позволяет обнаружить очаги неопластического поражения в передних отделах периферической зоны предстательной железы, недоступных при трансректальной биопсии. В целом МРТ существенно дополняет данные ПРИ и ТРУЗИ о локализации опухоли.
Эндоректальная MPТ позволяет визуализировать капсулу железы, сосудисто-нервные пучки, семенные пузырьки, верхушку железы, перипростатичсское венозное сплетение и определить локальную распространённость опухоли железы. Следует подчеркнуть, что пенетрацию капсулы считают микроскопическим признаком, и даже современные аппараты МРТ (эндоректальная катушка) не способны дать такую информацию. Возможно лишь получение данных о прорастании за пределы капсулы железы.
Критерии диагностики экстракапсулярной экстензии при МРТ:
- наличие собственно экстракапсулярной опухоли;
- неровность контура железы (деформация, ангулярность);
- асимметрия нейроваскулярных пучков;
- облитерация ректопростатических углов;
- широкий контакт опухоли с капсулой.
Самой высокой специфичности (до 95-98%) и точности результата МРТ достигают при обследовании пациентов среднего или высокого риска экстракапсулярной инвазии. Считают, что экстракапсулярная инвазия (по данным МРТ) указывает на нецелесообразность хирургического лечения и неблагоприятный прогноз заболевания. Гормональная или лучевая терапия не влияет на точность обнаружения экстракапсулярного распространения опухоли предстательной железы. Основная трудность в обнаружении очагов рака и экстракапсулярного распространения опухоли - высокая вариабельность интерпретации томограмм разными специалистами. Первостепенная задача специалиста по лучевой диагностике - достижение высокой специфичности диагностики (даже в ущерб чувствительности) для того, чтобы не лишить операбельных пациентов шанса на проведение радикального лечения.
Сходство плотности раковой, гиперплазированной и нормальной ткани предстательной железы при КТ делает этот метод малопригодным для оценки местной распространенности опухоли. Прорастание в семенные пузырьки более важно, чем прорастание в капсулы, но и в этом случае КТ даёт информацию лишь при запущенном процессе. Однако этот метод активно применяют для разметки области воздействия перед лучевой терапией.
Медленное развитие лучевой диагностики в нашей стране привело к поздней диагностике РПЖ и, следовательно, к недостаточной распространённости радикальных методов лечения РПЖ (например, простатэктомии), малой доступности современных томографов и отсутствию соответствующих обучающих программ для специалистов по лучевой диагностике и урологов. Несмотря на то что КТ и МРТ сейчас широко распространены, уровень оснащения кабинетов и образования специалистов по лучевой диагностике недостаточен для того, чтобы полученная информация стала определяющей при выборе метода лечения больных РПЖ.
Регионарные лимфатические узлы (N)
Оценивать регионарные лимфатические узлы следует лишь в тех случаях, когда это напрямую влияет на лечебную тактику (обычно при планировании радикального лечения). Высокий уровень ПСА, опухоли Т2с-Т3а, низкая дифференцировка и периневральная инвазия сопряжены с высоким риском метастазирования в лимфатические узлы. Оценку состояния лимфатических узлов по уровню ПСА считают недостаточной.
Необходимую информацию предоставляет лишь лимфаденэктомия (открытая или лапароскопическая). Недавние исследования расширенной лимфаденэктомии показали, что РПЖ не всегда поражает запирательные лимфатические узлы. При бессимптомных опухолях и уровне ПСА менее 20 кг/мл. КТ подтверждает увеличение лимфатических узлов лишь в 1 % случаев. Применение МРТ или КТ оправдано при высоком риске метастазирования, так как специфичность этих методов достигает 93-96%. Однако даже положительный результат при их применении может быть ложным, и только пункция подозрительного лимфатического узла позволяет отказаться от лимфаденэктомии, По данным ретроспективного анализа, размеры лимфатического узла не всегда свидетельствуют о наличии в нем метастазов, более информативным признаком считают асимметрию пораженных лимфатических узлов. В настоящее время только у 2-3% больных, перенёсших радикальную простатэктомию по поводу локального РПЖ, диагностируют метастазирование в лимфатические узлы на основании послеоперационного гистологического исследования.
В качестве методов обнаружения метастазирования в лимфатические узлы рекомендуют использовать позитронно-эмиссионную томографию (ПЭТ) и сцинтиграфию с мечеными антителами, но их применение пока ограничено в связи с недостаточной чувствительностью.
Для оценки риска поражения регионарных лимфатических узлов можно использовать номограммы Партина (2001). Номограммы - Математические алгоритмы, которые используют для конкретного пациента или для группы больных. Эти таблицы позволяют определить вероятность местного распространения опухоли (на капсулу, семенные пузырьки) и поражения лимфатических узлов на основании клинической стадии, уровня ПСА и индекса Глисона. В частности, они дают возможность выделить группу больных с низкой (менее 10%) вероятностью метастазирования в лимфатические узлы (при уровне ПСА более 20 нг/мд, стадии Т1-2а и индексе Глисона 2-6); в этой группе перед радикальным лечением состояние лимфатических узлов можно не уточнять. Оценить риск метастазировани я в лимфатические узлы позволяет и обнаружение участков опухоли с выраженной анаплазией (4-5 баллов): если такие участки обнаруживают в четырёх биоптатах и более или они преобладают хотя бы в одном биоптате, риск достигает 20-45%. У остальных больных он не превышает 2,5%. Дополнительное обследование в таких случаях не требуется
Отдалённые метастазы (М)
У 85% больных, умирающих от РПЖ, обнаруживают поражения осевого скелета. Костные метастазы возникают вследствие попадания раковых клеток с током крови в костный мозг, что приводит к росту опухоли и лизису костных структур. Распространенность костных метастазов влияет на прогноз, а их раннее обнаружение предупреждает врача о возможных осложнениях. В 70% случаев метастазирование сочетается с повышением активности костного изофермента щелочной фосфатазы (ЩФ). Определение активности ЩФ и уровня ПСА в подавляющем большинстве случаев позволяет обнаружить костное метастазирование. Поданным многофакторного анализа, на эти показатели влияет лишь количество метастазов в кости. Важно, что активность костного изофермента ЩФ отражает степень поражения костей более точно, чем уровень ПСА.
Наиболее чувствительным методом обнаружения метастазов в кости считают сцинтиграфию (превосходит рентгенографию и определение активности щелочной и кислой фосфатазы). В качестве радиофармацевтического препарата лучше использовать дифосфонаты технеция, накопление которых в костях происходит намного активнее, чем в мягких тканях. Показана корреляция между полуколичественной оценкой поражения костей и выживаемостью. Обнаружение отдалённых метастазов возможно в любом органе. Чаще они возникают в нерегионарных лимфатических узлах, легких, печени, головном мозге и коже. При соответствующих жалобах и симптомах для их обнаружения используют рентгенографию грудной клетки, УЗИ, КТ и МРТ. Тактика при подозрении на костное метастазирование представлена на схеме.
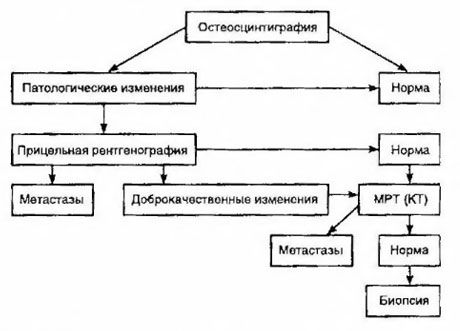
Самым надёжным лабораторным показателем, помогающим в определении степени метастазирования, служит уровень ПСА. Показано, что его увеличение свыше 100 нг/мл - единственный параметр, достоверно указывающий на отдалённые метастазы. Определение уровня ПСА уменьшает число больных, нуждающихся в сцинтиграфии костей. Вероятность обнаружения метастазов в кости при уменьшении уровня ПСА очень низка. При отсутствии жалоб и исходном содержании ПСА менее 20 нг/мл, обнаружении высоко- и умереннодифференцированных опухолей от сцинтиграфии можно отказаться. В то же время при низкодифференцированных опухолях и прорастании капсулы показана сцинтиграфия (независимо от уровня ПСА).
Читайте также:

