Интермиттирующая гормонотерапия рака предстательной железы
Рак предстательной железы (РПЖ) является в настоящее время одним из наиболее социально значимых онкологических заболеваний, что связано с крайне высоким уровнем заболеваемости данным злокачественным новообразованием. В США и некоторых странах Европы по показателю заболеваемости РПЖ вышел на первое место в структуре онкологической патологии у мужчин. В 2009 г. в США наблюдалось более 2 млн больных с опухолями предстательной железы, и было отмечено, что риск заболеть РПЖ в течение жизни имеет 1 из 6 родившихся мальчиков. В России в последнее десятилетие наблюдается бурный рост заболеваемости РПЖ, так что по темпам прироста числа заболевших новообразования простаты занимают первое место, намного опережая опухоли других локализаций. К сожалению, продолжает возрастать и смертность от РПЖ.
Резкое увеличение числа больных РПЖ, связанное с все более широким внедрением в клиническую практику теста на определение уровня простатического специфического антигена (ПСА), привело к интенсивному освоению онкологами и урологами методов радикального, комбинированного и паллиативного лечения данной категории больных. Лечебная тактика у пациентов с РПЖопределяется стадией онкологического процесса. Основными методами лечения больных локализованным РПЖ (стадия Т1—Т2N0M0) являются радикальная простатэктомия (РПЭ), дистанционная лучевая терапия (ДЛТ) и брахитерапия, которые обеспечивают сопоставимые результаты выживаемости пациентов. Существенной проблемой местных вариантов лечения местнораспространенного и лимфогенно-диссеминированного РПЖ (стадии T3a—T3bN0—N1M0) является высокий риск развития как локорегионарного рецидива, так и генерализации процесса. Для улучшения результатов лечения РПЖс экстракапсулярным распространением опухоли или лимфогенными метастазами широко используют проведение адъювантной гормональной терапии (ГТ). При развитии биохимического прогрессирования после радикального местного лечения в большинстве случаев также проводится эндокринная терапия. У больных метастатическим РПЖГТ – основной и наиболее эффективный метод лечения.
Гормональная терапия позволяет хорошо справляться с симптоматикой, увеличивает продолжительность жизни больных, но оказывает целый ряд побочных эффектов на организм мужчины. Это снижение и полная потеря сексуальной функции, снижение полового влечения, приливы. Длительная ГТ, направленная на подавление уровня тестостерона, как, например, двухсторонняя орхиэктомия, ведет к снижению плотности костной ткани (остеопороз), увеличению риска развития сердечно-сосудистых заболеваний, сахарного диабета и метаболического синдрома. Все вышеперечисленное отрицательно сказывается прежде всего на качестве жизни больных, а также создает дополнительные проблемы для лечащих врачей, которым помимо основного заболевания приходится бороться и с осложнениями лечения. А поскольку современная ГТ продлевает жизнь пациенту на 7—10 лет, то риск развития данных осложнений достаточно высок.
До недавнего времени ГТ в непрерывном режиме, одним из вариантов которой является упомянутый метод хирургической кастрации, была общепризнанным вариантом лечения больных РПЖ. Тем не менее в последние 2 десятилетия появился новый подход к эндокринной терапии РПЖ, который активно изучался в экспериментальных и клинических исследованиях и связан с проведением прерывистой (интермиттирующей) ГТ (ИГТ) у больных РПЖ.
Интерес к проведению ИГТ возник вследствие стремления клиницистов улучшить качество жизни больных РПЖ, которым показано проведение ГТ, а также благодаря теоретическим и экспериментальным предпосылкам, указывающим на возможности увеличения продолжительности времени до развития гормонорефрактерного РПЖ(ГРРПЖ). Как известно, продолжительная ГТ не приводит к полной элиминации опухолевых клеток у больных РПЖ, и по истечении определенного периода времени (в среднем через 24–36 мес) опухолевые клетки теряют чувствительность к проводимой ГТ, что приводит к прогрессированию заболевания и развитию стадии так называемого андрогеннезависимого или ГРРПЖ. Таким образом, теоретическое обоснование ИГТ основано на возможном продлении чувствительности клеток РПЖк андрогенам посредством чередования фаз назначения ГТ и перерывов между ними, в период которых сохраняющаяся популяция андрогензависимых и андрогенчувствительных опухолевых клеток предотвращает неудержимую пролиферацию андрогеннезависимых клеток, что способствует удлинению фазы заболевания, при которой опухоль чувствительна к эндокринной терапии.
В 2009 г. Европейское общество урологов в своих рекомендациях постулировало, что интермиттирующая терапия является стандартным методом лечения больных РПЖ. Этот вывод основан на результатах многих крупных исследований, где сравнивались постоянная и интермиттирующая схемы ГТ. Оказалось, что эффективность этих двух методов одинакова, но интермиттирующая терапия на период отмены препарата позволяет восстанавливать уровень тестостерона, избавляя пациентов от проявления побочных эффектов лечения (приливов, снижения сексуальной функции), и снижает риск развития остеопороза, сердечно-сосудистых заболеваний и диабета. Качество жизни больных, получающих интермиттирующую терапию, выше, чем тех, у кого применяют непрерывную.
В МНИОИ им. П. А. Герцена в 2006 г. проведено ретроспективное исследование по сравнению эффективности ГТ в непрерывном, постоянном (ПГТ) и интермиттирующем режиме, включавшее 107 больных локализованным и местно-распространенным РПЖ. В группу ПГТ вошли 52 больных, в группу ИГТ – 55 пациентов, группы ИГТ и ПГТ были однородными и сопоставимыми по основным характеристикам опухолевого процесса. Сроки наблюдения за больными составили 37–89 мес (средний период наблюдения – 62 ± 18,2 мес).
В группе ИГТ лечение начинали с 3-месячного курса терапии в режиме максимальной андрогенной блокады (МАБ), включающей гозерелин и антиандроген (бикалутамид или флутамид). При снижении концентрации ПСА менее 4,0 нг/мл лечение прерывали и контролировали уровень маркера ежемесячно. При росте уровня ПСА выше 4,0 нг/мл ГТ возобновляли в режиме монотерапии гозерелином или МАБ. Если в течение 3 мес уровень ПСА не снижался ниже 4,0 нг/мл, индукционный цикл пролонгировали до 6 мес. Больные с сохраняющейся концентрацией ПСА выше 4,0 нг/мл в исследование не включались. В группе ПГТ при снижении уровня ПСА после индукционного курса ГТ продолжали в режиме монотерапии гозерелином, в режиме МАБ или выполняли билатеральную орхиэктомию.
Сравнительный анализ результатов лечения в группах больных, получавших ПГТ и ИГТ, не выявил различий между группами как по частоте развития прогрессирования болезни, так и по показателям безрецидивной выживаемости. Частота выявления прогрессирования РПЖ в группе больных, получавших ПГТ, составила 50%, в группе ИГТ – 60% (p=0,3). Показатели общей выживаемости, безрецидивной выживаемости без признаков клинического прогрессирования и безрецидивной выживаемости без признаков биохимического (ПСА) прогрессирования также достоверно не отличались в двух группах.
Медиана времени до клинического прогрессирования, т. е. до развития гормонорефрактерной фазы, в группе больных, получавших ПГТ, составила 49 мес, в группе больных, получавших ИГТ, – 45 мес. Различия медианы времени до развития гормонорефрактерной фазы, таким образом, оказались не-достоверными (p=0,32). В то же время качество жизни больных, по данным анкетирования, оказалось достоверно лучше в группе пациентов, получавших ИГТ, в первую очередь за счет уменьшения частоты развития приливов и сохранения в перерывах лечения сексуальной функции.
В руководстве Европейского общества урологов сформулированы основные принципы проведения ИГТ.
- Продолжительность индукционного курса должна составлять 6–9 мес, иначе восстановление уровня тестостерона маловероятно.
- Терапию следует прекратить только при наличии всех следующих критериев. 1. Больной должен быть полностью проинформирован обо всех аспектах предполагаемого лечения. 2. У больного не должно наблюдаться признаков клинического прогрессирования заболевания. 3. На проводимую терапию должен наблюдаться ответ в виде снижения уровня ПСА, установленного эмпирически как величина 4 нг/мл у больных с отсутствием отдаленных метастазов или > 10–15 нг/мл у больных генерализованным РПЖ).
- Такую же терапию необходимо проводить на протяжении по крайней мере 3–6 мес.
- Последующие циклы терапии следует проводить по тем же правилам до появления первых признаков ГРРПЖ.
Таким образом, ИГТ является эффективным и безопасным методом гормонального лечения больных РПЖ, результаты которого не уступают результатам ПГТ. Проведение ИГТ существенно улучшает качество жизни больных в период отсутствия терапии и может быть рекомендовано для лечения больных РПЖ в различных клинических ситуациях, в том числе у пациентов с наличием отдаленных метастазов. Следует помнить, что при выполнении хирургической кастрации возможность применения этого метода теряется, в связи с чем проведение ИГТ возможно только лекарственными гормональными препаратами (агонисты ЛГРГ и антиандрогены).
Текущий раздел: Урология
Интермиттирующая гормональная терапия рака предстательной железы
Павлов А.Ю., Гафанов Р.А.,Иванов С.А., Фастовец С.В., ФГУ “Российский научный центр рентгенорадиологии ” Минздравсоцразвития России, г. Москва
Статья опубликована 07 декабря 2010 года.
Идентификационный номер статьи в ФГУП НТЦ “ИНФОРМРЕГИСТР”: 0421000015\0046
Рабочий адрес: 117997, г . Москва, ул. Профсоюзная, д. 86
Павлов Андрей Юрьевич тел. (495)333-41-80 E-mail: pavlovdetur@mail.ru
Гафанов Рустем Айратович тел. (495)334-70-62 E - mail : docgra @ mail . ru
Фастовец Сергей Владимирович тел. (495)334-70-62 E-mail: sega14@mail.ru
Агонисты ЛГРГ доказали свою эффективность в лечении рака простаты. Хотя при гормональной терапии имеются побочные эффекты, большинство из них обратимы после прекращения терапии. За прошедшие годы интермитирующая гормонотерапия была оценена в нескольких клинических исследованиях II фазы. Эти испытания показали возможности интермитирующей гормонотерап ии и ее преимущество по показателям качества жизни и уменьшении побочных эффектов. Эти исследования подтвердили преимущество качества жизни у пациентов, получающих гормональную терапию в интермиттирующем режиме и низкое количество побочных явлений связанных с терапией. Однако , не было продемонстрировано, что интермитирующая гормонотерапия продлевает время до развития гормонорефрактерного рака простаты. Таким образом, необходима разработка руководства по использованию интермитирующей гормонотерапии в клинической практике, определяющие время для остановки и начала терапии, а также различные режимы терапии.
Ключевые слова: рак предстательной железы, интермитирующая гормональная терапия, максимальная андрогенная блокада.
Intermittent hormone therapy for prostate cancer.
Pavlov , Andrey Y ., Gafanov Rustem A ., Ivanov Sergey A ., Fastovets Sergey V .
Federal State Establishment “Russian Scientific Center of Roentgenoradiology of Russian Health and Social Development Ministry”, Moscow
LHRH agonists have proven effective in the treatment of prostate cancer.Although the hormone therapy has side effects, most of them are reversible after discontinuation of therapy. Over the years, intermittent hormone therapy has been evaluated in several clinical phase II trials. These tests showed the possibility of intermittent hormone therapy and its advantage on indicators of quality of life and reducing side effects. These studies confirmed the advantage of quality of life in patients receiving hormone replacement therapy in the intermittent mode and the low number of adverse events associated with therapy. However, it was demonstrated that intermittent hormonal therapy prolongs the time before the development of hormone-refractory prostate cancer. Thus, the need for guidance on the use of intermittent hormone therapy in clinical practice, determining the time to stop and start of therapy, as well as different modes of therapy.
Key words: prostate cancer, intermittent hormone therapy, maximum androgen blockade.
В настоящее время гормональная терапия (ГТ) используется в большинстве случаев для лечения пациентов раком предстательной железы (РПЖ). Эффективность гормонотерапии доказана, за что и была признана основным видом лечения рака простаты, в особенности с метастатическим поражением, на протяжении многих лет [1]. Цель ГТ у пациентов с метастатическим РПЖ состоит в том, чтобы уменьшить риск осложнений, распространения болезни, и по возможности улучшить показатель общей выживаемости [1]. ГТ также, все чаще проводится в более ранних стадиях РПЖ, к примеру, перед радикальной терапией у пациентов локализованным и местнораспространённым РПЖ, при биохимическом рецидиве (повышение уровня ПСА) после предшествующего радикального лечения. Однако , все еще остается неясным целесообразность и длительность ГТ в этих клинических случаях [1,2].
Общепринятым является проведение ГТ до развития прогрессирования болезни или смерти пациента. В результате чего, большинство пациентов, длительное время получают гормонотерапию, ценой которой могут стать побочные эффекты проводимого лечения. Первоначально проведение ГТ связано с развитием приливов, слабости, потери либидо, и усталостью 3. Более длительное использование ГТ может привести к деминерализации костей, анемии, уменьшению мышечной массы, нарушению жирового обмена - ожирению, изменению настроения и снижению конгестивной функции. Также может возрастать риск заболеваемости сердечно-сосудистой системы и смертность от неё 7. При долгосрочной терапии побочные эффекты возникают чаще, что оказывает отрицательное воздействие на качество жизни пациентов. Хотя у ГТ есть побочные эффекты, большинство из них обратимы после отмены терапии [5,9]. Другой аспект непрерывной ГТ - развитие гормональной резистентности . Было показано, что у большинства пациентов метастатическим РПЖ непрерывно получающих ГТ, гормональная резистентность рака простаты (ГРРП) развивалась в пределах 1,5-2,5 лет [9,10]. Кроме того, доклинические исследования показали, что возобновление антиандрогенной терапии усиливало процесс апоптоза андрогензависимых опухолевых клеток, которые выжили при Г T и задерживало развитие андрогенной резистентности 11. При интермиттирующей гормональной терапии (ИГТ) опухолей ( андрогензависимые карциномы и рак простаты) время до развития гормонорезистентности увеличивалось в 3 раза. Авторы заключили, что ИГТ может вызвать многократное снижение апоптоза в этих опухолях [11,14-16]. Преимущества и недостатки непрерывной Г T должны быть тщательно уравновешены и проанализированы. ИГТ исследуется как альтернатива непрерывной ГТ, с целью уменьшения побочных эффектов, для поддержания или улучшения качества жизни и продления периода до развития ГРРП. Кроме того, ИГ T дополнительно подразумевает сокращение затрат на лечение [3].
Интермиттирующая гормональная терапия, показания к назначению
ИГТ - циклическая терапия, состоящая из периодов лечения, сопровождаемых перерывами [3]. Период лечения цикла должен длиться до максимальной индукции гормонотерапевтического апоптоза и должен быть остановлен до периода перехода опухолевого процесса в стабильную фазу. Лечение длится от 6 до 9 месяцев, по некоторым данным от 2 до 3 месяцев. Некоторые авторы предлагают длительность лечения напрямую связывать с достижением низшей точки ПСА ( нг /мл).
Период без ГТ является переменным, и его продолжительность определяется уровнем ПСА пациента. Если повышение уровня ПСА наблюдается во время перерыва, начинают следующий цикл терапии. В настоящее время проводятся исследования для установки порогового уровня ПСА для повторной терапии, основанные на продолжающихся испытаниях 3 фазы клинических исследований. Так у пациентов с локализованными формами уровень ПСА составляет 6-15 нг /мл, тогда как у пациентов с метастатическим процессом пороговый уровень составляет 10-20 нг /мл. У пациентов с локализованными формами РПЖ с биохимическим рецидивом после радикальной простатэктомии или лучевой терапии пороговый уровень ПСА составляет более 3 нг /мл и более 6-10 нг /мл у пациентов с генерализованными формами РПЖ [3]. ИГТ можно назначать пациентам, которые отвечают на ГТ снижением уровня ПСА до нормальных значений [3]. У нелеченых пациентов нормальным значением считают уровень ПСА менее 4 нг /мл, для пациентов у которых был рецидив после радикальной простатэктомии или лучевой терапии порог уровня ПСА считается менее 0,5 нг /мл [3,9].
(анализ II фазы клинических исследований)
В мире проведено более 20 клинических исследований II фазы, которые включили в себя лечение около 2000 пациентов. В них оценивалась целесообразность, эффективность и безопасность ИГТ [3,9]. В эти исследования были рандомизированы пациенты с различными стадиями заболевания: пациенты с локализованными, местнораспространенными и генерализованными формами РПЖ, биохимическим рецидивом после радикальных методов лечения [3,9,17]. Большинство исследований, оценивающих ИГТ применяли максимальную андрогенную блокаду (МАБ) - комбинацию аналога лютеинизирующего гормона рилизинг гормона ЛГРГ и антиандрогена . Некоторые исследования использовали монотерапию аналогами ЛГРГ или монотерапию антиандрогенами . При метаанализе 10 испытаний II фазы, которые включили данные по 1446 пациентам, было установлено, что пациенты всех этих исследований в среднем около 39 % времени провели без терапии. Анализ показал, что инициальный уровень ПСА и низшая точка ПСА были важными прогностическими признаками клинического результата пациентов с РП, получающих ИГТ [17].
В целом, испытания II фазы продемонстрировали, что проведение ИГТ перспективно. Пациенты имели лучшие показатели качества жизни как во время периодов вне ГТ, так и во время ГТ. Кроме того, испытания II фазы показали, что ИГТ уменьшало общее количество побочных эффектов и осложнений, удлиняла период стабилизации и повышала показатели выживаемости. Однако , из-за того что эти исследования проводились в различных условиях, в небольших и гетерогенных популяциях, эти результаты должны быть подтверждены в хорошо разработанных клинических исследований III фазы. III фаза исследований должна дать ответ на основные вопросы об эффективности ИГТ: о влиянии на время до развития ГРРП и на общую выживаемость пациентов [3].
В настоящее время проходят несколько рандомизированных исследований III фазы по оценке ИГТ в Соединенных Штатах, Канаде, Японии, и Европе. Эти исследования проводятся пациентам с местнораспространенным или метастатическим P ПЖ и пациентам с рецидивом уровня ПСА после радикальной простатэктомии и лучевой терапии.
Таб. 1. Клинические исследования III фазы интермиттирующего ГТ при РП
Гормонотерапия при раке простаты ещё несколько лет назад была предпочтительным методом лечения пожилых мужчин и даже при раннем раке составляла конкуренцию радикальным способам — хирургии и лучевой терапии.
Недавнее изучение эффективности адъювантного (профилактического) эндокринного воздействия показало, что ведущий критерий гарантированной результативности гормонотерапии — низкий уровень ПСА не оправдал клинических надежд, а стандартные показания к использованию гормональных средств при раке простаты нуждаются в коррекции.
Что такое гормональная терапия?
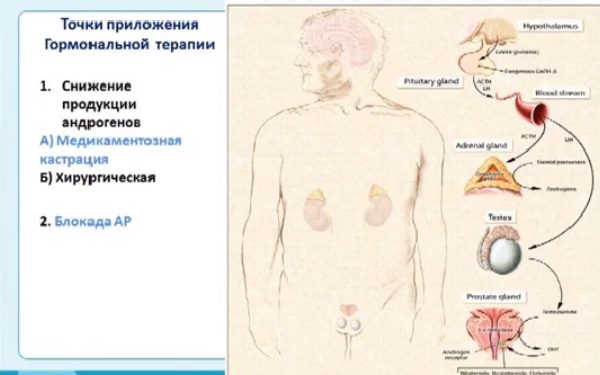
Ведущий механизм лечебного эндокринного воздействия при раке простаты — снижение уровня тестостерона в клетках железы за счёт уменьшения его продукции яичками или блокадой его проникновения внутрь клетки.
Лечение рака простаты гормонотерапией
Гормонотерапия не считается радикальным воздействием, то есть неспособна излечить от злокачественного заболевания, но на длительный срок останавливает прогрессию опухоли.
- дополняет радикальную операцию, снижая вероятность рецидива заболевания при распространении ракового процесса в лимфоузлы, но на проценте выживаемости через 10 лет после хирургии, как выяснили исследования, отражается мало;
- используется до операции — неоадъювантно, позволяя уменьшить размеры первичного образования и лимфатических узлов при продвинутой стадии;
- предваряет и сопровождает дистанционное облучение и брахитерапию, общий срок применения в 3 года существенно улучшает общие результаты лечения;
- самостоятельно используется при метастатическом варианте или противопоказаниях к радикальным способам лечения, позволяя на годы продлить жизнь без тяжких симптомов болезни;
- используется вместе с химиотерапией, повышая результативность цитостатиков.
В качестве гормонального воздействия на разных этапах развития простатической карциномы в разных комбинациях можно использовать операцию и пять групп гормональных препаратов.
Антагонисты ЛГРГ лишены синдрома вспышки, поскольку включаются в работу уже в гипофизе головного мозга, по эффективности не уступают другим методикам кастрации. Препарат дегареликс вводится только раз в месяц, но обладает неприятными побочными эффектами, самый частый из которых — сильная боль при подкожном введении.
Антиандрогены на поверхности раковой клетки связываются с рецептором, не допуская тестостерон внутрь, опосредовано снижая и выброс ЛГРГ. Представлены тремя нестероидными препаратами — бикалутамидом, нилутамидом и флутамидом, и тремя стероидами, из которых клиническое значением имеет только ципротерон. Различия в строении лекарств не влияют на эффективность, в отличии от спектра побочных реакций. Как правило, используются вместе с агонистами ЛГРГ или после хирургической кастрации, но не исключается и монотерапия. Лечение многолетнее и ежедневное, оптимальная суточная доза набирается за несколько приемов.
К препаратам второго ряда отнесён аминоглютетимид, снижающий уровень выработки андрогенов надпочечниками, и требующий обязательного дополнительного приёма глюкокортикоидов для уменьшения побочных эффектов, самое опасное из которых — надпочечниковая недостаточность.
В каких случаях назначают гормонотерапию при раке простаты?
Гормональное лечение возможно при любой стадии рака простаты, как изолированно, так и вместе с радикальными подходами.
Профилактическое использование рекомендуется при высоком риске послеоперационного рецидива, что вероятно после удаления большой первичной опухоли и метастазах более чем в двух лимфоузлах, а также после радикальной лучевой терапии. Гормональные средства не нужны после удаления раннего рака невысокой степени агрессивности, такие пациенты и без дополнительного лечения имеют все шансы жить долго и навсегда забыть про рак.
Очень помогает высокой выживаемости без рецидива присоединение профилактической по задачам гормонотерапии к облучению, эндокринное воздействие продолжается 2-3 года. В качестве адъювантной может использоваться хирургическая кастрация или медикаментозная в комплексе с антиандрогенами, которые начинают принимать загодя — за неделю до агониста ЛГРГ, предотвращая неприятности синдрома вспышки.
Гормонотерапия пациентов с формально операбельным процессом без метастазов, но с тяжкими сопутствующими болезнями, препятствующими хирургии и облучению, позволяет избежать смерти от рака простаты.
При метастатической стадии рака простаты достойной альтернативы гормонам не существует, даже химиотерапия не показывает такой результативности, прогрессирование процесса останавливается на долгие годы и даже десятилетия, позволяя больному активно жить при минимальных проявлениях болезни.
При рецидиве рака простаты лекарственное лечение эндокринными препаратами проводится после облучения или в самостоятельном виде.
Следует уточнить, что даже при резистентном к гормональной терапии раке, дополнение антиандрогенов к химиотерапии помогает пациенту больше, чем одна химиотерапия.
Достоинства гормонотерапии
Достоинство гормональной терапии в её высокой эффективности, до настоящего времени клинические исследования не выявили самого лучшего препарата или комбинации, поэтому для каждого конкретного пациента можно подобрать оптимальное лечение с учётом сопутствующих болезней, доступности лечебного учреждения и финансов пациента.
Гормональное воздействие не свободно от побочных реакций, но в сравнении с другими методами лечения рака лучше переносится и не мешает активной жизни пациента.
Противопоказания
Гормонотерапия переносится хорошо большинством пациентов, что позволило её сделать альтернативой хирургической операции у очень пожилых или ослабленных хроническими болезнями пациентов.
Противопоказание для хирургической кастрации одно — психологический негатив больного мужчины.
Агонисты ЛГРГ противопоказаны в монорежиме при прогнозировании феномена вспышки — только вместе с антиандрогенами.
Эстрогенотерапия невозможна при заболеваниях сердца и сосудов.Исключается применение только одних антиэстрогенов при первичном раннем раке предстательной железы, поскольку существуют менее токсичные методики. Лучевая терапия при небольшой опухоли простаты, особенно брахитерапия, поможет полному избавлению от болезни, при полном противопоказании к облучению должно проводиться лечение комбинацией гормональных препаратов.
Возможные последствия
Гормональные препараты не столь токсичны, как принято считать, конечно же лечение ими не свободно от побочных реакций, но не таких ярких и тяжких, как последствия противоопухолевых цитостатиков.
Большинство реакций обусловлено снижением выработки половых гормонов, все препараты вызывают:
- импотенцию (эректильную дисфункцию)
- снижение полового влечения (либидо)
- нарушение жирового обмена с исходом в избыточный вес
- дисгормональный остеопороз
- приливы и увеличение молочных (грудных) желез — гинекомастию.
К таким последствиям в разном наборе и разной степени выраженности приводят и лекарства, и кастрация — хирургическая и медикаментозная.
Двусторонняя орхидэктомия исключает использование в дальнейшем одной современной методики лечения, снижающей токсические проявления — интермиттирующей андрогенной блокады, когда препараты даются не постоянно, а по схеме.
Антиандрогены неблагоприятно действуют на слизистую желудочно-кишечного тракта, почти также часто, как широко используемые с обезболивающей целью НПВС. Они снижают функциональные возможности печеночных клеток, способны ухудшить состояние сердечно-сосудистой системы, только стероидные препараты наносят урон за счёт эффекта, подобного действию прогестерона, а нестероидные — из-за повышения содержание тестостерона в крови. Наименее токсичный из одногруппников — бикалутамид, при его длительном приёме довольно редки повреждения желудочно-кишечного тракта, но со стороны грудных желез жалоб больше — увеличение их сопровождается болевым синдромом.
Прогноз и эффективность
За время болезни почти каждому пациенту удаётся получить лечение практически всеми группами лекарственных средств, когда по мере прогрессирования одна линия сменяет другую. Большинству больных проводится не менее 4 комбинаций гормональной терапии — беспрецедентная возможность, недоступная страдающим другими злокачественными процессами.
У каждого шестого с отсутствием эффекта от кастрации приём одних только антиандрогенов позволяет достичь позитивного результата. При прогрессировании на фоне антиандрогенов у каждого третьего мужчины эстрогены способны остановить рост рака. После исчерпания эффекта гормонов остается альтернатива в виде химиотерапии.
Многое определяется возможностями клиники и искусством онкоурологов и химиотерапевтов, умело манипулирующими гормональными препаратами и симптоматическими средствами для купирования осложнений лечения, неизбежных при многолетнем противоопухолевом эндокринном воздействии. Всем пациентам нашей клиники мы помогаем жить активно, как можно лучше и дольше.

Гормонотерапия при раке простаты
Гормонотерапия при раке простаты
Более 12% всех злокачественных опухолевых заболеваний у мужчин занимает рак предстательной железы (РПЖ), а после 70 лет процент заболевших значительно увеличивается и в среднем составляет до 1400 случаев на 100000. В 1977 году профессор А. Shelly был удостоен Нобелевской премии за исследовательские работы пептидных гормонов, которые дали возможность разработать эффективную методику терапии агонистами ЛГРГ для медикаментозной кастрации. На сегодняшний день гормонотерапия при раке простаты считается главным методом лечения болезни, который позволяет увеличивать показатель выживаемости.

Принцип действия гормональной терапии
Перерождение обыкновенных клеток предстательной железы происходит под воздействием тестостерона – мужского полового гормона, синтезируемого особыми клетками семенников и корой надпочечников, это продукт периферического метаболизма. Конкретный механизм возникновения патологии до сих пор до конца не изучен, но уже имеющиеся знания дают возможность рекомендовать довольно эффективные протоколы лечения.

Гормонотерапия уменьшает количество тестостерона и блокирует его физиологическое воздействие на мужские органы. Врачи назначают прием гормонов на основании имеющихся анализов обследования больного и только после получения его согласия. Курс терапии должен выполнить несколько задач.
- Уменьшить размеры предстательной железы. В результате заболевания ее объем увеличивается в несколько раз, в случае радиотерапии приходится облучать большую площадь и захватывать здоровые ткани. Чем меньше опухоль – тем точнее можно сфокусировать ионизирующий луч, тем незначительнее негативные последствия лучевой терапии.
- Заметно уменьшить боли, минимизировать количество приема анестетиков. Многие из них имеют противопоказания, вызывают нежелательные сопутствующие реакции. Уменьшение и локализация боли значительно повышает качество жизни больного.
- Сократить скорость роста раковых клеток – продлить длительность жизни пациентов даже на последних стадиях развития болезни.
Если гормональная терапия при раке простаты у больных вызывает резистентность, то принимаются специальные индивидуальные мероприятия для ее предотвращения.
Исследованием новых методов терапии онкологических патологий занимается огромное количество научных сотрудников в развитых странах мира, в результате появляются новые более эффективные методики.
Используемые варианты гормональной терапии
Длительные наблюдения доказали эффективность андрогенной депривации примерно у 90% пациентов, в том числе и на поздних стадиях патологии. В последние несколько лет медики получили подтверждение эффективности и в качестве дополнения к лучевому или хирургическому методам лечения. Такие данные стали причиной интереса науки к интермиттирующей терапии – альтернативным протоколам гормональной терапии. Основными вариантами гормональной терапии являются следующие направления:
- монотерапия антиандрогенами, антиандрогены + ингибиторы;
- медикаментозная кастрация, Flare блокада + медикаментозная кастрация;
- интермиттирующая андрогенная депривация;
- альфаредуктазы, комбинированная андрогенная депривация;
- триплетная лекарственная терапия.
Таблица. Гормонотерапия при диссеминированном раке молочной железы: эффективность различных методов (неподобранные больные) [цит. по C. Henderson, 1991]
| Вид терапии | Число больных | Эффективность (%) |
| Антиэстрогены (тамоксифен)* | 1269 | 32 (16-52) |
| Овариэктомия** | 3380 | 33 (21-41) |
| Прогестины (МПА, мегестрол)* | 3479 | 31 (9-67) |
| Ингибиторы ароматазы (аминоглютетимид)* | 1153 | 32 (16-43) |
| LH-RH аналоги (золадекс)** | 293 | 40 (32-45) |
| Эстрогены* | 1683 | 26 (15-38) |
| Андрогены* | 2250 | 21 (10-38) |
| Адреналэктомия* | 3739 | 32 (23-46) |
| Гипофизэктомия | 1174 | 36 (22-58) |
Цель гормональной терапии состоит в том, чтобы положительно воздействовать на раковые клетки после хирургического вмешательства. Во всех случаях выживаемость после сложных хирургических вмешательств увеличилась с 62% до 71%.
Используемые типы гормонотерапии
Протоколы лечения допускают возможность использовать три вида терапии гормонами, окончательное решение принимается лечащим врачом на основании анализа состояния больного. Во время приема могут вноситься изменения с учетом реакции организма пациента.
![]()
Аналоги ЛГРГ
К ним относятся леупрорелина ацетат, трипторелин, гозерелин и бусерелин. Препараты подавляют продукцию тестостерона, не излечивают РПЖ, но заметно улучшают симптоматику и задерживают прогрессирование развития онкологических клеток. Гормональное лечение рака предстательной железы повышает качество жизни, врачи имеют время для использования полного комплекса существующих методик с целью минимизации последствий заболевания.
После первого приема препаратов агонисты провоцируют временный выброс ЛГ, что становится причиной увеличения плазменного уровня тестостерона (так называемый эффект вспышки). В клинических условиях такие ситуации предупреждаются путем назначения антиандрогенов. Через 3–4 недели наблюдается снижение чувствительности гипофиза больного, как следствие – уменьшение вырабатываемых гормонов тестостерона. Благоприятный профиль побочных эффектов позволяет рекомендовать прием препарата на различных стадиях заболевания.
Интермиттирующая гормональная терапия
ИГТ используется для задержки образования гормонорезистентных клеток РП, уменьшения риска появления негативных побочных явлений и понижения общей стоимости лечения. Гормональная терапия сопровождается до того времени, пока значение ПСА не опустится до исходного уровня. Затем прием препарата прекращается, а за больным выполняется постоянное наблюдение. Как только обнаружится повторное ухудшение состояния – прием препаратов возобновляется.
Используемые методы определения начала назначения агонистов ЛГРГ с учетом уровня тестостерона признаны безопасными, эффективными, дают возможность значительно уменьшить стоимость дальнейшего лечения.
Агонисты ЛГРГ в терапии распространенного рака

Таблица 2. Оптимальная последовательность различных методов гормонотерапии
В зависимости от индивидуальных особенностей организма больного гормонотерапия при раке предстательной железы может вызывать те или иные побочные действия. Приливы наблюдаются у 50–70% пациентов, гинекомастия до 15%, тошнота и рвота у 0,13%, на импотенцию и снижение либидо жалуются до 100% больных. Серьезной проблемой для пациентов, длительное время принимающих препараты, является прогрессирующий остеопороз. Врачи должны внимательно наблюдать за ними и рекомендовать соответствующие поведение и лечебные препараты. Но во всех случаях эти симптомы нельзя считать критичными, по их показанием отменяется лечение лишь у 0–4% пациентов.
В зависимости от стадии развития болезни используется три протоколы гормонального лечения.
- Локализованная стадия. Для уменьшения объема железы, улучшения состояния здоровья больного перед хирургическим вмешательством и сужения поля облучения тканей при лучевой терапии назначается неоадъювантная гормонотерапия агонисты-ГнРГ ± антиандрогены. Такие же препараты рекомендовано принимать и при острой необходимости по клиническим показаниям отсрочить основное лечение. Продолжительность приема гормональных препаратов лечащий врач назначает индивидуально каждому пациенту на основании последних лабораторных анализов и с учетом его самочувствия.
- Распространенная стадия. Рекомендуется адъювантная гормонотерапия агонисты-ГнРГ ± антиандрогены одновременно с курсом лучевой терапии. Если уровень ПСА Вывод: Профилактика болезней во время гормонотерапии необходима
В результате приема гормональных препаратов повышаются риски заболевания диабетом и возникновения проблем с сердечно-сосудистой системой. Больному запрещается курение и употребление всех алкогольных напитков, рекомендуют препараты кальция и железа. Рекомендуется снизить вес до физиологической нормы, придерживаться сбалансированного здорового питания. Очень важную роль играют положительные эмоции, нацеленность на борьбу с болезнью. Если пациент не может самостоятельно управлять своим психическим состоянием, то надо обращаться врачам-психотерапевтам.
Читайте также:


