Ингибируют пролиферацию раковых клеток
Связь между едой и здоровьем человека доказана давно в огромных количествах научных работ, проведенных самыми именитыми институтами мира.

В век, когда рак становится весьма распространенным заболеванием и резко "молодеет", следует знать как себя можно защитить от опасной болезни при помощи еды — самого, пожалуй, доступного метода, кроме, разве что, отказа от вредных привычек.
1. Продукты, с клетчаткой
Их очень большой перечень. Это
- овощи,
- фрукты,
- цельное зерно и продукты из него,
- бобовые,
- любая листовая зелень.
Употребление этой пищи регулярно защитит от риска возникновения рака толстой и прямой кишки.
2. Фрукты и овощи
Их систематическое употребление может предотвратить возникновение опухолей во рту, возникновения рака глотки и гортани, а также защитит пищевод и желудок благодаря наличию большого количества антиоксидантов и целого ряда витаминов и минералов.
Все они борются со свободными радикалами — виновниками "поломки" ДНК клеток, что часто и становится причиной их перерождения в злокачественные.
Кроме того, фрукты и овощи помогают держать вес тела, не давая ему увеличиваться, что также является залогом здоровья.
3. Овощи из семейства крестоцветных — защита от рака
Есть любые виды капусты просто необходимо, так как они содержат множество противораковых компонентов и на основе их вытяжек делают препараты для борьбы с доброкачественными новообразованиями.
Кроме капусты и любых ее видов, в мощный антираковый перечень входят репа, редис, горчица и руккола, которые уничтожают канцерогены.
4. Луковое семейство
Обычный лук, красный сладкий лук, зеленый лук, лук-порей считаются защитниками желудка и легких от возникновения опухолей благодаря наличию серы, которая и придает им своеобразный запах.
В желудке они создают защитные ферменты, которые выводят канцерогены из организма, а наличие в луке вещества кверцетин станет щитом от возникновения рака легких.
К остропахнущим антиракам относится и чеснок, систематическое употребление которого защитит от рака толстой кишки и рака прямой кишки.
В нем высокое содержание аллицина — соединения серы, которая и защищает от возникновения злокачественных патологий и способной остановить их рост в случае развития.
Кроме того, чеснок способен снимать воспалительные процессы, если таковые есть в организме.
5. Овощи и фрукты с ликопином
От рака легких защищают овощи, содержащие ликопин:
- помидоры,
- арбузы,
- дыни,
- грейпфруты.
Эти продукты предотвращают и защищают от рака простаты. Считается, что ликопин обладает мощными антиоксидантными способностями. А также ингибирует пролиферацию раковых клеток, улучшает иммунную систему. Подобно чесноку, уменьшает воспалительные процессы в организме.
6. Овощи и фрукты, богатые витамином С
Такие продукты, как:
- перец,
- капуста,
- цветная капуста,
- брюссельская капуста,
- горчица,
- брокколи,
- шпинат,
- помидоры,
- цитрусовые,
- киви,
- гуава,
- смородина,
- малина,
- шиповник и
- клубника.
Они особенно эффективно предотвращают рак пищевода.
Витамин С, также называемый аскорбиновой кислотой, является водорастворимым антиоксидантом. В результате играет важную роль в нейтрализации свободных радикалов в водянистой части тканей нашего тела. Ягоды особенно богаты витамином С.
7. Продукты с селеном
Вещество селен давно известен ученым как мощный антирак.
Он содержится в необходимых количествах в
- бразильских орехах,
- семечках,
- фисташках,
- огурцах,
- чесноке,
- грибах,
- яичных желтках,
- минтае.
Селен работает по всему организму, однако самое сокрушительное его воздействие направлено против рака простаты у мужчин.
8. Продукты, содержащие фолиевую кислоту
Это большой перечень продуктов из цельного зерна, а также практически все зеленые листовые овощи и свекла.
Все они — защита от рака поджелудочной железы благодаря большому количеству фолиевой кислоты, которая, как научно доказано, задерживает канцерогенные гены и предотвращает трансформации из нормальной клетки в злокачественную.
9. Продукты с кальцием
Капуста, брокколи, орехи миндаля, семена кунжута и шпинат предотвращают рак толстой кишки и рака прямой кишки, в том числе и разрушая раковые клетки в последней.
Важно: было обнаружено, что высокое потребление кальция — 1500 мг или более в день-связано с повышенным риском рака простаты у мужчин. Однако, это очень высокое количество кальция, которая вряд ли будет поступать в организм с продуктами питания.
10. Оливковое масло
Высокое потребление оливкового масла является отличительной чертой традиционной средиземноморской диеты и связано с более низкой заболеваемостью раком, включая рак толстой кишки и прямой кишки по сравнению с другими западными странами.
11. Куркума
Эта приправа, которую просто обожают в Индии считается там же и основой долголетия и здоровья.
Множество научных работ подтвердили популярную индийскую теорию, выяснив, что и сама куркума и ее экстракты могут ингибировать раковые процессы и развитие рака
- кожи,
- желудка,
- двенадцатиперстной кишки,
- языка,
- толстой кишки,
- молочной железы,
- простаты.
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
Абстракт
Хотя гиалуронан (ГК), как было показано, модулировал клеточную пролиферацию в многочисленных типах клеток, немного известно о его эффекте на раковые клетки. Мы оценили антипролиферативную деятельность ГК с молекулярной массой 5.0-7.5 * 10 5 Да на широком диапазоне типов раковых клеток. Мы выяснили, что ГК при низких концентрациях ( 5 Да, обладает значительным потенциалом для развития или как химиотерапевтический агент, или как дополнение к антираковым агентам.
Ключевые слова
Рак, пролиферация клеток, CD44
Введение
Гиалуронан (ГК) - главный неструктурный компонент соединительной ткани, важной для того, чтобы поддерживать внеклеточную матриксную структуру и обеспечивать клеточную подвижность, прилипание и пролиферацию. Низкая и высокая молекулярная масса ГК, как сообщали, обе модулировали пролиферацию некоторых нормальных (доброкачественных) типов клеток. ГК низкой молекулярная масса приблизительно от 1.3 до 4.5 * 10 3 Да (3-10 дисахаридных единиц), но не ГК высокой молекулярной массы, как было показано, вызывала пролиферацию аортальных эндотелиальных клеток, эффект, который был коррелирован с увеличениями уровня белка киназы. Напротив, ГК приблизительно от 1.3 до 7.2 * 10 3 Да (3-16 дисахаридных единиц) определенно ингибировал in vitro пролиферацию нормальных клеток эндотелия, но не нормальных фибробластов или нормальных гладкомышечных клеток. Для ГК высокой молекулярной массы, также было выяснено, чтобы она может и вызвать, и ингибировать пролиферацию некоторых типов нормальных клеток. ГК с молекулярной массой 1.1 * 10 6 Да, казалось, стимулировал пролиферацию человеческих фибробластов, которые задерживались в матрице коллагена через расширенный синтез тубулина, а ГК 8.6 * 105 Да стимулировала быстрое увеличение роговичных эпителиальных клеток. Напротив, ГК от 4.0 * 10 5 до > 1.0 * 10 6 Да ингибировали пролиферацию нормальной эндотелиальной клетки и ГК > 1.0 * 10 6 Да, как было показано, ингибировала пролиферацию синовиальных клеток нормального кролика и крысиных фибробластов клеточной линии 3T3. Кроме того, в концентрации менее, чем 1.0 мг/мл, ГК с молекулярной массой менее 1.0 x 10 6 Да стимулировала пролиферацию синовиальных клеток нормального кролика и крысиных фибробластов клеточной линии 3T3. Несоизмеримые результаты, часто наблюдаемые с похожими формами препаратов ГК, могут быть связаны с различиями в экспрессии ГК рецептора, с концентрацией ГК или с присутствием простимулирующих примесей в препаратах ГК.
Хотя эффекты ГК и низкой, и высокой молекулярной массы на пролиферацию нормальных клеток были широко исследованы, об эффекте ГК на раковых клетках известно немного. In vitro, при концентрации более, чем 0.32 мг/мл, ГК от 1.3 до 5.6 * 10 3 Да (3-12 дисахаридныхe единиц) и больше, чем 1.2 * 10 6 Да ингибировали пролиферацию высоко опухолеобразующих, экспрессирующих рецептор CD44H, B16-F10 крысиных клеток меланомы от 50 до 90%. В концентрации менее 0.16 мг/мл, ГК немного стимулировал их пролиферацию. In vivo, при концентрации 1 мг/мл, ГК от 1.3 до 5.6 * 10 3 Da подкожно управляли более чем 7 дней осмотическим насосом Алзета в промежуточной близости крысиной опухоли меланомы B16-F10, уменьшали объем опухоли на 85%. Эффект более высоких концентраций ГК, до 100 мг/мл, не имел значительно большей ингибиторной активности. К эффектам этого ГК на клетках опухоли было приписано разрушение комплексов ГК-CD44. Эффект ГК высокой молекулярной массы на рост опухоли B16F10 in vivo не был проверен. В этой статье мы оценили возможности фармацевтических препаратов ГК с молекулярной массой 5.0-7.5 * 10 5 ДА, чтобы непосредственно ингибировать пролиферацию многих раковых клеток или усилить активность антираковых лекарственных препаратов, основанных на ДНК и хемотерапевтических средствах.
Материалы & методы
Все линии клеток были получены из американской коллекции клеточных культур (ATCC, Роквилл, Мэриленд, США) и были выращены в среде, рекомендуемой ATCC. Таблица 1 показывает линии клеток, их происхождение и их свойства.
ГК 5.0-7.5 * 10 5 Да были очищены из Streptococci sp. и растворены в стерильном солевом растворе в концентрации 0.8 мг/мл (Cystistat®, Bioniche Life Sciences Inc, Белвилл, Онтарио, Канада). МСС, микобактериальный стенной состав клетки, изолированный от Mycobacterium phlei (М. Phlei), где микобактериальная ДНК сохранена и связана в комплекс непосредственно с клеточной стенкой, был подготовлен Bioniche Life Sciences Inc. М. phlei ДНК была очищена, как ранее описано. Цисплатин, 5-флуороурацил и тамоксифен были получены из Sigma-Aldrich, Канада (Оквилл, Онтарио, Канада). Димемилтиазолдифенилтетразолиум бромид (MTT) от Ameresco (Солон, Огайо, США) и FITC-маркированные антитела к CD44 от BD Pharmingen (Mississauga, Онтарио, Канада).
Путь клеточной пролиферации
Раковые клетки были инкубированы в 6 отдельных отсеках пластины с культурой ткани в содержании 1.0 * 10 5 клеток/мл в течение 48 часов с различными концентрациями ГК, МСС, M. phlei ДНК, цисплатином, 5-флуороурацилом и тамоксифеном. Пролиферация клеток была измерена, используя метод восстановления MTT. Кратко, 100 мкл 5 мг/мл MTT, растворенного в ПБС, были добавлены к каждому отсеку. После 4 часов инкубации было добавлено по 1.0 мл кислотного изопропилового спирта (0.04 N HCl в изопропиловом спирте) и ставший растворимым MTT был измерен при 570 нм, используя мультипластинный сканер.
Анализ экспрессии CD44
Экспрессия рецептора CD44 на поверхности клетки была измерена методом проточной цитометрии (FACScan, Becton-Dickinson, Сан-Хосе, Калифорния, США), используя 1 x 10 5 клеток с FITC-маркированным антителом к CD44 (клон G44-26), в условиях, описанных изготовителем.
Таблица 1. Раковые клетки, использующиеся в этом исследовании
Сверхэкспрессия P-гликопротеина, p 16
удален, р53 мутация
p53 и p 21 ( Waf-1) мутации
Результаты & обсуждение
Ингибирование пролиферации раковой клетки
Способность ГК с молекулярной массой 5.0-7.5 * 10 5 Да, чтобы ингибировать пролиферацию раковых клеток была оценена, используя различные крысиные и человеческие линии раковых клеток (Таблица 1). Как показано на рисунке 1, ГК располагается на шкале концентрации от 0.08 до 80 мкг/мл, ингибируя в зависимости от дозы пролиферацию раковых клеток простаты (PC 3, LNCaP, DU-145), клеток рака молочной железы (МКФ 7), клеток меланомы (B16-F1) и клеток фибросаркомы (HT-1080). Раковые клетки пузыря (UMUC-3, RT-4, HT-1376, T24) были менее чувствительными к ГК, чем другие проверенные линии клеток и степень ингибирования их пролиферации не увеличивалась с увеличивающимися концентрациями ГК (рисунок 1). Раковые клетки гематопоэтического происхождения, лейкемии и лимфомы (Jurkat T, THP-1, K562 EL-4), не отвечали на ГК обработку при используемых концентрациях (рисунок 1). Не было замечено, что ингибирование пролиферации раковых клеток ГК имело место быть коррелированным с присутствием любых специфических механизмов спасения (таблица 1).
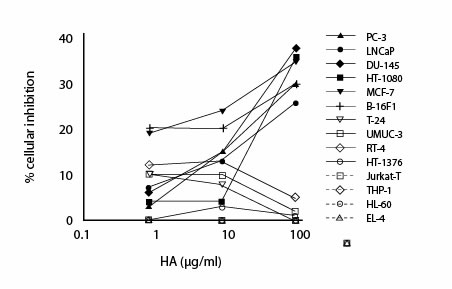
Иллюстрация 1. Раковые клетки были инкубированы в 1 * 10 5 клеток/мл с различными концентрациями ГК на 48 часов при 37°C, 5%-ый CO2. Клеточная пролиферация была определена сокращением MTT, как описано в Материалах & Методах. Показанные результаты являются усредненными из трех независимых экспериментов. С.О. составляли меньше чем 10 % и не были показаны.
Уровень экспрессии CD44
Мы определили, наблюдалась ли корреляция между антипролиферативной активностью ГК и уровнем экспрессии CD44. Гликопротеин CD44 - главный внеклеточный рецептор для ГК. Рецептор CD44 связан со злокачественными процессами в нескольких типах рака и, как было показано, способствует выживанию раковых клеток. Разрушение функции CD44 в крысиной грудной карциноме, как сообщали, вызвало апоптоз. Экспрессия CD44 раковыми клетками была оценена, используя антитело (клон G44-26), которое узнает домен, общий у всех изоформ CD44. Как показано в таблице 2, мы выяснили, что раковые клетки, используемые в этом исследовании, экспрессировали переменные уровни CD44 на поверхности клетки.
Таблица 2. Экспрессия CD44 на поверхности клеток
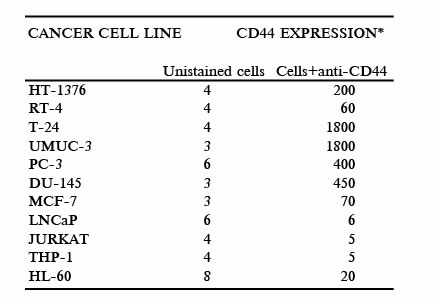
* значимая единица флуоресценции Мы не обнаружили корреляции между уровнем экспрессии CD44 и способностью ГК ингибировать пролиферацию при любой концентрации (p>0.4). Например, раковые клетки простаты LNCaP отвечают на ГК при отсутствии обнаружимого количества CD44 на поверхности клетки, в то время как T-24 и UMUC-3, которые показывают высокие уровни экспрессии CD44 на поверхности клетки, незначительно отвечают на воздействие ГК. Однако, с тех пор как было описано более десяти изоформ CD44, мы не можем исключить возможность, что отдельная изоформа CD44 может быть связана с антипролиферативной активностью, наблюдаемой с ГК. Эта антипролиферативная активность могла также быть связана с другим ГК рецептором. В частности RHAMM и его изоформы были вовлечены в регулирование развития клеточного цикла. Например, сверхэкспрессия RHAMM путём трансфекции в доброкачественные фибробласты, как показывали, преобразовало эти клетки в полностью метастатическую фибросаркому.
ГК усиливает активность антираковых агентов, основанных на ДНК
МСС, приготовление микобактериальной клеточной стенки, где микобактериальная ДНК сохранена и связана в комплекс с клеточной стенкой, и M. phlei ДНК, обладает антираковой активностью против различных типов рака. Более подробно, МСС, как было показано, непосредственно вызывал апоптоз в человеческих раковых клетках пузыря. M. phlei ДНК, связанная с МСС, ответственна за ее про-апоптотическую активность. МСС, кажется, добивается своей антираковой активности, модулируя экспрессию многих онкогенов, цикл клетки связывает белки и гены, регулирующие апоптоз. Мы проверили, может ли ГК усиливать активность МСС или M. phlei ДНК против раковых клеток простаты и пузыря. Мы выяснили, что ГК при различных концентрациях может действовать синергистически с МСС или M. phlei ДНК. Как отображено на иллюстрации 2, ГК в концентрации 0.8 мкг/мл усиливает активность МСС и M. phlei ДНК и для PC-3 раковых клеток простаты (рисунок 2a) и для RT-4 раковых клетки пузыря (рисунок 2b). Эксперименты находятся в стадии реализации, чтобы помочь понять, почему ГК действует синергистически с МСС и M. phlei ДНК. Одно возможное объяснение этой синергистической деятельности - защита ДНК от деградации в присутствии деоксирибонуклеаз в растворе (рукопись в стадии подготовки). Другая возможность – дифференциальная активность ДНК и ГК на развитие клеточного цикла. ГК, как показывали, присутствовал в ядре клеток, предполагая, что ГК может быть вовлечен в функцию ядрышек, хромосомную перестройку или другие события в пролиферации клеток.
ГК усиливает активность антираковых лекарств
Мы определили, может ли ГК также усиливать деятельность химиотерапевтических лекарственных препаратов. Эти исследования были выполнены при концентрации ГК, не имеющей ингибиторной активности. Как показано на иллюстрации 3, мы выяснили, что ГК в концентрации 0.008 мкг/мл может усиливать деятельность цисплатина, агента алкилирования, и 5-флуороурацила, антиметаболита ДНК/РНК, против RT-4 раковых клеток пузыря. Мы также проверили деятельность ГК в комбинации с тамоксифеном, препаратом антирака, используемым при лечении рака молочной железы. Тамоксифен, антагонист рецептора эстрогена, может также непосредственно вызывать апоптоз в раковых клетках молочной железы. Мы обнаружили, что ГК в концентрации 0.008 мкг/млl взаимодействует синергистически с тамоксифеном против MCF-7 раковых клеток (рисунок 3). Наши данные предполагают, что синергистическая активность, наблюдаемая у ГК при взаимодействии со многими антираковыми препаратами (МСС, M. phlei ДНК, цисплатин, 5- флуороурацил и тамоксифен), кажется, независима от их механизма действия. Кроме того, недавно было показано, что ковалентное связывание ГК с бутиратом натрия есть антиканцерогенная структура, которая улучшает антипролиферативную активность бутирата по отношению к клеткам MCF-7 рака молочной железы.
Заключение
Наши данные показывают, что ГК, очищенный из Streptococci sp. и имеющий молекулярную массу 5.0-7.5 * 10 3 Да имеет прямую антипролиферативную активность на ряде раковых клеток при низких концентрациях (0.8-80 мкг/мл). Во многих проверенных линиях раковых клеток ингибирование пролиферации гиалуронаном было значительно меньше при его самой высокой используемой концентрации. Раковые клетки, происходящие из костного мозга, кажется, нечувствительны к ГК при проверенных концентрациях. Активность ГК, казалось, была независима от присутствия многих механизмов спасения, связанных с прогрессией рака, и присутствия CD44 на поверхности клетки. ГК также усиливает активность ряда антираковых лекарственных препаратов, имеющих различные механизмы действия. Наши данные указывают, что ГК, имея молекулярную массу 5.0-7.5 * 10 5 Да имеет значительный потенциал для развития как химиотерапевтический агент или как дополнение к антираковым агентам.
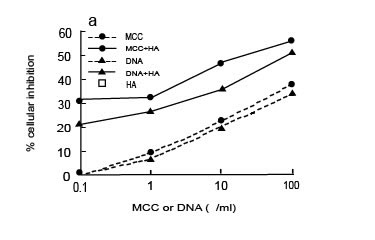
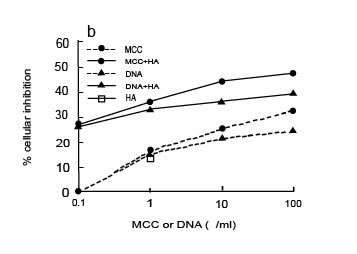
Иллюстрация 2. РС-3 ячейки (a) или RT-4 клетки (b) были инкубированы в 1 * 10 5 клеток/мл с 0.8 мкг/мл ГК одного или в комбинации с увеличивающимися концентрациями МСС или М. phlei ДНК в течение 48 часов при 37°C, 5%-ый CO2. Клеточная пролиферация была определена восстановлением MTT, как описано в Материалах & Методах. Показанные результаты являются усредненными из трех независимых экспериментов. С.О. составляли меньше чем 10 % и не были показаны.
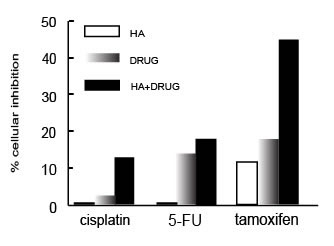
Иллюстрация 3. RT-4 клетки были инкубированы в 1 x 10 5 клеток/мл с 0.008 мкг/мл ГК, 0.1 мкг/мл цисплатина или 1.0 нг/мл 5-флуороурацила (5-FU) одного или в комбинации в течение 48 часов при 37°C, 5%-ый CO2. Клетки MCF-7 были инкубированы в 1 x 10 5 клеток/мл с 0.008 мкг/мл ГК или 0.1 мкг/мл тамоксифена, одного или в комбинации в течение 48 часов при 37°C, 5%-ый CO2. Клеточная пролиферация была определена восстановлением MTT, как описано в Материалах & Методах. Показанные результаты являются усредненными из трех независимых экспериментов. С.О. составляли меньше чем 10 % и не были показаны.
Учредительная активация STAT3 является одним из основных онкогенных путей, участвующих в развитии различных типов злокачественных новообразований, включая колоректальный рак (CRC); и, таким образом, становится многообещающей терапевтической целью. Spica Prunella давно используется в качестве важного компонента во многих традиционных китайских рецептах медицины для клинического лечения CRC. Ранее мы обнаружили, что Spica Prunellae ингибирует рост клеток CRC через опосредованный митохондрием апоптоз. Кроме того, мы продемонстрировали свою антиангиогенную активность in vivo и in vitro. Для дальнейшего выяснения точного механизма потенциальной опухолевой активности Spica Prunellae с использованием модели ксенотрансплантата мыши CRC в этом исследовании мы оценили его терапевтическую эффективность против CRC и исследовали основные молекулярные механизмы.
Модель ксенотрансплантата мыши CRC генерировалась подкожной инъекцией клеток HT-29 карциномы толстой кишки человека в голых мышей. Животным вводили внутрижелудочное введение 6 г / кг экстракт этанола Spica Prunellae (EESP) ежедневно, 5 дней в неделю в течение 16 дней. Вес тела и рост опухоли измеряли каждые два дня. Рост опухоли in vivo определяли путем измерения объема и веса опухоли. Жизнеспособность клеток HT-29 исследовали методом МТТ. Аппоз и пролиферацию клеток в опухолях у мышей Ксенотрансплантата CRC оценивали с помощью иммуногистохимического окрашивания (IHS) для TUNEL и PCNA, а плотность внутрисосудистого микрососуда (MVD) исследовали с использованием IHS для эндотелиального клеточного маркера CD31. Активацию STAT3 оценивали путем определения его уровня фосфорилирования с использованием IHS. Экспрессию мРНК и белка Bcl-2, Bax, Cyclin D1, VEGF-A и VEGFR2 измеряли соответственно RT-PCR и IHS.
Обработка EESP уменьшала объем опухоли и массу опухоли, но не влияла на изменение массы тела у мышей с CRC; уменьшала жизнеспособность клеток HT-29 дозозависимым образом, указывая на то, что EESP проявляет терапевтическую эффективность против роста толстой кишки in vivo и in vitro без явной токсичности. Кроме того, EESP значительно ингибирует фосфорилирование STAT3 в опухолевых тканях, что указывает на его подавляющее действие на активацию передачи сигналов STAT3. Следовательно, ингибирующее действие EESP на активацию STAT3 приводило к увеличению проапоптотического соотношения Bax / Bcl-2, уменьшению экспрессии пролиферативного Cyclin D1 и CDK4, а также снижению регуляции проангиогенного VEGF-A и VEGFR-2. Наконец, эти молекулярные эффекты привели к индукции апоптоза, ингибированию пролиферации клеток и ангиогенезу опухоли.
Spica Prunellae обладает широким спектром противораковых мероприятий из-за ее способности влиять на путь STAT3, предполагая, что Spica Prunellae может стать новым мощным терапевтическим средством для лечения CRC.
Колоректальная карцинома (CRC) является серьезной проблемой общественного здравоохранения, в которой ежегодно ежегодно регистрируется более миллиона новых случаев заболевания [1]. В западных обществах CRC представляет собой вторую по частоте причину смерти от рака [2]. Патогенез CRC является сложным и гетерогенным, с участием нескольких клеточных сигнальных трансдукционных каскадов, включая преобразователь сигнала и активатор транскрипции 3 (STAT3). В качестве одного из наиболее важных факторов транскрипции STAT3 участвует в контроле многих фундаментальных биологических процессов, таких как пролиферация клеток, апоптоз и ангиогенез 7. STAT3 может быть активирован многими цитокинами и факторами роста, такими как IL-6 и EGF [9,10], который опосредуется фосфорилированием STAT3 у тирозина 705 после связывания IL-6 или EGF с специфическими рецепторами клеточной поверхности [ 11]. Фосфорилированные белки STAT3 в цитоплазме димеризуют и транслоцируют в ядро, где они регулируют экспрессию генов, содержащих STAT3-связывающие сайты в их промоторах [12]. Активация STAT3 является быстрой и кратковременной в нормальных клетках; однако в раковых клетках STAT3 конститутивно активируется, что приводит к дисбалансу между пролиферацией клеток и апоптозом и неконтролируемым ангиогенезом опухоли. Устойчивая активация STAT3 была обнаружена у многих видов рака человека, включая CRC, и обычно предполагает плохой прогноз 14. Поэтому подавление пути STAT3 является основной терапевтической мишенью для лечения рака.
Несмотря на недавние успехи в химиотерапии CRC, схемы с 5-фторурацилом (5-FU) по-прежнему являются международной стандартной химиотерапией для пациентов с инвазивным и метастатическим продвинутым CRC [24]. Однако из-за резистентности к лекарственным средствам и неприемлемого уровня токсичности для нормальных клеток системная химиотерапия, использующая схемы на основе 5-ФУ, дает объективные показатели ответа менее 40% [25,26]. Эти проблемы подчеркивают настоятельную необходимость разработки новых химиотерапий рака. Натуральные продукты, такие как традиционные китайские травяные лекарства, получили внимание, поскольку они имеют относительно небольшое количество побочных эффектов и уже давно используются в качестве значительных альтернативных средств для лечения различных заболеваний 27. Spica Prunellae, плодовые шипы многолетнего растения Prunella vulgaris L., является лекарственной травой, широко распространенной в северо-восточной Азии. Spica Prunellae, как хорошо известная китайская народная целебная трава со свойствами очистки и детоксикации, Spica Prunellae используется для лечения плохого зрения, застоя крови и отеков, острого конъюнктивита, лимфатического туберкулеза и чахотки, острого мастита и гиперплазии молочной железы, тиремегалии и гипертония [30]. Более того, Spica Prunellae, как полагают, обладает противораковой активностью, поскольку в традиционной китайской медицине (TCM) система накопления тепла и токсичной сырости является основным причинным фактором для опухолевого генеза. Действительно, Spica Prunella давно используется в качестве важного компонента в нескольких формулах TCM для клинического лечения нескольких видов рака, включая CRC [31,32]. Хотя мы ранее сообщали, что экстракт Spica Prunellae способствует апоптозу клеток карциномы толстой кишки человека и проявляет антиангиогенную активность in vitro [33,34], способ его противоракового действия остается в значительной степени неизвестным. Для дальнейшего выяснения механизма опухолецидной активности Spica Prunellae с использованием модели ксенотрансплантата мыши CRC в настоящем исследовании мы оценили терапевтическую эффективность экстракта этанола Spica Prunellae (EESP) против роста опухоли in vivo и исследовали основные молекулярные механизмы.
Из Инвитрогена (Карлсбад, Нью-Мексико, США) были приобретены модифицированная Дульбекко среда Игла (DMEM), эмбриональная бычья сыворотка (FBS), пенициллин-стрептомицин, трипсин-ЭДТА, реагент Trizol. Обратная транскриптаза SuperScript II была предоставлена Promega (Madison, WI, USA). PCA, CD31, Bcl-2, Bax, CyclinD1, CDK4, VEGF-A, VEGFR, конъюгированные с пероксидазой хрена (HRP) были получены из Cell Signaling (Беверли, Массачусетс, США). Комплект анализа TUNEL был приобретен у R & D Systems (Миннеаполис, США, США). Все другие используемые химикаты, если не указано иное, были получены от Sigma Chemicals (Сент-Луис, Миссури, США).
Раковая клетка характеризуется дисбалансом между апоптозом клеток и пролиферацией [41]. Митохондрии играют важную роль в этом процессе апоптоза, который сильно регулируется белками семейства Bcl-2, включая как антиапоптотические элементы, такие как Bcl-2, так и проапоптотические члены, такие как Bax. Соотношение членов семейства Bcl-2 от анти- и проапоптоза определяет судьбу клеток, а изменение отношения путем аберрантной экспрессии этих белков нарушает нормальную апоптозную программу, способствующую различным заболеваниям, включая рак. Например, более высокие отношения Bcl-2 к Bax обычно встречаются при раковых заболеваниях, что не только дает преимущество выживаемости раковым клеткам, но также вызывает резистентность к химиотерапии [42]. Распространение эукариотических клеток в основном регулируется клеточным циклом, где переход G1 / S является основным контрольным пунктом, ответственным за инициирование и завершение репликации ДНК. Прогрессия G1 / S сильно регулируется комбинированной активностью комплекса Cyclin D1 / CDK4 [43]. Неконтролируемый или гиперактивированный комплекс Cyclin D1 / CDK4 часто приводит к неконтролируемому делению клеток и, следовательно, к раковым заболеваниям [44,45]. Поэтому повторная балансировка апоптоза и пролиферации клеток посредством регуляции экспрессии генов, связанных с апоптозом или клеточным циклом, является многообещающей стратегией для лечения рака. Используя модель ксенотрансплантата мыши CRC, мы продемонстрировали, что эффект этанола Spica Prunellae (EESP) ингибирует рост рака in vivo без явной токсичности. Используя иммуногистохимическое окрашивание для TUNEL и PCNA, мы обнаружили, что EESP способствует апоптозу и ингибирует пролиферацию в опухолевых тканях. Кроме того, проапоптотическая и антипролиферативная активность EESP опосредовалась его влиянием на экспрессию соответствующих генов. Лечение EESP глубоко увеличивало проапоптотическое соотношение Bax / Bcl-2 и уменьшало экспрессию пропролиферативного Cyclin D1 и CDK4.
Ангиогенез, процесс, связанный с ростом новых кровеносных сосудов из ранее существовавшей сосудистой сети, необходим для продолжения роста опухоли и обеспечивает путь для гематогенного метастазирования [46]. Фактор роста эндотелия сосудов A (VEGF-A) является одним из наиболее эффективных биологических индукторов ангиогенеза, который высоко экспрессируется в широком спектре раковых заболеваний человека и связан с прогрессированием рака, инвазией и метастазами и плохим прогнозом пациента. VEGF-A оказывает свою проангиогенную функцию посредством связывания с его специфическими рецепторами, включая VEGFR-2, который расположен на сосудистых эндотелиальных клетках. Связывание VEGF-A с VEGFR-2 приводит к серии ангиогенных процессов [47]. В данном случае мы обнаружили, что EESP значительно уменьшал внутригрудную микрососудистую плотность (MVD) у мышей ксенотрансплантата CRC путем понижающей регуляции экспрессии VEGF-A и VEGFR-2, демонстрируя свою антиангиогенную активность in vivo.
STAT3 является важным фактором транскрипции, который играет важную роль в передаче внеклеточных сигналов, инициированных цитокинами и факторами роста от цитоплазмы к ядру. После активации через фосфорилирование белки STAT3 димеризуют и транслоцируют в ядро, где они регулируют экспрессию многочисленных критических генов, участвующих в прогрессировании, пролиферации и ангиогенезе клеточного цикла, включая вышеупомянутые Bcl-2, Bax, Cyclin D1, CDK4 и VEGF- A. Поэтому подавление активации STAT3 должно быть многообещающим подходом в развитии противораковых терапий. Используя иммуногистохимическое окрашивание, мы обнаружили, что EESP значительно снижает уровень фосфорилирования STAT3 в опухолях мышей CRC в соответствии с его проапоптотической, антипролиферативной и антиангиогенной активностью.
В заключение, в первый раз мы демонстрируем, что Spica Prunellae ингибирует рост колоректального рака in vivo путем поощрения апоптоза раковых клеток, ингибирования пролиферации и антииогенеза, который опосредуется подавлением пути STAT3. Наши результаты показывают, что Spica Prunellae может быть потенциальным новым терапевтическим средством для лечения рака с конститутивной активацией STAT3.
CRC: колоректальный рак; STAT3: преобразователь сигналов и активатор транскрипции 3; EESP: экстракт этанола Spica Prunellae; TCM: традиционная китайская медицина; TUNEL: Терминальная дезоксинуклеотидилтрансфераза-опосредованная маркировка ниттера dUTP; PCNA: ядерный антиген пролиферирующих клеток; CDK4: Циклинзависимая киназа 4; VEGF-A: сосудистый эндотелиальный фактор роста A.
Авторы не заявляют о финансовом или коммерческом конфликте интересов.
WL участвовал в разработке проекта, проводил большую часть экспериментов, способствовал интерпретации данных и писал первоначальные проекты рукописи. LZ и QZ способствовали исследованию ксенотрансплантата опухоли in vivo и анализу МТТ in vitro. JZ и ZC способствовали RT-PCR, иммуногистохимическому анализу и Western Blot. JZ и SL способствовали анализу ВЭЖХ. WX способствовал получению экстракта этанола из Spica Prunellae. JP внес вклад в концепцию и дизайн всего исследования и окончательное редактирование рукописи. Все авторы прочитали и одобрили рукопись для публикации.
Доступ к этой публикации можно получить здесь:
Эта работа была организована Национальным научным фондом Китая (81073097 и 81202790)
Читайте также:

