Иммуногистохимическое исследование при меланоме что это такое

Меланома кожи (МК) - злокачественная опухоль из клеток меланоцитарной системы и одно из наиболее агрессивно протекающих злокачественных новообразований человека, обладающих высоким метастатическим потенциалом [2]. Около 75% больных к моменту начала специального лечения уже имеют распространенный процесс [1; 9]. Развитие меланомы – сложный процесс, в который вовлечены различные факторы. В 75% случаев МК возникает из отдельных кожных меланоцитов, а в 25% – из предсуществующих невусов 7. Некоторые исследователи рассматривают всю совокупность меланоцитов организма как своеобразную эндокринную или цитокринную меланогенную систему, ответственную за выработку пигмента. Степень функционирования этой системы организма во многом зависит от факторов внешней среды (прежде всего уровня инсоляции) и регулируется продукцией меланостимулирующего гормона, вырабатываемого передней долей гипофиза. В клинической практике внимание уделяется признакам активизации невусов, которые свидетельствуют об усилении пролиферативной активности клеток невуса или даже его малигнизации [3; 5]. Считается, что диспластический невус является недостающим звеном между доброкачественным и злокачественным меланоцитарным поражением. С другой стороны, диспластические невусы десятилетиями остаются без изменений, и для их малигнизации нужны дополнительные генетические нарушения [10]. За последнее десятилетие, начиная с 2002 г., когда была открыта мутация BRAF, достигнут значительный прогресс в изучении молекулярных механизмов канцерогенеза меланомы. Так, мутации NRAS обнаруживают в 94,7% случаев врожденных меланоцитарных невусов, которые характеризуются повышенным риском трансформации в меланому [3]. Способность опухолевых клеток к инвазии в ткань дермы является критическим событием в развитии меланомы кожи и в итоге индикатором плохого прогноза для пациентов. Изучение некоторых молекулярно-биологических параметров меланоцитарных образований кожи и молекулярных процессов, связанных с приобретением инвазивного фенотипа, может способствовать раскрытию новых звеньев патогенеза меланомы и поиску дополнительных диагностических критериев.
Изучить экспрессию некоторых молекулярно-биологических маркеров, контролирующих апоптоз (р53), пролиферацию (ki-67), ангиогенез (CD31, VEGF) в ткани меланоцитарных образований кожи.
Материал и методы исследования
В исследование были включены 15 больных в возрасте от 21 до 49 лет с пигментными доброкачественными образованиями, включая 5 больных с диспластическими невусами. Невусы, взятые для исследования, располагались на коже туловища, конечностей, лица и шеи. Их размеры по длине колебались от 5 до 25 мм, по ширине – от 2 до 18 мм, по толщине – от 2 до 8 мм. И 11 больных с меланомой кожи. Меланомы, взятые для исследования, располагались на коже спины и нижних конечностей. Их размеры по длине колебались от 1,3 до 8,5 мм, по ширине – от 1,0 до 2,5 мм, при поверхностно-распространяющейся меланоме, толщина по Бреслоу составила от 1,3 до 7,0 мм, при узловой меланоме кожи толщина по Бреслоу – от 1,0 до 3,5 мм, уровень инвазии по Кларку составил от II до IV.
Иммуногистохимическое исследование проводили на срезах с парафиновых блоков, предназначенных для стандартного морфологического исследования, с помощью моноклональных антител ki-67, р53, CD31, VEGF. Использованные в работе первичные антитела и их разведения представлены в таблице.
Панель использованных в исследовании антител
Антиген ki-67, пролиферативная активность (ядерное окрашивание)
Нормальный и мутантный тип p53 (ядерное окрашивание)
CD31/PECAM-1 Ab-6 (мембранное окрашивание эндотелиальных клеток)
10 мМ Tris,
1 мМ EDTA
В исследовании применяли следующие критерии оценки маркеров:
1) опухоль считали отрицательной по р53, если в ткани опухоли отсутствовала ядерная реакция с антителами или количество окрашенных клеток было менее 25%, и положительной по р53, если было окрашено более 25% ядер опухолевых клеток;
2) для оценки пролиферативной активности (ПА) подсчитывали количество ki-67-положительных клеток, приходящихся на 200–300 опухолевых клеток. Индекс ki-67 определяли по формуле:
ПА= число ki-67 положительных клеток х 100/общее количество клеток.
Маркеры пролиферативной активности расценивали на основе наиболее часто употребляющегося способа оценки пролиферативной активности: 0–20% – низкая пролиферативная активность, 21–50% – умеренная пролиферативная активность, 51 –100% – высокая пролиферативная активность;
3) опухоль считали положительной по VEGF (VEGFопухоль+), если окрашено более 25% опухолевых клеток. Мы также в каждом конкретном случае количественно подсчитывали долю клеток (в%), окрашенных антителами к VEGF;
4) для оценки ангиогенеза использовали индекс внутриопухолевой микрососудистой плотности (intratumormicrovesseldensity – MVD). Микрососуды окрашивали антителом CD31. Количество сосудов определяли в каждом поле зрения препарата при использовании объектива х40 с использованием программы AxioVs40 v-4.8.1.0. Статистический анализ результатов исследования проводился с помощью программы STATISTICA 7.0 (StatSoftInc., США) и MedCalc (версия 9.3.5.0).
Результаты исследования и их обсуждение
Наиболее ранними событиями в процессах канцерогенеза и прогрессирования опухолей являются нарушение механизмов пролиферации и апоптоза в опухолевых клетках. На этой стадии теряются нормальные механизмы контроля клеточного деления и апоптоза. Способность к неограниченному размножению является одной из главных особенностей опухолевых клеток. Одним из методов определения пролиферативной активности (ПА) опухоли служит индекс ki-67-положительных клеток. При оценке пролиферативного потенциала меланоцитарных образований выявлено наличие умеренной пролиферативной активности ki-67у 11 больных (100%) меланомой кожи и у 5 (33,3%) с невусами, которые были определены как диспластические. Низкая пролиферативная активность отмечалась у 66,7% (10) больных с доброкачественными образованиями и отсутствовала у больных меланомой. Высокая пролиферативная активность в нашем исследовании не встречалась ни в одной из исследуемых групп. Доля пролиферирующих ki-67-положительных клеток в группе больных меланомой находилась в пределах от 30 до 45% клеток, в среднем составив 38,3 ± 3,6%. В группе доброкачественных образований доля ki-67-позитивных клеток находилась в пределах от 4 до 25%, где их среднее содержание составило 14,9 ± 1,2%, причем доля пролиферирующих клеток в диспластических невусах была максимальной и составляла 20-25% (рис. 1).
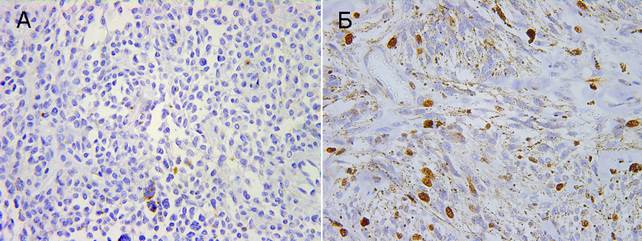
Рис. 1. Экспрессия ki-67. Ув. × 400. А – внутридермальный невус, Б – узловая меланома, веретеноклеточный вариант
Полученные нами данные, так же как и литературные, подтверждают, что иммунореактивность ki-67 хорошо коррелирует с доброкачественностью или злокачественностью меланоцитарных поражений и может помочь в дифференциальной диагностике доброкачественных невусов от меланом [9].
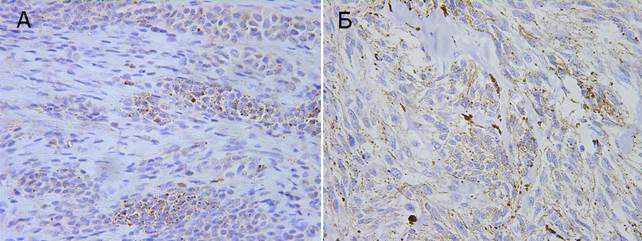
Рис. 2. Экспрессия p53. Ув. × 400. А – внутридермальный невус, Б – узловая меланома, веретеноклеточный вариант
Ангиогенез, как необходимая стадия в развитии новообразований, является сложным процессом, в который включено взаимодействие стромальных и опухолевых клеток. В индукцию ангиогенеза включены опухолеассоциированные макрофаги, которые имеют диагностическое и прогностическое значение при некоторых опухолях. VEGF занимает позицию главного митогена эндотелиальных клеток, и его присутствие требуется для образования незрелых сосудов при васкулогенезе или неоангиогенезе. Именно он и заставляет кровеносную систему организма закладывать новые сосуды, пронизывающие опухоль и образующие в ней разветвлённую сеть. Плотность микрососудов, которая отражает количество/объём образования новых сосудов, значительно больше в ткани, поражённой раком, чем в здоровой, и она находится в определённом соотношении с распространением опухоли. Важным показателем развития опухолевой прогрессии является микрососудистая инвазия опухоли, которую иммуногистохимически можно выявить с помощью антител к CD31. По уровню экспрессии CD31 производится подсчет плотности микрососудов в опухоли, которая является важным прогностическим признаком [4].
Экспрессия VEGF выявлена в цитоплазме клеток меланомы в 100% случаев (11), тогда как в доброкачественных образованиях – в 66,7% (10). Отсутствие экспрессии в клетках невусов отмечалось в 33,3% (5). Разброс окрашенных клеток антителами к VEGF и в меланомах, и в невусах очень неоднороден и составляет от менее 5% и до 50%. Нами выявлены достоверно значимые различия в экспрессии VEGF среди исследуемых групп, где среднее содержание клеток VEGF+ составило 32,5 ± 2,9%, тогда как в невусах 23,8± 2,1% (р 25%) наблюдалась у 6 (54,5%) пациентов с МК, тогда как в группе с невусами данная экспрессия не была отмечена. Нами выявлены достоверно значимые различия в экспрессии VEGF среди исследуемых групп, где среднее содержание клеток VEGF+ составило 32,5 ± 2,9%, тогда как в невусах 23,8 ± 2,1% (р

Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.

Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Какие задачи в онкологии помогает решать иммуногистохимия?
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
Как это работает?
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
Как проводят исследование?
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Какие молекулы-мишени выявляют во время иммуногистохимии?
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Какова роль иммуногистохимии в современной онкологии?
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
Еще фото
В основе иммуногистохимических (ИГХ) методов лежит принцип специфического взаимодействия тканевых и клеточных антигенов со специально полученными антителами, имеющими на себе разнообразные метки. Т.е. это метод исследования, основанный на выявлении наличия и локализации определенных антигенов в клетках и тканях при помощи специфических антител.
Изучая конкретные молекулы, иммуногистохимия позволяет получать информацию о функциональном состоянии клетки, ее взаимодействии с микросредой, устанавливать фенотип и принадлежность клетки к определенной ткани. Так, исследование содержания в клетке анти- и проапоптотических факторов позволяет судить о состоянии системы апоптоза в клетке. Изучение рецепторного аппарата дает возможность глубже понять межклеточные взаимоотношения при различных патологических процессах.
Результаты подобных исследований необходимы для изучения процессов дифференцировки и катаплазии клеток, что имеет принципиальное значение в установлении гистогенеза опухолей, их диагностике и прогнозе. Например, определение гистохимическими методами гистопринадлежности новообразования позволяет четко идентифицировать тип сарком, лимфом, опухолей центральной нервной системы, низко- и недифференцированых опухолей.
Наиболее успешно метод применяется в диагностике гематопоэтических, лимфопролиферативных новообразований, мягкотканных сарком. Описано несколько десятков лейкоцитарных маркеров (CD-антигены), часть которых является маркерами направления, степени дифференцировки, созревания, трансформации клеток, а часть – обладает специфическими функциями.
Для ИГХ-анализа опухолей и их метастазов применяется широкий спектр маркеров, к которым можно отнести: тканеспецифичные (белки промежуточных филаментов, компоненты базальной мембраны, рецепторы и др.), цитоспецифичные (CD-антигены лейкоцитов, миоглобин, гладкомышечный актин и др.), опухолеассоциированные антигены, опухолевые маркеры, гормоны, ферменты и белковые продукты клеточных онкогенов, генов-супрессоров и т.д. Некоторые ИГХ-маркеры имеют специфическую ультраструктурную локализацию, другие – располагаются либо на различных органеллах, либо в цитозоле или внеклеточно.
Высокозлокачественная опухоль, поражающая кожу и слизистые оболочки животных. У собак обнаруживается значительно чаще, чем у кошек. Важным обстоятельством является то, что у людей меланома развивается на фоне ранее существовавшего пигментного невуса, а у собак – на фоне темного окраса кожи или слизистых оболочек.
Опухоль имеет нейроэктодермальное происхождение. Меланобласты (предшественники меланоцитов) возникают в невральном гребешке и в последующем мигрируют в эпидермис. Меланома исходит из меланоцитов или невусных клеток. Меланоциты располагаются в базальном слое эпидермиса по линии дермоэпидермальной границы, основной их функцией является синтез меланина, который захватывается и накапливается эпидермальными клетками. Если происходит малигнизация меланобластов – клеток, еще не способных синтезировать пигмент (т.е. низкодифференцированных), то развивается амеланотическая меланома, которая имеет более агрессивное биологическое поведение. Если же произошла малигнизация меланоцитов, синтезирующих пигмент, то развивается пигментосодержащая меланома. Морфологически различают 3 варианта меланом: веретеноклеточную, эпителиоидноклеточную и смешанную. В развитии меланом различают две фазы: горизонтальную и вертикальную. Горизонтальная фаза характеризуется развитием опухоли в пределах эпителиального пласта, она быстро переходит в вертикальную, характеризующуюся проникновением опухоли в поверхностные слои эпидермиса и инвазией в подкожную жировую клетчатку. Меланома склонна к рецидивированию и метастазированию гематогенным и лимфогенным путем.
Маркеры для верификации меланом
HMB 45. Реактивный антиген представлен в кожных меланоцитах, пренатальном и неонатальном пигментном эпителии сетчатки и меланомных клетках и считается по своей природе онкофетальным. Эти антитела окрашивают большинство меланосом.
Синаптофизин является основным маркером, пожалуй, маркером первой линии для нейроэндокринной дифференцировки. Этот кислый, трансмембранный гликопротеин мелких пресинаптических везикул является протеином мембранных каналов. В периферических тканях он экспрессируется в нервных и нейроэндокринных клетках, таких как ганглиозные клетки, аксоны, параганглии, и в большинстве клеток дисперсной нейроэндокринной системы. В меланомах человека этот маркер определяется крайне редко, однако у собак обнаруживается чаще и доказывает нейроэктодермальное происхождение опухоли.
Виментин. Белок промежуточных филаментов соединительных тканей и других тканей мезодермального происхождения. Динамическая природа виментина важна для изменения формы клеток. Именно виментин обеспечивает прочность клеток и их устойчивость к механическому стрессу. Поэтому считается, что виментин – компонент цитоскелета, отвечающий за поддержание целостности клетки. Виментин используется в качестве онкомаркера саркомы для идентификации мезенхимы.
Описание клинического случая
В ветеринарный центр патоморфологии и лабораторной диагностики поступил материал на исследование: ткань опухоли слизистой оболочки рта собаки породы немецкая овчарка, возраст 12 лет. Опухолевый узел диаметром до 4 см, поверхность опухоли изъязвлена. Элементов костной ткани препарат не содержал. На данном материале было проведено гистологическое исследование со стандартной гистологической окраской гематоксилином и эозином. Описание гистологического препарата: опухоль образована атипичными полиморфными клетками веретенообразной и вытянутой формы. Клетки расположены в виде пучков, тяжей и завихрений. Ядра клеток крупные, овальные, расположены центрально или эксцентрично, содержат неравномерно распределенный глыбчатый хроматин и множественные крупные нуклеолы. Цитоплазма клеток умеренная, базофильная. Много патологических фигур митоза. Васкуляризация опухоли скудная, выявляются очаги некроза. Заключение: низкодифференцированная опухоль неясного генеза. Необходимо провести дифференциальную диагностику между фибросаркомой и веретеноклеточной меланомой.
Было принято решение о проведении ИГХ-исследования. Выбранная панель антител включала в себя маркеры мезенхимальной, нейроэктодермальной, эпителиальной и лимфоидной дифференцировки. Положительную экспрессию дали: HMB 45, S100, виментин, syn. Отрицательная экспрессия CD 3, pax 5, p 63, chrom.
ИГХ-метод исследования является методом выбора в диагностике низкодифференцированных новообразований. Метод является дополнительным и проводится после классического рутинного гистологического анализа. По результатам гистологического исследования врач-патолог определяет панель используемых антител, ориентируясь на гистогенез опухоли и степень ее дифференцировки. Каждая лаборатория определяет собственные алгоритмы ИГХ-исследования, учитывая потребности и задачи клиентов.
1. Кузнецов С.Л., Мушкамбаров Н.Н., Горячкина В.Л. Атлас по гистологии, цитологии и эмбриологии. М.: Медицинское информационное агентство, 2002.
2. Бикхардт К. Клиническая ветеринарная патофизиология. М.: Медицина, 2001.
3. Пальцев М.А., Аничков Н.М. Патологическая анатомия. М.: Медицина, 2001.
4. Панцырев Ю.М. Клиническая хирургия. М.: Медицина, 1988.
5. Пальцев М.А., Пономарев А.Б., Берестова А.В. Атлас по патологической анатомии. М.: Медицина, 2003.
6. С труков А.И., Серов В.В. Патологическая анатомия. М.: Медицина, 1979.
Иммуногистохимические исследования или иммуногистохимия (сокращенно ИГХ) — это анализ, который применяется для диагностики различных заболеваний и нашел особенно широкое применение в онкологии. С помощью него обнаруживают маркеры — вещества (белки), которые в больших количествах вырабатываются опухолевыми клетками. Это помогает врачам решать различные диагностические задачи.
Суть исследования ИГХ в том, что к образцу опухолевой ткани добавляют антитела, которые распознают искомое вещество как антиген и связываются с ним. Благодаря этому соответствующие участки опухолевой ткани окрашиваются, и их можно обнаружить при исследовании под микроскопом.


Для чего применяют анализ ИГХ в онкологии?
иммуногистохимия помогает решать следующие задачи:
Как проводят анализ?
Для того чтобы провести исследование на различные опухолевые маркеры, врач должен выполнить биопсию — получить фрагмент ткани злокачественной опухоли и отправить его в лабораторию. Там материал особым образом подготавливают (с помощью парафинизации или заморозки), обрабатывают соответствующими антителами и изучают под микроскопом. Иммуногистохимия опухолей позволяет не только выявить искомое вещество, но и оценить его локализацию в ткани, судить о количестве.
После того как исследование завершено, лечащий врач получает из лаборатории заключение. Сроки проведения анализа установлены пунктом 24 Приказа Минздрава России № 179н от 24 марта 2016 г. Если опухолевую ткань исследуют на 5 разных маркеров или меньшее количество, результат должен быть готов в течение одной недели, если на большее количество — в течение 15 дней.
При каких типах рака чаще всего применяют иммуногистохимические исследования?
Иммуногистохимическое исследование биопсийного материала помогает выявлять разные виды опухолевых маркеров. Вот некоторые:
- При раке молочной железы: рецепторы к гормонам (эстрогенам, прогестерону), HER2.
- При карциноидах (нейроэндокринных опухолях): рецепторы к гормону соматостатину типов 2А и 5.
- При немелкоклеточном раке легкого (НМРЛ) и некоторых других типах рака: , ROS1, ALK.
- При раке толстой кишки и некоторых других злокачественных опухолях: микросателлитная нестабильность.
Оставьте свой номер телефона
При раке молочной железы самое большое значение имеют три белка: рецептор к эстрогенам, рецептор к прогестерону и HER2. Присутствие этих молекул на поверхности раковых клеток делает их чувствительными к определенным лекарственным препаратам. Если по результатам иммуногистохимии ни одна из этих молекул не обнаружена, диагностируют тройной негативный рак молочной железы. Он отличается более агрессивным течением, его сложнее лечить.
В лаборатории содержание этих веществ в опухолевых клетках оценивают с помощью специальных шкал:

При раке легкого с помощью иммуногистохимии можно уточнить гистологический тип злокачественной опухоли. Разные подтипы клеток при немелкоклеточном раке легкого могут экспрессировать различные маркеры:
- Большинство аденокарцином (злокачественные опухоли из клеток, вырабатывающих слизь): цитокератин 7 (СК7), тиреоидный транскрипционный (), опухолевый белок p63, цитокератин 20 (CK20), опухолевый белок p63, .
- Плоскоклеточный рак (из плоского эпителия, который выстилает дыхательные пути): CK5/6, p63, 34bE12. и CK7 при плоскоклеточном раке легкого обычно не обнаруживают.
- EGFR — рецептор эпидермального фактора роста, который находится на поверхности опухолевых клеток и заставляет их бесконтрольно размножаться. В данном случае могут быть эффективны таргетные препараты: эрлотиниб (Тарцева), афатиниб (Гилотриф), гефитиниб (Иресса), осимертиниб (Тагриссо), дакомитиниб (Визимпро), нецитумумаб (Portrazza).
- ALK — мутация в этом гене встречается при немелкоклеточном раке легкого примерно в 5% случаев. Применяют таргетные препараты: кризотиниб (Ксалкори), церитиниб (Зикадия), алектиниб (Алекенза), бригатиниб (Алунбриг), лорлатиниб (Лорбрена).
- ROS1 — ген, мутации в котором возникают при немелкоклеточном раке легкого в 1–2% случаев. При этом помогают такие таргетные препараты, как кризотиниб (Ксалкори), церитиниб (Зикадия), лорлатиниб (Лорбрена), энтректиниб (Розлитрек).
- — белок, который связывается с молекулой PD1 на поверхности , подавляет их активность, мешает атаковать опухолевые клетки. Если в опухолевой ткани обнаружен этот маркер, могут быть назначены иммунопрепараты из группы ингибиторов контрольных точек.
Первое: сбор жалоб и анамнеза. Пациент может жаловаться на вновь появившееся образование на коже, чаще на местах, подвергающихся инсоляции. В таких случаях важно узнать, как давно появилось образование и каковы темпы его роста, посещает ли пациент солярии или пляжи. Также пациент может жаловаться на увеличение уже имеющегося у него кожного образования (к примеру, невуса), изменение его формы, окраски. При опросе врачу нужно собрать семейный анамнез, так как около 5% меланом имеют наследственный характер.
Второе: осмотр кожного образования. В настоящее время к визуальным методикам оценки образований на коже относят:
1. Дерматоскопия. Дерматоскопия позволяет провести оценку поверхностных структур образования и рядом лежащей кожи, цвета, распределения пигмента и немеланоцитарных структур, используя отраженный свет, и определить показания для оперативного лечения. При дерматоскопии можно выделить такие структурные компоненты, как пигментная сеть, бесструктурные области, пигментные капли, точки, разветвленные полосы, роговые псевдокисты, псевдофолликулярные щели, сосудистые узоры. Нетипичный сосудистый узор в виде макового поля наиболее часто встречается при меланоме.
Одним из наиболее известных симптомокомплексов, используемых в диагностике меланомы, является правило ABCD, предложенное Friedman в 1985 году. В статье ABCD rule of dermatoscopy: new practical method for early recognition of malignant melanoma описано, что это правило включает оценку пигментного новообразования кожи по 4 параметрам: А (asymmetry) — асимметрия пигментного пятна; В (border)— неровность границ; C (color)— неравномерность окраски; D (diameter) — диаметр более 6мм. С 1999г. правило дополнено критерием Е (evaluation). Он характеризует результаты динамического наблюдения за лицами из группы риска и позволяет оценить динамику изменений цвета, формы и размеров пигментного образования кожи.
А – асимметрия. Для выявления асимметрии образования оно делится двумя взаимно перпендикулярными линиями.
В – граница. Оценка границы основана на том, есть ли резкое или постепенное изменение рисунка пигментации по периферии образования.
С – цвет. В образовании можно уверенно дифференцировать 6 цветов (белый, красный, светло-коричневый, темно-коричневый, серо-голубой, черный).
D – не только диаметр образования, но и дифференциальные структуры. Оценивается присутствие сети, бесструктурных областей, капель, точек и полос.
2. Флуоресцентная дерматоскопия с 5-аминолевулиновой кислотой применяется в том случае, когда образование экзофитное и не позволяет провести обычную дерматоскопию. (см. рисунок 3).
Если благодаря неинвазивным методикам врач определил показания для оперативного вмешательства, диагностика кожной меланомы переходит на новый уровень.
4. Биопсия образования с последующим гистологическим исследованием. Для меланомы эксцизионная биопсия является также и методом её хирургического лечения. После иссечения образования препарат попадает в руки врачу-патологу.
5. Морфологическое исследование препарата, окрашенного гематоксилин-эозином. На данном этапе патолог может поставить диагноз, опираясь на основные критерии, присущие кожной меланоме. Они хорошо описаны в специализированной литературе, а также на интернет-ресурсах для патологов:
Кроме нозологического диагноза патолог даёт заключение о радикальности операции (оценивает края резекции). Для стадирования меланомы патолог применяет современные критерии, описанные в AJCC Cancer Staging Manual 8th - оценивает состояние её поверхности (изъязвлённая либо неизъязвлённая), глубину инвазии меланомы (степень инвазии по Кларку), толщину опухоли от зернистого слоя до самой глубокой точки её инвазии (толщина опухоли по Бреслоу), митотический индекс (обнаружение более 1 митоза на 1мм2 указывает на высокую митотическую активность опухоли), количество пигмента в опухоли, лимфоидную инфильтрацию опухоли, наличие сателлитов.
Однако поставить диагноз, используя морфологический метод, при стандартном окрашивании не всегда возможно.
6. Иммуногистохимическое исследование гистологического препарата. Для уточнения диагноза и дифференциальной диагностики меланомы, а также выявления микрометастазов в лимфоузлах используется иммуногистохимическое исследование. Отличить меланоциты от немеланоцитарных клеток позволяют:
протеин S100 – показывает ядерное и цитоплазматическое окрашивание в 90% меланом;
HMB45 - цитоплазматическое и слабое ядерное окрашивание, менее чувствительный, но более специфичный, чем S100; отрицательный в десмопластической меланоме;
MelanA / MART1- чувствительные, но также положительны в стероид-продуцирующих клетках яичников, яичек, коры надпочечников;
тирозиназа - чувствительный маркер, но им также окрашиваются периферические нервные оболочки и нейроэндокринные опухоли;
PHH3 и Ki67 - применяются для оценки пролиферативной активности и помогают отличить меланому от невуса, другим маркером является SM5-1;
Другие положительные окраски: Fontana-Masson (обнаруживает гранулы меланина), виментин; вариабельное окрашивание с помощью CAM 5.2, CEA, EMA, альфа-1-антихимотрипсина, CD68.
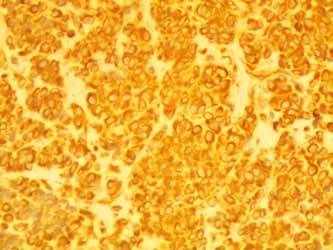
К прогностическим маркерам меланомы относятся p53, Ki67, белки теплового шока, bcl 2, VLA-, a-v/b-3 интегрины, CD 26, NM 23, E-кадгерин, циклин D1, циклин D3, p16-INK-4a, фактор VIII, CD 31, CD 34, подопланин,С-kit. Cм. Рисунок 6 (иммуногистохимическое окрашивание меланомы).
Молекулярно-генетическое исследование меланоцитарных поражений кожи проводится для дифференциальной диагностики меланомы с невусами и другими опухолями немеланоцитарной природы, а также для определения мутации гена BRAF.
Генетические нарушения присутствуют как на ранней стадии формирования опухоли (фаза радиального роста), так и на более поздней (фаза вертикального роста). При этом степень выраженности этих нарушений не зависит от фазы развития опухоли. Помимо этого, отмечено существование меланом с преобладающим типом нарушений: с амплификацией исследуемых генов или с делецией. Также было установлено, что в наибольшей степени (в 72,1 %) подвержен аберрациям ген RREB1. Не менее чем у 50 % больных меланомой обнаруживается мутация гена BRAF V600E. В норме ген BRAF регулирует рост клеток, но при такой мутации он начинает способствовать быстрому распространению клеток меланомы по всему организму. (см. рисунок 7).
8. Определение мутации в 15 экзоне гена BRAF в образцах меланомы осуществляется методом секвенирования по Сэнгеру.
В статье THE PROGRESS IN THE DIAGNOSIS OF CUTANEOUS MELANOMA хорошо описаны все эти методики.
1) Stolz W., Riemann A., Cognetta A. et al. ABCD rule of dermatoscopy: new practical method for early recognition of malignant melanoma // Eur. J. Dermatol. — 1994;
2) THE PROGRESS IN THE DIAGNOSIS OF CUTANEOUS MELANOMA
L. V. Demidov, D. V. Sokolov, I. V. Bulycheva, B. V. Shashkov, A. N. Makhson, G. N. Vorozhtsov, S. G. Kuzmin3, V. V. Sokolov. Clinical Oncology Research Institute, N. N. Blokhin RCRC RAMS, Moscow Moscow City Cancer Hospital No.62, Krasnogorsk, Moscow Region 3 Intermedbiophyschim Center, Moscow;
3) AJCC Cancer Staging Manual 8th ed. 2017, Corr. 3rd printing 2018 Edition;
Читайте также:






