Иммуногистохимический анализ при раке предстательной железы
Введение
Учитывая глобальное постарение населения, в том числе мужского, проблема дифференциальной диагностики и прогноза болезней предстательной железы у мужчин старше 40 лет в ближайшем будущем не утратит своей остроты. Рак предстательной железы (РПЖ) является одним из самых распространенных заболеваний у мужчин. Как свидетельствуют статистические данные, в 2015 г. в России РПЖ впервые диагностирован у 38812 пациентов, при этом прирост заболеваемости с 2005 г. составил 135%. В структуре смертности от злокачественных новообразований в 2015 г. в России РПЖ составил 7,6%, с 2005 по 2015 гг. прирост 42% [1]. Диагностическая ценность комплекса рутинных методов обследования пациентов с болезнями предстательной железы в настоящее время преимущественно определяется исследованием уровня простат-специфического антигена (ПСА) и его фракций, ТРУЗИ, пальцевого ректального исследования и МРТ, обладающих довольно низкой специфичностью.
Количество ложноотрицательных результатов при первичной биопсии простаты достигает 30%. Проводятся многочисленные исследования с внедрением в широкую практику различных методов для выявления данного новообразования на стадии локализованного процесса, однако диагностика поздних стадий и смертность от рака предстательной железы как России, так и в других странах остаются высокими. У многих мужчин изначально диагностируют местно-распространенные (38,5%) и метастатические (23,2%) опухоли [2]. Следовательно, одной из приоритетных задач остается выявление данного новообразования на стадии локализованного процесса.
В настоящее время иммуногистохимические (ИГХ) методы исследования занимают важную роль в дифференциальной диагностике новообразований различной локализации, в том числе и РПЖ. Не вызывает сомнения то обстоятельство, что развитие патологического процесса в предстательной железе носит мультифакторный характер и сопряжено с нарушением и перестройкой большей части внутриклеточных механизмов. Иммуногистохимические методы позволяют увеличить выявляемость РПЖ на стадии локализованного процесса, сократить количество необоснованных повторных биопсий и необходимость повторных госпитализаций. Одним из важных направлений являются исследования, показывающие роль различных факторов роста в развитии и факторов прогрессирования новообразований предстательной железы [3, 4]. Деградация базальной мембраны межклеточного матрикса и различных строгальных элементов, включающих в состав структурные белковые компоненты, определяют инвазию и метастазирование опухоли. Данный механизм опосредован секрецией протеолитических ферментов, таких как матричные металлопротеиназы (ММП) — клеточных энзиматических продуцентов. [5].
В связи этим, на протяжении нескольких десятилетий повышается интерес к ММП, вовлекающим внеклеточный матрикс в процессы структурно-функционального ремоделирования, чаще всего путем деградации цепей коллагена. Уже идентифицировано около 30 энзимов данного семейства, которые характеризуются наличием общих свойств: разрушают внеклеточный матрикс, секретируются в виде профермента и активируются в результате протеолитического расщепления, проявляют активность в нейтральной среде. Однако для большинства из них до сих пор четко не обозначена их роль. В физиологических условиях существуют различные биологические механизмы по предотвращению протеолиза тканей, вызванного активацией ММП, такие как секреция клетками стромы тканевых ингибиторов ММП илиTIMP (tissue inhibitor of metalloproteinases). [4, 5, 6].
Ki-67 - это специфический белок, антиген ракового процесса, который является регуляторным. Его появление соответствует вступлению клетки в митоз, что позволяет использовать его в качестве универсального маркера пролиферации при оценке роста злокачественных опухолей, в том числе и РПЖ. Индекс Ki-67, определяемый как отношение количества клеток с интенсивной ядерной реакцией на Ki-67 к общему числу клеток, является независимым показателем прогноза рецидива и выживаемости у больных РПЖ. [7, 8].
На сегодняшний день описаны около 30 типов коллагена, которые кодируются различными генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации-интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является присутствие их во внеклеточном матриксе. Коллаген IV является основным компонентом базальной мембраны эпителиальных клеток, встречается в стенке артериальных сосудов и собственном веществе соединительной ткани. Инвазивные свойства опухолевых клеток связаны с разрушением этого важного компонента соединительной ткани [9].
В данном исследовании с использованием иммуногистохимических методов проведен анализ продукции матриксной ММП 9 типа, ингибитора металлопротеиназы TIMP-1, маркера пролиферации Ki-67, и изучение распределения коллагена IV в неизмененных клетках секреторного эпителия при доброкачественной гиперплазии предстательной железы (ДГПЖ) и атипических клетках аденокарциномы простаты различных градаций по шкале Глисона с целью изучения молекулярных механизмов инвазивного роста рака предстательной железы.
Материалы и методы
Когорта пациентов, включенных в исследования составила 184 мужчин, разделенных на 2 группы, средний возраст 68,2±2,17 лет. 65 пациентов с ДГПЖ и 118 пациентов с верифицированным раком предстательной железы различной степени анаплазии.
Для проведения ИГХ исследовании использовались следующие антитела к антигенам человека: моноклинальные мышиные антитела к белку Ki-67 (MM1, Diagnostic Biosystems, 1: 200); моноклинальные мышиные антитела к коллагену IV (PHM-12, Thermoscientific, 1:100); очищенные антитела кроличьей антисыворотки к матриксной металлопротеиназе-9 (Thermoscientific, 1:400); моноклинальные кроличьи антитела к ингибитору TIMP-1 (EPR 1550, 1:100, EPITOMICS).
Распределение коллагена IV в базальной мембране желез предстательной железы и строме оценивали полуколичественным методом в баллах по следующим показателям: 0 — отсутствие коллагена вдоль базальной мембраны и стромы; 1 — наличие тонкой полоски коллагена; 2 — толстая полоска коллагена вдоль базальной мембраны, сравнимая по толщине и интенсивности окрашивания со стенкой сосудов. Продукцию ММП-9 исследовали в различных опухолевых образованиях: ДГПЖ и аденокарциноме простаты различной градации от 2 до 5. Как правило, протеиназа выявляется в цитоплазме опухолевых клеток в виде мелких или крупных гранул, при этом отмечается различная интенсивность окрашивания. Оценку интенсивности ИГХ реакции с MMП-9 проводили в баллах по следующим параметрам: 0 — отсутствие коричневых гранул в цитоплазме клеток, 1 — наличие отдельных мелких гранул в цитоплазме, 2 — распределение в отдельных клетках крупных гранул, 3 — наличие крупных гранул в цитоплазме большинства клеток. Оценку интенсивности ИГХ реакции с ингибиторомTIMP-1 проводили по той же бальной шкале, что и ММП-9.
Статистическую обработку полученных данных проводили с помощью программы STATISTICA 10.0, с последующим математическим анализом полученных материалов. Корреляционные взаимоотношения между числом Глисона опухоли, ПСА, индексом пролиферации клеток, выраженностью продукции оценивали с помощью коэффициента корреляции Спирмена (rs).
Результаты и обсуждение
Пропорционально увеличению возраста пациентов в неизмененных эпителиальных клетках предстательной железы увеличивается продукция показателя клеточной пролиферации Ki-67 (3,24±0,61), но различия статистически недостоверны (р>0,05). В биоптатах пациентов с ДГПЖ отдельно расположенные пролиферирующие клетки локализовались только в базальном клеточном слое, пролиферативная активность клеток секреторного клеточного слоя не определялась. В аденокарциномах различных градаций выявлен широкий спектр пролиферативной активности секреторных железистых клеток (рис. 1а). При исследовании больных с опухолями 2-й и 3-й градации по шкале Глисона выявлена умеренная пролиферативная активность секреторных опухолевых клеток, где ИП Ki-67 составил 5,3+1,1% и 7,2+1,4%, (р
Комплексное исследование включает в себя два метода исследования (гистологическое и иммуногистохимическое), совместно использование которых позволяет повысить точность диагностики заболевания, определить оптимальные варианты лечения и скорректировать схему терапии.
- Гистологическое исследование с определением опухоли предстательной железы
- Иммуногистохимическая диагностика опухоли предстательной железы
Гистологическая и ИГХ диагностика опухоли простаты.
Complex histological and immunohistochemical examination with prostate tumor detection (Ck5, P63, AMACR).
Какой биоматериал можно использовать для исследования?
Образец ткани (биоптат) опухолевого образования предстательной железы.
Общая информация об исследовании
Рак предстательной железы (РПЖ) обусловлен развитием аномальных клеток в простате, которые могут неконтролируемым образом делиться и распространяться вне органа, поражая близлежащие или отдаленные части тела. Это, как правило, медленно развивающееся заболевание, которое в большинстве случаев в течение многих лет протекает бессимптомно, поэтому часто обнаруживается уже на продвинутых стадиях. В настоящее время летальность от этой патологии составляет 4,7%.
Может вызывать такие симптомы, как необходимость часто мочиться, особенно ночью, сложность начала или сдерживания мочеиспускания, слабый или прерывистый поток струи мочи, болезненное мочеиспускание, эректильная дисфункция, уменьшение количества эякулята, болезненная эякуляция, кровь в моче или сперме, давление или боль в прямой кишке, боль или скованность в нижней части спины, промежности или таза. Практически все указанные симптомы могут встречаться при других урологических заболеваниях (например, при простатите, доброкачественной простатической гипертрофии), которые очень распространены. При обнаружении в ходе ректального пальцевого обследования или по данным УЗИ опухолевидного образования и/или в случае обнаружения в крови повышенного содержания ПСА (простатспецифического антигена) высок риск онкологического заболевания простаты. Чтобы его исключить, может выполняться биопсия предстательной железы, полученный материал отправляется на гистологическое исследование. Оно позволяет выявить предраковые заболевания, подтвердить или исключить злокачественность процесса, верифицировать его, определить стадию, сопутствующие фоновые изменения и оценить агрессивность процесса.
Злокачественные новообразования предстательной железы морфологически классифицируются на эпителиальные (аденокарцинома, переходно-клеточный и плоскоклеточный рак) и неэпителиальные опухоли. В 95-97% случаев РПЖ представлен аденокарциномой, которая по своему строению микроскопически неоднородна. Но иногда (например, из-за недостаточного количества биоптата, вероятного отсутствия достаточного количества измененных желез для получения однозначного заключения, атипической мелкоацинарной пролиферации (ASAP)) возникают сложности с трактовкой результатов гистологического исследования - в таких случаях рекомендуется использовать иммуногистохимическое исследование (ИГХ) с антителами, направленными против базальных клеток (p63), к цитокератинам (Ck5) и с альфа-метилацил-кофермент А-рацемазой (α-melhylacylcoenzymeAracemase – AMACR). Оно позволяет не только достоверно верифицировать раковый процесс, но и обнаружить рак in situ.
Альфа-метилацил-КоАрацемаза участвует в бета-окислении жирных кислот и метаболизме желчных кислот и может быть обнаружена в нормальных тканях (например, гепатоцитах печени, в тубулярном эпителии почек, эпителии бронхов, желчном пузыре). Начиная с 2000 г., после установления связи между повышенной экспрессией AMACR и наличием карциномы простаты, этот белок стал рассматриваться как онкомаркер. Повышение экспрессии альфа-метилацил-КоАрацемазы возможно и при карциномах других локализаций (например, колоректальных, овариальных, груди, мочевого пузыря, легких, почечно-клеточных), тем не менее данный маркер высокоэффективен, так как позволяет провести дифференциальную диагностику рака с другими заболеваниями и более точно определить стадию процесса. AMACR позитивен как в случае наличия предракового поражения (простатической интраэпителиальной неоплазии (ПИН), так и при карциномах простаты, в том числе при ASAP. Считается, что чем выше экспрессия альфа-метилацил-КоАрацемазы, тем агрессивнее ведет себя опухоль.
Дополнительными маркерами базальных клеток для диагностики аденокарциномы являются p63, цитокератины (Ck) 5/6, цистатин А54 и кальциклин. При помощи маркера p63 можно обнаружить белок p63 в ядрах базальных клеток. Ген, кодирующий выработку этого белка, относится к семейству p53 опухолевых супрессорных генов. р63 обладает широким спектром биологических функций, включая участие в делении и дифференцировке клеток, его можно обнаружить в различных видах эпителия. Определение р63 помогает провести дифференцировку между доброкачественными и онкологическими процессами. Высокомолекулярные цитокератины также относятся к маркерам базального эпителия предстательной железы и, как правило, меньше экспрессируются или отсутствуют при раке предстательной железы.
Использование во время проведения исследования сразу нескольких маркеров повышает его чувствительность.
Для чего используется исследование?
- Для дифференциальной диагностики патологического процесса.
- Для определения вида и подвида опухоли, степени ее злокачественности и распространенности онкологического процесса.
- Для оценки фокусов атипических желез с подозрением на аденокарциному.
- Для подбора адекватной терапии, в том числе с учетом полученных результатов иммуногистохимического анализа.
- Для контроля эффективности лечения.
- Для верификации метастазов.
- Для динамического контроля и прогноза у лиц с предраковыми состояниями (ПИН).
Когда назначается исследование?
- При наличии симптомов и/или признаков, позволяющих заподозрить злокачественный процесс в предстательной железе (например, при обнаружении уплотнения в простате при пальцевом ректальном обследовании, при наличии характерных изменений в предстательной железе по данным УЗИ, при повышенном уровне ПСА).
- При атипичном течении заболевания, если во время первичной биопсии не было данных об онкологическом процессе.
- В случае обнаружения при первичной биопсии простатической интраэпителиальной неоплазии высокой степени.
- Для верификации метастатических опухолей.
Что означают результаты?
Проводится морфологическая оценка опухоли согласно классификации ВОЗ, оценка экспрессии маркеров в атипичных клетках. Диапазон референсных значений экспрессии маркеров индивидуален и зависит от многих факторов.
Правильно интерпретировать результат исследования может только врач.
Иммуногистохимические методы используются для выявления локализации того или иного клеточного или тканевого компонента (антигена) in situ посредством связывания его с мечеными антителами и являются неотъемлемой частью современной диагностики рака, обеспечивая обнаружение локализации в тканях различных клеток, гормонов и их рецепторов, ферментов, иммуноглобулинов, компонентов клеток и отдельных генов.
Метод ИГХ нашел свое применение и в диагностике рака простаты. Маркеры рака предстательной железы выполняют 2 функции: используются для диагностики РПЖ и определяют потенциал злокачественности РПЖ. Определенные виды маркеров выполняют как одну, так и другую функцию (PSA, PSAP).
— цитокератины (общий цитокератин, СК-5/6, высокомолекулярный цитокератин) и маркер р63. Они экспрессируются базальным слоем эпителия. При РПЖ их экспрессия подавлена, они определяются в базальном эпителии доброкачественных структур предстательной железы.
— альфа-метилацил-КоА-рацемаза (AMACR). Повышение концентрации AMACR усиливает свободнорадикальные процессы в клетке и повреждение ДНК. Скорее всего это объясняет повышенный риск РПЖ при высоком уровне поступления разветвленных жирных кислот с пищей (например, с молочными продуктами или говядиной). Высокоэффективен при иммуногистохимическом исследовании и позволяет дифференцировать рак от других патологических процессов, а также более точно определить стадию заболевания, в том числе и в биопсийном материале. Этот маркер считается позитивным в 80-100% случаев малых очагов рака. Используется совместно с р63 маркером базальных клеток, что обеспечивает эффективность 92-97%.
— хромогранин А, синаптофизин, серотонин. Используются для нейроэндокринной дифференцировки.
— простатспецифический антиген (PSA). Синтезируется секреторным эпителием ПЖ при участии дигидростерона. PSA экспрессируется во всех аденокарциномах предстательной железы. Снижение или отсутствие экспрессии PSA констатируется при низкодифференцированном раке. При некоторых аденокарциномах экспрессия PSA исчезает после проведения гормонотерапии или лучевой терапии.
— простатическая кислая фосфотаза (PSAP). Ее экспрессия весьма близка к экспрессии PSA. Оба маркера особенно пригодны для дифференциальной диагностики рака простатического происхождения с опухолями другого генеза, а также для определения исходной локализации опухоли при метастазах. В редких случаях, когда в аденокарциноме предстательной железы экспрессируется только один из этих двух маркеров, именно экспрессия PSAP чаще всего сохранена.
— простатспецифический мембранный антиген (PSMA). Используется, когда остутствует экспрессия PSA и PSAP.
— андрогены и эстрогены. Обладают способностью стимулировать пролиферативные процессы в предстательной железе. Для андрогенов основной тканью-мишенью является эпителий, а для эстрогенов соединительная и мышечная строма предстательной железы. Используются для предсказания чувствительности к гормонотерапии.
— Ki-67. Ген, кодирующий Ki-67, расположен на длинном плече 10 хромосомы. Ki-67 относится к регуляторным белкам. Стадия РПЖ напрямую соотносится с количеством опухолевых клеток, экспрессирующих Ki-67, поэтому индекс Ki-67 является независимым показателем прогноза рецидива и выживаемости у больных РПЖ.
— bcl-2 и р53. Ген р53 локализуется в ядре клетки, является супрессором опухолевого роста, предотвращая вступление клетки с поврежденной ДНК в синтетическую фазу цикла и индуцируя апоптоз. Мутация гена р53 ведет к потере контроля пролиферации клеток, угнетению апоптоза. Утрата функции этого гена может быть связана с высоким метастатическим потенциалом опухоли и развитием андрогеннезависимого РПЖ. Наличие мутаций в гене р53 в сочетании с повышенной экспрессией белка Bcl-2 при РПЖ является неблагоприятным прогностическим фактором течения заболевания. Также нарушение экспрессии р53 коррелирует со снижением выживаемости после простатэктомии. Белки семейства Bcl (Bcl-2 и Вах) играют ключевую роль в регуляции процессов апоптоза. Они индуцируют или ингибируют апоптоз в клетках ПЖ. Ген Вс1-2 может задерживать апоптоз клеток ПЖ, вызванный р53 и другими стимуляторами, в том числе цитостатическими препаратами. В случае гиперэкспрессии ген Bcl-2 выступает в качестве онкогена. В ткани ПЖ в норме экспрессия Bcl-2 осуществляется только клетками базального слоя эпителия. В андрогеннезависимом РПЖ отмечается усиленная экспрессия гена Bcl-2, что является признаком гормоноустойчивости и резистентности к индукторам апоптоза.
— белки p21 и p27. Являются опухолевыми супрессорами и ингибируют все типы циклин-зависимой киназы (cyclin dependent kinase CDK), препятствуя вступлению клетки в очередную фазу цикла деления. Мутации генов, кодирующих р21 и р27, встречаются при раке предстательной железы достаточно часто и коррелируют с неблагоприятным прогнозом заболевания. Иммуногистохимическая экспрессия p21/p27 коррелирует с длительностью безрецидивного течения, выживаемостью, степенью местной инвазии, поражением регионарных лимфоузлов.
— pRb. Играет важную роль в регуляции клеточного цикла. Утеря гетерозиготности локуса Rb наблюдается более чем в 60% случаев РПЖ.
Отдельной подгруппой идут факторы роста, которые при проникновении в ядро клетки обладают способностью стимулировать или ингибировать деление и дифференцировку клеток:
— рецептор эпидермального фактора роста (EGFR). Трансмембранный гликопротеин, обладающий тирозинкиназной активностью. EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции клеточного роста и дифференцировки. Экспрессия EGFR при РПЖ достигает 40%.
— инсулиноподобный фактор роста (IGF). Является одним из основных факторов роста в ПЖ, ответственных за фазу синтеза ДНК. Выработка IGF эпителиальными клетками ПЖ по аутокринному типу является одним из изменений, происходящих одновременно с развитием РПЖ. IGF способен усиливать локальное действие андрогенов. Определение IGF иммуногистохимическим методом в ткани с помощью моноклональных антител. Выявлена достоверная положительная корреляционная связь между степенью злокачественности опухоли и экспрессией IGF при РПЖ.
— фактор роста эндотелия сосудов (VEGF). Мультифункциональный цитокин, вызывающий пролиферацию и миграцию эндотелиальных клеток, в том числе и при РПЖ. Повышает способность эндотелиальных клеток к миграции, а опухолевых клеток к инвазии и метастазированию. При доброкачественной гиперплазии предстательной железы (ДГПЖ) экспрессия VEGF в опухоли ниже, чем при РПЖ, и наблюдается в менее чем 5% клеток.
— интерлейкин-8 (ИЛ-8). Является фактором роста с паракринным и аутокринным механизмом действия. Синтез ИЛ-8 осуществляется нейроэндокринными клетками ПЖ. Интерлейкин-8 и его рецептор CXCR1 при ДГПЖ, простатической интраэпителиальной неоплазии и андрогензависимом РПЖ иммуногистохимически не экспрессируется. В случае развития андрогеннезависимого РПЖ отмечается экспрессия рецепторов к ИЛ-8 CXCR2, что указывает на роль местных тканевых факторов роста в процессах пролиферации клеток РПЖ.
Иммуногистохимия (ИГХ)– современный и точный метод диагностики, позволяющий выявить злокачественную опухоль на ранних стадиях. Он основан на обработке срезов тканей мечеными антителами к выявляемому веществу, в данном случае оно является антигеном. После того, как была сделана биопсия предстательной железы, расшифровка результатов влияет на прогноз и тактику лечения.
ИГХ назначается при подозрении на опухоль предстательной железы. Если имеется рак, иммуногистохимия позволяет выявить природу первичного очага, его распространенность и составить прогноз.
- Суть метода
- Этапы проведения ИГХ
- Показания к проведению ИГХ простаты
- Подготовка к исследованию
- Как проводится биопсия для ИГХ?
- Возможные осложнения биопсии
- Сколько делается анализ?
- Расшифровка анализа
- Полезное видео
- Подведем итоги
Суть метода
Что такое иммуногистохимия, и для чего она назначается? В организме на всякое чужеродное вещество вырабатываются специфические антитела, которые предотвращают распространение патологического процесса.
Опухолевые клетки выделяют особые белки, которые и служат антигенами. Они обладают способностью связываться с антителами.
На этой реакции и основан метод гистохимии.
Для этой цели используются флуоресцентные красители, электронно-плотные частицы, ферменты. Образующийся комплекс имеет свойство флуоресценции, то есть, он создает свечение. Если в биоптате обнаружилось подобное изменение, то с большой вероятностью можно говорить о наличии раковых клеток.
Важно! Срез тканей в лаборатории обрабатывают специальными реактивами, содержащими меченые белки.
- устанавливает нозоологический вид первичного образования,
- позволяет определить распространенность процесса,
- выявляет тип опухоли из метастаза с неизвестным первичным очагом,
- оценивает эффективность лечения, определяет чувствительность клеток к химиотерапевтическим препаратам, а также к лучевой терапии,
- определяет стадию злокачественного процесса и прогноз заболевания,
- выявляет пролиферацию, то есть скорость роста опухоли.
Иммуногистохимия считается более достоверным методом диагностики, чем обычное гистологическое исследование. Однако во многих случаях требуется именно гистология, поэтому оптимально сочетать оба вида анализов.
В ходе иммуногистохимического исследования можно определить наличие специфических гормонов и их рецепторов, определенных ферментов, иммуноглобулинов, частичек клеток.
Этапы проведения ИГХ
Исследование состоит из следующих этапов:
- Забор образца путем биопсии, для исследования понадобится кусочек из подозрительного места и близлежащих тканей. Материал может быть получен во время оперативного вмешательства.
- Фиксация, обезжиривание.
- Заливка парафином, в ходе данной операции формируют гистологические блоки. В дальнейшем они поступают на вечное хранение, следовательно, исследование можно повторить в любое время при необходимости.
- Микротомирование – это получение тончайших срезов из образца. В дальнейшем лаборант их помещается на специальное гистологическое стекло.
- Окраска иммуногистохимическими препаратами, содержащими антитела заданной концентрации. Существует малая гистохимическая панель, в нее входят антитела 5 видов, и большая панель (количество маркеров составляет от 6 до десятка). Какими именно антителами будет обработан образец, зависит от вида предполагаемой опухоли.
- Микроскопия материала, заключение, расшифровка результатов анализа.
Показания к проведению ИГХ простаты
Анализ ИГХ назначается после ряда других исследований. Предварительно оцениваются результаты ПСА, пальцевого ректального исследования, данные УЗИ предстательной железы.
Показания к ИГХ следующие:
- При ректальной пальпации предстательной железы обнаружены участки уплотнения, бугорчатая поверхность.
- Выявлены структурные изменения простаты на УЗИ (исследование проводится через прямую кишку или переднюю брюшную стенку).
- Анализ ПСА (простат-специфического антигена опухолевого маркера) превышает допустимые величины. Повышение ПСА может свидетельствовать как об онкологическом заболевании, так и о банальном простатите.
- Результаты биопсии простаты показали морфологические изменения.
- Необходимо точно определить вид опухоли, ее распространенность, стадию болезни.
- Оценка реакции клеток на применение химиотерапевтических препаратов и лучевой терапии.
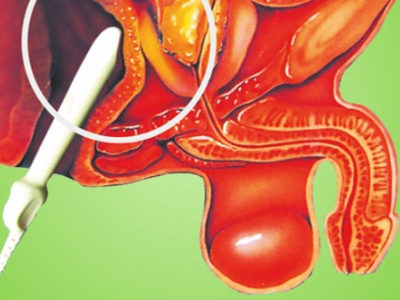
ИГХ назначается при малейшем подозрении на злокачественное перерождение предстательной железы.
Не каждое образование имеет опухолевую природу. Так, имитировать рак могут другие патологии: доброкачественное увеличение железы (аденома), острое и хроническое воспаление, аденоз простаты.
Для дифференциальной диагностики применяют гистологические и гистохимические анализы, причем ИГХ используется как дополнительный метод.
Проведение биопсии предстательной железы противопоказано, если имеется:
- Острое инфекционное заболевание.
- Тяжелая сердечная и легочная патология, печеночная и почечная недостаточность.
- Воспаление предстательной железы в острой фазе.
- Обострение болезней прямой кишки геморроя, проктита.
- Наследственные нарушения системы гемостаза (гемофилия). Биопсия в этом случае может привести к кровотечению, которое практически невозможно остановить.
Подготовка к исследованию
Подготовка состоит из следующих этапов:
- За неделю до проведения биопсии предстательной железы следует исключить препараты, воздействующие на свертываемость крови (Аспирин, Варфарин, Кардиомагнил, гепарины). Хотя большинство этих средств и не вызывают осложнений, но во избежание кровотечения их лучше отменить.
- За 3 дня до исследования исключаются противовоспалительные средства (Ибупрофен, Диклофенак). Эти препараты действуют так же, как антиагреганты и антикоагулянты, то есть могут спровоцировать кровоточивость.
- Прийти на биопсию нужно натощак.
- Накануне вечером и утром делается очистительная клизма в том случае, если назначена биопсия через прямую кишку. При заборе материала через промежность, очищения кишечника не требуется.
Если пациент принимает натуральные добавки (витамины, травяные настои, БАДы), их также рекомендуется на время исключить.
В течение нескольких дней перед биопсией предстательной железы соблюдается бесшлаковая диета с исключением грубой волокнистой пищи и продуктов, вызывающих метеоризм. Нельзя употреблять в пищу перловую и пшеничную кашу, капусту, свежие ягоды, фрукты, цельное молоко, черный хлеб, газировку, алкоголь.
Дневной рацион состоит из легких супов на нежирном бульоне, отварного мяса, сухого печенья, крекеров, куриных яиц. Допускаются гречневая и рисовая каши, сладкие продукты (желе, мед), компоты, чай.
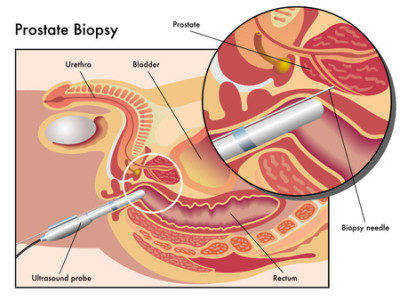
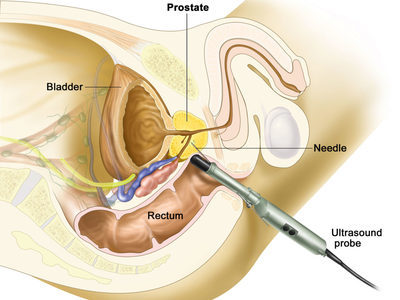
Как проводится биопсия для ИГХ?
Чаще всего биопсия делается трансректальным способом, то есть через прямую кишку. После местного обезболивания в кишечник вводится датчик УЗИ-аппарата, к которому прикреплен пистолет с биопсийной иглой. Во время быстрого прокола игла проходит в предстательную железу и забирает кусочек ткани, так называемый столбик. При трансректальной биопсии берут от 12 до 30 столбиков, при промежностной их количество достигает 50. Чем больше кусочков ткани было взято у пациента, тем точнее результат исследования.
Биопсия предстательной железы делается не более 30 минут, сам укол длится несколько секунд.

В дальнейшем образец помещается в пластиковый контейнер и доставляется в гистохимическую лабораторию. Здесь он хранится постоянно в виде парафиновых блоков. Результаты биопсии простаты в дальнейшем лежат в архиве лаборатории.
Любое вмешательство вызывает тревогу у пациентов: насколько это больно? Говорить о резкой болезненности нельзя, скорее, манипуляция вызывает небольшой дискомфорт.
Проведенная анестезия уменьшает неприятные ощущения. Однако немалую роль играет психологическое состояние самого человека. Тревогу снимут успокаивающие средства, назначаемые перед манипуляцией.
Возможные осложнения биопсии
Неприятные ощущения в прямой кишке после биопсии – обычное явление. Острой боли не возникает, но появляется легкий дискомфорт. Он самостоятельно проходит в течение нескольких дней. Иногда пациенту назначают обезболивающие и седативные лекарства для устранения симптомов.
Одним из осложнений биопсии предстательной железы является острый проктит. Заболевание характеризуется резкой болью в промежности, возле ануса, повышением температуры, расстройством мочевыделения. При малейшем подозрении на воспаление прямой кишки требуется госпитализация в проктологическое отделение.
В редких случаях после биопсии предстательной железы развиваются инфекционные заболевания мочеполовой системы: уретрит, цистит, орхит. Дело в том, что бактерии E.coli проникают из прямой кишки в мочевыводящий тракт и вызывают там воспаление.
Такое случается при нарушении рекомендаций, например, пациент накануне не сделал очистительной клизмы.
Для предупреждения инфекционных осложнений пациенту назначаются антибиотики. Их принимают за 2-3 дня до процедуры и в течение 5-7 дней после нее.
После биопсии простаты появляется выделение крови в виде гематурии, гематоспермии, анального кровотечения. Небольшая кровоточивость допускается врачами, она исчезает через 3-4 дня. Если симптомы сохраняются продолжительное время, развивается массивное кровотечение, повышение температуры, требуется скорая врачебная помощь.
Сколько делается анализ?
Исследование проводится в патоморфологических лабораториях. Врач, делающий анализ, обязательно проходит специальную подготовку по ИГХ. Результаты анализа ИГХ выдаются через 7 дней (если использовалась малая панель), или через 15 дней (при расширенном исследовании).
Важно! Самостоятельно назначить себе анализ ИГХ нельзя, материал берется врачом, им же принимается решение о проведении гистохимии.
В заключении указывается набор маркеров, которые использовались в ходе анализа, наличие экспрессии маркеров, расшифровка вида опухоли. Врач определяет, к каким именно антителам имеется сродство тканей. Он описывает морфологическую структуру образца, наличие перерожденных клеток, их количество. Если выявлена тропность ткани к маркерам определенного вида, это обязательно отмечается врачом.
Расшифровка анализа
Результаты биопсии простаты могут быть следующие:
- острый воспалительный процесс,
- хроническое воспаление простаты,
- гиперплазия тканей доброкачественной природы,
- склерозирующий аденоз,
- аденокарцинома с указанием количества видоизмененных клеток, их прорастания в здоровые ткани.
Полезное видео
Подведем итоги
Рак предстательной железы самое распространенное злокачественное новообразование у мужчин старшего возраста. Своевременная диагностика позволяет провести ранее лечение и обеспечивает благоприятный прогноз. Пациентам не нужно бояться биопсии, ведь осложнения после нее развиваются редко.
Читайте также:

