Иммунофенотип опухоли с учетом морфологического строения
Автор (ы): Н.В. Митрохина, к.в.н., ветеринарный врач-патоморфолог, заведующая ветеринарным центром патоморфологии и лабораторной диагностики доктора Митрохиной
Журнал: №1 - 2019
Лимфома мелких домашних животных является часто встречающейся патологией и, во многих случаях, назначение специфического лечения, позволяет продлить качественный срок жизни животного. Прогнозы заболевания и назначаемая терапия зависят от гистогенеза опухоли и ее иммунофенотипа. Целью статьи явилось описание различных морфологических вариантов лимфом и описание специфических микрочерт для понимания биологии их поведения, клинического проявления и прогнозирования течения данного заболевания.
Lymphoma of small Pets is a common pathology and, in many cases, the appointment of specific treatment, allows you to extend the quality of life of the animal. The prognosis of the disease and the prescribed therapy depend on the histogenesis of the tumor and its immunophenotype. The aim of the article was to describe various morphological variants of lymphomas for understanding the biology of their behavior, clinical manifestations and prognosis.
Лимфатические узлы, костный мозг, селезенка, тимус являются органами кроветворения. Скопления лимфоидной ткани в органах и лейкоциты являются частью лимфатической системы. Последняя представлена разветвленной сетью лимфатических сосудов, прерывающихся по ходу лимфатических узлов. Лимфатические сосуды образуют систему лимфатических капилляров, являющихся корнями лимфатической системы в органах. Они пронизывают все органы кроме головного и спинного мозга, паренхимы селезенки, клубочков почки, слизистых оболочек, хрящей, склеры, хрусталика, плаценты. Таким образом, все органы и ткани многоклеточного организма содержат в той или иной мере развитую лимфоидную ткань. Лимфоидная клетка является источником развития лимфомы. Наличие лимфоидных клеток во всех тканях организма является причиной отсутствия органной тропности данного заболевания.
В зависимости от места возникновения и характера опухолевого роста, особенностей развития и клинических проявлений, лимфопролиферативные заболевания разделены на острые и хронические лейкозы и лимфомы, которые первоначально имеют внекостномозговую локализацию (лимфатический узел, селезенка, кожа, лимфоидная ткань слизистой оболочки желудка и т.д.). Рост опухоли может сопровождаться инфильтрацией костного мозга и лейкемизацией. Проблема систематизации злокачественных лимфом находит свое отражение в различных классификациях. Известно, что с 1925 г. их было предложено более 25. Ветеринарные классификации несовершенны и просты, в то время как усложнение классификаций лимфоидных опухолей отражает прогресс в понимании биологии и характера течения этих заболеваний. Существуют морфологически сходные формы лимфопролиферативных заболеваний, но отличающиеся по клинической картине, тактике и результатам лечения. С другой стороны, идентичные клинические и лабораторные данные могут наблюдаться при различных нозологических формах лимфом. Поэтому крайне необходимо совершенствовать существующие классификации лимфопролиферативных заболеваний, которые основаны на морфологических признаках опухолевой ткани и ее иммунофенотипе.
Анатомо-морфологические классификации лимфом
Наиболее часто встречающиеся лимфопролиферативные заболевания мелких домашних животных – это лимфомы из Т- или В-лимфоцитов. Причем, и те и другие могут происходить как из зрелых клеток, так и из клеток-предшественников. Значительно реже выявляется фолликулярная лимфома, плазмоцитома и гистиоцитарные опухоли. Существуют различные анатомические формы лимфомы:
– алиментарная лимфома. Характеризуется неопластическим поражением (как диффузным, так и очаговым) всех слоев стенок желудка и кишечника и/или мезентериальных лимфоузлов. Наблюдается преимущественно у старых кошек.
– медиастинальная лимфома. Характеризуется поражением тимуса и средостенных лимфоузлов, чаще всего вовлекаются в процесс передние и задние средостенные лимфоузлы. Данная форма практически всегда сопровождается плевральным выпотом. Встречается преимущественно у молодых животных.
– мультицентрическая лимфома. Характеризуется поражением поверхностных лимфоузлов с/без вовлечения печени и селезенки.
– экстранодулярная лимфома. Характеризуется поражением разных органов – почек, глаз, носа, центральной нервной системы, кожи.
Любая из этих анатомических форм лимфомы может иметь как Т, так и В-клеточную дифференцировку, может развиваться как из клеток предшественников, так и из зрелых лимфоцитов. Гистологическая классификация лимфом основана на разделении Т и В-клеточных форм. Так, по литературным данным в 75% случаев встречается В-клеточный иммунофенотип, а при медиастинальной форме, преимущественно Т-клеточный. Клиническая картина и прогнозы заболевания связаны линейной принадлежностью опухоли, т.е. с ее Т или В-клеточным происхождением. По клиническому течению различают индолентные и агрессивные формы лимфом. Индолентные лимфомы характеризуются медленным, благоприятным течением, длительно не требуют специфического лечения. Агрессивные формы характеризуются быстрым прогрессированием опухоли с выраженной клинической картиной и требуют немедленного лечения. Окончательный диагноз ранее устанавливали на основании гистологического и иммуногистохимического исследования биоптатов ткани опухоли или пораженного органа.
Морфологическая характеристика лимфом
В основе гистологического исследования биопсий лимфатических узлов, как и всех других органов и тканей, лежит детальное исследование тканевой структуры (архитектоники) и клеточного состава биоптата. Гистологическое исследование препаратов, окрашенных гематоксилином–эозином, позволяет отнести исследуемую опухоль лимфоидной ткани к одной из групп лимфом, объединенных выраженным морфологическим сходством.
Признаки, объединяющие лимфомы в группы сходного гистологического строения:
1) пролиферация бластных клеток,
2) диффузная пролиферация мелких клеток,
3) диффузная пролиферация крупных клеток,
4) фолликулярный рост лимфоидной ткани,
5) анапластическая морфология лимфоидных клеток,
6) диффузная полиморфноклеточная лимфоидная пролиферация.
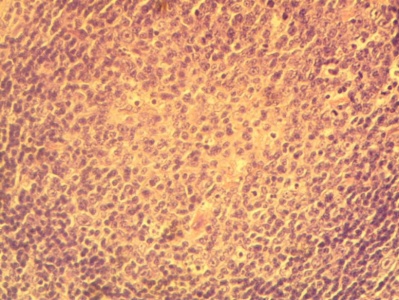
Диффузная пролиферация лимфоидных клеток с бластной морфологией характеризуется замещением ткани лимфатического узла или другого органа мономорфным пролифератом из клеток среднего размера (в 1,5–2 раза больше ядра малого лимфоцита). Ядра этих клеток округлые, правильной формы или с неровными контурами. Цитоплазма может быть различима в виде узкого базофильного ободка. Много фигур митозов. Ключевым признаком, определяющим бластную морфологию опухолевых клеток, является строение ядра. Гетерохроматин в ядрах имеет однородное пылевидное, зернистое или мелкоглыбчатое строение. В некоторых случаях отчетливо видно сетчатое и нежно петлистое строение хроматина, имеющего вид тонких нитей. Гетерохроматин равномерно распределен по всему объему ядра. Ядра содержат 1–3 небольших полиморфных нуклеолы. К опухолям подобного строения относятся лимфобластные лимфомы из клеток, предшественников В-лимфоцитов, лимфобластные лимфомы из клеток-предшественников Т–лимфоцитов.
Гистологическое исследование не позволяет дифференцировать лимфобластные лимфомы, отличающиеся своей принадлежностью к В- или Т-клеточной линии. Для данной задачи используется иммуногистохимический метод с определением белков CD3 и PAX5.
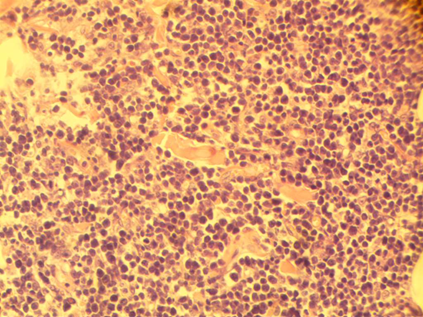
Рис. 1. Диффузная пролиферация лимфоидных клеток с бластной морфологией. Окраска гематоксилином и эозином, х 200
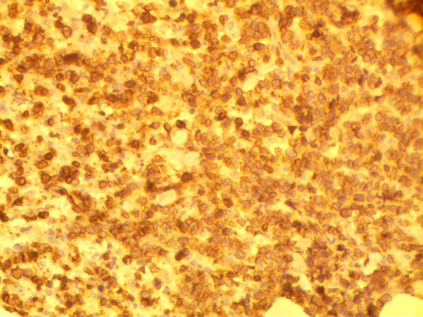
Рис. 2. Тот же препарат, иммунофенотипирование CD3 – выраженная экспрессия, что определяет ткань как опухоль Т-клеточной линии
Диффузная пролиферация мелких лимфоидных клеток практически не оставляет сомнений в опухолевой природе процесса при достаточном объеме исследуемой ткани. В подавляющем большинстве случаев опухоли диффузного строения из мелких клеток имеют Т-клеточный фенотип, очень редким исключением может быть Т-пролимфоцитарный лейкоз.
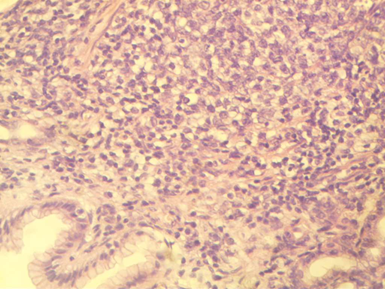
Рис. 3. Диффузная пролиферация мелких лимфоидных клеток в слизистой оболочке желудка. В-клеточная линия. Окраска гематоксилином и эозином, х 200
Фолликулярный рост лимфоидной ткани означает В-клеточную природу опухолевого или гиперпластического процесса, поэтому для установления диагноза в иммуногистохимическом исследовании с антителами к В-линейным антигенам, строго говоря, нет необходимости. Опухолевые фолликулы при фолликулярных лимфомах обнаруживаются во всех анатомических зонах исследуемой ткани. Фолликулы чаще имеют однообразную форму и примерно одинаковые размеры, чем отличаются от реактивных фолликулов при гиперпластических процессах в лимфатических узлах. Вообще, при поражении лимфатического узла фолликулярной лимфомой, основная задача, которая стоит перед морфологом – это дифференциальная диагностика опухолевого процесса от реактивного лимфаденита. Опухолевые фолликулы имеют ряд отличий от реактивных. Опухолевые фолликулы не окружает слой малых лимфоцитов, называемый зоной мантии. Четкие концентрические слои малых лимфоидных клеток – признак, характерный для гиперпластического процесса. Центроциты и центробласты образуют довольно однородную смесь и для опухолевых фолликулов поляризация строения нехарактерна. Митотическая и пролиферативная (Ki,67) активность клеток фолликулярной лимфомы обычно невелика, почти всегда она меньше, чем в реактивных фолликулах.
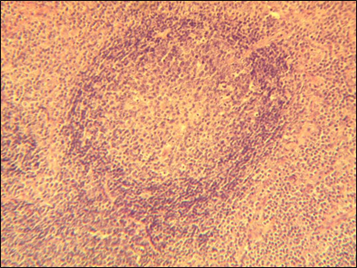
Рис. 4. Опухолевый лимфоидный фолликул. Окраска гематоксилином и эозином, х 100
Диффузная полиморфноклеточная опухолевая лимфоидная пролиферация при первичной локализации в лимфатических узлах в большинстве случаев связана с Т-клеточной лимфомой. Вполне специфичными для предварительного гистологического диагноза следует считать следующие морфологические признаки принадлежности лимфом полиморфноклеточного строения к Т-клеточному типу:
1) диффузный характер роста лимфомы с поражением в начальных стадиях развития опухоли паракортикальной зоны;
2) гнездный вид расположения опухолевых клеток с образованием групп, разделенных тонкими пучками коллагеновых волокон,
3) широкие вариации размеров и формы ядер, отсутствие клеток с расщепленными ядрами,
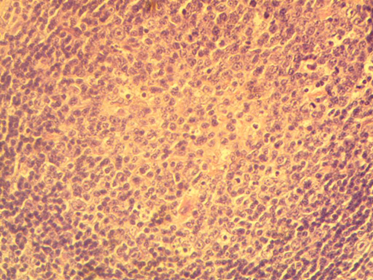
Рис. 5. Диффузная полиморфноклеточная опухолевая инфильтрация при Т-клеточной лимфоме в ткани лимфатического узла. Окраска гематоксилином и эозином, х400
Следует помнить, что в некоторых случаях особенности гистологического строения опухоли лимфоидной ткани, неоднозначность результатов, полученных в результате иммунофенотипирования или аберрантный иммунофенотип опухолевых клеток, делают невозможной верификацию диагноза лимфомы.
Агрессивные и индолентные лимфомы
Хотя конкретные подтипы могут иметь свои особенности, практически у всех подформ индолентных лимфом есть много общих черт. Могут развиваться признаки кишечной непроходимости вследствие внутрибрюшной лимфаденопатии; забрюшинная локализация конгломерата лимфатических узлов может проявляться в виде обструктивной уропатии. Поражение паховых ЛУ может вызывать компрессию венозной системы с тромбозом глубоких вен. Экстранодальные проявления возникают часто и могут поразить любой орган. Симптомы могут быть неспецифическими или связанными с вовлечением той или иной зоны. У многих пациентов индолентная лимфома протекает бессимптомно.
Агрессивные формы лимфом отличаются, напротив, быстрым течением и генерализацией, неблагоприятными прогнозами.
Наиболее распространенными вариантами агрессивных лимфом являются диффузная В-крупноклеточная, мантийноклеточная, первичная медиастинальная. Клиническая симптоматика агрессивных лимфом зависит от локализации патологического процесса, морфологической формы опухоли и клинической стадии заболевания. Соответственно, клинические проявления индолентных и агрессивных лимфом могут не отличаться. Таким образом, гистологическое и иммуногистохимическое исследования являются обязательными в алгоритме обследования пациентов с подозрением на лимфопролиферативное заболевание.
1. Лимфопролиферативные заболевания являются часто встречающимися у мелких домашних животных, имеют полиморфную клиническую картину и разнообразную симптоматику,
2. Лимфомы различаются по морфологическому строению и иммунофенотипу, что находит отражение в скорости распространения опухолевого процесса, течении и прогнозировании заболевания,
3. Лимфомы условно разделяют на агрессивные и индолентные, отличающиеся по характеру течения и прогнозам,
4. Для диагностики лимфом необходимо применение гистологического и иммуногистохимического исследования, поскольку гистологический метод является специфическим только для некоторых морфологических вариантов лимфом.
1. К. Hittmairand coil. - Feline alimentary lymphosarcoma. The European Journal of companion animal practice. Vol.XI-(2)-October 2001.
2. David M. Vail, E. Gregory Mac Ewen.- Feline lymphoma and leukemia.- Small animal clinical oncology, 2001.
3. Hans Lutz and Regina Hofman.- Feline leukemia virus infection, pathogenesis, diagnosis and vaccination.- 47. Annual Congress of the FK-DVG, 2001.
5. Петров СВ, Райхлин НТ Руководство по иммуногистохимической диагностике опухолей человека, 4-е изд., Казань, 2012.
Иммунофенотип
Одной из основных черт анапластической крупноклеточной лимфомы (АККЛ) является экспрессия CD30 (КМ)-молекулы. CD30 является 120 kDa трансмембранным цитокиновым рецептором из семейства рецепторов фактора некроза опухоли TNF), для которого был установлен лиганд (CD30L).
Растворимая 85 kDa-форма CD30 вырабатывается мембраносвязанной молекулой путем протеолитического распада и может быть обнаружена в больших концентрациях в сыворотке крови пациентов.
В крупных анапластических опухолевых клетках экспрессия CD30 ограничена мембраной, цитоплазмой и точечной (гранулярной) реакцией (dot-like) в области аппарата Гольджи.
В мелкоклеточном варианте только крупные анапластические клетки (чаще сосредоточенные около сосудов) проявляют положительную экспрессию CD30, в то время как мелкие опухолевые клетки чаще являются слабопозитивными или негативными на CD30.
Воспроизводимость диагноза АККЛ по морфологическим признакам составляет 46% и может быть увеличена до 85% при иммунном окрашивании на CD30, и, тем не менее, именно иммунные реакции на CD30 должны всегда проводиться параллельно с определением наличия прочих лимфоидных и нелимфоидных маркеров, потому что экспрессия CD30 не является специфической чертой только АККЛ и наблюдается в нормальных активированных клетках других В- и Т-клеточных лимфоидных и нелимфоидных опухолей, а также при негемопоэтических злокачественных заболеваниях, некоторых карциномах и новообразованиях из герминогенных клеток.
Однако при анапластической крупноклеточной лимфоме характерным является выраженная, интенсивная реакция на CD30 в подавляющем большинстве клеток. Другие неоплазмы могут также характеризо-ваться положительной СР30-реакцией, но обычно менее интенсивной и гетерогенной.
Положительная экспрессия эпителиально-мембранного антигена (ЕМА) наблюдается более чем в 50% случаев АККЛ, хотя в некоторых случаях экспрессия положительна только в части опухолевых клеток. Опыт многих работ показал, что экспрессия EMA при АККЛ чаще наблюдается у детей и молодых пациентов и сочетается с благоприятным прогнозом.
В настоящее время ИВХ-реакцию на определение экспрессии ALK-белка принято считать наиболее специфичным диагностическим методом.
Современная усовершенствованная генная технология продемонстрировала аномальную экспрессию кластерина (clusterin) при системных АККЛ и ее отсутствие при кожных формах. Наличие кластерина не коррелирует с экспрессией АLК-белка, что характерно для экспрессии BCL-2 и с-Мус. Было установлено, что экспрессия BCL-2 возможна в основном при АLК-негативных вариантах, а ядерная экспрессия с-Мус, напротив, у АLК-позитивных анапластических крупноклеточных лимфом, что позволяет заключить, что наличие АLК-белка может оказывать влияние на индукцию апоптоза при АККЛ.
Системные АККЛ имеют два главных иммунофенотипа: Т- и О-клеточный. Большинство случаев имеют Т-клеточное происхождение, что подтверждается экспрессией одного или нескольких Т-клеточных антигенов. АККЛ О-клеточного фенотипа, возможно, принадлежит к Т-клеточному фенотипу, так как опухолевые клетки обычно экспрессируют цитотоксические молекулы: перфорин, гранзим В (granzyme) и Т1А-1.
Кожная анапластическая крупноклеточная лимфома характеризуется Т-фенотипом, но при этом отличается от системной формы, так как всегда АLK-негативна и обычно не экспрессирует ЕМА и цитотоксические молекулы.
Молекулярно-генетическая характеристика анапластической крупноклеточной лимфомы
По данным мировой литературы, в 60-70% случаев АККЛ наблюдается t(2;5)(q23q35), которая вызывает слияние гена ALK хромосомы 2 с геном NPM (нуклеофозмин) хромосомы 5. Следует отметить, что при периферических лимфопролиферациях в отличие от случаев, наблюдаемых при острых лейкозах, хромосомная транслокация, ведущая к появлению гибридных генов, редка.
Дикий тип NPM-гена отвечает за кодирование филогенетически-консервированного и повсеместно проявляемого 37 kDa кислотного фосфобелглавных аргирофильных нуклеолярных (ядрышковых) белков (AgNOR ядрышек). Основной функцией NPM является перенос только что синтезированных белков в ядрышко. Для выполнения этой функции необходимы домен олигоомеризации N-концевой области и два ядерных сигнала в С-конечной области.
Область ядрышковых организаторов (ОЯОР) представляет собой участок вторичных перетяжек акроцентрических хромосом, где локализованы гены, кодирующие рибосомную РНК (рРНК), и формируется ядрышко непосредственно после деления клетки. С ОЯОР ассоциированы кислые негистоновые аргирофильные белки, регулирующие процесс синтеза рРНК и образование рибосом. Среди аргирофильных белков ОЯОР наиболее охарактеризованы РНК-полимераза I, белки С23 (нуклеолин) и В23 (нуклеофозмин).
Аргирофильные свойства ассоциированных с областью ядрышковых организаторов кислых негистоновых белков используются при выявлении ОЯОР при помощи нитрата серебра. Образующиеся при этом гранулы серебра являются маркерами ОЯОР. Показано, что нитратом серебра выявляются транскрипционно активные ОЯОР, и в этой связи степень аргирофилии ядрышковых структур может рассматриваться как цитохимический эквивалент функциональной активности рибосомных генов. Аргирофильные белки играют важную роль в регуляции клеточного цикла, определяя его продолжительность.
При исследовании различных опухолей было выявлено повышение содержания в них белков области ядрышковых организаторов по мере прогрессирования злокачественного процесса. При этом, как было показано экспериментальными исследованиями, наблюдаемое повышение содержания белков ОЯОР происходит не в результате синтеза новых белков этого класса, а в результате усиленного синтеза белков ОЯОР — С23 и В23. Эти результаты позволили рассматривать активность области ядрышковых организаторов как один из критериев разграничения доброкачественных и злокачественных новообразований, выявления опухолей высокой и низкой степени злокачественности, определения прогноза.
ALK-ген дикого типа кодирует крупный, гликилизированный, 200 kDa трансмембранный рецептор, ближе всего связанный с Ltk (лейкоцитотирозинкиназа), для которого соответствующий лиганд до сих пор не установлен и его обычная функция не определена.
Местонахождение ALK-гена дикого типа в нормальных тканях ограничено поверхностной мембраной и цитоплазмой. Внутрицитоплазматический конец ALK несет тирозинкиназа каталитической области, которая физиологически активируется в результате гомодимеризации и связывания лигандов.
Как следствие t (2;5) часть гена NPM, кодирующая аминоконечную область NPM (аминокислоты 1-116), сливается с частью гена ALK, кодирующей всю цитоплазматическую область белка ALK (последние 563 аминокислоты ALK) (рис. 1). В результате ген ALK попадает под контроль промотера NPM, что в свою очередь ведет к перманентному и повсеместному считыванию кода гибридного NPM-ALK-гена и получению 80 kDа рекомбинантного белка, обозначаемого NPM-ALK, или р80 (рис. 1).

Рис. 1. Молекулярная структура нуклеофозмина (NPM), киназы анапластической лимфомы и гибридных форм ALK.
Рекомбинантный белок NPM-ALK способен образовывать гомодимеры (путем перекрещивания с NPM дикого типа). Образование гомодимеров ведет к конституционной активации каталитической области ALK путем имитации рецепторной димеризации и активации. In vitro трансфекция NPM-ALK в клеточные линии мышей/крыс ведет к формированию трансформированного фенотипа. Мало известно о сигнальных путях, по которым NPM-ALK оказывает онкогенное действие.
Фосфолипаза С-у, по всей видимости, является важной мишенью для NPM-ALK. На самом деле этот гибридный белок может связываться in vitro с областями SH2 фосфолипазы С-у, что ведет к ее тирозинфосфорилированию и активации с последующей трансдукцией митогенных сигналов. NPM-ALK, вероятно, связан с фосфатидилинозитом (PI-3K) и производит конститутивную активацию путей антиапоптозной PI-3-киназы/ALK.
Менее ясной представляется роль взаимодействий NPM-ALK и других сигнальных молекул, а именно STAT5 и внутриклеточной областью CD30. In vitro NPM-ALK также связывается с Shc и субстратом инсулинового рецептора (insulin receptor substate 1, IRS-1), но эти взаимодействия не являются необходимыми для трансформации. Наконец, полученные противоречивые сведения, которые свидетельствуют о прямой подаче сигнала от NPM-ALK к соединительному белку GRB2, но в то же время у NPM-ALK не было найдено области, отвечающей за распознавание GRB2.
Онкогенные свойства NPM-ALK in vivo подтверждаются экспериментальными данными, показывающими, что инфузия мышиных гемопоэтических клеток с трансфекцией NPM-ALK ведет к развитию лимфом. В то же время эти мышиные лимфомы имеют В-клеточное происхождение и, очевидно, отличаются от ALK-положительной лимфомы, развивающейся у людей, Т- и О-типа.
Эти данные наводят на мысль о том, что активация одного и того же тирозинкиназасигнального пути может, с одной стороны, носить онкогенный характер в различных типах клеток, а с другой — свидетельствовать о взаимодействии NPM-ALK с широким диапазоном опухолевых молекул.

Рис. 2. Молекулярные механизмы взаимодействия NPM-ALK.
Для обнаружения NPM-ALK транслокаций в тканевых срезах существует несколько методов: PCR, метод in situ гибридизации, флюоресцентная in situ гибридизация (FISH). Так как при использовании метода PCR возможны артефакты и его применение требует высококачественного RNA, а FISH занимает много времени, иммуногистохимическое исследование, с практической точки зрения, является наиболее удобным и широко используемым методом, так как оно имеет строго определенные показания и легкое исполнение, недорого и дает быстрый результат.
Более того, этот метод позволяет использовать архивный, залитый в парафин материал, что дает возможность судить о природе меченых клеток и архитектонике тканей, а также определять молекулярные варианты АККЛ, которые несут гибридные гены, отличные от NPM-ALK, и не распознаются с помощью PCR.
Поликлональные и с недавних пор крайне специфические моноклональные антитела, направленные против фиксатор-резистентных эпитопов цитоплазматической области ALK, т.е. антитела ALK1 и ALKc, а также антитела против N-концевой области NPM, стали доступными для оптимального иммуногистохимического (ИГХ)-распознавания этих белков в парафиновых срезах. В отличие от копий NPM-ALK и ATIC-ALK, распознающихся с помощью PCR даже в низком содержании в обычных и реактивных лимфоидных тканях, белок ALK не экспрессируется в нормальных тканях, за исключением некоторых клеток нейрогенного происхождения.
Поэтому присутствие ALK-белка при проведении ИГХ-анализа в тканях, отличных от тканей мозга, является свидетельством аномального проявления ALK, обычно в форме связанного с t(2;5) химерного белка NPM-ALK. ИГХ-свидетельство молекулярной связи распознанного ALK c NPM находится в субклеточном распределении белка ALK, который в случае t(2;5) можно увидеть не только в цитоплазме, но и в ядре.
Около 15-20% ALK-позитивной AKKA дают неожиданный для t(2;5) ИГХ-рисунок в виде ограниченной цитоплазмой экспрессии ALK и ограниченной ядром экспрессии NPM (N-конец) (рис. 3). На основании этих результатов были высказаны предположения о существовании молекулярных вариантов AKKA, при которых в качестве партнера при слиянии с ALK выступает ген, отличный от NPM, и это приводит к возникновению иных гибридных белков ALK.

Рис. 3. Экспрессия различных гибридных белков ALK.
Возможность того, что отличные от NPM гены могут вступать в контакт с геном ALK и приводить к появлению отличных от NPM-ALK рекомбинантных ALK-белков, была высказана в связи с наличием цитогенетических данных, показывающих, что при AKKA ген ALK 2p23 присутствует в генетических аномалиях, отличных от t(2;5), например t(1;2) (q21; p23), t(2;3)(p23q21) и инверсии (p23;q35).
В настоящее время нет убедительного ответа на вопрос, представляется ли ALK-негативный вариант AККЛ отдельной нозологической единицей или является подвариантом неспецифицированной периферической T-клеточной лимфомы.
Ответ на этот вопрос может быть дан в результате детального изучения молекулярных механизмов лимфомагенеза. Для клинической практики патолог должен диагностировать анапластическую крупноклеточную лимфому согласно строгим критериям, описанным выше, определяя в каждом случае основное — является ли опухоль ALK-позитивным или ALK-негативным вариантом, поскольку высказываются мнения о прогностическом значении этого феномена.
ALK-позитивная АККЛ представляет собой широкий морфологический спектр — от мелкоклеточного до крупноклеточного варианта АККЛ. Ядерная ALK-экспрессия — признак транслокации (2;5) — мелких и крупных клеток опухоли является доказательством, что они принадлежат к одному и тому же неопластическому клону. В некоторых случаях трансформация мелкоклеточного варианта в анапластической крупноклеточной лимфоме классического типа связана с приобретением дополнительной хромосомной аномалии, вовлекающей половую хромосому и хромосомы 6, 7, 9 и 15.
И.В. Поддубная, А.А. Семенова, Н.А. Пробатова
2 Practical oncology Название опухоли Код Лимфома из клеток зоны мантии 9673/3 Диффузная крупноклеточная В-клеточная лимфома 9680/3 Медиастинальная крупноклеточная В-клеточная лимфома 9679/3 Внутрисосудистая крупноклеточная В-клеточная лимфома 9680/3 Первичная лимфома серозных полостей 9678/3 Лимфома Бёркитта 1 / 9687/3 1 лейкоз Бёркитта /3 2 В-клеточные лимфопролиферативные процессы с неопределенным опухолевым потенциалом Лимфоматоидный гранулематоз 9766/1 Посттрансплантационное лимфопролиферативное заболевание, полиморфноклеточное 9970/1 Т-клеточные опухоли Опухоли из предшественников Т-лимфоцитов Т-лимфобластный лейкоз 1 / 9837/3 1 лимфома из предшественников Т-клеток 2 (острый лимфобластный лейкоз из предшественников Т-клеток)9729/3 2 T- и NK-клеточные опухоли с фенотипом зрелых лимфоцитов Лейкозы и первично диссеминированные лимфомы Т-клеточный пролимфоцитрный лейкоз 9834/3 Т-клеточный лейкоз из крупных гранулярных лимфоцитов 9831/3 Агрессивный NK-клеточный лейкоз 9948/3 Т-клеточный лейкоз / лимфома взрослых 9827/3 Кожные лимфомы Грибовидный микоз 9700/3 Синдром Сезари 9701/3 Первичная кожная крупноклеточная анапластическая лимфома 9718/3 Лимфоматоидный папулёз 9718/1 Другие экстранодальные лимфомы Экстранодальная NK/T-клеточная лимфома, назальный тип 9719/3 Т-клеточная лимфома типа энтеропатии 9717/3 Гепатолиенальная Т-клеточная лимфома 9716/3 Панникулитоподобная Т-клеточная лимфома подкожной клетчатки 9708/3 Лимфомы лимфатических узлов Ангиоиммунобластная Т-клеточная лимфома 9705/3 Лимфома из клеток с иммунофенотипом периферических Т-лимфоцитов, неуточнённая 9702/3 Анапластическая крупноклеточная лимфома 9714/3 Опухоль неопределенной дифференцировки Бластная NK-клеточная лимфома 9727/3 Лимфома Ходжкина Лимфогранулематоз, нодулярный тип лимфоидного преобладания 9659/3 Классическая лимфома Ходжкина, нодулярный склероз 9663/3 Классическая лимфома Ходжкина, смешанно-клеточный вариант 9652/3 Классическая лимфома Ходжкина, с большим количеством лимфоцитов 9651/3 Классическая лимфома Ходжкина, с истощением лимфоидной ткани 9653/3 Морфологические особенности опухолей лимфоидной ткани (многообразие вариантов, сходство нормальных и опухолевых клеток, сходство некоторых гистологических вариантов лимфом, сходство реактивных процессов и опухолей лимфоидной ткани, неоднозначный или аберрантный иммунофенотип опухолевых клеток) определяют способы получения и исследования биопсийного материала. Материал для морфологического исследования лимфатического узла может быть получен с помощью аспирационной биопсии (взвесь клеток), пункционной биопсии (столбик ткани), открытой инцизионной биопсии (фрагмент лимфатического узла) и открытой эксцизионной биопсии (весь лимфатический узел или конгломерат лимфатических узлов). Тонкоигольная аспирационная биопсия увеличенного лимфатического узла позволяет провести цитологическую диагностику метастазов рака и получить материал для микробиологического исследования при инфекционных процессах. Однако цитологическое исследование пунктата при лимфопролиферативных заболеваниях не должно быть единственным методом диагностики. Из-за значительного морфологического сходства нормальных и опухолевых лимфоидных клеток и невозможности исследовать тканевую архитектонику в подавляющем большинстве случаев, с помощью цитологического 170 ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ Т. 5,
3 Practical oncology исследования не удается установить нозологический диагноз опухоли лимфоидной ткани. Диагноз опухоли лимфоидной ткани должен основываться на гистологическом и иммуногистохимическом исследовании биоптата, полученного при эксцизионной или инцизионной биопсии лимфатического узла. Иммуногистохимическое исследование опухолей лимфоидной ткани является методом выбора при необходимости дифференциальной диагностики опухолей с выраженным сходством гистологического строения [4]. Пункционная биопсия позволяет получить столбик ткани, размеры которого зависят от технических характеристик пункционной иглы. Объем биоптата может быть достаточным для гистологического исследования, цель которого подтвердить рецидив лимфомы или обнаружить трансформацию лимфомы в случаях ранее установленного диагноза. Пункционная биопсия, проводимая под контролем лучевых методов визуализации (УЗИ, рентгеновская компьютерная томография), в некоторых случаях бывает единственным способом получения фрагмента опухоли для гистологического исследования из труднодоступных мест (забрюшинное пространство и др.). Специфичность рутинных гистологических методов для дифференциальной диагностики внутри групп морфологически сходных лимфом в большинстве случаев недостаточна. Применение классификации ВОЗ опухолей лимфоидной ткани в практической работе обусловлено возможностью использования иммуногистохимического метода. С целью дифференциальной диагностики необходимо выбрать рациональный состав панели иммунологических маркеров (антител), который позволяет различить гистологически сходные варианты лимфом между собой [1]. Общие принципы иммуногистохимического исследования в диагностике лимфом предусматривают применение в каждом случае панели антител (набор, составленный в соответствии с диагностической гипотезой, возникшей в результате рутинного гистологического исследования биоптата), а не одного какого-либо антитела, и учете комбинации позитивных и негативных результатов реакции в соответствии с известной информацией о морфологическом строении опухоли и иммунофенотипе опухолевых клеток [2]. В основе гистологического исследования биопсий лимфатических узлов, как и всех других органов и тканей, лежит детальное исследование тканевой структуры (архитектоники) и клеточного состава биоптата [3]. Гистологическое исследование препаратов, окрашенных гематоксилином эозином или азур II эозином, позволяет отнести исследуемую опухоль лимфоидной ткани к одной из групп лимфом, объединенных выраженным морфологическим сходством. Признаки, объединяющие лимфомы в группы сходного гистологического строения: 1) пролиферация бластных клеток, 2) диффузная пролиферация мелких клеток, 3) диффузная пролиферация крупных клеток, 4) фолликулярный рост лимфоидной ткани, 5) нодулярный характер роста опухолевой ткани, 6) анапластическая морфология лимфоидных клеток, 7) диффузная полиморфноклеточная лимфоидная пролиферация, 8) лимфогранулематозоподобное строение опухоли. Диффузная пролиферация лимфоидных клеток с бластной морфологией характеризуется замещением ткани лимфатического узла довольно однообразным пролифератом из клеток среднего размера (в 1,5 2 раза больше ядра малого лимфоцита). Ядра этих клеток округлые, правильной формы или с неровными, иногда зазубренными контурами. Цитоплазма может быть различима в виде узкого сероватого ободка. Много фигур митозов. Ключевым признаком, определяющим бластную морфологию опухолевых клеток, является строение ядра. Гетерохроматин в ядрах имеет однородное пылевидное, зернистое или мелкоглыбчатое строение. В некоторых случаях отчетливо видно сетчатое и нежно петлистое строение хроматина, имеющего вид тонких нитей. Гетерохроматин равномерно распределен по всему объему ядра. Ядра содержат 1 3 небольших полиморфных ядрышка. В отдельных случаях бласты могут содержать в ядрах довольно грубый хроматин в виде мелких глыбок, несколько отличающихся своими размерами, хроматин может быть распределен с увеличением его количества возле ядерной мембраны. К опухолям подобного строения относятся лимфобластные лимфомы из клеток-предшественников В-лимфоцитов, лимфобластные лимфомы из клеток-предшественников Т-лимфоцитов и бластоидный вариант лимфомы из клеток зоны мантии. Гистологическое исследование не позволяет дифференцировать лимфобластные лимфомы, отличающиеся своей принадлежностью к В- или Т-клеточной линии. Характерным отличием бластоидного варианта лимфомы из клеток зоны мантии является довольно отчетливая зазубрина в ядре опухолевых клеток или даже глубокая щель, что нехарактерно для лимфобластных лимфом. Клетки лимфобластных лимфом в некоторых случаях, особенно в биоптатах опухоли средостения, образуют своеобразные параллельные ряды клеток, разделенные едва различимыми пучками коллагеновых волокон. Лимфобластные лимфомы из клеток-предшественников В-лимфоцитов обнаруживают цитоплазматическую экспрессию пан-в-клеточного антигена CD79α, значительно реже экспрессируется другой пан-в-клеточный антиген CD20, поэтому в составе дифференциально-диагностической панели предпочтение следует отдать антителам к CD79α. Бластоидный вариант лимфомы из клеток зоны мантии также характеризуется экспрессией CD79α. Лимфобластные лимфомы из клеток-предшественников Т-лимфоцитов в подавляющем большинстве случаев демонстрируют интенсивное цитоплазматическое окрашивание с антителами к пан-т-клеточному антигену CD3, экспрессия другого пан-т-клеточного анти- ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ Т. 5,
5 Practical oncology Опухолевые фолликулы при фолликулярных лимфомах обнаруживаются во всех анатомических зонах лимфатического узла. Фолликулы чаще имеют однообразную форму и примерно одинаковые размеры, чем отличаются от реактивных фолликулов при гиперпластических процессах в лимфатических узлах. Опухолевые фолликулы могут располагаться так тесно, что деформируют друг друга и приобретают отчасти полигональную форму. Тем не менее, между фолликулами в фолликулярной лимфоме практически всегда удается различить более или менее выраженную Т-зону, которая содержит малые лимфоциты, посткапиллярные венулы. Тщательное исследование под большим увеличением межфолликулярных пространств в фолликулярных лимфомах позволяет всегда обнаружить там центроциты мелкие угловатые клетки, которые в норме не обнаруживаются вне лимфоидных фолликулов, и крупные лимфоидные клетки с признаками атипии в виде ядер с глубокими вдавлениями и неправильными контурами ядра. Опухолевые фолликулы не окружает слой малых лимфоцитов, называемый зоной мантии. Четкие концентрические слои малых лимфоидных клеток признак, характерный для гиперпластического процесса. Центроциты и центробласты образуют довольно однородную смесь и для опухолевых фолликулов поляризация строения нехарактерна. Митотическая и пролиферативная (Ki-67) активность клеток фолликулярной лимфомы обычно невелика, почти всегда она меньше, чем в реактивных фолликулах. Макрофаги в ткани фолликулярной лимфомы почти не фагоцитируют, тогда как в реактивных светлых центрах размножения фолликулов легко обнаружить фагоцитоз обломков ядерного вещества. Внеклеточные белковые эозинофильные депозиты тоже редко обнаруживаются в опухолевых фолликулах, что отличает лимфому от реактивных изменений. Если при иммуногистохимическом исследовании с помощью антител к легким цепям иммуноглобулинов удается обнаружить экспрессию клетками фолликулярных центров только одного какого-либо типа цепей (только каппа- или только лямбда-цепей), то процесс считают моноклональным и почти наверняка опухолевым. Применение этого метода сильно ограничивает выраженное фоновое окрашивание, обусловленное иммуноглобулинами тканевой жидкости. Частота обнаружения экспрессии BCL-2 протеина в фолликулярных лимфомах из крупных клеток (III степень) приближается к 76%, в лимфомах из мелких и крупных клеток (II степень) к 86% и в лимфомах из мелких клеток (I степень) к 100%. В нормальных В-клетках зародышевых центров отсутствует экспрессия протеина BCL-2. Нодулярный (узловатый) тип роста опухолевой ткани создает в лимфоме относительно однообразные шарообразные структуры из стромальных элементов. Пространственная организация узлов может быть подчеркнута при выявлении стромы опухоли, в одних случаях это характерное строение ретикулинового каркаса (импрегнация солями серебра), в других сеть из фолликулярных дендритических клеток (экспрессия CD21, CD23). Нодулярные структуры могут обнаруживаться в лимфоме из клеток зоны мантии, в В-клеточных лимфомах маргинальной зоны, в лимфоцитарной лимфоме и, по определению, в лимфогранулематозе с нодулярным типом лимфоидного преобладания. Принципиальным отличием лимфогранулематоза с нодулярным типом лимфоидного преобладания от всех других лимфом с нодулярным характером роста является клеточный состав лимфоидной ткани в узлах: при лимфогранулематозе это массив неопухолевых лимфоидных клеток, гистиоцитов и малочисленные разрозненные крупные опухолевые клетки, а в лимфоме из клеток зоны мантии, в В-клеточных лимфомах маргинальной зоны и лимфоцитарной лимфоме это опухолевые В-клетки и незначительное количество клеток реактивного компонента. Такое различие позволяет определить две ветви дифференциальной диагностики. Одно направление будет соответствовать анализу опухолевой ткани в соответствии с цитологическим составом и иммунофенотипом В-клеточных лимфом из мелких лимфоидных клеток, а другое направление будет нацелено в первую очередь на изучение структуры и фенотипа крупных опухолевых клеток (L&H варианта клеток Березовского Штернберга Рид) и во вторую их микроокружения. Для решения о направлении дифференциальной диагностики целесообразно иммуногистохимическое исследование разбить на два этапа. На первом этапе следует применить антитела к пан-т- и пан-в-клеточным антигенам (CD3 и CD20). Если в результате будут обнаружены крупные клетки с атипичными ядрами многодольчатого строения и экспрессией на клеточной мембране CD20, часто окруженные кольцом малых Т-лимфоцитов, то дальнейшее исследование должно быть направлено на подтверждение диагноза лимфогранулематоза с нодулярным типом лимфоидного преобладания и исключение классических форм лимфогранулематоза (СD30, EMA, CD57). Альтернативное направление дифференциальной диагностики выбирают, если обнаруживаются опухолевые узловатые структуры из мелких В-клеток (CD5, CD10, CD23, CyD1). Обнаружение хотя бы одной нодулярной структуры характерного строения в ткани, имеющей в остальном диффузный тип роста, исключает диагноз В-клеточной лимфомы с большим количеством Т-клеток. Диффузная полиморфноклеточная опухолевая лимфоидная пролиферация при первичной локализации в лимфатических узлах в большинстве случаев связана с ангиоиммунобластной Т-клеточной лимфомой или лимфомой из клеток с иммунофенотипом периферических Т-лимфоцитов, неуточнённой. Экстранодальная первичная локализация лимфомы полиморфноклеточного строения характерна для экстранодальной NK/ T-клеточной лимфомы назального типа, подкожной пан- ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ Т. 5,
Читайте также:

