Идо что это при раке
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами - антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
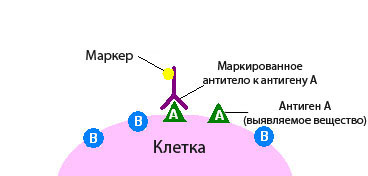
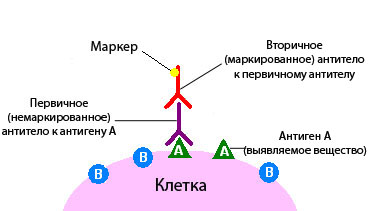
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR - протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны - эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от 0 до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu - это рецептор эпидермального фактора роста раковой клетки. Это - ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.

Ki-67 - это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот - чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 - это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке - активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется - индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.

VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF - для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Способность к инвазивному росту — одно из ключевых свойств злокачественных новообразований, которое отличает их от доброкачественных. Это означает, что опухоль способна прорастать в окружающие ткани. Таким образом, инвазивный рак молочной железы — это такой, который распространяется глубже, за пределы того места, где изначально появились опухолевые клетки. Согласно статистике США, это заболевание возникает в течение жизни у каждой восьмой женщины.
Сначала опухоль прорастает в соседние ткани, следующим этапом будет распространение в близлежащие (регионарные) лимфатические узлы и рост отдаленных метастазов. Чем раньше установлен диагноз, тем выше шансы на успешное лечение и вероятность наступления ремиссии.
- Причины инвазивного рака
- Классификация
- Стадии инвазивного рака
- Симптомы
- Диагностика
- Биомаркеры
- Особенности протекания заболевания у мужчин
- Особенности протекания заболевания у беременных женщин
- Лечение
- Реабилитация
- Прогноз и профилактика рака молочной железы
Причины инвазивного рака
Точные причины возникновения злокачественных опухолей в молочной железе неизвестны. Клетка становится раковой из-за некоторых мутаций, но почему они возникли в каждом конкретном случае — точно сказать нельзя. Известны лишь некоторые факторы риска, повышающие вероятность развития заболевания:
- Женский пол. У мужчин заболевание тоже встречается, но гораздо реже.
- Возраст. Чем старше женщина, тем выше ее риски.
- Наследственность. Вероятность заболеть повышена, если у женщины есть близкие родственницы (мать, сестры, дочери), у которых уже диагностирован рак молочной железы.
- Генетические дефекты. Например, риск рака молочной железы повышается при мутациях в генах BRCA1, BRCA2.
- Лишний вес, ожирение.
- Позднее менархе.
- Ранняя менопауза.
- Отсутствие беременностей.
- Поздние первые роды. Риски повышены у женщин, которые родили первого ребенка после 30 лет.
- Употребление алкоголя.
- Заместительная гормональная терапия после менопаузы.
Ни один из этих факторов не приведет к болезни со стопроцентной вероятностью. Каждый из них лишь в той или иной степени повышает риск. Женщина может заболеть раком, даже если у нее нет ни одного фактора из этого списка — но с более низкой вероятностью.
Классификация
Примерно в 90% случаев инвазивные злокачественные опухоли молочной железы представлены одним из двух типов:
- Протоковая карцинома (инфильтрирующий протоковый рак) — наиболее распространенный тип, составляет 70–80% случаев. Злокачественное новообразование начинает расти в молочных протоках и затем распространяется глубже.
- Дольковая карцинома представлена в 10% случаев. Она развивается из клеток долек в молочной железе, которые в период грудного вскармливания вырабатывают молоко.
Иногда встречаются смешанные варианты, они сочетают одновременно черты протоковой и дольковой карциномы. Реже новообразование бывает представлено медуллярной (1–5% случаев), муцинозной (1–6%), трубчатой (2%) карциномой и другими гистологическими типами.

Стадии инвазивного рака
Злокачественные опухоли молочной железы классифицируют в соответствии с общепринятой системой TNM, где буква T обозначает особенности первичной опухоли в груди, N — ее распространение в регионарные лимфоузлы, M — отдаленные метастазы. В зависимости от разных сочетаний показателей T, N и M, инвазивные новообразования в груди относят к одной из четырех стадий:
- Стадия I — небольшая опухоль без очагов в лимфоузлах (IA), либо опухоль не более 2 см и очаг в лимфатическом узле не более 2 мм (IB).
- Стадия II — опухоль до 2 см, распространившаяся в подмышечные узлы (IIA, IIB), либо опухоль не более 5 см, не распространившаяся в лимфатические узлы (IIC).
- Стадия III — опухоль, которая распространилась на большее число лимфатических узлов, проросла в грудную стенку, привела к изъязвлению на коже молочной железы. Выделяют подстадии IIIA, IIIB и IIIC.
- Стадия IV — имеются отдаленные метастазы.
Стадию заболевания оценивают по данным обследования и биопсии. Кроме того, можно определить степень дифференцировки опухолевых клеток, то есть насколько они отличаются от нормальных. Степень дифференцировки обозначают буквой G с соответствующей цифрой:
- G1 означает, что опухолевая ткань сильно напоминает нормальную. В таком случае она будет менее агрессивной.
- Инвазивный неспецифицированный рак молочной железы G2 уже существенно отличается от здоровой ткани. Он быстрее растет и распространяется в организме.
- G3 — это низкая степень дифференцировки. Такие опухоли наиболее агрессивны.
Симптомы
На ранних стадиях симптомы обычно отсутствуют. По мере прогрессирования рака женщина может заметить следующие патологические изменения со стороны молочных желез:
Диагностика
Если во время осмотра врач обнаружил признаки рака в молочной железе, первым делом он назначит ультразвуковое исследование или маммографию. Это поможет обнаружить новообразование, предварительно оценить, является ли оно инвазивной опухолью (раком).
Далее проводят биопсию: получают фрагмент патологически измененной ткани и отправляют в лабораторию для гистологического, цитологического исследования. Биопсия позволяет установить диагноз с высокой точностью. Кроме того, можно провести молекулярно-генетический анализ: он поможет понять, какие мутации произошли в опухолевой клетке и какие препараты будут эффективны в данном случае.
Молекулярно-генетическое исследование позволяет назначить персонализированную терапию, то есть такую, которая будет оптимальна для конкретной женщины, с учетом особенностей ее опухоли. Это особенно актуально на поздних стадиях рака, когда не помогают классические протоколы лечения. Благодаря сотрудничеству с ведущими зарубежными лабораториями, в Европейской онкологической клинике может быть выполнен такой анализ.
Далее, когда точно установлено, что образование в молочной железе является раком, нужно разобраться, насколько инвазивная опухоль успела распространиться в организме за пределами молочной железы. Для этого проводят следующие исследования:
- КТ, МРТ.
- ПЭТ-сканирование.
- Рентгенография грудной клетки.
- Радиоизотопное исследование костей.
- УЗИ печени, органов брюшной полости.

Биомаркеры
Биомаркерами называют вещества, с помощью которых можно оценить характеристики злокачественной опухоли, разобраться, почему клетки стали раковыми, и на какие препараты они будут реагировать. При инвазивном раке молочной железы определяют следующие разновидности биомаркеров:
- Наличие на опухолевых клетках рецепторов к гормонам. При ER-позитивном раке определяются рецепторы к женским половым гормонам — эстрогенам, при PR-позитивном — к прогестерону. В данном случае рост опухоли зависит от гормональных эффектов, и в качестве метода противоопухолевого лечения будет эффективна гормональная терапия.
- Уровень HER2 — белка-рецептора, который находится на поверхности опухолевых клеток и стимулирует их быстрое размножение. Если активность HER2 повышена, то ожидается, что при таком раке будут эффективны определенные противоопухолевые препараты. Если результат анализа на гормоны и HER2 отрицательный, то такой рак называют тройным негативным. Он плохо реагирует на лечение и ведет себя более агрессивно.
- Исследование экспрессии (активности) некоторых генов. Такой анализ помогает выявить женщин, которым потребуется курс химиотерапии после хирургического лечения, прогнозировать риск рецидива рака I–II стадии после завершения курса лечения.

Особенности протекания заболевания у мужчин
Вероятность развития инвазивного рака молочной железы есть не только у женщин, но и у мужчин. Но распространенность патологии среди представителей мужского пола намного ниже. Риск развития рака груди у мужчины в течение жизни составляет 1:1000. Как правило, заболевание встречается после 65 лет и протекает более благоприятно, чем у женщин. Выше пятилетняя выживаемость.
Чаще всего инвазивная злокачественная опухоль в груди у мужчины проявляется в виде безболезненного узла. Реже встречаются такие симптомы, как изменение внешнего вида соска, выделения из него, язвы и другие изменения на коже.
Особенности протекания заболевания у беременных женщин
Принципы лечения инвазивного рака молочной железы во время беременности те же, что и у небеременных женщин. Но это более сложная задача, потому что некоторые препараты и процедуры могут нанести вред будущему ребенку.
Хирургическое вмешательство может быть выполнено на любом сроке беременности. Анестезия несет некоторые риски для плода, но зачастую они оправданы. Если инвазивная опухоль молочной железы обнаружена на ранних сроках беременности, то обычно выполняют мастэктомию — молочную железу удаляют полностью. После частичной резекции обычно требуется химиотерапия, лучевая терапия.
Химиотерапия возможна только во втором и третьем триместрах беременности. В первом триместре она нанесет вред будущему ребенку. Если женщине требуется активное лечение, может встать вопрос о прерывании беременности.
Лучевая терапия, таргетная и гормональная терапия у будущих мам практически не применяются, потому что они могут нанести вред плоду.
Лечение
Программа лечения при раке в молочной железе зависит от стадии, типа, степени агрессивности злокачественного новообразования, а также от общего состояния женщины, наличия у нее сопутствующих заболеваний, ее личных предпочтений. Проводят хирургические вмешательства, применяют различные типы химиопрепаратов, таргетные, гормональные препараты, лучевую терапию.
Химиопрепараты назначают до операции (неоадъювантная химиотерапия), после хирургического вмешательства (адъювантная химиотерапия) или в качестве основного вида лечения при раке на поздних стадиях. В последнем случае лечение носит паллиативный характер, то есть направлено не на достижение ремиссии, а на уменьшение размеров опухоли, замедление прогрессирования заболевания, продление жизни.
На ранних стадиях, когда опухоль находится только в молочной железе и не распространяется на другие части тела, может быть выполнена радикальная операция. Существует два типа хирургических вмешательств:
- Мастэктомия — когда молочную железу удаляют полностью.
- Органосохраняющая операция (секторальная резекция, лампэктомия) — удаление части молочной железы. Зачастую такие вмешательства более предпочтительны, так как они позволяют сохранить внешний вид груди и не несут повышенного риска рецидива (если после операции есть возможность провести курс лучевой терапии). Решение в каждом случае принимают индивидуально.
После удаления опухоли можно провести реконструктивно-пластическое вмешательство, направленное на восстановление внешнего вида груди. Иногда его можно выполнить сразу, иногда нужно отложить на некоторое время.
При раке на поздних стадиях радикальное хирургическое лечение, как правило, невозможно. Проводят паллиативные операции, направленные на уменьшение болей и других симптомов, удаление отдельных метастазов, устранение сдавления спинного мозга, механической желтухи, при прорастании опухоли в кожу с образованием язв, ран.

Лучевую терапию применяют для лечения опухолей в молочной железе до операции (неоадъювантная лучевая терапия), после хирургического вмешательства (адъювантная), а также на поздних стадиях, когда имеются метастатические очаги в различных частях тела. Применяют облучение из внешнего источника, а также брахитерапию — когда источник излучения в виде небольших гранул помещается прямо в опухолевую ткань или рядом с ней.
Около 2/3 злокачественных новообразований в молочной железе являются гормонально-позитивными. В таких случаях эффективна гормональная терапия. Обычно ее назначают после операции, чтобы снизить риск рецидива, в некоторых случаях — до хирургического лечения. Суть лечения в том, чтобы подавить гормональные влияния на опухоль и тем самым затормозить ее рост.

Применяют такие препараты, как тамоксифен, фулвестрант, ингибиторы ароматазы. В некоторых случаях подавляют выработку гормонов, воздействуя на яичники химиопрепаратами или с помощью их хирургического удаления — оофорэктомии.
Реабилитация
После того, как лечение инвазивного рака молочной железы завершено, женщина должна регулярно наблюдаться у врача, потому что всегда есть риском рецидива. Онколог назначит осмотры раз в несколько месяцев, по прошествии 5 лет — раз в год. Через 6–12 месяцев, а далее раз в год проводят маммографию. Если женщина проходила курс гормональной терапии, ее должен регулярно осматривать гинеколог, после лечения ингибиторами ароматазы контролируют плотность костей. При необходимости врач может назначить другие анализы и исследования.
После хирургического лечения рака груди может быть выполнена реконструктивно-пластическая операция.
У молодых женщин нередко встает вопрос о возможности беременности после лечения инвазивного рака молочной железы. Чаще всего женщина может зачать и выносить ребенка. Но некоторые виды противоопухолевого лечения, в частности, химиотерапия, способны повлиять на фертильность, этот вопрос нужно обсудить с онкологом заранее.
Прогноз и профилактика рака молочной железы
Прогноз при онкологических заболеваниях принято рассчитывать по показателю пятилетней выживаемости. Это процент пациентов, которые остались живы в течение пяти лет с момента установления диагноза.
Пятилетняя выживаемость главным образом зависит от стадии рака. Показатели при злокачественных опухолях молочной железы:
- Если рак не распространился за пределы молочной железы: 99%.
- Опухоль, проросшая в окружающие ткани и/или распространившаяся в лимфатические узлы: 85%.
- Рак груди с отдаленными метастазами 27%.
Меры профилактики, которые подходят для всех женщин:
- Поддержание нормального веса.
- Регулярная физическая активность.
- Здоровое питание.
- Ограничение потребления алкоголя.
- После рождения ребенка — кормление грудью в течение нескольких месяцев.
- По возможности ограничение применения заместительной гормональной терапии в постменопаузе.
Женщины с высоким риском (например, если рак груди был диагностирован у многих родственниц, при обнаружении мутаций в генах BRCA1 и BRCA2) должны проконсультироваться онкологом. Возможно, им потребуются специальные меры профилактики.

- ИГХ исследования – что это такое
- Суть методики
- Кому показано
- ИГХ исследования: что это такое и как проводятся
- Расшифровка
ИГХ исследования – что это такое
ИГХ представляет собой методику, используемую в патологической анатомии для диагностики раковых и доброкачественных опухолей. Его назначают, когда установить точный диагноз стандартным гистологическим способом невозможно или необходима детализация клинически значимых параметров новообразований на молекулярном уровне.
Очень часто гистологии бывает недостаточно. В большинстве случаев причиной этому является крайне нетипичная структура патологического образования, что существенно затрудняет постановку точного диагноза. В частности, при лимфоме и лейкозе ИГХ делают практически всегда.
Нужно отметить, что всего насчитывается около 70 разновидностей лейкозов и лимфом. Верифицировать некоторые их них удается лишь путем нескольких исследований – гистологического, иммуногистохимического и молекулярно-генетического.
Суть методики
При развитии любого опухолевого процесса формируются чужеродные организму белки – антигены, в противовес которым иммунная система человека вырабатывает антитела – иммуноглобулины. Они прикрепляются к антигенам и связываются с эпитопами – основными частями антигенных макромолекул. Антитела выполняют сразу две функции: связывающую и эффекторную. Проще говоря, они напрямую мешают антигенам наносить вред и одновременно активируют комплемент, запуская ответную реакцию иммунитета.
Роль антигенов в данном случае принадлежит атипичным опухолевым клеткам. Перед тем как провести иммуногистохимическое исследование, срезы биометариала маркируются специфическими антителами к ним. В целях дальнейшей визуализации эти антитела окрашиваются ферментами. Далее, используя высокоточную оптику, наблюдают за поведением испытуемых клеток.
Если белковые соединения, помеченные как антитела, связываются с опухолевыми клетками, будет видно свечение – флюоресценцию, свидетельствующую о наличии искомых веществ. Так выявляют, например, рецепторы к гормонам и онкомаркеры. При подозрении на рак молочной железы таким образом обнаруживаются рецепторы к эстрогену и прогестерону.
Кому показано
В отдельных случаях иммуногистохимический анализ позволяет установить источник метастазов, когда локализация первичного очага неизвестна, а также провести дифференциальную диагностику при нескольких новообразованиях разного происхождения.
ИГХ может назначаться при бесплодии, хронических патологиях эндометрия, матки и яичников, привычных выкидышах. Ее целесообразно делать и в том случае, если беременность не наступает после нескольких процедур ЭКО.
Иммуногистохимия поможет обнаружить наличие клеток, препятствующих зачатию, и определить дальнейшую тактику лечения бесплодия.
Методом ИГХ оценивают и лекарственную чувствительность путем выявления:
- рецепторов половых гормонов – эстрогена, прогестерона и андрогенов. Необходимо при поражении женской репродуктивной системы;
- фактора роста опухоли Her2/neu. Биомаркер и терапевтическая мишень агрессивных типов рака груди;
- соматостатиновых рецепторов 2а и 5 типа, важных при карциноидах;
- мембранного белка иммуноглобулинов PD-L1, гена ALK и рецептора тирозинкиназы ROS. Данные показатели исследуются преимущественно при немелкоклеточном раке легких;
- микросателлитной нестабильности;
- индекса пролиферативной активности.
Трудно переоценить важность микросателлитной нестабильности (MSI), которая существенно расширяет прогностические и лечебные возможности у пациентов со злокачественными поражениями ЖКТ. Новообразования с низкой MSI медленнее растут и реже дают метастазы. Поэтому своевременное выявление MSI позволяет избежать назначения агрессивной, но заведомо неэффективной терапии.
ИГХ исследования: что это такое и как проводятся
Для выполнения ИГХ необходим биоматериал, забор которого осуществляется в основном путем взятия биопсии. Несколько реже его получают в ходе эндоскопической или классической открытой операции. Способ изъятия пораженной ткани зависит от типа и локализации рака. При этом следует учесть, что брать материал на анализ следует до начала терапии. В противном случае возможно искажение результатов исследования.
Этапы проведения анализа:
- Полученный биоматериал фиксируют, обрабатывая в формалине, и отправляют в лабораторию.
- Затем его обезжиривают и подвергают повторной фиксации, после чего заливают парафином.
- Далее производится микротомирование – с готовых парафиновых блоков делаются тонкие срезы, которые помещаются на специальные стекла. Толщина среза составляет не больше 1 мкм.
Когда ткани лежат на стеклах, их обрабатывают раствором антител. Количество их видов ограничено несколькими десятками. Исследование реакций с применением до 5 разных антител проводится на малой панели. При более масштабном эксперименте нужна большая панель.
В ходе ИГХ рак любого органа проявляется эффектом свечения – флюоресценции, – благодаря чему выявляются злокачественные клетки, определяются рецепторы гормонов или другие заданные параметры.
Расшифровка
Изучением срезов биоматериала занимаются врачи-патологоанатомы. Они же первыми составляют прогноз, исходя из выявленного типа и объема онкогенных клеток. При расшифровке результатов особое внимание обращают на показатель К-67 – специфический белок, антиген ракового процесса. Он вырабатывается только при активном делении клеток, а в состоянии покоя не продуцируется.
К-67 – это именно тот онкомаркер, что показывает степень озлокачествления процесса. Если его уровень в процентном содержании составляет 85% и выше, то заболевание прогрессирует стремительно и с высокой вероятностью вскоре приведет к смерти.
Благоприятным будет прогноз при К-67=10%. В случае грамотно составленного плана терапии есть все шансы на полное выздоровление, зачастую без риска рецидива. При К=30% констатируют среднюю степень тяжести болезни, что означает достаточно быстрый рост рака. С помощью курсовой химиотерапии его можно замедлить и даже остановить.
Однако К-67 – это не единственный показатель, который указывается в медицинском заключении. Также записываются антитела, к которым выявлены соответствующие антигены, тип и количество последних.
Полученное заключение врач-патологоанатом передает лечащему онкологу, который подбирает лечение. Для оценки его эффективности иммуногистохимию проводят еще раз после завершения терапевтического курса.
Читайте также:

