Идентификация рак молочной железы
Молекулярно-биологические подходы к идентификации групп онкологического риска
Залогом успешного лечения онкологических заболеваний является их своевременная диагностика.
Существующие методы скрининга обладают достаточно высокой эффективностью; однако по целому ряду причин их регулярное использование в полном масштабе (т. е. на всей человеческой популяции) представляется весьма затруднительным.
Фокусирование диагностических мероприятий на так называемых группах онкологического риска признается разумным компромиссом, обеспечивающим сфокусированность превентивных усилий именно на тех индивидуумах, которые в них больше всего нуждаются.
Поэтому разработка научно обоснованных подходов к формированию подобных групп представляется исключительно важной задачей.
Вирусная теория рака длительное время доминировала среди остальных онкологических гипотез. Однако эксперименты конца 1970-х гг. убедительно доказали, что вирусы не имеют никакого отношения к этиологии подавляющего большинства типов опухолей у человека. Тем не менее последующие 20 лет выявили ряд исключений из этого правила.
В частности, к настоящему моменту научно подтверждены ассоциации между вирусами папилломы человека и раком шейки матки, вирусом Эпштейна-Барр и некоторыми видами лимфом и назофарингеальных карцином, вирусами гепатита и раком печени и т. д. Наибольшей практической значимостью обладают исследования последнего десятилетия, установившие причастность вируса папилломы человека (ВПЧ) к возникновению рака гениталий.
Папилломавирусы представляются основным этиологическим агентом рака шейки матки — наиболее частой опухоли репродуктивного тракта у женщин. Встречаемость бессимптомной ВПЧ-инфекции исключительно высока: около 30% здоровых посетительниц гинекологических консультаций инфицированы папилломавирусами. Однако онкологическую опасность представляет не носительство как таковое, а хронизация этого процесса, наблюдающаяся несколько реже — примерно у 10-20% женщин.
ВПЧ-тестирование имеет чрезвычайную социальную значимость, так как позволяет надежно выделить группы высокого риска рака шейки матки. Известно, что для данного заболевания характерна строгая стадийность развития, при этом возникновению злокачественной опухоли предшествует относительно длительный этап предракового поражения.
Следовательно, выявление групп с онкологической предрасположенностью, которое позволяет сконцентрировать клинические превентивные мероприятия на относительно узких группах пациенток, может существенно увеличить эффективность выявления опухолей шейки матки на ранних, дозлокачественных стадиях.
Достоверным методом диагностики ВПЧ-инфекций является полимеразная цепная реакция (ПЦР). Обследование на присутствие ВПЧ в урогенитальном тракте рутинно применяется многими учреждениями акушерско-гинекологического профиля.
Генетическое исследование при подозрении на наследственный опухолевый синдром начинается со сбора онкологического анамнеза, при этом первостепенное внимание уделяется случаям злокачественных заболеваний у кровных родственников. В результате составляют родословные, позволяющие с той или иной степенью вероятности заподозрить или отвергнуть наследственную патологию, принимая во внимание нозологические формы онкологических заболеваний, возраст возникновения патологии, наличие первично-множественных форм опухолей.
Следующим, решающим этапом является лабораторная диагностика — главным образом исследование дезоксирибонуклеиновой кислоты (ДНК). Она позволяет установить наличие определенных мутаций в генотипе пациента, а также членов его семьи. Если ответ положительный, то носителям мутаций назначается дополнительное клиническое обследование на предмет обнаружения новых опухолей; они получают настойчивые рекомендации в отношении режима дальнейших профилактических осмотров, а также стиля жизни; иногда подвергаются превентивному лечению.
Упомянутые выше наследственные мутации, безусловно, относятся к патологическим состояниям генома. Помимо них онкологическую предрасположенность могут модифицировать не только генетические повреждения, но и вариации в пределах нормы -аллельные полиморфизмы.
В качестве наиболее наглядного примера можно привести исключительно высокую заболеваемость раком кожи среди европейских иммигрантов в Австралии. В данном случае белый цвет кожных покровов, являясь нормальным наследуемым полиморфным признаком и обеспечивая адекватную приспособленность в странах с низкой солнечной инсоляцией, оказывается онкологически неблагоприятным в австралийских условиях. По-видимому, особенности индивидуального генетического фона играют очень существенную, если не решающую, роль в детерминации онкологического риска.
Однако генетическая конституция человека складывается из тысяч взаимодействующих полиморфных аллелей, при этом каждый полиморфизм по отдельности обладает лишь весьма умеренным эффектом. Поэтому роль нормальных вариаций генома в патологии с трудом поддается изучению, а результаты отдельных работ отличаются плохой воспроизводимостью.
В настоящее время идентифицированы десятки полиморфных генов-кандидатов, которые могут принимать участие в формировании онкологического риска. К ним относятся представители семейств цитохромов, глутатионтрансфераз, ацетилтрансфераз, некоторые онкогены и антионкогены, участники гормонального метаболизма и т. д. (табл. 6).
Таблица 6. Полиморфные гены с предполагаемой ролью в детерминации онкологического риска
Диагностические и прогностические молекулярные маркеры в онкологии, стратегия выбора и методы анализа
К настоящему времени молекулярная онкология предоставила врачам около 400 новых диагностических и прогностических показателей, которые используются или испытываются в клинической практике. Некоторые тесты уже получили обязательный статус.
Ключевым моментом в привлечении молекулярной диагностики в онкогематологию явилось бурное развитие пересадок костного мозга. Для успешных трансплантаций потребовался целый комплекс лабораторных мероприятий: HLA-генотипирование, методы генетического мониторинга клеточных клонов, диагностика цитомегаловирусной инфекции и т. д..
В клинике солидных опухолей наибольшую известность получили молекулярно-биологические тесты на амплификацию онкогенов NMYC и ERBB2. Увеличение числа копий онкогена NMYC зачастую наблюдается у больных нейробластомой и свидетельствует о плохом прогнозе заболевания. Неблагоприятные результаты подобного лабораторного исследования могут свидетельствовать о необходимости увеличить интенсивность терапевтических и диспансерных мероприятий.
Амплификация гена ERBB2 при раке молочной железы имеет более комплексное значение — она является не только прогностическим индикатором, но и указывает на специфический спектр чувствительности опухоли к химиопрепаратам. Более того, в настоящее время ведутся интенсивные клинические испытания специфических ингибиторов данного рецептора — разумеется, подобная терапия представляется оправданной только для ERBB2-положительных неоплазий.
Выбор маркеров для исследования основан на систематическом анализе научных публикаций в области молекулярной и клинической онкологии (PubMed, ASCO, AACR), а также биомедицинских баз данных, описывающих структуру генома и транскриптома человека (ENSEMBL, UCSC), молекулярные механизмы наследственных заболеваний (OMIM, LSDB), генетические нарушения при злокачественных опухолях (ICGC, TCGA, CGP), особенности опухолевого транскриптома (ReMBraNDt, OCELOT и др.) и влияние молекулярных нарушений на течение опухолевого процесса и эффективность противоопухолевого лечения (Broad Institute Cancer Portals, Oncomine).
Исследования проводятся с применением ряда современных молекулярно-биологических методов:
1. С помощью методов прямого секвенирования, фрагментного анализа, рестрикционного анализа и аллель-специфичной ПЦР определяют первичную структуру (нуклеотидную последовательность) ДНК, а также проводят оценку статуса метилирования CpG-островков ДНК, после бисульфитной модификации ДНК или ее обработки метилчувствительными и метилспецифическими рестриктазами.
2. С помощью методов количественной РТ-ПЦР и флуоресцентной гибридизации in situ (FISH) проводят анализ количества копий фрагментов ДНК, а также выявляют крупные перестройки в ДНК (транслокации, делеции и инсерции).
С помощь метода количественной ПЦР с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени осуществляют оценку уровня экспрессии генов по РНК.
Рак или не рак? Болезни груди: классификация и идентификация
Изменения в груди – это далеко не всегда признак развития рака. Не стоит изначально настраиваться на плохой диагноз – для начала следует посетить специалиста.
Изменения в груди, такие как уплотнения, выделения из сосков, изменение формы и боль – повод обратиться в медицинское учреждение. Чтобы выздороветь, вам, возможно, будет достаточно лишь пройти курс лабораторного лечения. А вот постоянное откладывание визита в больницу чревато превращением на первых порах безобидной болезни в онкологическую. Чем дольше вы откладываете консультацию у врача, тем больше разрастается опухоль, а вместе с ней возрастает и необходимость в операции, и сложность ее проведения.
Как правило, с раком груди путают следующие заболевания молочной железы: фиброаденома, мастопатия и внутрипротоковая папиллома.
Фиброаденома
Фиброаденомой называется доброкачественное новообразование в груди. Как правило, она не превращается в рак, однако здесь, как и в любом правиле, есть исключения. Развитие фиброаденомы, как правило, не причиняет ни боли, ни дискомфорта, а обнаруживается она лишь на ощупь.
Опасность:
Единственный вид фиброаденомы, а именно листовидная, может перерасти в злокачественную опухоль.
Лечение:
Небольшие фиброаденомы, по размеру не превышающие 1 см, должны наблюдаться врачом. Если размер опухоли превышает 1,5 см, ее удаляют хирургическим путем. Это актуально и для листовидной фиброаденомы.
Группа риска:
Эта опухоль образуется у девушек в период полового созревания (15–20 лет) и обусловливаются неправильным развитием грудной ткани. Также обследование у маммолога необходимо проходить женщинам, планирующим беременность. В этот период гормональный фон в организме женщины резко меняются, и это может спровоцировать возникновение или резкий рост имеющейся фиброаденомы.
Мастопатия
С этим недугом сталкивается 50% женщин. При мастопатии в груди появляются уплотнения и болевые ощущения, вызванные разрастанием ткани молочной железы. Иногда при мастопатии наблюдаются выделения из сосков мутно-желтого или даже зеленого цвета. Мастопатия – доброкачественная опухоль, которая тем не менее требует немедленного обращения к врачу.
Опасность:
Как правило, заболевание начинается с диффузной мастопатии, которая, однако, может превратиться в узловую, а та, в свою очередь, в рак молочной железы. На появление узловой мастопатии указывают следующие признаки: сильная боль в груди, выделения из сосков, опухолевые образования, которые можно прощупать.
Лечение:
Диффузная мастопатия требует назначения антиоксидантных и гомеопатических препаратов, а также фитотерапии и иногда – гормонального лечения. При узловой мастопатии также возможно медикаментозное лечение, однако чаще необходимо хирургическое вмешаельство.
Группа риска:
Женщины, страдающие от проблем с эндокринной системой и печенью. Женщины, отказавшиеся от кормления грудью, находящиеся в постоянном стрессе или делавшие аборт. Девушки, у которых рано началось половое созревание, а также те, у кого в семье были случаи онкологических заболеваний.
Внутрипротоковая папиллома
Представляет собой разрастания величиной в несколько миллиметров, возникающие внутри молочных протоков грудной железы. Внутрипротоковая папиллома не вызывает боли, однако является причиной выделений из сосков: прозрачных, кровянистых и даже черных.
Опасность:
Внутрипротоковая папиллома часто становится причиной развития злокачественной опухоли.
Лечение:
Опухоль лечится хирургическим вмешательством, никак не изменяющим внешний вид груди.
Группа риска:
Внутрипротоковая папиллома часто возникает у женщин старшего возраста перед менопаузой и указывает на сбои в гормональной системе.
Молекулярно-биологические подходы к идентификации групп онкологического риска
Залогом успешного лечения онкологических заболеваний является их своевременная диагностика.
Существующие методы скрининга обладают достаточно высокой эффективностью; однако по целому ряду причин их регулярное использование в полном масштабе (т. е. на всей человеческой популяции) представляется весьма затруднительным.
Фокусирование диагностических мероприятий на так называемых группах онкологического риска признается разумным компромиссом, обеспечивающим сфокусированность превентивных усилий именно на тех индивидуумах, которые в них больше всего нуждаются.
Поэтому разработка научно обоснованных подходов к формированию подобных групп представляется исключительно важной задачей.
Вирусная теория рака длительное время доминировала среди остальных онкологических гипотез. Однако эксперименты конца 1970-х гг. убедительно доказали, что вирусы не имеют никакого отношения к этиологии подавляющего большинства типов опухолей у человека. Тем не менее последующие 20 лет выявили ряд исключений из этого правила.
В частности, к настоящему моменту научно подтверждены ассоциации между вирусами папилломы человека и раком шейки матки, вирусом Эпштейна-Барр и некоторыми видами лимфом и назофарингеальных карцином, вирусами гепатита и раком печени и т. д. Наибольшей практической значимостью обладают исследования последнего десятилетия, установившие причастность вируса папилломы человека (ВПЧ) к возникновению рака гениталий.
Папилломавирусы представляются основным этиологическим агентом рака шейки матки - наиболее частой опухоли репродуктивного тракта у женщин. Встречаемость бессимптомной ВПЧ-инфекции исключительно высока: около 30% здоровых посетительниц гинекологических консультаций инфицированы папилломавирусами. Однако онкологическую опасность представляет не носительство как таковое, а хронизация этого процесса, наблюдающаяся несколько реже - примерно у 10-20% женщин.
ВПЧ-тестирование имеет чрезвычайную социальную значимость, так как позволяет надежно выделить группы высокого риска рака шейки матки. Известно, что для данного заболевания характерна строгая стадийность развития, при этом возникновению злокачественной опухоли предшествует относительно длительный этап предракового поражения.
Следовательно, выявление групп с онкологической предрасположенностью, которое позволяет сконцентрировать клинические превентивные мероприятия на относительно узких группах пациенток, может существенно увеличить эффективность выявления опухолей шейки матки на ранних, дозлокачественных стадиях.
Достоверным методом диагностики ВПЧ-инфекций является полимеразная цепная реакция (ПЦР). Обследование на присутствие ВПЧ в урогенитальном тракте рутинно применяется многими учреждениями акушерско-гинекологического профиля.

Генетическое исследование при подозрении на наследственный опухолевый синдром начинается со сбора онкологического анамнеза, при этом первостепенное внимание уделяется случаям злокачественных заболеваний у кровных родственников. В результате составляют родословные, позволяющие с той или иной степенью вероятности заподозрить или отвергнуть наследственную патологию, принимая во внимание нозологические формы онкологических заболеваний, возраст возникновения патологии, наличие первично-множественных форм опухолей.
Следующим, решающим этапом является лабораторная диагностика - главным образом исследование дезоксирибонуклеиновой кислоты (ДНК). Она позволяет установить наличие определенных мутаций в генотипе пациента, а также членов его семьи. Если ответ положительный, то носителям мутаций назначается дополнительное клиническое обследование на предмет обнаружения новых опухолей; они получают настойчивые рекомендации в отношении режима дальнейших профилактических осмотров, а также стиля жизни; иногда подвергаются превентивному лечению.
Упомянутые выше наследственные мутации, безусловно, относятся к патологическим состояниям генома. Помимо них онкологическую предрасположенность могут модифицировать не только генетические повреждения, но и вариации в пределах нормы -аллельные полиморфизмы.
В качестве наиболее наглядного примера можно привести исключительно высокую заболеваемость раком кожи среди европейских иммигрантов в Австралии. В данном случае белый цвет кожных покровов, являясь нормальным наследуемым полиморфным признаком и обеспечивая адекватную приспособленность в странах с низкой солнечной инсоляцией, оказывается онкологически неблагоприятным в австралийских условиях. По-видимому, особенности индивидуального генетического фона играют очень существенную, если не решающую, роль в детерминации онкологического риска.
Однако генетическая конституция человека складывается из тысяч взаимодействующих полиморфных аллелей, при этом каждый полиморфизм по отдельности обладает лишь весьма умеренным эффектом. Поэтому роль нормальных вариаций генома в патологии с трудом поддается изучению, а результаты отдельных работ отличаются плохой воспроизводимостью.
В настоящее время идентифицированы десятки полиморфных генов-кандидатов, которые могут принимать участие в формировании онкологического риска. К ним относятся представители семейств цитохромов, глутатионтрансфераз, ацетилтрансфераз, некоторые онкогены и антионкогены, участники гормонального метаболизма и т. д. (табл. 6).
Таблица 6. Полиморфные гены с предполагаемой ролью в детерминации онкологического риска

Диагностические и прогностические молекулярные маркеры в онкологии, стратегия выбора и методы анализа
К настоящему времени молекулярная онкология предоставила врачам около 400 новых диагностических и прогностических показателей, которые используются или испытываются в клинической практике. Некоторые тесты уже получили обязательный статус.
Ключевым моментом в привлечении молекулярной диагностики в онкогематологию явилось бурное развитие пересадок костного мозга. Для успешных трансплантаций потребовался целый комплекс лабораторных мероприятий: HLA-генотипирование, методы генетического мониторинга клеточных клонов, диагностика цитомегаловирусной инфекции и т. д..
В клинике солидных опухолей наибольшую известность получили молекулярно-биологические тесты на амплификацию онкогенов NMYC и ERBB2. Увеличение числа копий онкогена NMYC зачастую наблюдается у больных нейробластомой и свидетельствует о плохом прогнозе заболевания. Неблагоприятные результаты подобного лабораторного исследования могут свидетельствовать о необходимости увеличить интенсивность терапевтических и диспансерных мероприятий.
Амплификация гена ERBB2 при раке молочной железы имеет более комплексное значение - она является не только прогностическим индикатором, но и указывает на специфический спектр чувствительности опухоли к химиопрепаратам. Более того, в настоящее время ведутся интенсивные клинические испытания специфических ингибиторов данного рецептора - разумеется, подобная терапия представляется оправданной только для ERBB2-положительных неоплазий.
Выбор маркеров для исследования основан на систематическом анализе научных публикаций в области молекулярной и клинической онкологии (PubMed, ASCO, AACR), а также биомедицинских баз данных, описывающих структуру генома и транскриптома человека (ENSEMBL, UCSC), молекулярные механизмы наследственных заболеваний (OMIM, LSDB), генетические нарушения при злокачественных опухолях (ICGC, TCGA, CGP), особенности опухолевого транскриптома (ReMBraNDt, OCELOT и др.) и влияние молекулярных нарушений на течение опухолевого процесса и эффективность противоопухолевого лечения (Broad Institute Cancer Portals, Oncomine).
Исследования проводятся с применением ряда современных молекулярно-биологических методов:
1. С помощью методов прямого секвенирования, фрагментного анализа, рестрикционного анализа и аллель-специфичной ПЦР определяют первичную структуру (нуклеотидную последовательность) ДНК, а также проводят оценку статуса метилирования CpG-островков ДНК, после бисульфитной модификации ДНК или ее обработки метилчувствительными и метилспецифическими рестриктазами.
2. С помощью методов количественной РТ-ПЦР и флуоресцентной гибридизации in situ (FISH) проводят анализ количества копий фрагментов ДНК, а также выявляют крупные перестройки в ДНК (транслокации, делеции и инсерции).
С помощь метода количественной ПЦР с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени осуществляют оценку уровня экспрессии генов по РНК.

- Как возникает рак молочной железы?
- Типы рака молочной железы
- Причины и факторы риска
- Симптомы рака молочной железы
- Самостоятельная диагностика рака груди
- Диагностика
- Стадии рака молочной железы
- Лечение рака молочной железы
- Прогноз при раке молочной железы
Как возникает рак молочной железы?
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными .
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
Типы рака молочной железы
Злокачественные опухоли груди делятся на два типа: протоковые и железистые. Протоковый рак молочной железы встречается чаще. Он может быть внутриэпителиальным (in situ) и инвазивным. У внутриклеточного протокового рака молочной железы более благоприятный прогноз, он редко дает метастазы и излечивается в 98% случаев. Инвазивный же вариант опухоли склонен к бесконтрольному росту и генерализации процесса.
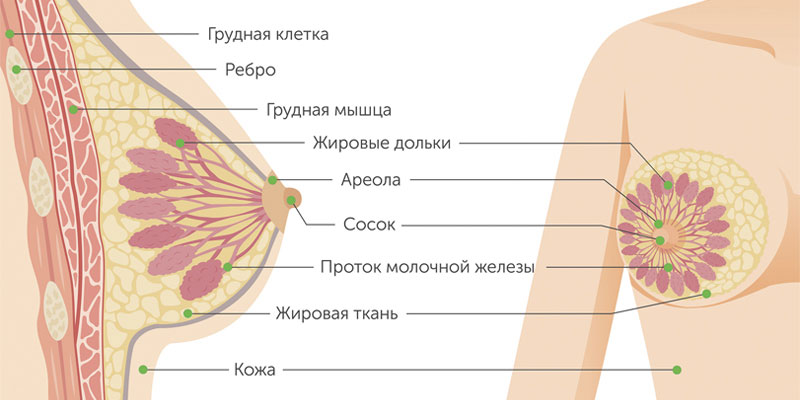
Железистый рак молочной железы может быть дольковым (инвазивная лобулярная карцинома) или произрастать из других клеток железистой ткани. Для долькового рака нередко характерен мультицентричный рост. Скорость увеличения в размерах и сроки метастазирования форм узлового рака груди зависят от степени дифференцировки опухоли.
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Симптомы рака молочной железы
На ранних стадиях рак молочной железы, как правило, никак клинически не проявляется. Чаще всего опухоль обнаруживается самими больными или выявляется случайно при проведении профилактических исследований.
Пациентки обычно жалуются на наличие пальпируемого образования, выделения из соска. Боль является редким симптомом рака грудной железы, однако болевой синдром может выйти на первый план на этапе генерализации процесса, в особенности при распространении метастазов в кости.
Довольно часто выявляются такие признаки рака груди, как появление асимметрии вследствие изменения размеров пораженной железы. Уменьшение, смещение кверху, деформация и сморщивание молочной железы может наблюдаться при скиррозной (фиброзной) форме опухоли. Напротив, увеличивается грудь на стороне поражения при быстром росте образования или из-за отека, который формируется по причине нарушенного оттока лимфы.
При распространении новообразования в подкожную клетчатку могут наблюдаться изменения кожи. При этом выявляются следующие симптомы рака молочной железы:
Иногда, при распространении опухоли на поверхность кожи могут наблюдаться такие признаки рака груди, как покраснение и изъязвление. Наличие этих симптомов говорит о запущенности процесса.
Изменения соска тоже могут определяться, но только на поздних стадиях. При этом имеют место такие симптомы рака грудной железы, как:
- Симптом Форга — на стороне поражения сосок находится выше, чем на здоровой стороне.
- Симптом Краузе — сосок утолщен, складки ареолы заметно выражены.
Такой признак рака молочной железы, как патологические выделения, является довольно редким, но в ряде случаев может быть единственным симптомом, который выявляется при осмотре. Часто выделения носят кровянистый характер, реже встречаются серозные и гнойные.
Также были выделены особые формы рака груди, которые проявляются типичной симптоматикой. К ним относятся:
- Отечно-инфильтративная форма, для которой характерно увеличение и отечность железы, мраморный цвет кожи, выраженная гиперемия.
- Маститоподобная. Данный вид рака груди проявляется уплотнением пораженной груди, повышением температуры тела.
- Рожистоподобная форма, при которой на коже выявляются очаги (иногда появляются изъязвления), которые внешне напоминают рожистое воспаление.
- Панцирная форма характеризуется наличием множественных узлов, за счет которых происходит сморщивание и деформация железы.
- Рак Педжета — поражает сосок и ареолу. При данной разновидности наблюдают утолщение соска, изменение кожи в виде покраснения и уплотнения, образование корок и чешуек.
Иногда люди, интересуясь по каким признакам можно распознать наличие опухоли молочной железы, по ошибке ищут симптомы рака грудины. Данное название является неверным, так как грудина является центральной плоской костью грудной клетки и даже при метастазировании злокачественного образования груди практически никогда не поражается.
Самостоятельная диагностика рака груди
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц после менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
Диагностика
Диагностика рака молочной железы начинается с беседы. На этом этапе для врача важно оценить жалобы женщины и выяснить, встречались ли случаи рака молочной железы в её семье, если да — насколько часто. Это помогает заподозрить наследственную форму рака, связанную с мутациями в генах BRCA1, BRCA2, NBS1, CHECK, TP53.
Далее врач осматривает, ощупывает молочные железы, проверяет, нет ли в них узлов и уплотнений, не увеличены ли лимфатические узлы в подмышечной, надключичной и подключичной областях.
После осмотра врач может направить женщину на маммографию — рентгенографию молочной железы. Показаниями к этому исследованию являются: уплотнения в молочной железе, изменения со стороны кожи, выделение крови из соска, а также любые другие симптомы, которые могут указывать на злокачественную опухоль. Также для диагностики рака молочной железы назначают ультразвуковое исследование. Маммография и УЗИ являются взаимодополняющими методами, каждый из них имеет свои преимущества:
Маммография
УЗИ молочных желез
Позволяет обнаружить патологические изменения за 1,5–2 года до появления симптомов.
При кровянистых выделениях из соска можно провести дуктографию — рентгенографию с контрастированием молочных протоков. Это помогает получить дополнительную полезную информацию.
Высокая чувствительность — точная диагностика до 90% случаев рака.
Возможность обнаружить микрокальцинаты до 0,5 мм.
Безопасность — нет воздействия на организм рентгеновскими лучами.
Хорошо подходит при высокой плотности ткани молочной железы, у молодых женщин (до 35–45 лет).
Позволяет отличать кисты (полости с жидкостью) от плотных опухолей.
Позволяет оценить состояние регионарных лимфатических узлов.
Хорошо подходит для контроля положения иглы во время биопсии.
Магнитно-резонансная томография — высокоинформативный метод диагностики злокачественных опухолей молочной железы. Ее применяют при лобулярном раке, когда неинформативны маммография и УЗИ, а также для оценки размеров и расположения опухоли, что помогает определиться с тактикой хирургического лечения. МРТ может применяться для скрининга у женщин-носительниц аномальных генов, связанных с повышенным риском рака молочной железы, при отягощенном семейном анамнезе.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:

В лаборатории проводят цитологическое и гистологическое исследование, то есть оценивают строение отдельных клеток и ткани. В настоящее время доступны молекулярно-генетические исследования: они помогают выявить мутации, за счет которых произошло злокачественное перерождение, и подобрать оптимальную противоопухолевую терапию.
Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой , что также влияет на схему лечения.
После того как рак диагностирован, важно определить его стадию и понять, насколько сильно он распространился в организме. Для этого применяют следующие исследования:

Стадии рака молочной железы
Стадирование при раке молочной железы опирается на общепринятую систему TNM. Буква T в этой аббревиатуре обозначает размер первичной опухоли:
Буквой N обозначают наличие метастазов в регионарных лимфатических узлах. N0 — очаги в лимфатических узлах отсутствуют. N1, N2 и N3 — поражение разного количества лимфатических узлов.
Буква M обозначает наличие отдаленных метастазов. Рядом с ней может быть указана одна из двух цифр: M0 — нет отдаленных метастазов, M1 — отдаленные метастазы имеются.
В зависимости от значений T, N и M, выделяют пять основных стадий рака молочной железы (внутри некоторых из них есть подстадии):
- Стадия 0: рак на месте.
- Стадия I: опухоль в молочной железе диаметром до 2 см.
- Стадия II: опухоль в молочной железе диаметром до 5 см и более, могут быть метастазы в подмышечных лимфоузлах на стороне поражения.
- Стадия III: опухоль в молочной железе до 5 см и более, может прорастать в грудную стенку или в кожу, имеются очаги в регионарных лимфатических узлах.
- Стадия IV: опухоль может быть любых размеров, не имеет значения, поражены ли регионарные лимфоузлы. Если обнаруживают отдаленные метастазы, всегда диагностируют рак четвертой стадии.
Лечение рака молочной железы
Стратегия лечения рака молочной железы должна подбираться индивидуально для каждой пациентки с учетом таких факторов, как тип опухоли, стадия, чувствительность новообразования к гормональной терапии. Берется во внимание и общее состояние больной. Если опухоль обнаружена на ранних стадиях и выбрана правильная тактика ведения пациентки, то шанс полностью вылечить рак груди является весьма высоким.
Выберите врача-онколога и запишитесь на приём:

Пластический хирург, онколог-маммолог, доктор медицинских наук
Читайте также:

