Хромосомные поломки при лейкозе
Острый лимфобластный лейкоз (ОЛЛ) — гетерогенная группа гемобластозов, развивающихся из самых молодых клеток лимфатического ряда. Эта группа состоит из отдельных подгрупп, каждая из которых в свою очередь гетерогенна.
Клоны клеток с хромосомными аномалиями обнаруживают примерно у 70—80 % пациентов, причем более чем в 30 % случаев это гипердиплоидные клоны, в 10 % — гиподиплоидные, в остальных — псевдодиплоидные.
Острый лимфобластный лейкоз (ОЛЛ) гораздо чаще наблюдается у детей и лиц молодого возраста, чем у пожилых. Средний возраст взрослых пациентов составляет около 30 лет. Мужчины болеют чаще, чем женщины.
Прогноз острого лимфобластного лейкоза у взрослых значительно хуже, чем у детей. Это коррелирует с возрастными различиями в частоте характерных аномалий кариотипа, т. е. при остром лимфобластном лейкозе у детей значительно чаще, чем у взрослых, встречаются хромосомные изменения, более благоприятные в прогностическом отношении, и наоборот — реже наблюдаются нарушения кариотипа, ассоциированные с плохим прогнозом. Особенно ярко возрастные различия проявляются при сравнении особенностей кариотипа острого лимфобластного лейкоза у детей и взрослых старше 60 лет.
Определенные особенности кариотипа важны для уточнения диагноза и прогнозирования ответа на терапию.
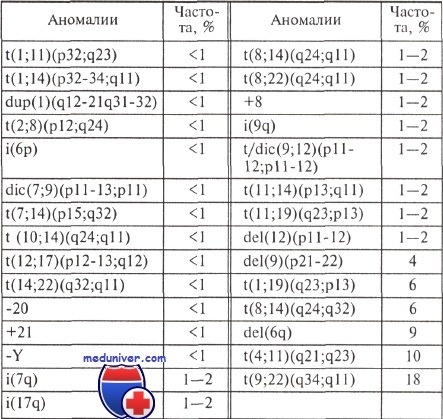
Хромосомные нарушения, наиболее характерные для острого лимфобластного лейкоза, представлены в таблице. Их частота вычислена S. Heim и F. Mitelman после объединения данных, полученных в разных цитогенетических лабораториях мира — всего около 6000 наблюдений. В таблице приведены не все, а только самые распространенные хромосомные аномалии, обнаруженные при остром лимфобластном лейкозе, но и они демонстрируют выраженную цитогенетическую гетерогенность этого заболевания. Большинство повторяющихся (неслучайных) аномалий наблюдается редко.
Необходимо отметить, что отдельные изменения кариотипа обнаруживают как при остром лимфобластном лейкозе, так и при других лимфоидных опухолях, другие изменения — исключительно при остром лимфобластном лейкозе. К первым относятся, в частности, перестройки хромосомных районов 14q11, 14q32, делеции длинного плеча хромосомы 6 и короткого плеча хромосом 9, 12 и 17. С другой стороны, t(9;22)(q34;q11), t(4;11)(q21;q23), t(1;19)(q23;p13) характерны для ОЛЛ, но не для других лимфопролиферативных заболеваний.
Еще одно общее замечание: В-клеточные лейкозы (в том числе и острые), а также лимфомы отличаются от Т-клеточных по спектру хромосомных изменений. Так, для новообразований В-клеточной природы характерны перестройки, затрагивающие локусы иммуноглобулиновых генов: гена Н-цепей иммуноглобулинов (14q32), L-цепей к (2р12) и h (2q11). В новообразованиях из Т-клеток нередко наблюдаются перестройки, затрагивающие гены Т-клеточных рецепторов (хромосомные участки 14q11, 7р15, 7q34).
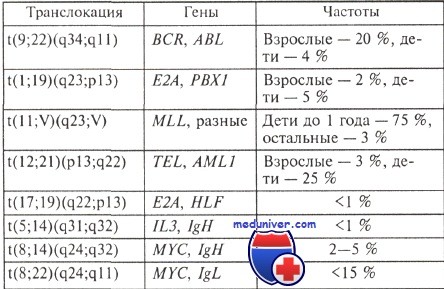
Частоты основных хромосомных перестроек, характерных именно для В- или Т-клеточных острых лимфобластных лейкозах, а также гены, вовлеченные в эти перестройки, приведены в таблицах.
Уже отмечалось, что частота отдельных характерных нарушений кариотипа различается при остром лимфобластном лейкозе у детей и взрослых. Это подтверждают данные таблице. Приведем конкретные примеры сначала по структурным изменениям, а затем по числовым.
Структурные аномалии: t(9;22) значительно чаще наблюдается у взрослых, a t(12;21) — у детей, причем первая крайне неблагоприятна в прогностическом отношении, а вторая — наоборот, предвещает хороший ответ на лечение в подавляющем большинстве случаев. Такие структурные аномалии, как перестройки хромосомного района 11q23, ассоциированные нередко с плохим прогнозом, часто наблюдаются у детей до 6 мес, их частота с возрастом понижается; у пожилых людей они редки.
Числовые изменения: клоны клеток с числом хромосом более 50 прогностически благоприятные, встречаются у детей значительно чаще, чем у взрослых: 25—30 и 5 % соответственно.
Числовые изменения кариотипа имеют большое значение для прогнозирования острого лимфобластного лейкоза. Уже отмечалось, что вариант острого лимфобластного лейкоза со значительным увеличением числа хромосом (более 50) имеет относительно благоприятный прогноз: 80—90 % больных переживает пятилетний срок с момента постановки диагноза, однако выявление некторых структурных перестроек в клетках лейкозного клона с такими числовыми нарушениями может ухудшить прогноз.
В отличие от острого лимфобластного лейкоза с гипердиплоидными клонами лейкозы, ассоциированные с гиподиплоией, имеют обычно плохой прогноз: только 30 % больных остается в живых по истечении 2 лет от момента постановки диагноза. Еще более неблагоприятен прогноз при острых лейкозах с так называемым окологаплоидным числом хромосом, при которых каждая клетка содержит 26—28 хромосом. В таких клетках вместо большинства хромосомных пар остается по одному гомологу; сохранено по два гомолога только в 10-й, 14-й, 18-й и 21-й парах.
Неблагоприятен прогноз и в случаях с околотетраплоидными клонами. Следует отметить, что окологаплоидный и околотетраплоидные клоны клеток редко наблюдаются при остром лимфобластном лейкозе — не более 1—2 % случаев.
Остановимся на отдельных структурных аномалиях кариотипа, характерных для острого лимфобластного лейкоза.
ОСТРЫЕ ЛЕЙКОЗЫ
Классификация. Этиология. Патогенез.
А.В.Колосков
(лекция для врачей и студентов)
Под термином "острые лейкозы" понимают группу клональных заболеваний, первично возникающих в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке до зрелых клеток крови.
Группу острых лейкозов объединяет общий морфологический признак: субстрат опухоли представлен незрелыми молодыми клетками -- бластами. Классификация острых лейкозов основана на признаках принадлежности опухолевых клеток к тому или иному ростку гемопоэза. Принадлежность опухолевых клеток может быть определена цитохимическим методом на основании выявления в цитоплазме этих клеток специфических включений (например гликогена в клетках лимфоидного ростка гемопоэза, миелопероксидазы в клетках миелоидного ростка гемопоэза или альфа-нафтилэстеразы в клетках моноцитарного ряда). Кроме того, для определения гистогенеза опухолевых клеток используется иммунологический метод (иммунофенотипирование), выявляющий на цитоплазматической мембране клетки антигены (кластеры дифференцировки -- CD), указывающие на происхождение клетки и степень ее зрелости.
На сегодняшний день для практических и научно-исследовательских целей используется Франко-Америко-Британская (FAB) классификация острых лейкозов. Классификация подразделяет все острые лейкозы на две главные подгруппы -- острые нелимфобластные лейкозы (составляют около 70% всех острых лейкозов) и острые лимфобластные лейкозы (составляют 30% всех острых лейкозов).
Для разграничения различных вариантов острых лейкозов (ОЛ) FAB классификация использует ряд цитологических критериев аспирата костного мозга и мазка периферической крови, а также цитохимические тесты.
Первым шагом FAB классификации является разграничение ОЛ и миелодиспластического синдрома, а также выделение острого эритробластного лейкоза (для его обозначения FAB классификация использует символ -- М6) (рисунок 1).
Рисунок 1. Алгоритм для диагностики острых лейкозов и разграничения их с миелодиспластическим синдромом. (по Bennett J.M. et al., 1985).
Далее для на основании цитологических и цитохимических критериев FAB классификация выделяет следующие варианты ОНеЛЛ (по Bennett J.M. et al., 1985).
Острый миелобластный лейкоз (М1)
Аспират костного мозга:
- бластные клетки составляют не менее 90%;
- созревающие гранулоциты (под этим термином FAB-классификация понимает все гранулоцитарные клетки от промиелоцитов до сегментоядерных) составляют менее 10%.
Острый миелобластный лейкоз с частичным созреванием (М2)
Аспират костного мозга:
- бластные клетки составляют не менее 30%, но менее 90%;
- клетки моноцитарного ростка кроветворения составляют менее 20%;
- созревающие гранулоциты составляют не менее 10%;
Острый промиелоцитарный лейкоз (М3)
Этот вариант ОНеЛЛ устанавливают на основании типичного морфологического субстрата (характерного вида промиелоциты в аспирате костного мозга) без использования каких-либо дополнительных тестов.
Острый миеломонобластный лейкоз (М4)
1. Аспират костного мозга:
- клетки миелоидного ростка кроветворения составляют не менее 30%, но менее 80%.
2. Периферическая кровь:
- клетки моноцитарного ростка кроветворения составляют не менее 5.0 х 10^9/л;
- Если 1 и 2 условия выполнены, то устанавливают диагноз -- М4 вариант ОНеЛЛ.
- Если 1 условие выполнено, а 2 не выполнено, то оценивают результаты цитохимической окраски бластных клеток на альфа-нафтилэстеразу. Если определяется не менее 20% бластов, дающих положительную окраску на альфа-нафтилэстеразу, то устанавливают диагноз -- М4 вариант ОНеЛЛ.
- Если определяется менее 20% бластов, дающих положительную окраску на альфа-нафтилэстеразу, то устанавливают диагноз -- М2 вариант ОНеЛЛ.
- Если аспират костного мозга соответствует описанию при М2 варианте ОНеЛЛ, а 2 условие выполнено, то оценивают результаты цитохимической окраски бластных клеток на альфа-нафтилэстеразу.
- Если определяется не менее 20% бластов, дающих положительную окраску на альфа-нафтилэстеразу, то устанавливают диагноз -- М4 вариант ОНеЛЛ.
- Если определяется менее 20% бластов, дающих положительную реакцию на альфа-нафтилэстеразу, то устанавливают диагноз -- М2 вариант ОНеЛЛ.
- Если в аспирате костного мозга присутствует не менее 5% эозинофилов, то устанавливают диагноз М4э вариант ОНеЛЛ (острый миеломонобластный лейкоз с эозинофилией).
Острый монобластный лейкоз (М5)
Аспират костного мозга:
-- клетки моноцитарного ряда гемопоэза составляют не менее 80%.
- Если монобласты составляют более 80% от всех клеток моноцитарного ростка кроветворения, то устанавливают диагноз -- М5а вариант ОНеЛЛ (острый монобластный лейкоз без созревания).
- Если монобласты составляют менее 80% от всех клеток моноцитарного ростка кроветворения, то устанавливают диагноз -- М5b вариант ОНеЛЛ (острый монобластный лейкоз с созреванием).
- В дополнениях к рассмотренной редакции FAB классификации выделяют еще два варианта ОНеЛЛ.
Острый мегакариобластный лейкоз (М7) -- диагноз устанавливают на основании данных электронно-микроскопического исследования бластных клеток или на основании данных иммунофенотипирования.
Острый ранний миелобластный лейкоз (М0) - диагноз устанавливают на основании отрицательных результатов всех цитохимических окрасок бластных клеток или на основании данных иммунофенотипирования.
Для классификации ОЛЛ FAB классификация использует цитологические особенности бластных клеток. На основании этих признаков проводится подразделение на три варианта - L1, L2 и L3. Однако такое классификационное построение оказалось условным. Выделенные варианты реально не отличались по особенностям течения, длительности выживания больных и ответу на терапии, что послужило основанием для отказа от этой части FAB классификации. В настоящее время используются иммунофенотипическая классификация ОЛЛ, которая выделяет три основное группы:
- Т-клеточный острый лимфобластный лейкоз (опухолевые клетки несут на своей поверхности антигенные маркеры принадлежности к Т-ряду лимфопоэза);
- В-клеточный острый лимфобластный лейкоз (опухолевые клетки несут на своей поверхности антигенные маркеры принадлежности к В-ряду лимфопоэза);
- общий острый лимфобластный лейкоз (опухолевые клетки при этом варианте лейкоза несут на своей поверхности антиген, специфичный для лимфоидных предшественников -- общий антиген острого лимфобластного лейкоза).
Эпидемиология.
Ежегодно регистрируется 35 новых случаев острых лейкозов на 1 млн населения. Структура встречаемости острых лейкозов в значительной степени зависит от возраста. Так в возрастной группе до 15 лет соотношение ОЛЛ : ОНеЛЛ составляет 4 : 1, в возрастной группе от 15 до 35 лет - 1 : 1.5, а в возрастной группе старше 35 лет - 1 : 8. Мужчины и женщины болеют с одинаковой частотой.
Для острых лейкозов, как и для большинства других опухолевых заболеваний, невозможно выделить специфический этиологический фактор. Этиологические факторы, способные вызывать развитие опухоли, были подробно рассмотрены в главе "Хронические миелопролиферативные заболевания".
В основе патогенеза острых лейкозов лежит мутация стволовой клетки крови, что влечет за собой практически полную потерю потомками мутировавшей клетки способности к созреванию. Мутантный клон автономен от каких-либо регулирующих воздействий организма и достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз.
С момента мутации до момента появления клинических и лабораторных признаков заболевания проходит в среднем 2 месяца. За этот период времени количество опухолевых клеток увеличивается с 1 (родоначальница мутантного клона) до 10^9 -- 10^12. Масса такого количества клеток составляет около одного килограмма. Вытеснение нормальных гемопоэтических клеток, и замещение их опухолевыми клетками, неспособными к созреванию, закономерно приводит к уменьшению в периферической крови зрелых клеток с развитием анемии, гранулоцитопении, лимфопении, моноцитопении и тромбоцитопении, что будет проявляться соответствующей клинической картиной.
Уменьшение количества эритроцитов влечет за собой развитие анемического синдрома. Уменьшение или полное исчезновение зрелых гранулоцитов, приводит к развитию иммунодефицита и инфекционных осложнений. Свой вклад в патогенез инфекционных осложнений вносят также лимфопения и моноцитопения. Тромбоцитопения лежит в основе кровоизлияний и кровотечений.
В ряде случаев опухолевые клетки не нуждаются в строго необходимом для нормальных гемопоэтических клеток стромальном микроокружении. Они могут покидать костный мозг и образовывать колонии опухолевого гемопоэза в других органах и тканях (селезенке, лимфоузлах, печени, центральной нервной системе, легких, коже, слизистых оболочках). Инфильтрация опухолевыми клетками органов и тканей относят к проявлениям пролиферативного синдрома. Степень злокачественности опухолевых клеток при остром лейкозе с течением времени возрастает (как и для других групп опухолей, для острых лейкозов правомочен закон опухолевой прогрессии). Поскольку опухолевые клетки при острых лейкозах, в большинстве вариантов, изначально имеют выраженный дефект созревания, то большая злокачественность часто проявляется появлением экстрамедуллярных очагов кроветворения, увеличением пролиферативной активности, развитием резистентности к проводимой терапии. В основе озлокачествления лежат вторичные мутации в опухолевых клетках. Это наглядно демонстрируют результаты цитогенетического исследования, выявляющего на ряду с изменениями хромосом, имевшими место в начале заболевания, появление дополнительных поломок по мере течения заболевания.
В дебюте острых лейкозов хромосомные аномалии выявляют в 90% случаев. Однако, столь же часто выявляемой хромосомной поломки, как транслокация 9;22 (филадельфийская хромосома) при хроническом миелолейкозе, при острых лейкозах не наблюдается. Тем не менее известна связь некоторых перестроек хромосом с вариантом острого лейкоза. Так транслокация 15;17 является специфичной для острого промиелоцитарного лейкоза (М3), она выявляется в среднем в 50% случаев. Транслокация 8;21 чаще всего встречается при остром миелобластном лейкозе (М1). В трети случаев общего варианта ОЛЛ встречается транслокация 9;22 (филадельфийская хромосома). Клоны клеток с аномалией хромосом не определяются в период ремиссии и появляются вновь при развитии рецидива заболевания. Наиболее часто встречающиеся при острых лейкозах поломки хромосом представлены в таблице 1.
Таблица 1. Наиболее частые аномалии хромосом при острых лейкозах.
хромосомная аномалия вариант острого лейкоза
| хромосомная аномалия | вариант острого лейкоза |
| t(8;21) | M2 |
| t(15;17) | M3 |
| inv(16) | M1;M2 |
| t(9;22) | M1;M2 |
| t(6:9) | M2;M4 |
| t(9:11) | M4;M5 |
| t(8;16) | M5b |
| inv(3) | M1;M2;M4;M7 |
| -7/7q- | M1;M2;M3:M4:M5 |
| 5q- | M1;M2;M3;M4; |
| t(3;5) | M2;M6 |
| t(9;22) | общий вариант ОЛЛ |
| t(7;12) | В-варианты ОЛЛ |
| t(9;12) | -"- |
| t(1;19) | -"- |
| t(8;14) | -"- |
| t(8;12) | -"- |
| t(2;8) | -"- |
| t(11;14) | Т-варианты ОЛЛ |
| t(10;14) | -"- |
| t(8;14) | -"- |
| t(1;14) | -"- |
| inv(14) | -"- |
| 7 | -"- |
| 7q+ | -"- |
Таким образом, в основе патогенеза острых лейкозов лежит мутация стволовой клетки крови. Следствием мутации является развитие в костном мозге клона клеток, утративших способность к созреванию. Неопластический клон вытесняет нормальные гемопоэтические клетки, что приводит к развитию дефицита зрелых клеток в периферической крови. Снижение количества или полное отсутствие зрелых клеток периферической крови приводит к выпадению соответствующих функций периферической крови, что влечет за собой развитие клинических проявлений заболевания. Патоморфология костного мозга.
В гистологическом препарате костного мозга при острых лейкозах определяется значительное увеличение количества бластных клеток, которые часто заполняют весь препарат .
Изучение хромосомных аномалий при остром лпмфобластном лейкозе (ОЛЛ) представляется крайне важной задачей. Цитогенетический анализ случаев ОЛЛ долгое время был связан со значительными методическими трудностями из-за плохой морфологии метафазных хромосом, патогномичной для лимфобластных клопов. Усовершенствование методик позволило установить изменения кариотипа примерно у 70% (55-90%) больных, причем, в отличие от других форм лейкозов, модальное число хромосом при ОЛЛ — самостоятельный прогностический признак.
У 25-30% пациентов клоны клеток содержат более 50 хромосом. Этот кариотип ассоциирован с рге-В/соттоп иммунофенотипом.
Гипердиплоидия (и > 50 хромосом), как правило, ассоциируется с наибольшей продолжительностью первой ремиссии и высокой безрецндивной выживаемостью (медиана составляет 50 месяцев). Предполагается, что гипердиплоидные клетки высокочувствительны к терапии фазовоспецифичными противоопухолевыми препаратами вследствие большой продолжительности 8-фазы. Почти в половине случаев гипердиплоидии п > 50 обнаруживаются дополнительные структурные хромосомные аберрации. Чаще других встречаются: !(9;22), !(4; 11) и 18о(17д). Наличие в кариотипе опухолевых клеток перечисленных неслучайных структурных ано-
малий обусловливает у таких пациентов возникновение ранних рецидивов или плохой ответ на терапию.
Промежуточный прогноз заболевания характерен для группы больных с модальным числом хромосом в лейкозных клетках — от 47 до 50 (гипердиплоидия п = 47-50). Довольно сложно оценить прогноз у пациентов с околотриплоидным набором хромосом из-за недостаточного числа подобных наблюдений. По некоторым данным, случаи с околотетраплоидным набором хромосом часто ассоциируются с Т-клеточным фенотипом ОЛЛ и могут иметь неблагоприятный прогноз. Наиболее часто в трисомии вовлекаются следующие хромосомы: 4, 6, 10, 14, 17, 18, 21 и X. Дополнительные структурные аномалии, как правило, являются типичными для ОЛЛ.
иммунологически фенотипом лейкоза. Ьашрей с соавторами обнаружили у больных с 1(4;1 1) перестройку генов тяжелых цепей иммуноглобулинов, что позволяет говорить о В-клеточной природе заболевания. Описаны также врожденные ОЛЛ с 1(4;11). При наличии у пациентов этой аберрации прогноз заболевания крайне тяжелый. Ремиссии удается достичь примерно у 50-60% больных, а ее продолжительность составляет всего 3 месяца. Для мониторинга минимальной резидуальной болезни можно использовать методы ПЦР и Р18И.
Для больных ОЛЛ характерны нарушения кариотипа, затрагивающие хромосому 8-й пары, где расположен с-тус онкоген, и области локализации генов тяжелых и легких цепей иммуноглобулинов - 2р12,14д32 и 22д11. Образуется !(2;8)(р12;д24) и ее варианты: !(8;14)(д24;д32), !(8;22)(д24;д11), которые приводят к активации онкогена с-тус, увеличивающейся его транскрипции и, в конечном счете, к неопластической трансформации. Иммунологически характерен В-клеточный вариант. Для пациентов с описанными выше аберрациями типичны поражение ЦНС, гепатоспле- номегалия, лимфаденопатия, резко повышенные уровни мочевой кислоты и лактатдегидрогеназы в крови. Ранее такие нарушения кариотипа относили к прогностически неблагоприятным хромосомным аномалиям. Используя современные протоколы терапии, полную ремиссию удается достичь у 86% взрослых больных, а
3- летняя выживаемость у них составляет 74%.
Для больных с Т-клеточным вариантом ОЛЛ типичными являются изменения кариотипа, затрагивающие точки локализации ге- ПНр://шшш.Ье51тедЬоок.сот/
| 1 1 ! ' '8 * 1 'I в М1 й 1 •* «1 :'Д л
'4 А 1 '* в 1 'А 0 1 'ХА' >Д 4. 1
19 20 21 22 г у
Рис. 4. Кариограмма пациента С. Ю. В.: 46, ХУ. де18(д24)
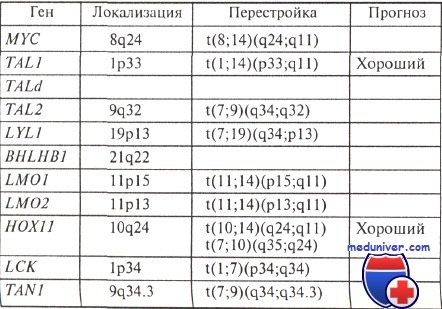
нов Т-клеточных рецепторов. Примером может служить 1(8; 14) (д24;д11), при которой с-тус онкоген патологически экспрессирован. В результате слияния генов МУС, картированного на 8(]24, и ТСКО, локализованного на 14д, образуется химерный ген, кодирующий протеин с новыми свойствами. Эта транслокация обусловливает крайне тяжелый прогноз заболевания (медиана выживаемости составляет 5 месяцев).
Приблизительно у 5% больных ОЛЛ встречается изолированная делеция Йе18(д24), которая также ассоциируется с крайне неблагоприятным прогнозом заболевания (рис. 4).
Делеция длинного плеча 6 хромосомы (йе1 6(д21)) (рис. 5) является характерным нарушением для ОЛЛ и встречается у 5-10% пациентов. На уровне 6д21-24 располагается онкоген с-шуЬ, гиперэкспрессия которого обнаруживается во всех случаях заболеваний с Йе16(д21). Большей частью аномалия встречается при соттоп ОЛЛ. Прогноз заболевания при данном нарушении кариотипа относительно благоприятный, медиана выживаемости составляет около 38 месяцев.
Однако описываются случаи обнаружения йе16(д) и при ОНЛЛ и ХМЛ. В этих случаях пациенты часто имеют дополнительные хромосомные нарушения. -
Данная аномалия обнаруживается при всех вариантах ОНЛЛ, но чаще наблюдается при ОНЛЛ Мб (26% всех ед-ОНЛЛ случаев). Как правило, уровни поломок находятся на д12 27. причем в 80% наблюдений вовлекается 6д21—23 район. Экспрессия с-туЬ обнаруживается во всех случаях.
| Рис. 6. Кариограмма пациентки Я.Р. А.: 46, XX, 1(1; 19)^23;р13) |
Транслокация 1(1;19)(я23;р13) (рис. 6) встречается в 3% всех случаев ОЛЛ с кариологическими нарушениями.
Это нарушение ассоциируется с рге-Б-ОЛЛ фенотипом. Молекулярные особенности 1(1; 19) в настоящее время до конца не изучены. Однако известно, что аберрация приводит к слиянию Е2А
гена, картированного на 19р13, с РВХ1 геном, расположенным на 1д23. Беёега и соавторы обнаружили в экспериментах на животных, что данный химерный ген индуцирует не только пролиферацию и апоптоз, но и злокачественные лимфомы у животных.
Прогностические особенности 1(1; 19) не совсем ясны, однако большинство исследователей показывают, что данная аберрация обусловливает неблагоприятный исход заболевания. У большинства больных рецидив наступает в течение года после достижения ремиссии.
Транслокация !(12;21)(р13;д22) — наиболее часто встречающаяся при В-клеточном ОЛЛ аномалия кариотипа у детей. Она является криптической (скрытой), не выявляющейся при стандартном цитогенетическом исследовании. Данная аберрация выявляется при помощи молекулярно-генетических методов исследования в 19-27% детских ОЛЛ. У взрослых описаны лишь единичные случаи. На молекулярном уровне вследствие транслокации образуется химерный ген из генов ТЕЬ (12р13) и АМЫ (2Ц22). Клинически данная транслокация ассоциируется с возрастом больных от
1 до 10 лет, относительно невысоким лейкоцитозом (
Лейкемия характеризуется неконтролируемым размножением белых кровяных клеток (лейкоцитов). У части пациентов с лейкемией имеются хромосомные аномалии, которые может определить опытный цитогенетик.
Цитогенетик - это специалист, занимающийся исследованием наследственности методом выявления хромосомных аномалий в специально культивированных клетках организма. Для цитогенетического обследования при лейкемии на анализ берется проба костного мозга из бедренной кости и используется для выявления хромосомных аномалий, которые обуславливают различные типы нарушений роста клеток крови.
Культура клеток костного мозга
Костный мозг активно продуцирует клетки крови - эритроциты, лейкоциты и тромбоциты. Высокая способность клеток костного мозга к делению используется для изучения хромосом, содержащихся в их ядрах.
Для культивации небольшое количество костного мозга помещается в специальную пробирку, содержащую обогащенную питательную среду, а затем инкубируется в течение 24 часов. При этом клетки, находящиеся в процессе клеточного деления (митоза), останавливаются на стадии метафазы, в которой хромосомы становятся видимыми под микроскопом.
Лабораторный метод
В лаборатории клеточные культуры пропитываются гипотоническим раствором, который способствует набуханию клеточных ядер, что позволяет хромосомам свободно плавать в цитоплазме клетки. Затем клетки фиксируются, помещаются на предметное стекло и окрашиваются для облегчения исследования.
Полученные препараты изучаются с помощью светового микроскопа. Они тщательно просматриваются с целью обнаружения клеток на стадии метафазы, на которой возможно рассмотреть хромосомы.
При 1200-кратном увеличении хромосомы имеют определенный характер поперечной исчерченности, который позволяет идентифицировать каждую хромосому в наборе. Клетки человеческого организма содержат по 46 хромосом, составляющих 23 пары. Полный набор хромосом в клетке называется кариотилом.
Опытный цитогенетик исследует хромосомы и может определить несоответствие их количества или структуры.
Манипуляции с хромосомами
В настоящее время разработана компьютерная система анализа, которая помогает в распознавании хромосом. Она позволяет перемещать видимые хромосомы на экране монитора и составлять кариограмму, в которой 46 отдельных хромосом находятся в парах. Любое несоответствие в этих парах можно легко увидеть при данном методе.
Обнаружение нарушений структуры и количества хромосом является признаком заболевания и помогает в диагностике и определении прогноза лейкемии.
На кариограмме показаны пары хромосом. Внизу справа изображены половые хромосомы.
Хромосомные аномалии
Выявление хромосомных аномалий играет важную роль в определении типа лейкемии и прогноза заболевания.
Лейкемия делится на типы в зависимости от вовлечения в раковый процесс тех или иных видов белых кровяных клеток (лейкоцитов). Не во всех случаях лейкемии у пациента имеются хромосомные аномалии. Но если они обнаруживаются, это значительно облегчает определение типа лейкемии.
Интерпретация результатов
На основании данных, полученных в результате крупных клинических исследований, был составлен список хромосомных аномалий, встречающихся при лейкемии.
Результаты цитогенетического исследования в сочетании с другими данными позволяют всех пациентов с лейкемией распределить на три группы: благоприятного, среднего и неблагоприятного прогноза для жизни. Этот принцип разделения на группы широко используется гематологами и терапевтами и с учетом индивидуального прогноза пациента дает возможность подобрать наиболее подходящую схему лечения в каждом случае.
Транслокация
Первая стойкая (постоянная) хромосомная аномалия, обнаруженная при лейкемии, была описана в 1960 году, когда исследователи из Филадельфии определили, что у пациента с хронической гранулоцитарной лейкемией в одной из самых мелких хромосом - 22-й недостает большого участка. Впоследствии выяснилось, что этот участок был потерян в результате транслокации (обмена материалом) между двумя отдельными хромосомами - 9 и 22.
В течение многих лет эта хромосомная аномалия была единственной, используемой для диагностики соответствующего типа лейкемии. В дальнейшем, в 1970 году, с появлением специфических методов окраски хромосомных препаратов, стало возможным выявление и других хромосомных аномалий при различных типах лейкемии.
Описанные хромосомные аномалии при лейкемии
Так называемая филадельфийская хромосома была первой хромосомной аномалией, описанной при хронической гранулоцитарной лейкемии. В результате транслокации (обмена генетическим материалом) произошел перенос части 22-й хромосомы на 9-ю с образованием маленькой хромосомы (обозначена кружком).
Другая стойкая транслокация между хромосомами 15 и 17 характерна для острой промиелоцитарной лейкемии. Выявление этой хромосомной аномалии может быть использовано для подтверждения диагноза.
Транслокация между 4-й и 11-й хромосомами определяется при острой лимфобластной лейкемии, которая наиболее часто встречается у детей младшего возраста.
Инверсия хромосомы 16, показанная справа, едва различима. Центральный участок, вовлеченный в процесс ротации, достаточно сложно обнаружить. Встречается при острой миеломоноцитарной лейкемии с эозинофилией.
Визуализация хромосомных аномалий при лейкемии
С помощью специально приготовленных флюоресцентных меток, применяемых для каждой хромосомы, можно идентифицировать наличие делеции (отсутствие участка) или транслокации (его перемещение на другую хромосому). К тому же специальные флюоресцентные метки могут быть использованы на очень маленьких специфических участках хромосом, и аномалии хромосом определены даже в клетках, которые находятся не в фазе активного деления (митоз), а в фазе покоя (интерфаза). Для визуализации этих флюоресцентных меток необходим световой микроскоп с набором специальных фильтров.
Читайте также:

