Хирургия рака желудка давыдова
Informo, ergo sum!

Московского
Онкологического
Общества
| №1 (574) 2011 ЯНВАРЬ |
ЗАСЕДАНИЕ 574
состоится во вторник 27 января 2011 г. в 17:00
в конференц-зале клиники Российского онкологического
научного центра им. Н.Н. Блохина
Президиум: проф. А.И. Пачес, академик РАН и РАМН,
проф. М.И. Давыдов
ОДНОМОМЕНТНЫЕ ЭЗОФАГОГАСТРЭКТОМИИ
ОДНОМОМЕНТНАЯ ЭЗОФАГОГАСТРЭКТОМИЯ В ОНКОЛОГИИ
Давыдов М.М., Туркин И.Н.
(Российский онкологический научный центр им. Н.Н. Блохина)
Фиксированные выступления в прениях
Вашакмадзе Л.А., Мамонтов А.С. (МНИОИ им. П.А. Герцена)
Мазурин В.С., Аллахвердян А.С. (МОНИКИ им. М.Ф. Владимирского)
ЭНЦИКЛОПЕДИЯ ХИРУРГИИ РАКА ЖЕЛУДКА
Давыдов М.И., Туркин И.Н., Давыдов М.М.
В 2011 г. выходит в свет книга, основанная на многолетнем опыте хирургии рака желудка, опыте, которым располагает отдел торако-абдоминальной онкологии Российского онкологического научного центра им. Н.Н. Блохина:
М.И. Давыдов, И.Н. Туркин, М.М. Давыдов
ЭНЦИКЛОПЕДИЯ ХИРУРГИИ РАКА ЖЕЛУДКА.
Книга создана как иллюстрированное практическое руководство с акцентом на технические нюансы хирургических вмешательств. Ее главная цель – представить идеологию хирургического лечения больных раком желудка, помочь освоить современную хирургию рака желудка.
Представленная работа будет востребованной и полезной хирургам, занимающимся лечением больных раком желудка.
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY
№ 574 (January 27, 2011)
ONE-STEP ESOPHAGO-GASTRECTOMIES IN ONCOLOGY
Report: ONE-STEP ESOPHAGO-GASTRECTOMIES FOR CANCER LESIONS OF ESOPHAGUS AND STOMACK. By Dr. M.M. Davydov, Prof. I. Turkin, et al. (The N.N. Blokhin Russian Cancer Research Center).
Discussion: Prof. L. Vashakmadze et al. (The P.A. Hertzen Moscow Research Institute of Oncology).
Prof. V. Mazurin et al. (The M.V. Vladimirsky Moscow Region Research Clinical Institute).
Book-presentation: ENCYCLOPEDIA OF GASTRIC CANCER SURGERY. By Prof. M.I. Davydov, Prof. I.N. Turkin, Dr. M.M. Davydov (The N.N. Blokhin Russian Cancer Research Center).
ОДНОМОМЕНТНАЯ ЭЗОФАГОГАСТРЭКТОМИЯ В ОНКОЛОГИИ
Давыдов М.М., Туркин И.Н.
(Российский онкологический научный центр им. Н.Н. Блохина)
Публикации, посвященные одномоментной гастрэктомии и трансторакальной субтотальной резекции пищевода в онкологии, выполняемой по вынужденным показаниям, единичны. Одна из причин – высокий риск и сложность этих вмешательств, из-за чего у подавляющей части пациентов лечение ограничивается паллиативными мерами. Лишь в немногих работах авторы демонстрируют отдельные успешные случаи, причем большинство таких операций не сопровождаются полноценной забрюшинной и медиастинальной лимфодиссекцией.
Одним из наиболее частых показаний к одномоментной эзофагогастрэктомии является синхронный рак желудка и грудного отдела пищевода – редкая, но отнюдь не казуистическая сочетанная патология (рис. 1А). Частота ее составляет от 3,9 до 4,6%.
Не всегда вторую опухоль возможно выявить на дооперационном этапе: при стенозирующем раке пищевода синхронный рак желудка часто оказывается интраоперационной находкой, что требует от хирурга принять ответственное решение – значительно расширить объем вмешательства, либо признать случай иноперабельным и ограничиться симптоматическими мерами.
Высокое распространение рака желудка на пищевод и наличие отсевов в стенке пищевода также является одним из показаний к одномоментной эзофагогастрэктомии (рис. 1Б). Наличие отсевов свидетельствует о подслизистом распространении опухоли по типу ракового лимфангоита, граница которого всегда выше визуально и пальпаторно определяемой.
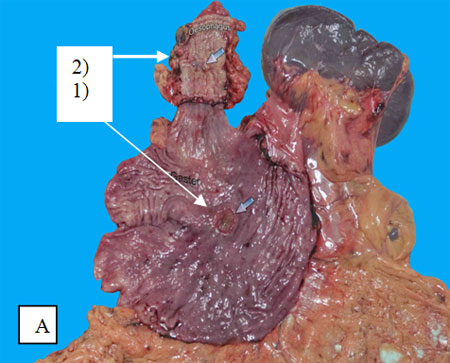
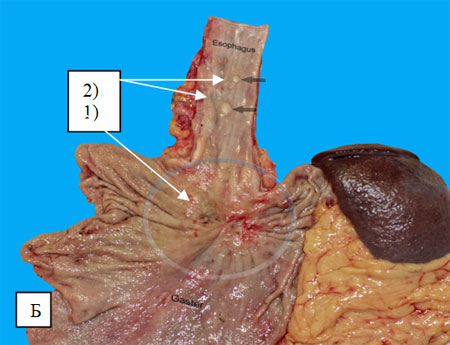
Рис. 1. Макропрепараты после одномоментной эзофагогастрэктомии.
А) Синхронный рак тела желудка (1) и грудного отдела пищевода (2).
Б) Кардио-эзофагеальный рак (1) с отсевами в стенке пищевода (2).
На наш взгляд эта стратегия имеет существенные недостатки:
Для пластического замещения пищевода нами использовалась ободочная кишка. Предоперационное обследование всегда включало колоноскопию для исключения первично- множественного поражения и лапароскопию для исключения перитонеальной диссеминации. Ангиография, как метод изучения особенностей ангиоархитектоники ободочной кишки, не применялась (являясь инвазивной методикой, она не дает исчерпывающей информации о функциональных особенностях сосудистой системы ободочной кишки. Предоперационная пероральная деконтаминация толстой кишки антибиотиками, по нашим данным, не влияет на частоту послеоперационных осложнений. При подготовке к операции ограничиваемся механической очисткой кишечника (прием фортранса / очистительные клизмы).
При планировании эзофагогастрэктомии мы отдаем предпочтение изоперистальтической пластике левой половиной ободочной кишки, которая показала хорошие функциональные результаты. Реже использовался антиперистальтический трансплантат на средних ободочных сосудах. Во всех случаях нам удавалось выкроить достаточный по длине, адекватно кровоснабжаемый трансплантат.
С 1980 по 2010 гг. в РОНЦ выполнено 38 эзофагогастрэктомий, из них 21 по поводу синхронного рака желудка и грудного отдела пищевода и 14 – по поводу рака желудка с распространением на пищевод. Кроме того, трижды нам приходилось использовать этот вид вмешательства в ургентных ситуациях у больных раком желудка на фоне перфорации пищевода. В одном наблюдении перфорация на уровне ретроперикардиального сегмента с развитием медиастинита носила ятрогенный характер и возникла при выполнении эзофагогастроскопии. Во втором, при стенозирующей опухоли проксимального отдела и тела желудка перфорация на уровне ретроперикардиального сегмента с развитием медиастинита была спонтанной. В третьем наблюдении медиастинит и эмпиема плевры справа на фоне пищеводно-плеврального свища были связаны с перфорацией дивертикула грудного отдела пищевода.
В 34 случаях операция выполнялась из двух последовательных доступов – срединной лапаротомии и боковой торакотомии справа по V межреберью в положении больного на левом боку. Лишь у четырех больных вмешательство выполнялось в три этапа, когда операция начиналась с торакотомии в связи с тем, что данные дооперационного обследования не позволяли окончательно оценить резектабельность опухоли пищевода. Между тем, в литературе описаны наблюдения выполнения эзофагогастрэктомии в 4 и даже в 7 этапов (Карачун А.М., 2003):
- Лапаротомия. Ревизия. Опухоль желудка удалима. Толстая кишка без патологии.
- Переднебоковая торакотомия в V межреберье справа. В бифуркационном сегменте пищевода ограниченно смещаемая инфильтративная опухоль протяженностью примерно 7–8 см, прораставшая все слои стенки органа.
- Абдоминальный этап. Мобилизован абдоминальный сегмент пищевода, прошит двумя аппаратами и пересечен между ними. Края лапаротомной раны сведены зажимами.
- Торакотомный этап. Трахеальный сегмент пищевода мобилизован с окружающей клетчаткой, прошит аппаратами и пересечен между ними. Поэтапно пищевод острым путем мобилизован и резецирован. Часть опухоли в связи с врастанием в левый главный бронх оставлена.
- Абдоминальный этап. Учитывая паллиативный характер резекции пищевода от выполнения забрюшинной лимфодиссекции решено отказаться. Гастрэктомия без спленэктомии. Сформирован изоперистальтический толстокишечный трансплантат из правой половины ободочной кишки на средней толстокишечной артерии, аппендэктомия. При оценке кровоснабжения орального конца трансплантата кровоток в сосудах подвздошной кишки признан недостаточным. Подвздошная кишка резецирована.
- Торакальный этап. Трансплантат проведен в плевральную полость. Сформирован эзофагоцекоанастомоз двухрядным узловым швом в куполе правого гемиторакса.
- Абдоминальный этап. Поперечная ободочная кишка пересечена в средней трети, аборальный конец толстокишечного трансплантата анастомозирован с тощей кишкой. Межкишечный анастомоз по Брауну, илео-трансверзоанастомоз.
Оптимальная последовательность этапов, по нашему мнению, должна быть тщательно продумана до вмешательства – это позволяет сократить время операции и минимизировать операционную травму.
ТЕХНИКА ЭЗОФАГОГАСТРЭКТОМИИ. МЕТОДИКА РОНЦ им. Н.Н. БЛОХИНА
Абдоминальный этап. Типично выполняется экстирпация желудка либо надпривратниковая гастрэктомия с D2-лимфодиссекцией. Надпривратниковая гастрэктомия как альтернатива экстирпации желудка выполняется при раке проксимального отдела локализованного типа, если субпилорические лимфоузлы интактны, а отступ от края опухоли составляет не менее 10 см (рис. 2А). Остающаяся часть желудка представлена только привратником.




Частичная диафрагмотомия выполняется всегда – не только с целью иссечения внутридиафрагмальных и наддиафрагмальных лимфатических узлов, но и для предотвращения удавливания толстокишечного трансплантата после перемещения его в плевральную полость.
Подготовка толстокишечного трансплантата. При эзофагогастрэктомии чаще всего применяется пластика левой половиной ободочной кишки. Ободочную кишку мобилизуют на всем протяжении.
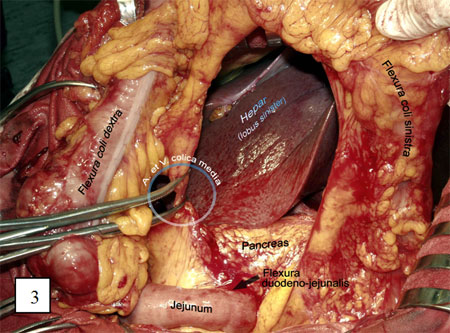
Рис. 3. Выделение и пересечение средних ободочных сосудов.
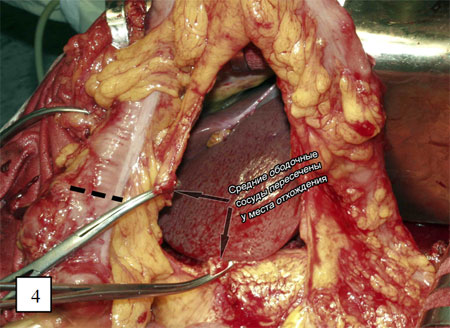
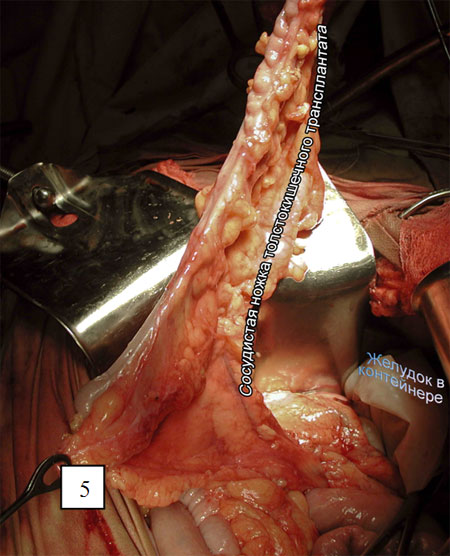
Рис. 4 и 5. Пересечение ободочной кишки в проксимальном направлении.
Выделяют начальный отдел средних ободочных сосудов, лигируя и пересекая их у места отхождения (рис. 3). Ободочную кишку и сосудистую аркаду пересекают в проксимальном направлении с таким расчетом, чтобы оральный конец трансплантата свободно достигал яремной вырезки грудины (рисунки 4 и 5).
Дистально толстую кишку пересекают на границе нисходящего отдела и сигмовидной кишки, сохраняя аркаду и прямые сосуды. Кровоснабжение трансплантата осуществляется из левых ободочных сосудов (рис. 6). Пластика левой половиной ободочной кишки на средних ободочных сосудах предпочтительна только в случаях когда калибр левой ободочной артерии значительно уступает калибру средней (рис. 7).
Трансплантат укладывают, ориентируя его верхушку в диафрагмальном окне, таким образом, чтобы не допустить его перекрута вокруг оси при перемещении в правую плевральную полость на торакальном этапе.

Рис. 6. Схема формирования изоперистальтического трансплантата из поперечно-ободочной кишки с кровоснабжением из левой ободочной артерии.
Рис. 7. Схема формирования антиперистальтического трансплантата из левой половины ободочной кишки с кровоснабжением из средней ободочной артерии.

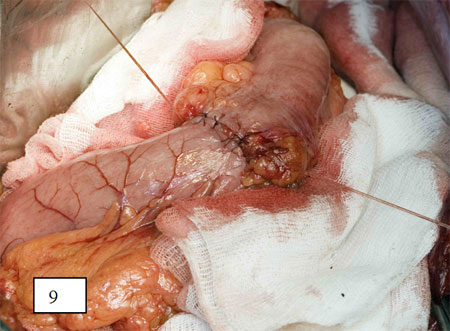
Рис. 9. Формирование толстокишечно-желудочного анастомоза после надпривратниковой гастрэктомии.
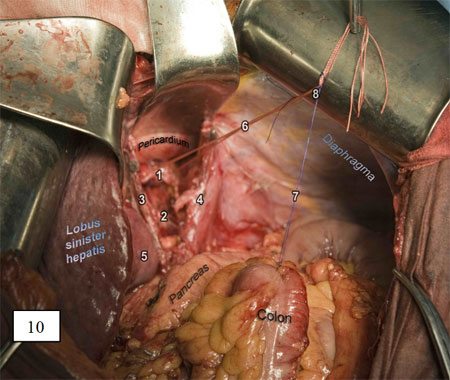
Рис. 10. Нити, фиксирующие толстокишечный трансплантат и пищевод, связаны. Они играют роль проводника при перемещении толстой кишки в плевральную полость.
Торакальный этап. Выполняется боковая торакотомия по V межреберью. После окончания мобилизации пищевода с медиастинальной лимфодиссекцией рассекают пищеводно-диафрагмальную связку, после чего толстокишечный трансплантат за нить-проводник выводят в правую плевральную полость через диафрагмальное окно, не допуская его перекрута по оси.
Пищевод пересекают на уровне трахеального сегмента, оставляя небольшой избыток слизистой. Окончательный вид операционного поля после типичной трансторакальной резекции грудного отдела пищевода представлен на рис. 11.

Рис. 11. Вид операционного поля после резекции грудного отдела пищевода с билатеральной медиастинальной лимфодиссекцией.
На рис. 12 представлены препараты после надпривратниковой гастрэктомии с резекцией грудного отдела пищевода (12А) и после тотальной гастрэктомии с резекцией грудного отдела пищевода (рис. 12Б).
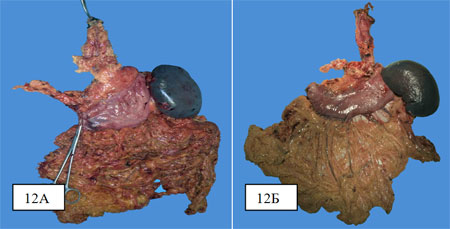
Непосредственные результаты. В группе из 38 оперированных частота послеоперационных осложнений составила 28,9%; умерли 3 (7,9%) больных – от гнойно-септических осложнений вследствие некроза толстокишечного трансплантата, деструктивной двухсторонней пневмонии, острой печеночной недостаточности.
ЭНЦИКЛОПЕДИЯ ХИРУРГИИ РАКА ЖЕЛУДКА
Давыдов М.И., Туркин И.Н., Давыдов М.М.
Из предисловия: Ситуация, отражающая состояние диагностики и лечения рака жeлyдкa в России драматична: одногодичная летальность этой категории больных составляет 57%. Выявление рака в ранних стадиях, с учетом возможностей современной онкологии, было бы идеальным решением проблемы, однако, как показал мировой опыт, массовый скрининг, за исключением Японии, не привел к желаемым результатам.
Не оправдываются пока надежды, возлагаемые онкологами на различные схемы мультимодальной терапии.
Отдаленное метастазирование обусловлено биологическими особенностями опухоли и относится к хирургически неконтролируемым факторам прогноза. Проблема же локорегионарного рецидивирования находится в пределах досягаемости хирургического метода и в значительной степени определяет место и принципы этого метода в онкологии.
На сегодняшний день объем хирургического вмешательства, набор технических приемов и их последовательность в различных хирургических клиниках весьма вариабельны, что делает невозможным корректное сравнение как непосредственных, так и отдаленных результатов оперативного лечения рака желудка. В связи с этим назрела острая необходимость стандартизации операций при раке желудка. Главные ее задачи – обеспечение онкологической адекватности и технической безопасности вмешательства, а также профилактика послеоперационных хирургических осложнений и максимально возможная функциональность.
Настоящая книга построена не по принципу классического научного труда. Она задумана как иллюстрированное практическое руководство с акцентом на технические нюансы хирургических вмешательств.
Ее главная цель – представить идеологию хирургического лечения рака желудка в РОНЦ им. Н.Н. Блохина, сформировать у читателя философию хирурга-онколога, помочь освоить современную хирургию рака желудка. Хирургию в том виде, в каком она должна быть с точки зрения хирурга-онколога: агрессивная, носящая примерно в половине наблюдений комбинированный характер, сопровождающаяся широкой превентивной лимфодиссекцией.
Представленные методологические приемы операций основаны на многолетнем опыте отдела торако-абдоминальной онкологии Российского онкологического научного центра им. Н.Н. Блохина (зав. – академик РАН и РАМН, проф. М.И. Давыдов). Их использование позволит хирургам избежать многих интра- и послеоперационных осложнений, а также минимизировать вероятность местного рецидива.
Большое внимание в книге уделено многочисленным вариантам сосудистой системы желудка, значению лимфогенного метастазирования, сравнительной характеристике применяемых в настоящее время классификаций рака желудка.
Коллективом отделения эндоскопии РОНЦ им. Н.Н. Блохина (зав. – проф. Г.В. Унгиадзе) представлен опыт, касающийся радикальных эндохирургических вмешательств при раннем раке желудка.
Из представленных в настоящем руководстве 1038 фотографий и схематических изображений 1009 являются оригинальными. Рисунки выполнены К.В. Телициной и Т.А. Красавиной. Единичные иллюстрации заимствованы из современных отечественных и зарубежных руководств по хирургии рака желудка. Гистологическая классификация рака желудка и фотографии гистологических препаратов представлены отделом патологической анатомии опухолей человека РОНЦ им. Н.Н. Блохина (зав. – проф. А.И. Карселадзе). Рентгенограммы представлены отделом лучевой диагностики и рентгенохирургических методов диагностики и лечения (зав. – чл.-корр. РАМН, проф. Б.И. Долгушин).
Раздел по анатомии лимфатической системы основан на результатах исследований нашего соотечественника, пионера лимфологии профессора Д.А. Жданова, работы которого по настоящее время являются основополагающими в понимании механизмов лимфогенного метастазирования рака желудка.
Мы надеемся, что представленная работа окажется востребованной и полезной для хирургов, занимающихся лечением больных раком желудка.

Глава кафедры онкологических заболеваний
Специализация
До 2017 года руководил РОНЦ им. Н.Н. Блохина. Этот исследовательский центр является крупнейшим научным центром онкологии как в России, так и в европейских странах. Современное медицинское оборудование, внедрение и использование передовых технологий и методик, большой опыт в своевременной диагностике и лечении раковых опухолей – вот основной перечень характеристик РОНЦ, объясняющих его популярность и вес обществе. На его счету огромное количество людей, которым была оказана высококвалифицированная и своевременная помощь в лечении онкологических опухолей. В РОНЦ более 3000 человек штатных сотрудников, из них академики Российской академии наук, корреспонденты академии наук, большое количество профессоров и докторов наук. Михаил Иванович, будучи директором данного центра, внёс весомый вклад в его развитие.
Научные достижения врача Давыдова, внедрение высоких технологий, методик лечения в области онкологических новообразований легкого, желудка и пищевода имеют большую актуальность и значимость.
Профессор Давыдов специализируется на хирургическом лечении онкологии пищевода, желудка и лёгких. На его счету колоссальное количество успешно проведённых операций и спасённых от рака пациентов. В области онкологии желудка, легкого и пищевода Михаил Иванович проводит не только операции по удалению опухолей, но также совершенствует методы лечения и работает над созданием новых. Т.е. наука в его деятельности занимает одно из ведущих мест.
Давыдов М. И имеет в своём арсенале много государственных наград, грамот и орденов. В их числе награды за научную деятельность, вклад в развитие практической медицинской работы, за достижения в онкологии. Знаменитый хирург-онколог издал большое количество научных работ, в том числе монографий, являлся руководителем разнообразных кандидатских и докторских диссертаций. В настоящее время его научно-методических фильмы смотрят студенты медицинских учебных заведений.
Если спросить у профессора Давыдова о том, как он решил пойти в медицину, а именно в хирургию, то он вам ответит, что это было спонтанное решение, ранее не планируемое. Сначала он учился в Суворовском военном училище в г. Киеве. Решение пойти в хирурги у нему пришло, когда он служил в армии и прочитал произведения писателя Германа. Там герой пошел в хирурги-фронтовики и Михаил Иванович внезапно решил последовать его примеру, ничего не понимая в хирургии. Поэтому, в 1975 году он заканчивает Первый мед. институт. В этом учебном заведении он стал лаборантом в оперативной хирургии. Определился со специализацией хирурга-онколога, будучи обучаясь в ординатуре, в которую поступил вскоре после окончания института. Сам Михаил Иванович планировал стать сосудистым хирургом, но вследствие какого-то конфликта, ему предложили онкологическое направление. Так он попал на Каширку, в торакальное отделение. Там он получил хороший опыт благодаря блестящему и талантливому хирургу этого отделения – Анатолию Ивановичу Пирогову.
После окончания ординатуры, будущий выдающийся хирург-онколог Давыдов М.И. остался работать младшим научным сотрудником в этом торакальном отделении. Находясь на этой должности, был направлен консультантом от ВОЗ в Северную Корею. В этой стране, на глазах японских коллег, впервые провёл операцию на желудок, который японцы посчитали неоперабельным. В Корее он также начал проводить другие сложные операции, которые затем воспроизводил в российских условиях. Некоторые из хирургических вмешательств были уникальны в России.
После окончания аспирантуры и защиты кандидатской диссертации в 1980 году, Михаил Иванович назначается старшим научным сотрудником. Через 8 лет Давыдов становится доктором медицинских наук, успешно защитив диссертацию по раку желудка. Став доктором наук, Давыдов занимает должность руководителя торакального отделения центра им. Н. Н. Блохина. В 70 лет хирург Давыдов оставляет пост директора исследовательского центра им. Н. Н. Блохина.
Если говорить про Давыдова Михаила Ивановича как о личности, то помимо медицинской научно-практической деятельности, по жизни он увлекается классической музыкой, в свободное время любит читать книги, слушать музыку, а также охотиться.
Лауреат Государственной премии РФ в области науки и техники (2002), Заслуженный деятель науки РФ. Главный онколог медицинского центра Управления делами Президента РФ, заведующий кафедрой онкологии Первого Московского Государственного Медицинского университета им. И.М.Сеченова. Член Европейского и Американского общества хирургов, член Международного общества хирургов, член Нью-Йоркской академии наук.
В 2003 году принят действительным членом в Российскую академию наук, в 2004 году — в Российскую академию медицинских наук. В 2006 году избран президентом РАМН. Занимал этот пост до 1 марта 2011 года.
Научная и практическая деятельность академика Давыдова посвящена разработке новых и совершенствованию существующих методов оперативного лечения опухолей лёгкого, пищевода, желудка, средостения. Он разработал принципиально новую методику внутриплевральных желудочно-пищеводных и пищеводно-кишечных анастомозов, отличающуюся оригинальностью технического выполнения, безопасностью и высокой физиологичностью. За счёт применения медиастинальной и ретроперитонеальной лимфодиссекции улучшены результаты лечения рака пищевода, лёгкого, желудка.
М.И. Давыдов первым в онкохирургии стал проводить операции с пластикой полой вены, лёгочной артерии, аорты. Им разработан метод комбинированной резекции пищевода с циркулярной резекцией и пластикой трахеи при раке пищевода, осложнённом пищеводно-трахеальным свищом.
М.И. Давыдовым создана школа онкологов-хирургов, занимающихся вопросами уточненной диагностики и совершенствования лечения злокачественных опухолей с привлечением самых современных достижений различных направлений экспериментальной и практической онкологии. Под его руководством защищено 53 докторских и 50 кандидатских диссертации. Он является автором и соавтором более 900 научных работ, включая 34 монографии и 9 научно-методических фильмов.
Деятельность Михаила Давыдова отмечена Государственной премией РФ и званием Заслуженного деятеля науки Российской Федерации.
1997 год – заслуженный деятель науки РФ.
2001 год – присуждена премия имени Т.И.Ерошевского за лучшую медицинскую работу в области медицинской геронтологии и гериатрии.
2002 год – награжден Орденом Почета.
2008 год – лауреат премии "Триумф-наука" в области наук о жизни и медицины.
2013 год – Почетный член академии художеств России (постановление Президиума академии художеств России от 24.12.2013г).
2014 год – лауреат российской премии Людвига Нобеля.
2015 год – Главный онколог МЗ РФ, академик РАН Михаил Иванович Давыдов избран Почетным доктором Института экспериментальной медицины за выдающиеся достижения в онкологии.
Наименование работы
Название издательства, год издания
Соавторы
Современные принципы выбора лечебной тактики и возможности хирургического лечения немелкококлеточного рака легкого
В кн.: Новое в терапии рака легкого gпод. ред. Н.И. Переводчиковой (терапия рака легкого начала ХХI века), Москва, 2003, с. 41-53
Внутриплевральная колоэзофагопластика в лечении больных раком пищевода
Рак желудка [С16]
Энциклопедия клинической онкологии: Руководство для практических врачей. РЛС, стр. 223 - 237
Хирургическое лечение солитарных и единичных метастазов рака почки в легкие
Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вен
Хирургическое лечение местного рецидива рака почки после нефрэктомии
Перспективы адоптивной иммунотерапии радикально оперированного рака желудка
Киселевский М.В. Титов К.С.
Эволюция представлений о хирургии рака легкого от эпохи проф. Б.Е.Петерсона до наших дней.
Полоцкий Б.Е. Волков С..М.
Организация онкологической помощи в России и распространенность злокачественных новообразований среди взрослых
Место видеохирургии в диагностике объемных образований органов грудной клетки
Комов Д.В. Комаров И.Г.
Санкт-Петербург, 2013, ISBN 978-5-93929-234-4

Лауреат Государственной премии РФ в области науки и техники (2002), Заслуженный деятель науки РФ. Главный онколог медицинского центра Управления делами Президента РФ, заведующий кафедрой онкологии Первого Московского Государственного Медицинского университета им. И.М.Сеченова. Член Европейского и Американского общества хирургов, член Международного общества хирургов, член Нью-Йоркской академии наук.
В 2003 году принят действительным членом в Российскую академию наук, в 2004 году — в Российскую академию медицинских наук. В 2006 году избран президентом РАМН. Занимал этот пост до 1 марта 2011 года.
Научная и практическая деятельность академика Давыдова посвящена разработке новых и совершенствованию существующих методов оперативного лечения опухолей лёгкого, пищевода, желудка, средостения. Он разработал принципиально новую методику внутриплевральных желудочно-пищеводных и пищеводно-кишечных анастомозов, отличающуюся оригинальностью технического выполнения, безопасностью и высокой физиологичностью. За счёт применения медиастинальной и ретроперитонеальной лимфодиссекции улучшены результаты лечения рака пищевода, лёгкого, желудка.
М.И. Давыдов первым в онкохирургии стал проводить операции с пластикой полой вены, лёгочной артерии, аорты. Им разработан метод комбинированной резекции пищевода с циркулярной резекцией и пластикой трахеи при раке пищевода, осложнённом пищеводно-трахеальным свищом.
М.И. Давыдовым создана школа онкологов-хирургов, занимающихся вопросами уточненной диагностики и совершенствования лечения злокачественных опухолей с привлечением самых современных достижений различных направлений экспериментальной и практической онкологии. Под его руководством защищено 53 докторских и 50 кандидатских диссертации. Он является автором и соавтором более 900 научных работ, включая 34 монографии и 9 научно-методических фильмов.
Деятельность Михаила Давыдова отмечена Государственной премией РФ и званием Заслуженного деятеля науки Российской Федерации.
1997 год – заслуженный деятель науки РФ.
2001 год – присуждена премия имени Т.И.Ерошевского за лучшую медицинскую работу в области медицинской геронтологии и гериатрии.
2002 год – награжден Орденом Почета.
2013 год – Почетный член академии художеств России (постановление Президиума академии художеств России от 24.12.2013г).
2014 год – лауреат российской премии Людвига Нобеля.
2015 год – Главный онколог МЗ РФ, академик РАН Михаил Иванович Давыдов избран Почетным доктором Института экспериментальной медицины за выдающиеся достижения в онкологии.
Наименование работы
Название издательства, год издания
Соавторы
Современные принципы выбора лечебной тактики и возможности хирургического лечения немелкококлеточного рака легкого
В кн.: Новое в терапии рака легкого gпод. ред. Н.И. Переводчиковой (терапия рака легкого начала ХХI века), Москва, 2003, с. 41-53
Внутриплевральная колоэзофагопластика в лечении больных раком пищевода
Рак желудка [С16]
Энциклопедия клинической онкологии: Руководство для практических врачей. РЛС, стр. 223 — 237
Хирургическое лечение солитарных и единичных метастазов рака почки в легкие
Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вен
Хирургическое лечение местного рецидива рака почки после нефрэктомии
Перспективы адоптивной иммунотерапии радикально оперированного рака желудка
Киселевский М.В. Титов К.С.
Эволюция представлений о хирургии рака легкого от эпохи проф. Б.Е.Петерсона до наших дней.
Полоцкий Б.Е. Волков С..М.
Организация онкологической помощи в России и распространенность злокачественных новообразований среди взрослых
Место видеохирургии в диагностике объемных образований органов грудной клетки
Комов Д.В. Комаров И.Г.
Санкт-Петербург, 2013, ISBN 978-5-93929-234-4
под ред. А.М.Гранова и М.И.Давыдова
ОТВЕТЫ на ВОПРОСЫ о РАКЕ ЖЕЛУДКА >>>
Показанием к хирургическому лечению рака желудка являются установление диагноза операбельного рака желудка и отсутствие общих противопоказаний к операции.
Гастрэктомия с онкологических позиций — полное удаление желудка и всех зон регионарного метастазирования — при отсутствии опухолевых клеток по линиям пересечения пищевода и двенадцатиперстной кишки (гистологически). Гастрэктомию выполняют из абдоминального или комбинированного доступа.
Показания для абдоминального доступа:
1.локализация опухоли с экзофитным или смешанным типом роста в средней трети желудка;
2.одновременное поражение дистальной и средней, средней и верхней трети желудка;
3.тотальное поражение желудка;
4.инфильтративный тип роста опухоли;
5.опухоли в дистальной трети желудка с метастазами в кардиальных, правых и левых желудочно-сальниковых, селезеночных, левых желудочных и поджелудочных лимфатических узлах;
6.опухоли верхней трети желудка с метастазами в правых желудочных, желудочно-сальниковых, привратниковых, поджелудочных и верхних панкреатодуоденальных лимфоузлах;
7.недифференцированные опухоли.
Показания для комбинированного доступа: рак желудка с распространением на пищевод. Используется лапаротомия и боковая торакотомия слева, производимая в шестом межреберье, либо доступ по Гарлоку.
Субтотальная дистальная резекция желудка показана при экзофитном или смешанном типе роста опухоли дистальной трети желудка I, II и III стадии (T1-4 N0-2 M0).
Гастрэктомия. Операцию, как правило, выполняют из верхнесрединного чрезбрюшинного доступа. Максимальные удобства оперирования достигаются правильной укладкой больного. Ось приподнимаемого во время операции стола должна располагаться на 3-4 см выше угла, образованного реберными дугами, на уровне границы между телом и мечевидным отростком грудины.
При комбинированном доступе больного укладывают на правый бок для левосторонней переднебоковой торакотомии. Правую руку вытягивают вперед, а левую запрокидывают за голову и фиксируют к подставке. Правая нога согнута в коленном и тазобедренном суставах, а левая вытянута. Больной лежит на боку несколько запрокинувшись назад. Валик операционного стола должен располагаться против точки пересечения среднемышечной линии с линией предполагаемого разреза по межреберью.
При распространии опухоли желудка на нижнегрудной отдел пищевода операцию начинают либо с верхнесрединной лапаротомии, либо с косой лапаротомии и после ревизии решают вопрос о комбинированном доступе с использованием доступа по Гарлоку — дополнение косой лапаротомии торакотомией в шестом межреберье слева с пересечением реберной дуги; либо торакотомии слева в шестом или седьмом межреберье и формированием анастомоза в левой плевральной полости.
Начальный этап операции — ревизия органов брюшной полости с целью установления распространения опухолевого процесса и возможности выполнения гастрэктомии.
Мобилизацию большого сальника и отделение его от поперечной ободочной кишки начинают с рассечения желудочно-ободочной связки примерно в области средней части ободочной кишки. Желудок захватывают и выводят в рану краниально, поперечную ободочную кишку отводят в противоположную сторону. Хирург левой рукой берет большой сальник и выводит его в рану. Желудочно-ободочная связка натягивается, и ее послойно пересекают в бессосудистой зоне. Производят мобилизацию большого сальника до печеночного угла толстой кишки. Рассекая между зажимами ткань большого сальника, доходят до стенки двенадцатиперстной кишки. Непосредственно у самой ткани поджелудочной железы перевязывают и пересекают правые желудочно-сальниковые сосуды. С пересечением желудочно-ободочной и привратниково-поджелудочных связок блок лимфатических узлов (привратниковые, правые желудочно-сальниковые, верхние панкреатодуоденальные) отходит к удаляемой части желудка.
Затем производят мобилизацию левой половины большого сальника до желудочно-селезеночной связки и проходящих в ней коротких желудочных сосудов. Короткие желудочные сосуды при мобилизации желудка по большой кривизне перевязывают непосредственно у селезенки в желудочно-селезеночной связке. Мобилизацию желудка по большой кривизне заканчивают рассечением слева от пищевода диафрагмально-желудочной связки, фиксирующей дно желудка к диафрагме.
Мобилизация малого сальника. Сальник с помощью зажимов по частям отделяют от печени и пересекают. У привратника непосредственно перевязывают правую желудочную артерию (ветвь обшей печеночной артерии). Производят лимфодиссекцию начиная с печеночных сосудов.
Следующий этап — перевязка левой желудочной артерии и вены. Все лимфоузлы с клетчаткой мобилизуют и сдвигают к желудку. В проксимальном отделе малого сальника перевязывают восходящую ветвь левой желудочной артерии, а затем пересекают справа от пищевода диафрагмально-желудочную связку и переднюю полуокружность пищеводно-диафрагмальной связки, после чего абдоминальный отдел пищевода становится доступным для окончательной мобилизации. Его тупо обводят пальцем и вокруг него проводят резиновую держалку. Пересекают ножницами оба блуждающих нерва.
Для более полной мобилизации пищевода и удобств создания в средостении пищеводно-кишечного анастомоза производят сагиттальную диафрагмотомию по Савиных. На зажимах пересекают lig. gastrodiafragmatica и прошивают нижние диафрагмальные сосуды.
Аппаратом УО-40 на расстоянии 2 см от привратника прошивают двенадцатиперстную кишку, отсекают от нее желудок. Аппаратом УО-40 над кардией прошивают пищевод и пересекают. Желудок с сальниками и лимфоузлами удаляют.
Таким образом, в одном блоке с желудком, малым и большим сальниками оказываются группы лимфоузлов, располагающихся по ходу печеночных сосудов, левой, правой, коротких желудочных артерий, левой и правой желудочно-сальниковых артерий. Двенадцатиперстная кишка дополнительно ушивается по Русанову.
Второй этап операции — формирование эзофагоеюноанастомоза.
Известно несколько десятков способов восстановления непрерывности пищеварительного тракта после удаления желудка, но все они построены на двух основных принципах: эзофагодуоденостомии и эзофагоеюностомии.
Субтотальная дистальная резекция желудка. В онкологической практике субтотальная дистальная резекция желудка способом Бильрот-II является наиболее распространенной операцией. Ревизию и начальную мобилизацию желудка производят так же, как при гастрэктомии, выполняемой из абдоминального доступа.
Мобилизацию и отсечение большого сальника от поперечной ободочной кишки производят вправо до печеночного угла с перевязкой правых желудочно-сальниковых артерий и вены, а влево — до коротких желудочных сосудов.
Мобилизацию желудка по малой кривизне выполняют с отсечением малого сальника непосредственно от печени. Начальный отдел двенадцатиперстной кишки на расстоянии 1-1,5 см ниже привратника мобилизуют так, чтобы вся клетчатка с лимфоузлами отошла к удаляемой части желудка. Правую желудочную артерию перевязывают и пересекают непосредственно у места отхождения от общей печеночной артерии. Малый сальник мобилизуют до пищевода, перевязывают и пересекают пищеводную ветвь левой желудочной артерии.
Перевязка левой желудочной артерии и вены. Все лимфатические узлы с клетчаткой сдвигают к стенке желудка. Левую желудочную артерию перевязывают и пересекают в области отхождения ее от чревного ствола.
Далее намечают линию резекции желудка. По малой кривизне она должна начинаться ниже кардии. По большой кривизне граница резекции располагается на уровне дистальных коротких сосудов желудка. Таким образом, при субтотальной дистальной резекции желудка онкологически правильным будет удаление всего малого и большого сальников (до уровня коротких желудочных артерий) с находящимися здесь лимфатическими узлами и сосудами.
Аппаратом УО-40 на расстоянии 1,5-2 см от привратника прошивают двенадцатиперстную кишку, отсекают, дополнительно ушивают по Русанову. По линии резекции желудка прошивают желудок со стороны малой и большой кривизны с помощью аппаратов УО-40, отсекают и удаляют препарат. Накладывают дополнительные серозно-мышечные швы на малую кривизну желудка до предполагаемой зоны анастомоза.
Следующий этап — формирование анастомоза между оставшейся частью желудка и петлей тощей кишки, проведенной через окно в брыжейке ободочной кишки. Ее располагают изоперистальтически и подшивают к задней стенке культи желудка первым рядом серозно-мышечных швов, потом накладывают непрерывный шов на заднюю и переднюю полуокружности анастомоза и второй ряд серозно-мышечных швов на переднюю стенку анастомоза. Культю желудка укрепляют отдельными швами в окне брыжейки поперечной ободочной кишки так, чтобы анастомоз располагался ниже брыжейки.
Модификации анастомозов. После резекции дистальной части желудка непрерывность пищеварительного тракта восстанавливают одним из двух путей: соединяют культю желудка непосредственно с культей двенадцатиперстной кишки или с начальной частью тощей кишки.
Способ Бильрот-II (1885) — культю желудка и культю двенадцатиперстной кишки закрывают швами наглухо, а непрерывность пищеварительного тракта восстанавливают путем наложения анастомоза между культей желудка и начальным отделом тощей кишки. При этом пища, минуя двенадцатиперстную кишку, поступает непосредственно в тощую.
В настоящее время применяют различные модификации этого способа:
1.Способ Рейхеля-Полиа (1908, 1911) — культю двенадцатиперстной кишки зашивают, а культю желудка не зашивают и на всю ширину просвета анастомозируют с начальной петлей тощей кишки, проведенной через отверстие в брыжейке толстой кишки.
2.Способ Ру (1893) — дуоденальную культю зашивают наглухо, а культю желудка анастомозируют с отводящим концом пересеченной тощей кишки, приводящий конец которой У-образно соединяют соустьем с отводящим концом кишки на 15-20 см ниже желудочно-кишечного анастомоза.
3.Способ Бальфура (1917) — желудочно-кишечный анастомоз накладывают на длинной петле тощей кишки, добавляя межкишечное соустье по Брауну.
4.Способ Гофмейстера-Финстерера (1896), или Спасокукоцкого-Финстерера (1914), или Спасокукоцкого—Вильмса, сейчас применяют чаще всего. Двенадцатиперстную кишку закрывают наглухо. Культю желудка закрывают только частично со стороны малой кривизны и анастомозируют с короткой петлей тощей кишки, проведенной через отверстие в брыжейке поперечной ободочной кишки. Приводящую к анастомозу часть кишки подшивают к культе желудка со стороны малой кривизны. Этим укрепляется наименее прочное место швов анастомоза — на стыке их со швами культи желудка и, кроме того, создается своего рода клапан, препятствующий поступлению содержимого желудка в двенадцатиперстную кишку.
Операция в модификации по Бильрот-I. Многолетний опыт хирургов показал, что:
1.резекция способом Бильрот-I опаснее;
2.при раке она менее радикальна;
3.состояние больных, перенесших это вмешательство, не лучше, чем после резекции, выполняемой способом Бильрот-II.
Операцией выбора следует считать субтотальную дистальную резекцию по Бильрот-П, так как этот способ не сложен технически, связан с наименьшим риском и позволяет всегда сделать операцию наиболее радикально.
Требования к анастомозу: наиболее распространена резекция желудка с наложением анастомоза путем подшивания культи желудка в бок тощей кишки способом Бильрот-II.
Анастомоз должен быть сформирован так, чтобы обеспечивалось беспрепятственное опорожнение желудка через отводящую петлю тощей кишки и предотвращалась возможность поступления желудочного содержимого в приводящую петлю. Содержимое двенадцатиперстной кишки должно свободно поступать в желудок по приводящей петле. Наиболее полно отвечает этим требованиям позадиободочный анастомоз на короткой петле тощей кишки с образованием своего рода клапана путем подшивания к малой кривизне желудка стенки приводящей петли выше анастомоза (по Гофмейстеру-Финстереру).
Такая конструкция анастомоза имеет ряд достоинств:
1.дуоденальное содержимое поступает через приводящую петлю в желудок;
2.меньше возможность эвакуаторных расстройств;
3.при короткой петле эвакуация из двенадцатиперстной кишки происходит свободно и нет застоя содержимого (условия для заживления культи двенадцатиперстной кишки более благоприятны, чем при анастомозе на длинной петле).
Читайте также:

