Химиотерапия рака история развития
На протяжении многих лет было достигнуто лишь небольшое увеличение 5-летней выживаемости больных распространенными видами рака. Небольшого увеличения выживаемости, например, удалось достигнуть для больных с опухолями мочевого пузыря и рака прямой кишки, что отчасти обусловливалось более ранней диагностикой заболевания.
Однако для других опухолей, например для карциномы легкого и поджелудочной железы, в настоящее время сохраняется столь же неблагоприятный прогноз, как и в 1980-е годы. Основной причиной смерти больных являются метастазы лимфо- и гематогенного происхождения. Повышение эффективности методов контроля над ростом первичной опухоли мало сказывается на распространении метастазов, которые часто обнаруживаются на операции.
Поэтому надежду на продление жизни больных связывают с разработкой более эффективных методов борьбы с метастазированием опухоли.
В последние 30 лет системное лечение онкологических больных стало важной составной частью терапии рака. При применении цитотоксических препаратов был достигнут существенный прогресс в лечении таких редких его форм, как опухоли детского возраста, лимфомы и тератомы. Для других, более распространенных, форм были получены менее впечатляющие результаты, хотя при применении химио- и гормональной терапии удалось достичь небольшого увеличения выживаемости больных раком молочной железы и коло-ректальными раками.
Схемы и режимы лечения являются дорогостоящими и обладают побочными токсическими эффектами. Поэтому лечащим врачам необходимо обладать подробными сведениями о возможностях и ограничениях химиотерапии и других методов лечения.
Если существует шанс излечения, то токсичность и стоимость лечения обычно не принимаются во внимание. Если же такого шанса не существует, то необходимо самым тщательным образом принять во внимание возможную пользу от паллиативной химиотерапии и вред от побочных эффектов ее применения.
В 1946 г. в клинической практике стали применять азотистый иприт. Вскоре была продемонстрирована эффективность соединений этого класса по отношению к лимфомам и их токсическое действие на желудочно-кишечный тракт и кроветворение. В 1947 г. Фарбер показал, что аминоптерин вызывает ремиссию у больных с острым лейкозом, а в 1949 г. появился аналогичный препарат — метотрексат.
В клинике быстро появляются другие препараты: 6-меркаптопурин в 1952 г. и противоопухолевый антибиотик актиномицин D в 1954 г. Начиная с 1965 г. были разработаны многочисленные новые антиметаболиты, алкилирующие агенты и антибиотики, обладающие значительной противоопухолевой активностью. По структуре многие из этих препаратов представляли собой аналоги первых эффективных противоопухолевых агентов.
За последние 25 лет в клинической практике стали применять такие эффективные препараты, как эпипододофиллотоксины, соединения платины и таксаны. Эти препараты оказывают прямое действие на ДНК или на процесс деления клеток. В последнее время вызывают интерес соединения с новыми механизмами действия, такие как ингибиторы передачи в клетку внешних сигналов.
Разработка новых противоопухолевых агентов, их доклинические исследования и клинические испытания занимают много времени, и для окончательной оценки эффективности нового лекарства с момента его создания может потребоваться 10 или более лет.

Одна из основных статей расходов нашего фонда — покупка лекарств противоопухолевой терапии. Так, за 2017 год расходы на их покупку для клиник составили более 313 миллионов рублей — и это не считая закупок в рамках адресной помощи.
Дело в том, что противоопухолевая терапия — очень динамично развивающаяся отрасль. Ежегодно в арсенале онкологов и онкогематологов возникают новые лекарства. Какие-то из них позволяют излечивать тех больных, которым раньше ничто не помогало. Какие-то не излечивают полностью, но существенно продлевают жизнь и улучшают ее качество. И почти все новые лекарства, увы, очень дороги. Потом они становятся более доступными, но на рынок выходят новые препараты, которые могут спасти новых пациентов. И вновь это очень дорогостоящие лекарства. Но их цена — это цена многих жизней.
При этом интересно, что химиотерапия — сравнительно молодая область. До начала XX века основным и фактически единственным инструментом онколога был скальпель хирурга. Чуть больше ста лет назад появился еще один метод — лучевая терапия. Но лишь с появлением химиотерапии многие онкологические заболевания из смертельных стали излечимыми или хорошо контролируемыми.
Может быть, пора оглянуться назад и посмотреть, какой огромный путь прошла лекарственная терапия онкологических заболеваний за последние 70 с лишним лет. И как врачи-исследователи, переходя от надежды к отчаянию и снова к надежде, одерживали победы над опухолями с 40-х годов XX века и до наших дней.
1. Рождение химиотерапии

2. Сидни Фарбер и его роль
3. Новые препараты. Оптимизм и пессимизм
4. Полихимиотерапия. Первые выжившие
Прорыв произошел в 1965 году. Он был связан с именами трех врачей и исследователей — Эмиля Фрая, Эмиля Фрайрайха и Джеймса Холланда. Именно они впервые предположили, что для повышения эффективности лечения можно и нужно использовать сразу несколько лекарств с разными механизмами действия — тогда опухоли труднее будет к ним приспособиться.
Эффект был потрясающим. Впервые появились не просто больные, у которых наступало кратковременное облегчение симптомов, а случаи длительных ремиссий, фактически равносильных выздоровлению. Шанс на долгую полноценную жизнь получили сразу десятки процентов детей с острым лимфобластным лейкозом и взрослых с ходжкинской лимфомой. Это и сейчас одни из самых излечимых онкологических заболеваний.
5. Адъювантная и неоадъювантная химиотерапия, сопроводительная терапия

Далее, врачи поняли, как сочетать химиотерапию и хирургическое лечение при солидных опухолях — то есть не лейкозах или лимфомах, а заболеваниях, где есть локальная масса опухолевых клеток. Использование пред- и послеоперационной (говоря по-научному, неоадъювантной и адъювантной) химиотерапии позволило добиться победы во многих случаях рака груди или кишечника у взрослых, нефробластомы и сарком у детей, при целом ряде других опухолей.
6. Таргетная терапия
Эти успехи вдохновили исследователей на новые разработки. Сейчас уже известны десятки таргетных препаратов, которые заметно улучшили результаты лечения при целом ряде опухолей. Разработка новых лекарств активно ведется и сейчас.
7. Современная противоопухолевая иммунотерапия
В 2018 году за разработку этого класса лекарств ученым Джеймсу Аллисону и Тасуко Хондзе была присуждена Нобелевская премия по физиологии и медицине.
- КЛЮЧЕВЫЕ СЛОВА: противоопухолевые препараты, химиотерапия, эндокринная терапия, таргетная терапия, молекулярная биология, клеточная генетика
Человечеству было известно о раке задолго до нашей эры, о чем свидетельствуют археологические находки. Ртуть, сера, висмут, мышьяк; сборы, отвары, настои растений; экстракты тканей животных (самых экзотических), змеиный и пчелиный яд в руках знахарей и врачевателей создавали видимость лечения опухолей – больные жили и страдали ровно столько, сколько им было отмерено.
К началу ХХ века онкология сформировалась как наука и жизненно важная медицинская и биологическая проблема. Ученые понимали, что рак полиэтиологичен, и подозревали, что он возникает вследствие мутационных факторов внешней и внутренней среды. Тогда уже было многое известно об этиологических факторах опухолей (химические канцерогены, вирусы, радиация, ультрафиолетовое и ионизирующее излучение, предрак), появились первые классификации опухолей. Но вплоть до середины прошлого века главным принципом онкологов был эмпиризм лекарственной терапии.
Химиотерапия
Химиотерапия рака с элементами рационализма начала свое существование в 1940-х гг., когда были переосмыслены данные патологоанатомических исследований тел погибших в результате атак ипритом в годы Первой мировой войны в Бельгии. После обнаружения тропности поражения этим отравляющим веществом пролиферирующих клеток костного мозга, эпителия желудочно-кишечного тракта (ЖКТ) и волосяного покрова возникла идея синтеза аналогов иприта с целью лечения быстро пролиферирующих опухолей органов кроветворения. Так появились препараты, определившие первое направление в химиотерапии, – алкилирующие агенты. В эту группу входят вещества, способные освобождать атом углерода из углеводородной цепи и передавать его в другие молекулы (нуклеофильные группы белков и нуклеиновых кислот). Биологическим выражением реакции алкилирования являются хромосомные повреждения и нарушение клеточного деления. Простейшая формула алкилирования выглядит так:
R – CH₂ – X + Y = R – CH₂ – Y + X.
Данное направление было поддержано и развито Л.Ф. Ларионовым [1], Н.Н. Блохиным [2] и их учениками. Всего за 20 лет после создания первого алкилирующего агента мустаргена (эмбихина) было синтезировано 3000 подобных веществ.
Сейчас в арсенале врачей-онкологов несколько противоопухолевых препаратов этой группы – дакарбазин, мелфалан, темозоломид, циклофосфамид, хлорамбуцил, производные платины и нитрозомочевины и др. В списке чувствительных к современным алкилирующим агентам опухолей – лимфомы Ходжкина, неходжкинские лимфомы, миеломная болезнь, солидные опухоли (рак яичника, немелкоклеточный рак легких, рак толстой кишки (РТК), опухоли головы и шеи (ОГШ), меланома, семинома, опухоли мозга и др.) [3–6].
В 1940-х гг. крупный американский онколог-гематолог S. Farber заметил, что препараты фолиевой кислоты, применяемые у детей с острым лимфобластным лейкозом для стимуляции синтеза гемоглобина, одновременно замедляли лейкозный процесс. Так возникла идея синтезировать аналоги фолиевой кислоты с небольшими химическими изменениями, которые могли бы имитировать метаболит по строению, но не по функции. Первый препарат этой группы аминоптерин дал невиданный ранее результат: у детей с острым лимфобластным лейкозом удалось добиться кратковременных ремиссий. Подобные лекарства получили название антиметаболитов; благодаря химическому сходству с метаболитами они вытесняют их на разных этапах биохимических реакций и вместе с тем блокируют окончание этих реакций.
В 50-х гг. прошлого века C. Heidelberger и соавт. [7] опубликовали данные о синтезе антиметаболита 5-фторурацила (аналог пиримидина) и первых клинических наблюдениях эффектов при эпителиальных опухолях ЖКТ. Аргументом для синтеза препарата послужило наблюдение: урацил-пиримидиновое основание, входящее в состав нуклеотидов и рибонуклеиновой кислоты, утилизируется опухолевыми клетками более интенсивно, чем нормальными. Исследователи предположили, что фтористый аналог урацила будет функционально дефектен для опухолевых клеток.
В настоящее время применяются 23 антиметаболита: гидроксимочевина, капецитабин, метотрексат, пеметрексед, пралатрексат, тегафур, флударабин, фторурацил, цитарабин и др. Антиметаболиты остаются важнейшей группой препаратов для лечения как часто встречающихся (рак молочной железы (РМЖ), РТК, ОГШ и др.), так и редких (хориокарцинома матки) опухолей [8, 9].
Открытие антибиотиков привело к огромным достижениям в области контроля инфекционных болезней: продукты жизнедеятельности грибов оказались губительными для микробов. Подтвердились предположения о возможности обнаружения в культуральных жидкостях антибиотиков с противоопухолевыми свойствами, и в конце 1960-х гг. были выделены и клинически апробированы актиномицин C и D и их аналоги. Особую важность имело открытие антрациклинов – противоопухолевых антибиотиков с широким спектром действия. Например, доксорубицин эффективен при 12 формах опухолей, эпирубицин применяется для лечения наиболее распространенных опухолей (РМЖ, рак желудка и др.) и т.д. Всего в арсенале онкологов 8 антибиотиков, их список в порядке частоты назначения выглядит следующим образом: доксорубицин, эпирубицин, митомицин, идарубицин, блеомицин, дауномицин, дактиномицин, митоксантрон. В последнее время список противоопухолевых антибиотиков, разрешенных для клинической практики, не расширялся [10–13].
Важную группу химиотерапевтических препаратов, широко применяемых и сейчас, составляют лекарства растительного происхождения. О целебных свойствах барвинка розового при разных болезнях было известно еще в Средние века, а в наше время обнаружена миелотоксичность алкалоидов, выделенных из этого растения, послужившая поводом для изучения их действия при опухолях. Оказалось, что антимитотический эффект этой группы препаратов связан с угнетением синтеза в клетках тубулина – белка, из которого построены микротрубочки, формирующие скелет клетки [14].
Заметный след в истории развития химиотерапии рака оставило создание группы таксанов, к которой относятся паклитаксел (изолирован из коры тихоокеанского тиса) и доцетаксел (полусинтетический препарат) [15]. Оба препарата в отличие от винкаалкалоидов не угнетают синтез тубулина, а, наоборот, стимулируют его, при этом микротрубочки приобретают неправильную форму и нарушают клеточное деление. Показанием для назначения паклитаксела или доцетаксела являются 9 форм опухолей. Всего в мире существует 15 противоопухолевых растительных препаратов.
Последняя группа химиотерапевтических препаратов, о которой мы хотели бы здесь упомянуть, – ингибиторы топоизомераз – ферментов, которые отвечают за топологию дезоксирибонуклеиновой кислоты (ДНК) и связаны с процессом репликации опухолевых клеток. В мире применяются четыре препарата этой группы [16].
Таким образом, химиотерапия рака, построенная в результате рациональных предположений, стала третьим методом лечения (после хиругического и лучевого) в онкологии. С помощью химиотерапии удается излечивать некоторые редкие формы опухолей – хориокарциномы, герминогенные опухоли яичек и яичников, некоторые опухоли детского возраста и системы крови. Комбинированная химиотерапия метастатических опухолей яичников, молочной железы, РТК, ОГШ и других новообразований увеличивает медиану выживаемости пациентов, продлевает им жизнь. Химиотерапия вместе с облучением приводит к уменьшению частоты и объема хирургических вмешательств при раке гортани, анальном раке, РМЖ, раке мочевого пузыря. Адъювантное и неоадъювантное применение химиопрепаратов улучшает отдаленные результаты хирургического лечения многих опухолей.
Вместе с тем традиционная химиотерапия достигла своего плато – эффекты при наиболее распространенных опухолях паллиативные – не излечивающие пациента, а лишь отодвигающие летальный исход; избирательность действия недостаточно высокая; мишени химиотерапии общие и не очень конкретные – нарушение синтеза ДНК, остановка клеточного деления.
Эндокринная терапия
Эндокринное лечение опухолей старше научной химиотерапии. Его назначают больным с гормонозависимыми опухолями (РМЖ, рак предстательной железы (РПрЖ), рак тела матки, нейроэндокринные опухоли ЖКТ и поджелудочной железы). Вначале развитие получили аблативные хирургические методы. Так, 117 лет тому назад английский хирург G. Beatson [17] обнаружил, что диссеминированный РМЖ регрессировал после удаления яичников у одной из больных. Через 4 года появилась публикация S. Boyd [18], основанная на материалах Лондонского госпиталя Красного Креста, о паллиативном эффекте овариэктомии у 46 менструирующих женщин с диссеминацией РМЖ.
Доказана терапевтическая значимость адреналэктомии и гипофизэктомии при РМЖ [19, 20]. Все эти хирургические воздействия при метастатическом РМЖ имели цель подавить синтез эстрогенов, которые, как позже было установлено, взаимодействуя с рецепторами эстрадиола, соединяются с элементом эстрогенного ответа ДНК; в результате активируются гены, стимулирующие опухолевую пролиферацию. Аналогичную эстрогенам роль выполняют андрогены при РПрЖ.
C. Huggins и C. Hodges [20] удивили мир сообщением о регрессии метастатического РПрЖ после орхэктомии. В настоящее время при лечении указанных опухолей прекратили выполнять аблативные адреналэктомии и гипофизэктомии, так как разработаны методы эндокринной терапии.
У двух третей больных РМЖ в опухолевых клетках экспрессируются эстрогенные (ЭР) и/или прогестероновые рецепторы (ПР). Ингибирование биосинтеза эстрогенов или их взаимодействие с рецепторами с помощью лекарственных препаратов способно остановить или замедлить развитие опухолевого процесса. Рецепторы стероидных гормонов – ЭР и ПР – чаще определяются при РМЖ у женщин в менопаузе в первичной опухоли, метастазах в лимфатических узлах, в мягких тканях, коже, реже – в висцеральных метастазах.
У больных РМЖ, как в менопаузе, так и менструирующих, при экспрессии ЭР и ПР могут применяться антиэстрогены тамоксифен и торемифен; в США назначают ралоксифен в программах профилактики РМЖ в группах риска. Адъювантное введение антиэстрогенов пациентам с ЭР- и ПР-позитивным РМЖ способствует уменьшению рецидивов болезни в течение 5 лет независимо от возраста и менструального статуса на 41%, а также снижению смертности на 34% [21].
Антиэстрогены используют и для лечения больных ЭР- и ПР-позитивным метастатическим РМЖ. Эффект отмечается у 30% пациенток, стабилизация – у 20%; при этом продолжительность эффекта выше, чем после химиотерапии, – от 12 до 24 месяцев [22].
Антагонист ЭР фулвестрант не занимает место этих рецепторов, а разрушает их. Препарат используют во второй линии эндокринной терапии РМЖ [22].
В клетках РПрЖ андрогенные рецепторы представлены чаще, чем эстрогенные в клетках РМЖ. Антиандрогенные препараты конкурируют с андрогенами за рецепторы. Различают два класса антиандрогенов: нестероидные (бикалутамид, нилутамид, флутамид) и стероидные (абиратерон, ципротерон) – все они применяются для лечения гормоночувствительного РПрЖ, а абиратерон эффективен также при развитии резистентности к другим антиандрогенам [26, 27].
В гипоталамусе, а также в клетках слизистой оболочки тонкой кишки и желудка, поджелудочной железы продуцируются пептидные гормоны, взаимодействующие со специфическими рецепторами, содержащимися в нормальных и опухолевых клетках. Эти пептидные гормоны являются нейротрансмиттерами, участвующими в передаче внутриклеточных сигналов и регуляции клеточного роста. Примером таких гормонов является тетрадекапептид соматостатин; описано несколько его аналогов, в частности Сандостатин (октреотид). Препарат применяется для лечения гормонально активных нейроэндокринных опухолей поджелудочной железы, желудка и тонкой кишки [28].
По параметру обоснованности эндокринная терапия ближе к таргетной терапии, чем химиотерапия.
Таргетная терапия
Механизмы опухолевой трансформации были раскрыты лишь в конце ХХ века. В 1976 г. M. Bishop и H.E. Varmus обнаружили первые онкогены; в 1982 г. был клонирован первый мутированный онкоген H-ras; в 1983 г. идентифицированы первые эпигеномные нарушения, а в 1985 г. – первые 15 онкогенов; в 1987 г. выделен первый супрессорный ген RB1 из ретинобластомы. В 2002 г. описаны 100 человеческих онкогенов и 15 супрессорных генов, в 2005 г. завершен атлас ракового генома, в 2009 г. описаны уже 410 генов, а в 2011 г. было известно о 142 586 генных мутациях [30].
После полной идентификации генома некоторых опухолей выяснилось, что с их возникновением связаны только 2% мутированных генов. Большинство мутированных генов обнаружены в клетках мезенхимальных новообразований – лейкозов, лимфом, сарком; около 80 – в клетках эпителиальных опухолей [31].
Молекулярная биология и клеточная генетика, по выражению R.A. Weinberg [32], уже выдали огромную информацию о раке, которую человеческий мозг пока не может полностью освоить и всесторонне понять (англ. assimilate and comprehend). Несмотря на молекулярно-биологические данные о сбоях в регуляции пролиферации, репликации и апоптоза в опухолевых клетках, прогресс в использовании этих знаний в лечебной практике еще ограничен.
Создание таргетных препаратов отстает от темпов познания и идентификации молекулярных мишеней, ответственных за свойства опухолевых клеток. Тем не менее таргетная терапия рака продолжает свое многообещающее развитие [33].
Первое направление таргетной терапии (англ. function-directed therapy) предполагает использование препаратов, для которых в качестве мишеней определены либо уникальные молекулы, экспрессируемые опухолевыми клетками, либо молекулы, экспрессируемые с большей частотой опухолью, чем нормальными клетками. Это лекарственные средства, обеспечивающие блокирование связывания лиганда с рецептором (бевацизумаб, панитумумаб, трастузумаб, цетуксимаб), торможение рецепторов тирозинкиназы (гефитиниб, лапатиниб, пазопаниб, сунитиниб, эрлотиниб), торможение внутриклеточных сигнальных белков и протеинкиназ (дасатиниб, иматиниб, нилотиниб, сорафениб, темсиролимус, эверолимус), деградацию белков (бортезомиб), иммуномодуляцию (леналидомид).
Второе направление таргетной терапии (англ. phenotype-directed targeted therapy) нацелено на опухолевый фенотип и характеризуется менее выраженным специфическим воздействием, чем препараты первой группы. К таргетным препаратам второй группы относятся ритуксимаб, алемтузумаб, офатумумаб, гемтузумаб, ибритумомаб, тозитумомаб, денилейкин дифтитокс, сипулеуцел-Т (вакцина против РПрЖ).
К сожалению, полная персонализация таргетного лечения каждого онкологического больного после рутинной полной молекулярной расшифровки генома его опухоли может стать реальностью лет через 20. Пока эта отрасль лекарственной терапии рака занята созданием препаратов против доминантных генов и ключевых белков, поврежденных драйверовскими мутациями, среди которых EGFR1, HER2, KRAS, RAF, P53, VEGFR, BCR-Abl, mTOR, c-kit. Есть точные попадания: метастатический РМЖ (HER2), гастроинтестинальные опухоли (c-kit), хронический миелолейкоз (BCR-Abl), аденокарциномы легкого (мутации EGFR); получены значимые эффекты при подавлении ангиогенеза или использовании мультитаргетных препаратов при РТК, почечноклеточном и гепатоцеллюлярном раке и других новообразованиях [34–38].
Итак, генный анализ продвигает классификацию опухолей от гистологического в сторону молекулярного уровня. Успех отдельных таргетных препаратов доказывает генную ответственность ряда мишеней.
Опухолевый генотип позволяет индивидуализировать лечение. Опухолево-специфические изменения ДНК – высокочувствительные маркеры диагностики и мониторинга. Продолжающийся анализ многочисленных геномов опухолей идентифицирует новые мишени, фармакологическая эксплуатация которых открывает перспективы обоснованного лечения опухолей.


12 июля 1917 года около бельгийского городка Ипр немецкая армия впервые пустила в ход отравляющее вещество, названное по месту сражения ипритом. Оказалось, новое оружие можно обратить против опухолей.
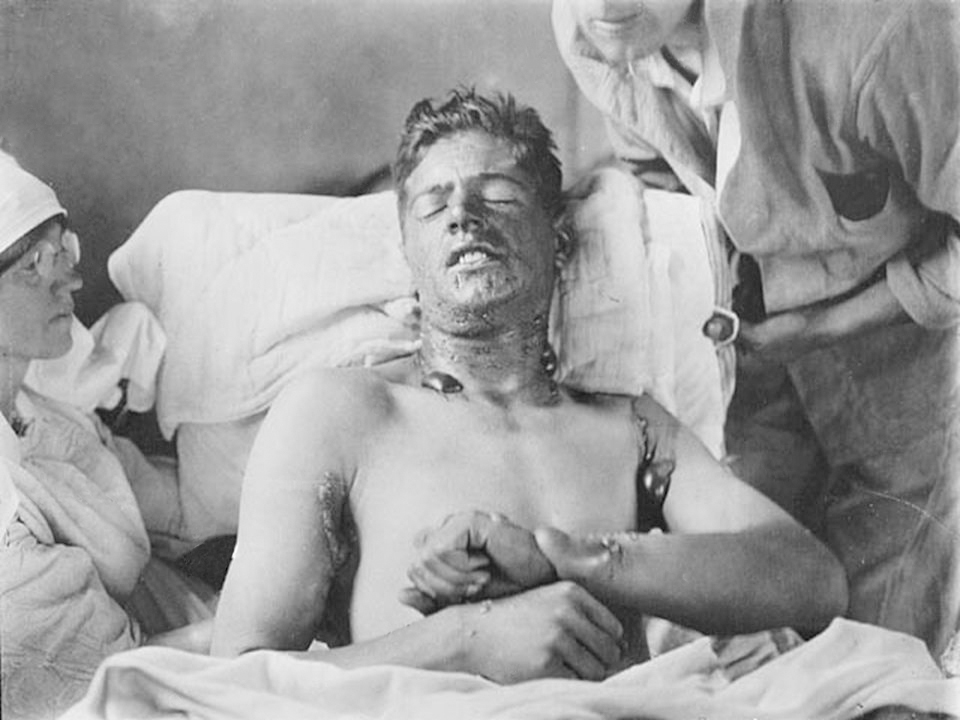
Волдыри и нарывы от иприта возникают прежде всего там, где кожа нежнее — на шее, под мышками, на запястьях.
Страшный яд оказывал действие, которого не ожидали даже сами немцы. Изучая последствия применения иприта, врачи придумали важнейший метод лечения рака — химиотерапию.
Задыхающиеся люди с повязками на глазах — они были не в силах выносить солнечный свет — держась друг за друга, брели в тыл, ведомые медсёстрами. Из 6000 готовых наступать бойцов пострадало 2143, умерло 95. К большинству остальных вернулось зрение, но ожоги и нарывы по всему телу не заживали месяца три. Эти-то не поддающиеся лечению нарывы и были сюрпризом для всех.

Немцы при опытах на шимпанзе и кошках не удосужились посмотреть, что творится у них под шерстью. До 12 июля 1917 года лишь один человек испытал на себе все прелести иприта. Это был не кто иной, как Николай Зелинский, в будущем великий химик и создатель противогаза. 30 лет назад, в 1886 году, молодой Зелинский был на практике в Гёттингенском университете. Научный руководитель Виктор Мейер поручил ему синтезировать вещество, которое как раз и оказалось ипритом. Зелинский случайно облился своим продуктом и еле выжил. Он едва дышал, надолго ослеп и три месяца со страшными язвами пролежал в местной клинической больнице. Мейер послал остатки иприта в больницу на исследование. Лабораторные кролики демонстрировали те же симптомы, что и пострадавший. Когда же раздражение появилось на коже лаборанта, эксперименты сразу прекратили. Потом о них вообще забыли, и потеряли журнал.
В 1917 году немцам уже некого было спросить: Зелинский на стороне противника, а Мейер двадцать лет назад впал в депрессию и принял цианистый калий. Только после боевого применения все бросились изучать иприт. Британские врачи установили, что у отравленных падает уровень лейкоцитов в крови. Вскоре на фронт прибыл американский хирург Эдвард Крамбхаар, в будущем знаменитый кардиолог и историк медицины. С ним была его супруга Хелен, женщина-врач, верный помощник и ассистент. Постоянно оперируя, они урывали время ото сна, чтобы внимательно изучить тела отравленных.
Этот вывод сразу же применили на практике. Немцы часто использовали смеси газов. Если анализ показывает снижение числа лейкоцитов и активности митоза, значит, пациент пострадал от иприта. Всего по обе стороны фронта таких отравленных насчитывалось около миллиона двухсот тысяч человек, из них до конца войны скончалась 91 тысяча. Остальные в массе своей не дожили до старости, умирая от инфекций дыхательных путей.
Но после Перл-Харбора стало ясно, что от японцев можно ждать всего. С декабря 1941 года в Йельском университете фармакологи Луис Гудман и Алфред Гилман стали по заказу военных искать антидот к азотистому иприту. А как проверить, действует ли антидот? Вспомнили работу Крамбхаара — если митоз идёт, значит, иприт нейтрализован. Активнее всего делятся раковые клетки, вот на них и можно проверять. Тут Гудмана осенило: да ведь инъекция иприта должна останавливать рост опухоли!
Если на опыты в интересах вооружённых сил изводили стаи кроликов, то для проверки этой гипотезы у Гилмана была всего одна мышь. У неё вызвали лимфому, затем ввели ей иприт — опухоль исчезла. Через две недели случился рецидив, после новых инъекций опухоль опять уменьшилась, однако теперь её клетки стали резистентными к яду, и мышь всё-таки умерла от рака. Но она прожила целых 84 дня, то есть на порядок больше, чем без лечения. Этот результат сообщили хирургу-онкологу Густаву Линдскогу. Он решился предложить такую химиотерапию кому-нибудь из безнадёжных пациентов больницы Нью-Хейвен. По счастливой случайности, первым согласился пациент с формой лейкоза, чувствительной к иприту. Будь у него другая патология, химиотерапия возникла бы на много лет позже.
Противоопухолевая химиотерапия — это один из современных высокотехнологичных методов лечения различных видов злокачественных новообразований с помощью введения в организм специальных химических веществ или лекарственных препаратов — противоопухолевых химиотерапевтических агентов.
История развития химиотерапии началась вместе с 20 веком и продолжается по сей день. Каждое десятилетие принесло свои плоды в становлении этого направления.
Первые четыре десятилетия 20-го века были посвящены разработке мышиных моделей для тестирования препаратов.
1910 год — разработка первых трансплантируемых опухолевых систем грызунов в Roswell Park Memorial Institute (RPMI) Buffalo, New York, что позволило стандартизировать модельные системы и испытывать большое количество химических веществ.

1935 год — создание Национальным Институтом Рака (NIC) программы Shear для тестирования препаратов на модельной системе — мышином S37.
1953 — закрытие данной программы ввиду токсичности тестируемых препаратов.
1943 год— Альфред Гилман и Луи Гудман проводят эксперименты на мышах с трансплантированной лимфоидной опухолью для изучения потенциальных терапевтических эффектов горчичный газ (иприт).
Что интересно, на это учёных сподвиг опыт Второй Мировой Войны: в результате случайного разлива иприта с бомбардировочного корабля на солдат удалось наблюдать у них картину истощения костного мозга и лимфатических узлов.
Наблюдая заметную регрессию опухоли, Гудман и Гилман убеждают своего коллегу, торакального хирурга Густава Линдскога, ввести иприт пациенту с неходжкинской лимфомой, что приводит к положительным результатам.
1946 год — публикация результатов исследования Гудмана и Гилмана и распространение использования иприта для борьбы с лимфомами.
К сожалению, ремиссии оказались короткими и неполными, и использование данного препарата приостановилось.
1948 год — создание Фабером и Харриет Килт антифолатного соединения — аминоптерина, более известного как метотрексат. И доказательство его эффективности на детях с лейкемией. Этому способствовал синтез фолиевой кислоты в 1937 году и открытие ее свойств.
1949 год — Хидчингс и Элион создают тиопурины: 6-тиокванин и 6-меркаптопурин, которые в дальнейшем используются для лечения острого лейкоза.
1949 год — принятие модели L1210 (лейкемия у мышей) в качестве универсальной системы скрининга опухолей у животных.
1950-е — исследование противоопухолевых свойств антибиотиков.
1955 год — создание Национального Центра Химиотерапии Рака (CCNSC)
1957 год — Чарльз Хайдельберг и коллеги разрабатывают препарат, нацеленный на негематологический рак, — фторпиримидин-5-фторурацил(5-FU). Он обладает широким спектром действия против ряда солидных опухолей, по сей день являясь краеугольным камнем в лечении колоректального рака.
1958 год — излечение хориокарциномы метотрексатом.

1963 год — Открытие активности растительных алкалоидов из Vinca rosea (винкристин) против лейкемии и болезни Ходжкина, а также прокарбазина против болезни Ходжкина.
Первая половина 1960-х — Разработка программы VAMP (винкристин, аметоптерин, 6-меркаптопурин и преднизон) — первая программа лечения болезни Ходжкина, которая позволила достичь ремиссии в 60% случаев.
Создание программы MOMP (иприт + винкристин, метотрексат и преднизон), а затем программы MOPP (без метотрексата) также для лечения болезни Ходжкина. Как следствие — ремиссии в 80% случаев.
1965-1967 год — предстваление результатов MOMP и MOPP на заседаниях AACR (American Association for Cancer Research).
Стоит отметить, что до 1970 года медицинская онкология не существовала как клиническая специальность.
1970 год — болезнь Ходжкина считается излечимой на 90% процентов.
1971 год — принятие Закона о раке.
1973 год — медицинская онкология признана отдельной клинической специальностью.
1968-середина 1970-х — развитие адъювантной химиотерапии для борьбы с метастазами.
1976 год — увеличение показателей излечения метастатического рака яичка.
1984 год — развитие молекулярной биологии. По мере появления информации и молекулярных нарушениях в раковых клетках, рандомозированный скрининг заменяется скринингом на конкретные молекулярные мишени.
1990 год — снижение заболеваемости и смертности от рака в США.
1996 год — разработка ингибитора тирозинкиназы — иматиниба — для лечения хронического миелоцитарного лейкоза.
1997 год — признание моноклональных антител клинически полезными.
2001 год — изучение генома человека.
2005 год — данные из последовательности генома позволяют предположить, что многие аномалии, относящиеся к раку, связаны с нарушенной функцией протеинкиназ, и основным направлением современной эры создания лекарств стала разработка ряда ингибиторов киназы.
2007 год — смертность от онкологических заболеваний снизилась в 2 раза.

В первую очередь, зависит от типа и стадии рака, а также от возраста пациента, наличия у него сопутствующих заболеваний. Не менее важно личное отношение пациента к своему лечению и оптимистичный настрой.

- Тошнота, рвота, анорексия, диарея;
- Ломкость, выпадение волос, ломкость ногтей;
- Анемия, повышенная кровоточивость;
- Иммуносупрессия, миелосупрессия;
- Периферическая нейропатия;
- Кардиотоксичность, гепатотоксичность, нефротоксичность;
- Когнитивные нарушения;
- Бесплодие.
Группы химиотерапевтических препаратов:
Химиотерапия классифицируется по:
А. По условиям проведения:
- Амбулаторная;
- Стационарная.
В. По способам проведения:
- Системная (внутривенная, пероральная);
- Региональная (введение препарата непосредственно в орган/опухоль);
- Локальная.
Внутривенный способ введения — наиболее распространенный.
C. По механизму действия:
- Цитостатическая;
- Цитотоксическая.
E. По отношению к радикальному оперативному/лучевому вмешательству:
- Адъювантная (после)
- Неадъювантная (до)
- Химиотерапия как единственный способ лечения.
F. По количественному и качественному составу:
- Монохимиотерапия
- Полихимиотерапия
- Радиохимиотерапия (химиолучевая терапия)
- Иммунохимиотерапия
- Гормонохимиотерапия
- Гормоноиммунохимиотерапия
G. По степени обязательности:
- Облигатная
- Рекомендуемая
- Необязательная
Пожалуй, это необходимый минимум, который необходимо знать о противоопухолевой химиотерапии.
Читайте также:

