Хгч при герминогенных опухолях
Герминогенные опухоли, что это такое?
Большая часть герминогенных опухолей возникает внутри гонад. Внегонадные опухоли встречаются значительно реже, это опухоли забрюшинного пространства, переднего средостения и центральной нервной системы.
Развитие герминогенных опухолей связано с аномалиями миграции зародышевых клеток в процессе развития эмбриона.
Большая часть этих опухолей диагностируется в пределах относительно узкого возрастного интервала: 25 — 35 лет.
Герминогенные опухоли относятся к достаточно редким заболеваниям и составляют около 1% от всех злокачественных опухолей у мужчин. Более 90% герминогенных опухолей у мужчин представлены новообразованиями яичка, т.е. могут быть отнесены к опухолям наружной локализации, доступным осмотру и пальпации.
На момент постановки диагноза большинство пациентов имеют распространенный процесс (IIC – III ст.): до 60% больных.
Классификация Всемирной Организации Здравоохранения (ВОЗ) подразделяет герминогенные опухоли на 3 категории:
- новообразования новорождённых и раннего детского возраста. К ним относят тератомы и опухоли желточного мешка. Они могут располагаться в яичках, яичниках, забрюшинном пространстве, средостении, головном мозге.
- новообразования яичка, которые возникают между 15 и 40 годами, и подразделяются на семиномы и несеминомы.
- сперматоцитные семиномы (пациенты старше 50 лет). В отличие от опухолей 1 и 2 типов, источником новообразования являются не эмбриональные зародышевые клетки, а более зрелые – сперматогонии и сперматоциты.
Вероятность возникновения герминогенных опухолей яичек увеличивается при крипторхизме (неопущении яичка в мошонку), травмах, инфекционных заболеваниях.
В группе риска находятся пациенты с различными генетическими заболеваниями.
Виды герминогенных опухолей
В зависимости от морфологической картины, клинического течения герминогенные опухоли делятся на семиномные и несеминомные опухоли. Семиномные опухоли составляют около 40%, несеминомные – 60%. Тактика лечения и прогноз различны в двух этих группах.
Семиномы характеризуются довольно вялым течением, долгое время человек не ощущает никаких симптомов болезни. Эти опухоли хорошо поддаются лечению: они чувствительны к лучевой терапии и особенно к химиотерапии.
При запущенном процессе наблюдается, как правило, лимфогенное метастазирование в забрюшинные лимфоузлы, реже в средостенные и надключичные лимфоузлы.
К данным опухолям относят следующие морфологические подтипы:
- внутрипротоковая герминогенная неоплазия неклассифицированного типа (carcinoma in situ); семинома с клетками синцитиотрофобласта;
- сперматоцитарная семинома;
- сперматоцитарная семинома с саркомой;
- эмбриональный рак;
- опухоль желточного мешка;
- трофобластические опухоли:
- хориокарцинома;
- монофазная хориокарцинома;
- трофобластическая опухоль места крепления плаценты;
- тератома:
- дермоидная киста;
- монодермальная тератома;
- тератома с соматической малигнизацией;
- смешанные опухоли.
Микропрепарат, тератома яичника
Симптомы и первые признаки герминогенных опухолей
Опухоли яичка в ранних стадиях не сопровождаются болями или другими неприятными симптомами, в связи с чем долгое время не возникает стимулов для обращения к врачу.
Чаще всего пациенты приходят с жалобами на увеличение яичка, боль в мошонке, увеличение лимфоузлов. При распространенности процесса появляются симптомы интоксикации, например, слабость, снижение веса, отсутствие аппетита.
Когда опухоль располагается в средостении, особенности при ее больших размерах, пациента будут беспокоить жалобы на кашель, одышку, боли в груди, невозможность выполнять без усилия привычную физическую активность, возможна отечность шеи, синюшность кожных покровов.
Могут возникать шум в голове/ушах, ухудшение зрения, головная боль, сонливость. Это объясняется тем, что растущая опухоль давит на верхнюю полую вену.
Опухоли забрюшинного пространства обычно также не дают о себе знать длительное время. На них могут указывать такие симптомы, как нарушение стула и мочеиспускания, боли в животе, варикозное расширение вен, а также отеки.
Герминогенные опухоли центральной нервной системы (головного мозга) имеют следующие клинические проявления: головная боль, расстройство движений глазных яблок, тошнота, рвота и развитие судорог.
Диагностика герминогенных опухолей
Стандартом диагностики герминогенных опухолей является физикальный осмотр пациента, сбор анамнеза и анализ крови на биологические опухолевые маркеры. К ним относятся АФП (альфа-фетопротеин), β -ХГЧ (β единица хорионического гонадотропина человека) и ЛДГ (лактатдегидрогеназа).
В качестве уточняющих исследований проводится КТ органов брюшной полости и грудной клетки, либо УЗИ органов брюшной полости и рентгенография грудной клетки в двух проекциях.
Также выполняют МРТ головного мозга, чтобы выявить наличие метастазов в нем.
Орхофуникулэктомия — удаление яичка, выполняется с диагностической и лечебной целью.
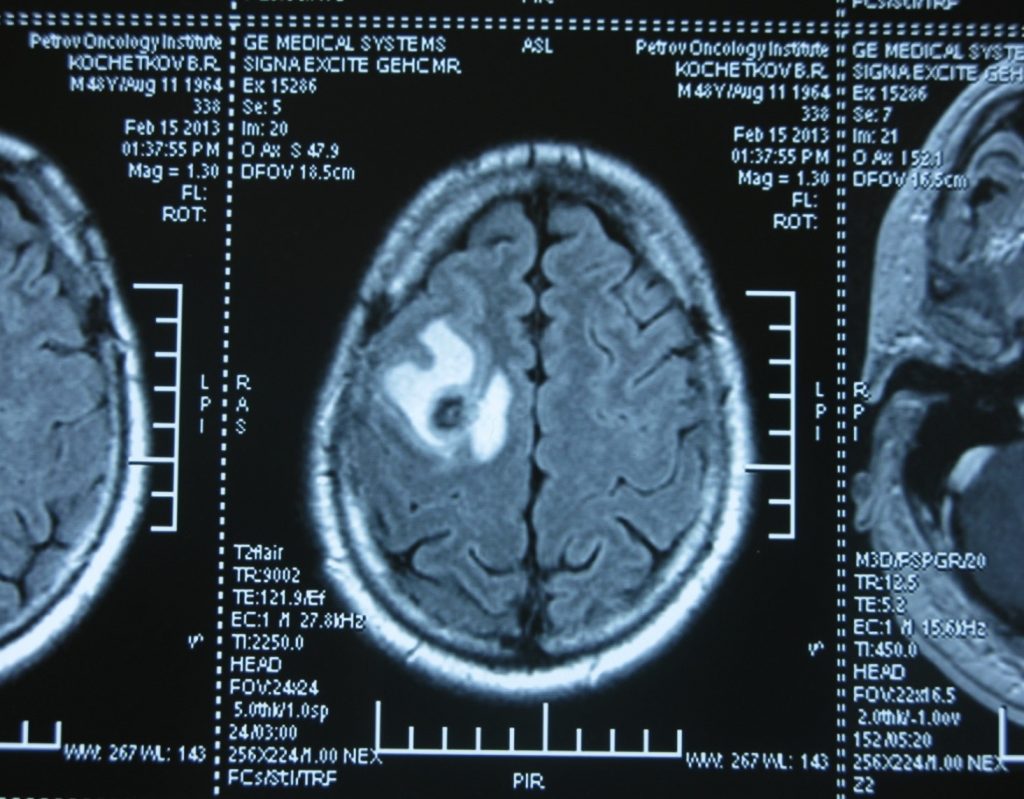
Метастаз в головной мозг при герминогенных опухолях (МРТ головного мозга)
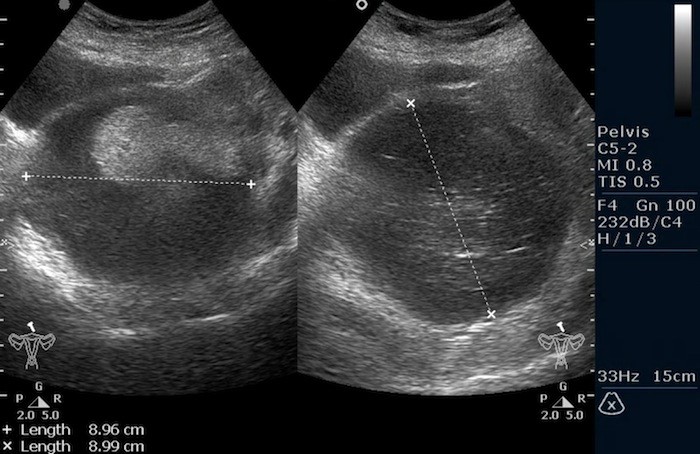
Тератома яичника (УЗИ малого таза)
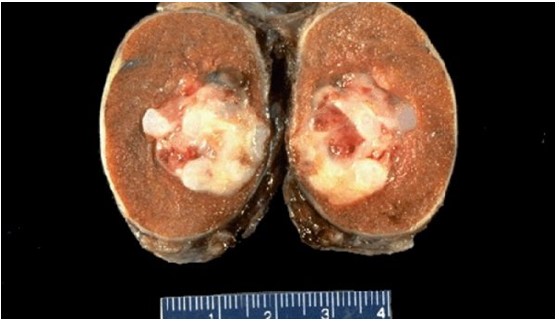
Герминогенная опухоль яичка (макропрепарат)
Стадии герминогенных опухолей
Для выработки индивидуального плана лечения учитываются классификации TNM, а также классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG).
Стадирование герминогенных опухолей в соответствии с классификацией ТNМ
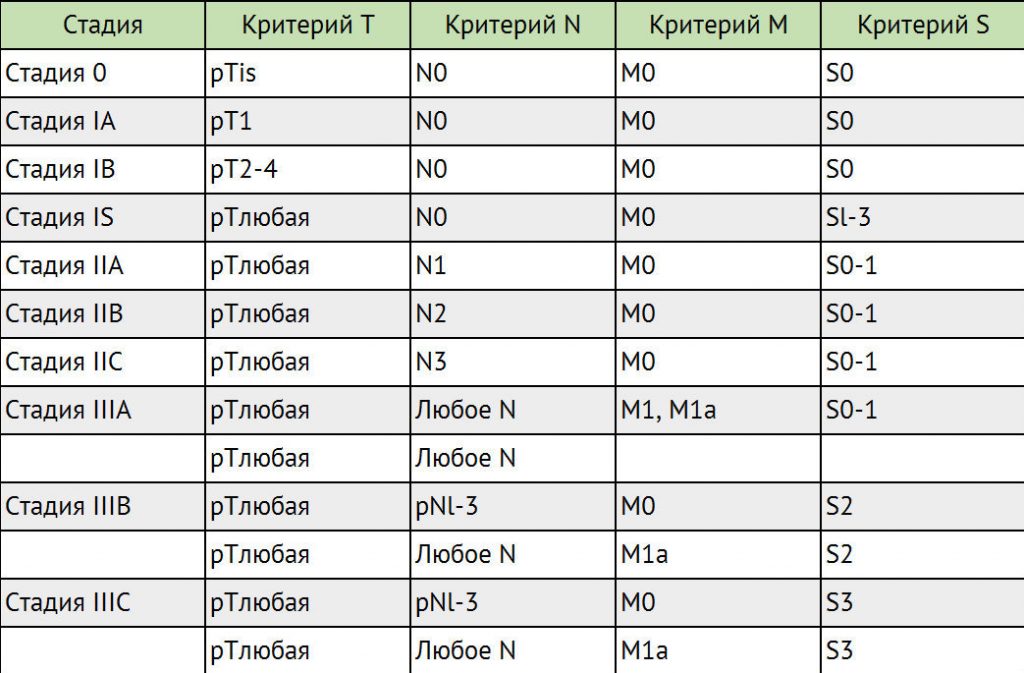
Для герминогенных опухолей IV стадия заболевания не предусмотрена.
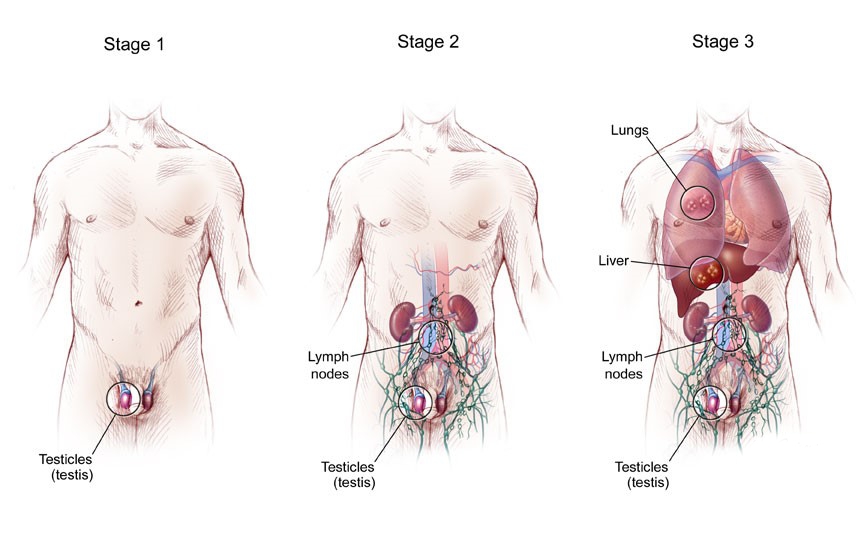
Методы лечения герминогенных опухолей
К настоящему времени в онкологической практике накоплен большой научно-практический материал, разработаны стандарты и международные рекомендации по лечебной тактике больных герминогенными опухолями.
При герминогенных опухолях проводится, как правило, комплексное лечение, которое включает в себя хирургическое лечение, системное противоопухолевое лечение, реже лучевую терапию.
Метод лечения основывается на морфологическом типе опухоли, группе прогноза и стадии заболевания.
Большинство больных герминогеными опухолями добиваются излечения даже при распространенной форме заболевания, когда процесс не ограничен только первичной опухолью. Наиболее эффективная схема лечения – это химиотерапия с последующим удалением остаточных опухолевых очагов.
Хирургические методы:
- орхфуникулэктомия
- забрюшинная лимфаденэктомия,
- удаление легочных метастазов и пр.
Лучевая терапия назначается чаще при поражении головного мозга. Ее применение обусловлено возможностью точного локального воздействия на опухолевые массы.
Химиотерапия
Следует отметить, что при проведении системного лекарственного лечения необходимо строгое соблюдение временных рамок (начало очередного цикла проводится на 22 день).
Для оценки эффективности химиотерапии каждые 2 цикла и после ее окончания проводится компьютерная томография исходных зон поражения, перед каждым циклом мониторинг уровня опухолевых маркеров. Рост маркеров на фоне лечения или после его завершения, а также замедление их снижения свидетельствует об активности опухолевого процесса и необходимости проведения второй линии химиотерапии.
Перед проведением химиотерапии рекомендуется обдумать и решить вопрос о необходимости криоконсервации спермы.
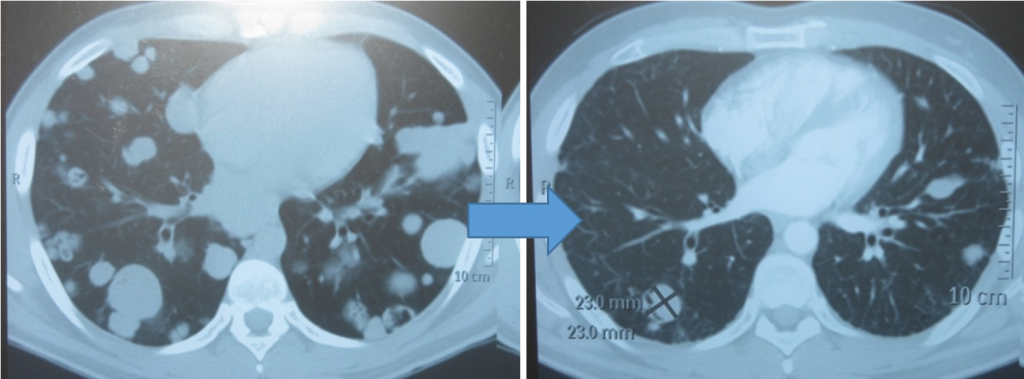
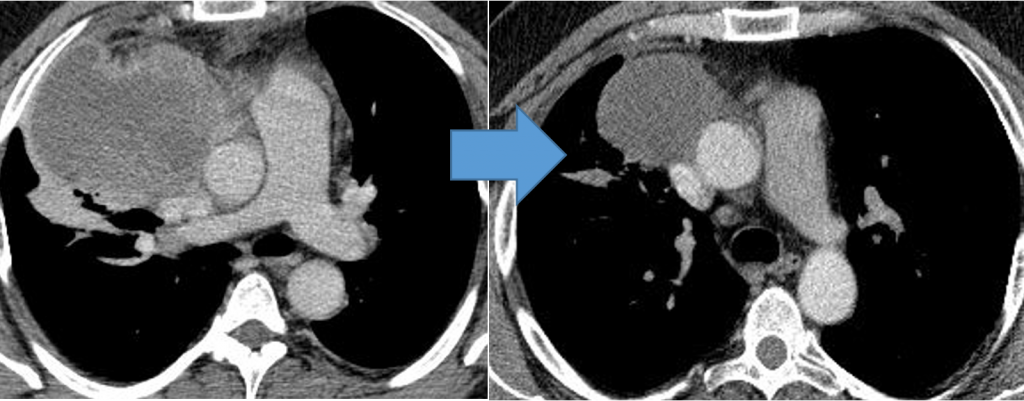
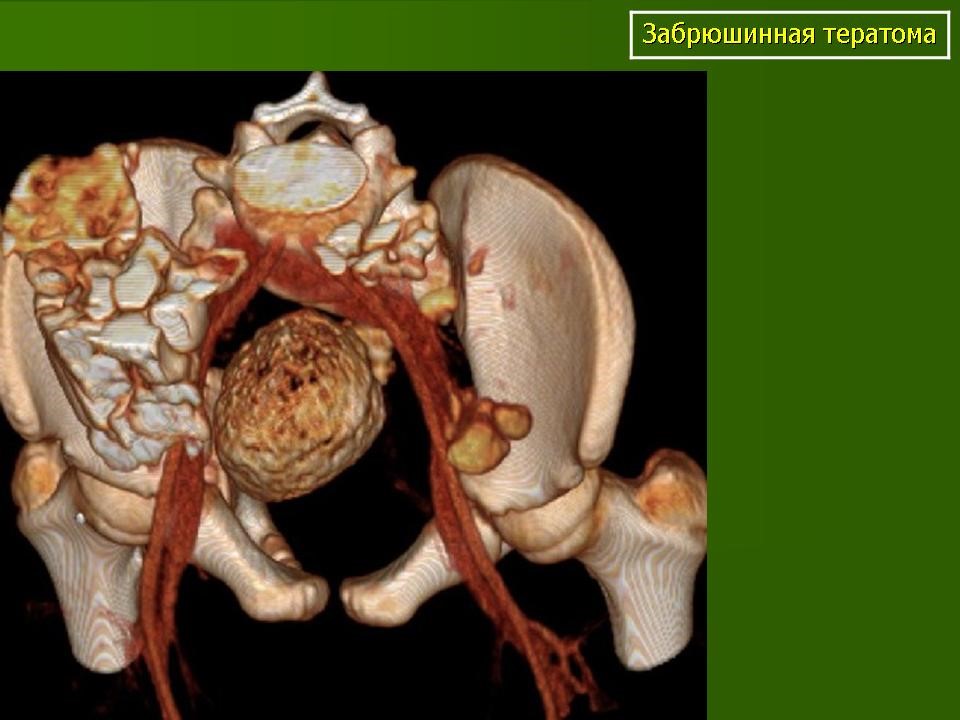
Забрюшинная тератома (3D реконструкция)
Контроль эффективности лечения и динамическое наблюдение.
Перед началом каждого цикла химиотерапии проводится контроль онкомаркеров (АФП, ЛДГ, ХГЧ).
Обязательный принцип динамического наблюдения за больными герминогенными опухолями — строгое соблюдение временных промежутков при выполнении контрольного обследования. Первый год после лечения необходимо проходить обследование каждые два месяца, а на второй год – раз в три месяца.
Следующие два года нужно обследоваться сначала каждые четыре месяца, затем каждые шесть месяцев. И далее планируется ежегодный поход к врачу.
Перечень обследований рекомендованных к выполнению в период динамического наблюдения: физикальный осмотр, кровь на маркеры (АФП, ЛДГ, ХГЧ), УЗИ пахово-подвздошных областей, брюшной полости и забрюшинного пространства, рентгенография органов грудной клетки каждые 6 месяцев.
Прогноз выживаемости
Благодаря успехам в развитии химиотерапии, герминогенные опухоли стали ярким примером курабельных солидных опухолей. Пятилетняя выживаемость больных герминогенными опухолями составляет от 60 до 90%.
Классификация метастатических герминогенных опухолей Международной объединенной группы по герминогенным опухолям (IGCCCG), основанная на прогностических факторах
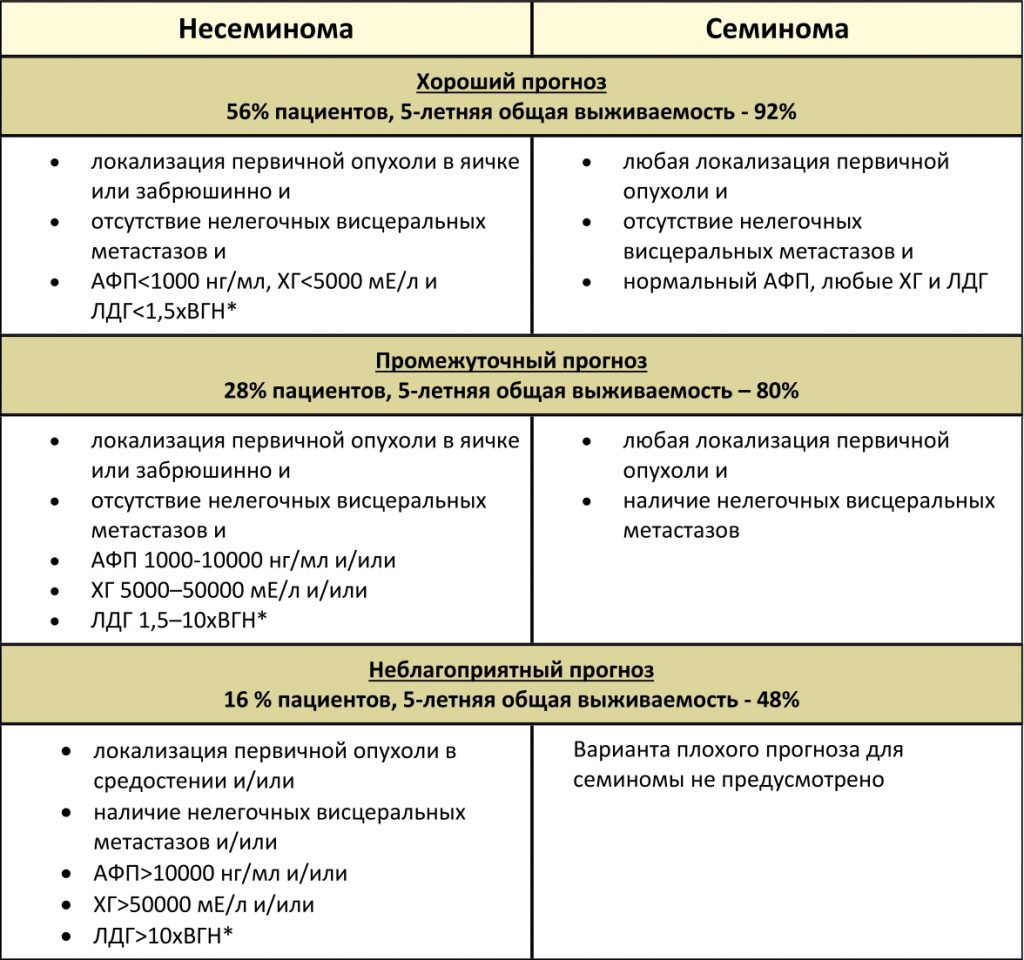
*ВГН – верхняя граница нормы.

Многие знают, что определение хорионического гонадотропина человека (ХГЧ) в крови используется для ранней диагностики беременности, когда тест-полоска еще не способна определить результат. Но, помимо этого, анализ на ХГЧ применяются при диагностике и мониторинге гестационной трофобластической болезни и герминогенных опухолей. О том, когда врач может назначить данное исследование и как расшифровать результаты, — пойдет речь в этой статье.

Другие названия теста: количественный ХГЧ, β-ХГЧ, общий ХГЧ, общий β-ХГЧ, интактный ХГЧ (англ. Beta hCG, Total hCG, Total beta hCG).
Что исследуется?
Хорионический гонадотропин человека (ХГЧ) — это гормон, состоящий из альфа- и бета-субстанций, который вырабатывается плацентой и обычно выявляется в крови только в период беременности. Однако некоторые аномальные ткани, раки также могут продуцировать ХГЧ, поэтому анализ на ХГЧ может быть использован в качестве индикатора этих опухолей. Исследование подразумевает определение содержания интактного ХГЧ в крови, а иногда отдельно и бета-субъединицы.
Повышенный уровень ХГЧ наблюдается при гестационной трофобластической болезни и некоторых герминогенных опухолях как доброкачественных, так и злокачественных. При этих патологиях тест может использоваться в качестве диагностического инструмента. Помимо этого, с его помощью можно мониторить терапию, а также контролировать течение заболевания.
Гестационная трофобластическая болезнь (ГТБ) — это сборное понятие, включающее группу доброкачественных и злокачественных новообразований, которые развиваются в матке из слоя клеток трофобласта. Трофобласт образует сплошной клеточный покров всего зародышевого комплекса, в дальнейшем формирует эпителиальный покров ворсин хориона, а впоследствии — ворсинок плаценты. Именно его клетки продуцируют хорионический гонадотропин человека. ГТБ обычно возникает в начале беременности после оплодотворения яйцеклетки. Вместо того, чтобы поддерживать рост плода, клетки образуют аномальные тканевые массы. ГТБ возникает примерно в 1 случае на 1000 беременностей. Основными формами ГТБ являются:
- Пузырный занос (молярная беременность) может быть полным (только опухолевая ткань) или частичным (смесью опухолевой и эмбриональной ткани); опухоли обычно доброкачественные, тем не менее, они должны быть удалены хирургическим путем.
- Хариоаденома — среднее состояние между пузырным заносом и хориокарциномой, опухоль врастает в стенку матки; она должна быть удалена.
- Хориокарцинома — редкая злокачественная опухоль, которая может развиться из других форм ГТБ, встречается примерно в 2-7 случаев на 100 000 беременностей; этот тип рака быстро растет и распространяется на другие участки тела.
- Трофобластическая опухоль плацентарной площадки — также встречаются очень редко, формируется на участке прикрепление плаценты к матке. Эта опухоль обычно развивается после нормальной или прерванной беременности, редко дает метастазы.
- Эпителиоидная трофобластическая опухоль — чрезвычайно редкая опухоль, она похожа по своему поведению и природе на хориокарциному, но в настоящее время считается отдельным заболеванием. Может пройти много лет после беременности, прежде чем эта опухоль проявит себя. Как правило, на момент ее выявления уже имеются отдаленные метастазы.
Примечание: современные методики лечения ГТБ позволяют в большинстве случаев добиться полного выздоровления.
Опухоли из зародышевых клеток (герминогенные опухоли) могут быть зло- или доброкачественными, встречаются главным образом в яичниках и яичках, возможна внегонадная их локализация, например, в одной полости.
- Опухоли из зародышевых клеток яичников встречается намного реже, чем эпителиальный рак этого органа и чаще наблюдаются у более молодых женщин.
- Опухоли из зародышевых клеток яичка составляют более 90% случаев рака этого органа (подробнее см. Рак яичка).
Уровни ХГЧ могут быть повышены и при других заболеваниях, например, при раке печени, молочной железы, легких, кожи и желудка. Возможны высокие уровни ХГЧ при циррозе печени, воспалительные заболевания кишечника (язвенном колите и болезни Крона).
Для чего используется исследование?
Количественный анализ хорионического гонадотропина человека (ХГЧ), часто называемый бета-ХГЧ (βhCG), измеряет количество этого гормона, находящегося в крови. Он используется при диагностике гестационной трофобластической болезни (ГТБ), а также совместно с определением АФП (альфа-фетопротеин) и лактатдегидрогеназы его применяют при диагностике опухоли из зародышевых клеток.
Поскольку ХГЧ обычно не выявляется в крови у мужчин и небеременных женщин, он полезен в качестве онкомаркера. Если опухоль или рак продуцируют ХГЧ, то тест может помочь обнаружить и контролировать активность онкопатологии.
Если анализ на ХГЧ используется в качестве опухолевого маркера, в отличие от выявления беременности, важно определять его интактную форму(альфа + бета-субстанции). При некоторых опухолях может быть полезным измерение бета-субстанции. Методики проведения тестов в разных лабораториях могут отличаться. Поэтому очень важно сдавать анализы в одной и той же лаборатории.
Когда назначается исследование?
Количественный тест на ХГЧ может быть назначен при подозрении на гестационную трофобластическую болезнь (ГТБ) или опухоль из зародышевой клетки.
Признаки и симптомы ГТБ могут включать:
- Вагинальное кровотечение во время беременности.
- Усталость, связанная с анемией (если кровопотеря значительна).
- Увеличение живота не соответствующее срокам беременности.
- Преэклампсия на ранних сроках беременности.
- Тошнота или рвота, выраженность которых не соответствует нормально протекающей беременности.
- Положительный тест на беременность (качественная ХГЧ), но на УЗИ плод не определяется.
- Матка, которая остается увеличенной после родов.
Клинические проявления герминогенных опухолей у женщин и мужчин аналогичны симптомом рака яичников и рака яичек соответственно. Если диагностирован один из этих раков, и ХГЧ изначально повышен, то его определение в крови будет проводится через определенные промежутки времени с целью мониторинга эффективности лечения и выявления рецидива.
Что означают результаты?
У мужчин и небеременных женщин ХГЧ обычно не определяется или он выявляется в очень малом количестве.
Если тест используется в качестве опухолевого маркера, повышенный уровень указывает на присутствие герминогенной опухоли (опухоль зародышевой клетки) или на гестационную трофобластическую болезнь (ГТБ).
Во время лечения ГТБ или герминогенной опухоли падение уровня обычно указывает на то, что заболевание реагирует на терапию (снижение на 50% каждые 1,5 дня). В свою очередь, постоянные или повышающиеся уровни указывают на то, что патологическое состояние прогрессирует. Повышенный ХГЧ после лечения может указывать на рецидив заболевания.
Что еще необходимо знать?
Ложноположительные результаты возможны, если принимаются определенные препараты, таких как противосудорожные, противопаркинсонические, снотворные, а также транквилизаторы. Присутствие их в крови может помешать правильной интерпретации результатов теста. Кроме того, определенные типы антител и фрагменты молекулы ХГЧ, которые присутствуют в крови некоторых людей, также могут повлиять на правильность результата. Как правило, если он вызывает сомнение, определение ХГЧ проводится с помощью других методик.
Редко, но иногда этот онкомаркер используется при диагностике и мониторинге онкологических заболеваний, которые не являются ГТД или герминогенными опухолями.
Можно ли сдать анализ мочи вместо крови?
Если в крови повышен уровень ХГЧ, то он будет высокий и в моче, но результаты не являются взаимозаменяемыми. Кровь является предпочтительным образцом для подтверждения онкологического заболевания.
Можно ли предотвратить гестационную трофобластическую болезнь?
Нет. Патологию нельзя предотвратить, так как она связана с самой беременностью. Это очень редкое заболевание, обычно патология выявляется сразу же после наступления беременности и успешно лечится.
Возможна ли нормальная беременность после ГТБ?
Да, в большинстве случаев, хотя вы подвержены высокому риску повторного пузырного заноса. После лечения ГТБ вам необходимо будет подождать некоторое время, следуя рекомендациям врача, прежде чем снова забеременеть.
Зачем спортсменов проверяют на ХГЧ?
Спортсмены, как любители, так и профессионалы должны периодически проходите допинг-контроль — сдавать анализы на стероиды и другие вещества, повышающие работоспособность. Обычно допинг-контроль осуществляется на протяжении всей их карьеры. Тесты мочи позволяют обнаружить около 200 химических соединений, включая стероиды и другие анаболические вещества, эритропоэтин, а также вещества, которые спортсмен употребляет, чтобы скрыть незаконное использование допинга. Это так называемые маскирующие агенты, то есть, позволяющее получить ложноотрицательные результаты допинг-тестов.
Некоторые спортсмены, которые используют в качестве допинга стероиды, принимают бета-ХГЧ, чтобы уменьшить побочные эффекты их использования. Поэтому иногда спортсменов проверяют на ХГЧ, чтобы подтвердить использование стероидов.
З.Г.Кадагидзе, В.М.Шелепова, А.В.Соколов
Российский онкологический научный центр им. Н.Н.Блохина РАМН, Москва
Общеизвестно, что за последние 15 лет достигнуты большие успехи в лечении трофобластических неоплазм и герминогенных опухолей. В онкологических центрах, специализирующихся на лечении этих заболеваний, частота излеченности больных превышает 90%. Главными причинами наблюдаемого значительного прогресса являются, наряду с внедрением новых лекарств — цисплатина, VP16-213 и др., — также и рациональное использование опухолевых маркёров.
Наиболее информативными при герминогенных опухолях считаются a-фетопротеин (АФП) и хорионический гонадотропин человека, b-субъединица (b-ХГЧ).
АФП представляет собой гликопротеин с молекулярной массой 70 кД. Он является физиологическим продуктом желточного мешка, печени и желудочно-кишечного тракта плода. Повышенный уровень сывороточного АФП у пациентов с герминогенными опухолями яичка был впервые обнаружен Абелевым в 1997 г. В герминогенных опухолях АФП продуцируется элементами эндодермального синуса (желточного мешка). У детей старше года, как и у взрослых, сывороточный АФП имеет верхнюю границу нормы 15 нг/мл (
10kE/л). Его концентрация может быть повышенной при доброкачественных заболеваниях печени и некоторых злокачественных новообразованиях. Наиболее часто повышенные уровни наблюдаются при герминогенных опухолях и гепатоклеточной карциноме, но иногда также — при раке желудка, кишечника, желчного пузыря, поджелудочной железы и лёгких (приблизительно у 20% пациентов). Полупериод жизни сывороточного АФП после орхэктомии составляет 4-5 дней.
В клинической практике эти маркёры используются для диагностики, мониторинга и прогноза герминогенных опухолей яичка.
Роль АФП и b-ХГЧ в диагностике.
Скрининг на наличие герминогенных опухолей по биохимическим тестам в общей популяции проводить не рекомендуется. При клиническом подозрении герминогенной опухоли (основанном на данных пальпации и УЗИ яичка) определение опухолевых маркёров может быть иногда полезным в дифференциальной диагностике злокачественной опухоли и эпидидимитов у пациентов с безболезненным опуханием одного из яичек. Использование маркёров в дополнение к рентгенологическому и ультразвуковому исследованию брюшной полости повышает диагностическую чувствительность в отношении как гонадных, так и внегонадных (медиастинальных, забрюшинных, центральной нервной системы) герминогенных опухолей.
Связь маркёров с патологией. Проблема диагностики рака яичка состояла, прежде всего, в дифференциации семиномных и несеминомных герминогенных опухолей. В настоящее время эта проблема в большой мере решена благодаря использованию АФП и b-ХГЧ. (таблица 1).
Таблица 1.
Наличие АФП и b-ХГЧ в сыворотке в зависимости от гистологического строения опухоли.
| Гистологическое строение опухоли | АФП | b -ХГЧ |
| Семинома чистого типа | — | — |
| Эмбриональный рак чистого типа | — | — |
| Тератомы незрелые | — | — |
| Тератокарциномы | + | + |
| Опухоли желточного мешка (из эндодермального синуса) | + | — |
| Желточный мешок + другие | + | +/- |
| Хорионкарциномы | — | + |
| Хорионкарциномы + другие | +/- | + |
| Низкодифференцированный рак | +/- | +/- |
Как можно видеть из представленных данных, все больные с герминогенными опухолями яичка в зависимости от наличия маркёров могут быть разделены на две группы. К первой группе (
Таблица 2
Частота герминогенных опухолей яичка с АФП>10kE/л, b-ХГЧ>5E/л.
| Гистологическое строение | АФП+ | ХГЧ+ |
| Несеминомные опухоли | ||
|---|---|---|
| Низко- и средне-дифференцированная злокачественная тератома | 70-72% | 55-60% |
| Зрелая тератома | 0% | 0% |
| Желточный мешок | 64% | 0% |
| Трофобластическая дифференцировка | 0% | 100% |
| Смешанные опухоли | 50-80% | 50-60% |
| Все | 60-80% | 40-60% |
| Семинома | ||
| Семинома | 0% | 15-20% |
Поскольку подходы к лечению семиномных и несеминомных герминогенных опухолей различаются, определение АФП и b-ХГЧ имеет очень важное практическое значение, и часто эти маркёры оказываются более информативными, чем патоморфологическое заключение. Так, по совокупным литературным данным, высокие уровни ХГЧ позволяют распознать трофобластические структуры, нераспознанные в рутинном патогистологическом рапорте, примерно в 10% семином и приблизительно в 30% несеминомных герминогенных опухолей. Практически не вызывает сомнения, что, если у пациентов с семиномой уровень ХГЧ повышен, то в опухоли имеют место быть несеминомные элементы, которые влияют на эффективность лечения и выживаемость.
Использование маркёров для стадирования. При клинической стадии I показано оперативное лечение. Второе определение маркёров проводят через 5-6 дней после операции, чтобы вычислить полупериод жизни соответствующего маркёра. Таким образом, установленная клинически стадия заболевания может быть подтверждена ретроспективно, если концентрация маркёра снижается в соответствии с полупериодом его жизни. До 1997 г. клиническое и патологическое стадирование герминогенных опухолей основывалось только на распространённости заболевания в соответствии с системой ТNM. Следовательно, для стадирования первичной опухоли необходимо было проведение орхэктомии, для классификации N и М — радиографическое исследование грудной клетки, брюшной полости и таза. Определение исходных (до лечения) уровней АФП, ХГЧ и ЛДГ было рекомендовано для клинической практики на основании результатов, полученных в ходе обширного исследования, включавшего 5000 пациентов с герминогенными опухолями и проводившегося под эгидой Международной Группы по изучению герминогенных опухолей — IGCTCG (The International Germ Cell Tumour Collaborative Group). Эти маркёры официально не включены в качестве обязательных в Международную систему по стадированию герминогенных опухолей, но благодаря их определению до и сразу же после орхэктомии, частоту ошибок клинического стадирования удаётся снизить с 50% до менее чем 15%.
Роль маркёров в лечении и наблюдении за больными.
Рациональное использование маркёров находится в соответствии со стадией заболевания.
Стадии 1А и 1В. После проведения паховой орхэктомии более предпочтительным, чем диссекция забрюшинных лимфоузлов, является наблюдение за больным. Наряду с клиническим обследованием и рентгенологическим исследованием органов грудной клетки должно проводиться рутинное определение опухолевых маркёров: ежемесячно в течение первого года после орхэктомии, а затем каждые 6 месяцев во второй и третий годы. Если после орхэктомии уровни АФП и b-ХГЧ остаются повышенными, и полупериод жизни маркёров увеличен, то, несмотря на то, что, по данным компьютерной томографии, остаточная опухоль не обнаруживается, существует высокая вероятность отдалённых метастазов; при этом системная химиотерапия будет предпочтительнее по сравнению с диссекцией забрюшинных лимфоузлов.
Стадия II. После удаления забрюшинных лимфоузлов и либо а) проведения 3-4 циклов химиотерапии, либо б) проведения 2-х циклов адъювантной химиотерапии непосредственно после диссекции — в обоих этих случаях мониторинг больных должен включать, наряду с физикальным и рентгенологическим обследованием, определение опухолевых маркёров: ежемесячно в течение первого года, каждые 3 месяца на протяжении второго года и 1 раз в 6 месяцев на протяжении 3-го года.
Распространённые стадии II и III. Скорость снижения опухолевых маркёров после химиотерапии прогнозирует ответ на лечение. Устойчивое повышение уровня маркёра или удлинение полупериода его жизни в первые 6 недель после специфической химиотерапии указывают на резистентность опухоли и плохой прогноз. Пациенты с остаточной опухолевой массой после проведения химиотерапии могут быть подвергнуты оперативному лечению. Однако, в тех случаях, когда уровни маркёров устойчиво повышаются, пациенты чаще всего оказываются иноперабельными, и вместо операции им показана химиотерапия.
Несеминомные герминогенные опухоли содержат различные типы клеток. Помимо этого, опухоль, которая синтезировала оба маркёра, в ходе лечения может переключиться на продукцию лишь одного из них. Случается, что безмаркёрная до лечения опухоль при рецидиве начинает продуцировать один или оба маркёра в больших количествах. Поэтому необходимо вести мониторинг с использованием обоих маркёров — как АФП, так и b-ХГЧ. Следует также учитывать, что в опухолях со смешанным типом клеток снижение концентрации АФП и b- ХГЧ после резекции отражает соответствующее уменьшение опухолевой массы, в то время как снижение уровней маркёров после химиотерапии отражает лишь поведение маркёр-положительного типа клеток.
После полного удаления опухоли уровни маркёров должны снижаться до нормальных значений в соответствии с их полупериодами жизни: для АФП 1000 кЕ/л, ХГЧ >10000 МЕ/л, опухолевые массы в средостении более 5 см в диаметре и 20 и более метастатических узлов в лёгких. IGCTCG предлагает использовать систему стадирования для метастатических герминогенных опухолей (как семиномных, так и несеминомных), основанную на факторах прогноза. Это позволяет подразделить опухоли на 3 группы — с хорошим, средним и плохим прогнозом — в зависимости от концентрации опухолевых маркёров, как показано в табл.3.
Таблица 3.
Вклад опухолевых маркёров в классификацию прогноза метастатических герминогенных опухолей
| Концентрация опухолевых маркёров | ||
| Группа прогноза1 | АФП (кЕ/л) ХГЧ (Е/л) ЛДГ (х RR)2 | |
| Хороший (S1) | 10 000 >50 000 >10 x (RR) | |
1) — S, сывороточный уровень маркёра
2) — концентрация ЛДГ выражена как произведение соответствующего значения на верхний предел референс-границы (RR- Reference Range).
Предлагаемая система учитывает также расположение опухоли (яичко, забрюшинная область, средостение) и наличие или отсутствие внелёгочных висцеральных метастазов. Для этих трёх прогностических групп частота безрецидивного периода и средней выживаемости составляет, соответственно: для S1 — 89% и 92%, для S2 — 75% и 80%, для S3 — 41% и 48%.
При лечебном мониторинге рекомендуется определять полупериод жизни АФП и ХГЧ; нормализация обоих маркёров (АФП за 5 дней, ХГЧ за 1-2 дня) предполагает благоприятный прогноз. У пациентов с полупериодом жизни АФП более 7 дней и/или ХГЧ более 3 дней частота выживаемости значительно ниже. Система прогноза распространённых герминогенных опухолей была значительно улучшена за счёт использования разработанных в Великобритании United Kingdom Medical Research Council — MRC — комбинированных прогностических критериев, включающих анализ полупериода жизни маркёров (табл. 4). На основании этого пациенты также подразделяются на 3 группы риска.
Таблица 4.
Прогностическая классификация для метастазирующих герминогенных опухолей, основанная на прогностических критериях UK MRC и измерении опухолевых маркёров.
Итак, герминогенные опухоли являются уникальным примером интеграции опухолевых маркёров в диагностику, стадирование и мониторинг терапии. При дифференциальной диагностике чистых семином и опухолей с трофобластическими элементами повышенные уровни ХГЧ более доказательны, чем гистологическое заключение, что имеет значение для выбора терапии. Помимо этого, определение опухолевых маркёров позволяет более аккуратно поставить стадию заболевания. Кинетика маркёров на протяжении первых 6 недель химиотерапии обеспечивает важную прогностическую информацию. У пациентов в ремиссии повышение уровней АФП и ХГЧ может прогнозировать рецидив за несколько месяцев до его клинического диагностирования. Определение маркёров показано при оценке ответа на терапию, а их нормализация является предпосылкой для успешной операции после воздействия химиотерапии.
Читайте также:

